弓形虫胶体金免疫层析试纸条的研制
2017-11-13王钊哲林矫矫陈兆国唐亚兰吴思敏江嘉欣李嘉静朱传刚
王钊哲,许 瑞,洪 炀,林矫矫,2,陆 珂,李 浩,陈兆国,唐亚兰,吴思敏,江嘉欣,李嘉静,朱传刚
(1.中国农业科学院上海兽医研究所 农业部寄生虫学重点开放实验室 国家防治动物血吸虫病专业实验室,上海200241;2.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
弓形虫胶体金免疫层析试纸条的研制
王钊哲1,许 瑞1,洪 炀1,林矫矫1,2,陆 珂1,李 浩1,陈兆国1,唐亚兰1,吴思敏1,江嘉欣1,李嘉静1,朱传刚1
(1.中国农业科学院上海兽医研究所 农业部寄生虫学重点开放实验室 国家防治动物血吸虫病专业实验室,上海200241;2.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
为了研制一种可用于检测弓形虫的快速诊断胶体金免疫层析试纸条,本研究对弓形虫表面抗原(surface antigen,SAG)SAG1和SAG2的基因片段进行重构合成,与PET-28a(+)载体连接后,转化至大肠杆菌BL21(DE3)中表达,利用His亲和层析柱对融合蛋白进行纯化,获得SAG重组表位抗原,Western blot对重组蛋白免疫原性进行分析。用rSAG重组蛋白及rSPG分别划线,作为检测线和质控线,制作胶体金免疫层析试纸条,利用小鼠弓形虫阳性血清及小鼠阴性血清检验胶体金免疫层析试纸条检查效果。本研究成功表达纯化了SAG抗原表位的重组蛋白,且该重组蛋白具有较好的免疫原性。以此多抗原表位的重组蛋白作为检查抗原研制了胶体金免疫层析试纸条,能够快速检测弓形虫的阳性血清,为基层弓形虫病的快速诊断奠定了基础。
胶体金免疫层析试纸条;重组蛋白;弓形虫
弓形虫(Toxoplasma gondii)是一种分布广泛的专性细胞内寄生虫[1],在感染人或动物后可通过胎盘方式垂直传播,造成胎儿畸形,早产,神经系统发育障碍;也可经口传播,如饮用未经灭菌的奶制品,或使用未熟的肉类。弓形虫对宿主选择性不强,可寄生在多种动物的有核细胞中,并侵害多种组织器官。其中羊是较易感动物,感染弓形虫后表现出流产、产死胎和弱畜。因此,弓形虫给人类和养殖业都造成了严重威胁。
为了寻找敏感、特异、快速的诊断方法,国内外学者在弓形虫病诊断方面进行了大量研究。目前,常见的弓形虫病诊断方法有病原学方法、分子生物学方法、免疫学方法等[2],但多出现检出率不高、操作繁杂、灵敏度低等缺点。为适应基层大规模普查的需要,有必要研制出针对多种动物的快速检测试剂盒。目前,以胶体金为标记物,利用特异性抗原抗体反应制备的胶体免疫层析试纸条成为学者们研究的对象。国内外学者多将从感染动物中收集或经组织、细胞培养的弓形虫速殖体作为抗原制备诊断试纸条,该方法虽然特异性好,但抗原纯度较低,成份复杂,价格昂贵。原核表达系统表达出的特异性目的蛋白,具有蛋白产量高、操作简单、费用低廉等优势,成为众多学者研究的对象。本研究对弓形虫抗原基因进行生物学分析,设计并合成弓形虫膜表面抗原(surface antigen,SAG)SAG1和SAG2多表位重构基因,构建原核表达质粒,对重组的目的蛋白进行表达纯化及抗原性检测,然后进行弓形虫胶体金免疫层析试纸条的制备,为有效防控弓形虫病奠定基础。
1 材料和方法
1.1 材料
1.1.1 质粒、菌种 E.coli BL21(DE3)购自北京全式金生物技术有限公司;质粒PET-28a(+) 为实验室保存。
1.1.2 相关试剂 限制性内切酶BamH I、HindIII、T4 DNA连接酶、2×PCR mix购自TaKaRa生物工程(大连)有限公司;Protein Ruler II(12-120 kDa)购自北京全式金生物技术有限公司;弓形虫小鼠阳性血清为实验室分离保存;羊抗鼠IgG-HRP购自北京康为世纪生物科技有限公司;His-rSPG为实验室纯化保存;硝酸纤维素膜(Sartorius CN140)、玻璃纤维素膜(GL0194)、PVC胶板(DB-6)购自上海杰一生物技术有限公司;氯金酸购自Sigma公司;其他化学试剂均为分析纯。
1.2 方法
1.2.1 弓形虫SAG重组基因的构建表达 从GenBank中查出已公布的编码弓形虫表面抗原的SAG基因序列,分别分析SAG1和SAG2的B细胞抗原表位,合并抗原表位集中区段组建并优化目的基因序列,将目的基因与PET-28a(+) 载体连接后,转化至BL21(DE3) 感受态细胞,挑取完整单个菌落于含Kana的LB液体培养基中振荡培养,加入1 mmol/L的IPTG诱导,使用His亲和层析柱对表达的重组蛋白进行纯化,Western blot检测重组蛋白的免疫原性。
1.2.2 胶体金最佳PH及最佳蛋白标记量的确定 分别用K2CO3和HCl调节1 mL胶体金溶液pH至3.0、4.0、5.0、6.0、7.0、8.0、9.0,加入50 μL重组G蛋白,震荡10 min后室温放置10 min;然后每管分别加入100 μL 10%NaCl溶液,震荡10 min后室温放置10 min;观察胶体金颜色变化,记录保持红色的最低pH 值。将胶体金溶液调至标记的最佳pH值后,依次加入浓度为5、10、15、20、25、30、35、40、45、50 μg/mL的rSPG,震荡10 min后室温放置10 min;然后每管分别加入100 μL 10%NaCl溶液,震荡10 min后室温放置10 min,观察胶体金颜色变化,记录保持红色的最小重组蛋白G用量。
1.2.3 胶体金探针的制备 烧制及贮存胶体金的所有玻璃器皿在酸缸中浸泡24 h,取出后用去离子水反复冲洗,烘干备用。将100 mL去离子水和1 mL1%氯金酸置于250 mL锥形瓶中,加热至沸腾。缓慢加入1.5 mL的柠檬酸三钠,观察到溶液颜色由淡黄变黑最后逐渐稳定成紫红色后,继续煮沸15 min,冷却至室温后定容到原体积。用0.2%K2CO3调节胶体金溶液pH至最佳值5.0,逐滴加入1.5 mL 1 mg/mL(浓度为15 μg/mL)的rSPG,振荡15 min后静置15 min;加入10 mL 10%PEG20000,使其终浓度为1%,振荡15 min后静置15 min;500× g离心20 min,弃沉淀;12 000×g离心30 min,弃上清,沉淀用20 mL TBS(1/5原体积)重悬。将制备好的胶体金探针均匀滴加于金标垫上,使1.0 cm2的金标垫中含有100 μL的胶体金探针,将金标垫置于-80℃放置2 h,真空干燥。
1.2.4 胶体金免疫层析试纸条的制备 将NC膜贴于底板上,之后用胶体金点样系统进行划线。分别用rSAG和rSPG(0.5 mg/mL)作为检测线(T线)和质控线(C线)。SAG重组蛋白划线设置两个划线量,分别是1 μL/cm、2 μL/cm;重组蛋白G划线量是1 μL/cm,划线后将底板置于37℃烘箱过夜烘干。将金标垫、样品垫、吸水纸依次贴于含有NC膜的底板上,用贴条机以0.3 cm的宽度切条。
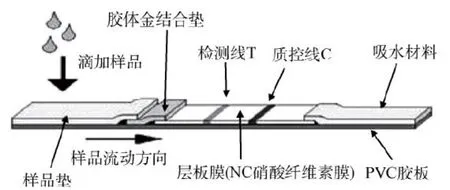
图1 试纸条的组装Fig.1 The assembly of strip
1.2.5 试纸条检测结果的判定 吸取适量待检样品滴加到试纸条的样品垫上,静置5 min。若T线和C线均显色,则结果为阳性;T线不显色,C线显色,则样品为阴性;若C线不显色,则试纸条无效。阳性血清按浓度比1:10、1:20、1:40、1:80稀释,观察出现阳性反应的最高稀释倍数。
2 结果与讨论
2.1 弓形虫SAG1和SAG2基因序列的构建合成 SAG1和SAG2抗原都是弓形虫特异性表膜抗原,以糖磷脂酰化形式锚定在细胞膜上[3],以阻止吞噬细胞对侵袭的弓形虫进行吞噬消化。SAG1主要与弓形虫毒力相关[4];SAG2与弓形虫入侵宿主细胞有密切的关系。有研究表明,弓形虫感染后的血清抗体能够识别SAG1和SAG2表面抗原[5],并己证实该基因编码的重组抗原可作为诊断抗原,用于弓形虫速殖子感染的免疫学检测。将不同特异性抗原联合使用作为诊断抗原,才可能增加检测的灵敏性。我们通过生物信息学的方法预测这两个蛋白的B细胞抗原表位,将这些抗原表位串联在一起集中表达,以取代原蛋白。这种方法将两个蛋白的抗原信息整合在一起,保留了两个蛋白的大部分抗原信息,克服了各自蛋白的缺点,有望提高检测的灵敏性和特异性。为了利用原核表达重组抗原,将基因信息中的稀有密码子替换成大肠杆菌的偏爱密码子,达到了产量高,易于纯化的目的,可确保诊断抗原的规范化生产和质量控制(图2)。
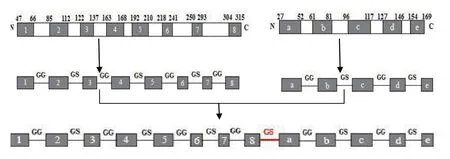
图2 弓形虫SAG基因序列的构建Fig.2 Construction of SAG gene sequence of Toxoplasma gondii
2.2 胶体金标记His-rSAG的最佳pH值和最佳蛋白标记量 用 K2CO3及 HCl 调节胶体金的 pH 值,根据肉眼观察 pH 值为5.0 时为保持红色最低pH值(图2)。调节胶体金 pH 至5.0,加入His-rSAG,用蛋白浓度梯度法,测定胶体金结合蛋白的最低量,结果显示,最佳蛋白标记浓度是15 μg/mL(图3)。
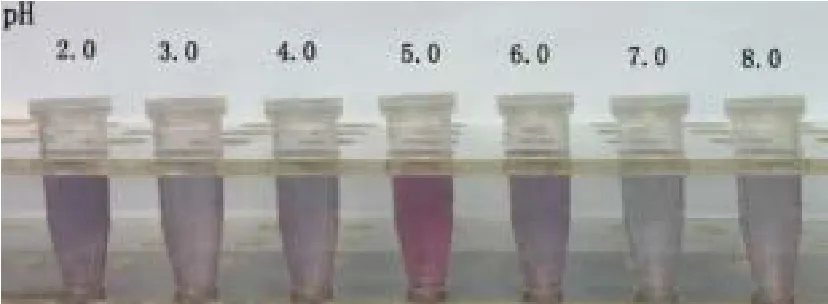
图2 胶体金标记His-rSPG的最佳pH值Fig.2 The optimal pH of gold colloid binding His-rSPG

图3 胶体金标记的最佳蛋白标记浓度Fig.3 The optimal concentration of gold colloid binding His-rSPG
2.3 重组蛋白表达纯化及Western blot鉴定结果rSAG在大肠杆菌BL21(DE3)中成功表达,并顺利纯化出大小约50 kDa的重组蛋白。Western blot结果显示,重组蛋白能够与小鼠阳性血清发生特异性结合(图4)。
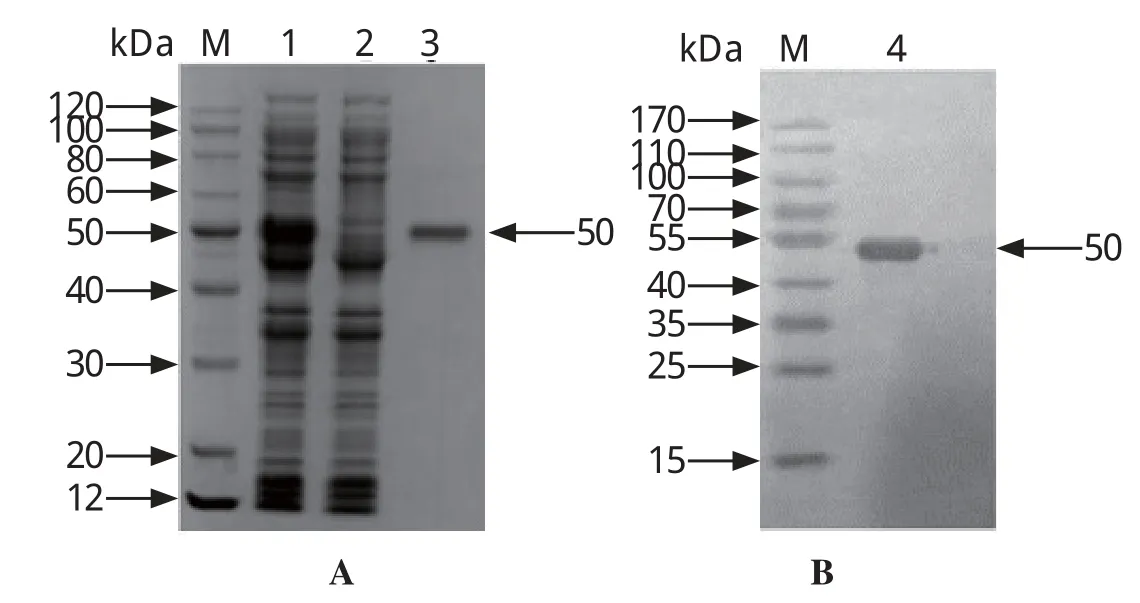
图4 重组蛋白SAG纯化结果(A)及Western blot(B)分析Fig.4 Puri fi cation result(A) and Western blot(B) of recombinant protein SAG
SAG基因的成功表达为弓形虫胶体金免疫层析试纸条的制备奠定基础。
2.4 胶体金免疫层析试纸条检测小鼠血清 重组蛋白rSAG划线量为2 μL/cm的试纸条与阳性血清反应明显,rSAG划线量为1 μL/cm的阳性血清反应不明显,结果反映为阳性,阳性血清浓度稀释至1:40仍可检测到明显的阳性反应。两种划线浓度制备的试纸条与阴性血清均不反应,结果反映为阴性(图5)。
胶体金作为一种快速诊断方法已广泛应用于寄生虫病检测中,王艳华等[6]制备了弓形虫抗体免疫胶体金快速诊断试纸条,并与IHA法进行对照,结果显示两种方法符合率达82.5%,且敏感度高于IHA。唐雨德等[7]应用胶体金免疫层析法检测囊虫抗体,并与ELISA法作对照,结果的符合率达96.8%。李学伍等[8]研制出旋毛虫病快速金标试纸条,该试纸条与ELISA检测结果符合率达100%。上述研究也进一步证明胶体金免疫层析试纸条在寄生虫病快速检测中发挥着重要作用。

图5 试纸条与小鼠弓形虫病血清样品反应结果Fig.5 The results of mouse toxoplasmosis positive serum with GICA
胶体金颗粒表面所带的负电荷可以与蛋白质的正电荷基团通过静电感应发生物理吸附,物理吸附作用对蛋白质的生物活性影响较小,从而更容易标记[9]。本次研制的试纸条依然采用柠檬酸三钠还原法制备胶体金并标记重组G蛋白,该试纸条应用的重组G蛋白保留了G蛋白同多种哺乳动物血清IgG的Fc段结合特性,去除了同IgG的Fab段和血清白蛋白结合部位,不仅提高了同IgG的结合力,而且减少了非特异性反应[10]。因此,本试纸条理论上可以作为多种哺乳动物弓形虫病的血清抗体检测。
用弓形虫的标准阴阳性血清检测研制的试纸条,获得了预期结果(表1)。本研究初步建立了快速检测弓形虫病的诊断方法,今后将对该试纸条的灵敏度、特异性及交叉反应性做进一步验证。

表1 不同稀释倍数的小鼠血清反应结果Table 1 Results of different dilution ratio of mice serum
[1] 李倩, 张莉, 李海龙, 等. 非人灵长类弓形虫病研究进展[J]. 中国人兽共患病学报, 2014, 30(5): 516-520.
[2] 李健, 杨秀珍, 梁东春, 等. PCR和ELISA检测弓形虫实验研究[J]. 中国人兽共患病学报, 2006, 22(4): 356-359.
[3] 何勇, 周鹏, 尹创成, 等. 弓形虫主要表面抗原的研究进展[J]. 畜牧与兽医, 2010, 42(5): 95-98.
[4] Huang X, Xuan X, Suzuki H, et al. Characterization of Toxoplasma gondii SAG2 expressed in insect cells by recombinant baculovirus and evaluation of its diagnostic Potential in an enzyme- linked immunosorbent assay[J].Clin Vaccine Immunol, 2002, 9(6):1343-1347.
[5] Parmley S F, Sgarlato G D, Mark J, et al. Expression,characterization, and serologic reacyivity of recombinant surface antigen P22 of Toxoplasma gondii[J]. J Clin Microbiol, 1992, 30(5): 1127-1133.
[6] 王艳华, 李克生, 才学鹏, 等. 弓形虫抗体免疫胶体金快速检测试纸条的研制[J]. 中国兽医科学, 2007, 30(01):29-32.
[7] 唐雨德, 周东明, 陆承平. 快速检测猪囊虫抗体的金免疫层析法的建立及应用[J]. 中国人兽共患病杂志, 2003,19(5): 77-79.
[8] 李学伍, 张改平, 邓瑞广, 等. 猪旋毛虫病快速检测试纸条的研制及特性测定[J]. 畜牧兽医学报, 2004, 35(3),343-346.
[9] 陈小锋, 刘曙照. 胶体金标记免疫分析及其在小分子化合物快速检测中的应用[J]. 药物生物技术, 2004, 11(4):278-280.
[10] 许瑞, 赵登云, 洪炀, 等. 链球菌蛋白G的结构域重构、表达及鉴定[J]. 中国动物传染病学报, 2015, 23(5): 46-52.
DEVELOPMENT OF COLLOIDAL GOLD IMMUNOCHROMATOGRAPHIC STRIP ASSAY FOR TOXOPLASMOSIS DIAGNOSIS
WANG Zhao-zhe1, XU Rui1, HONG Yang1, LIN Jiao-jiao1,2, LU Ke1, LI Hao1, CHEN Zhao-guo1,TANG Ya-lan1, WU Si-min1, JIANG Jia-xin1, LI Jia-jing1, ZHU Chuan-gang1
(1. Natural Laboratory of Animal Schistosomiasis Control, Key Laboratory for Animal Parasitology, Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China)
In order to develop a colloidal gold immunochromatographic strip assay for toxoplasmosis diagnosis, the surface antigen genes of SAG1 and SAG2 of Toxoplasma gondii were synthesized and subcloned into plasmid pET-28a(+) to be expressed in Escherichia coli BL21(DE3). To obtain high concentrations of recombinant SAGs, the target proteins were purified using His-fusion protein puri fi cation kit and analyzed in Western blotting. Recombinant SAG1 and SAG2 were blotted on the nitrocellulose membrane and murine T. gondii positive and negative serum samples were then added as primary antibodies to test the sensitivity of colloidal gold immune chromatography strip. Development of the method laid a foundation for rapid diagnosis of toxoplasmosis at the grass-roots levels.
Colloidal gold immunochromatographic strip; recombinant protein; Toxoplasma
S852.723
B
1674-6422(2017)05-0068-05
2017-01-10
国家重点研发计划(2017YFD0501306);中央级公益性科研院所基本科研业务费(2017JB20)
王钊哲,女,硕士,实习研究员,主要从事动物血吸虫病研究
朱传刚,E-mail: zcg@shvri.ac.cn
