骨形成蛋白2在脑多形性胶质母细胞瘤中的表达及临床意义
2017-11-08张少校吴瑛
张少校,吴瑛
(1. 辽宁省盘锦市中心医院VIP病房,辽宁 盘锦 124010; 2. 中国医科大学附属第一医院全科医学科,沈阳 110001)
骨形成蛋白2在脑多形性胶质母细胞瘤中的表达及临床意义
张少校1,吴瑛2
(1. 辽宁省盘锦市中心医院VIP病房,辽宁 盘锦 124010; 2. 中国医科大学附属第一医院全科医学科,沈阳 110001)
目的分析人多形性胶质母细胞瘤(GBM)中骨形成蛋白2 (BMP2)表达的预后意义和可能的相关信号机制。方法利用癌症基因组图谱(TCGA) 数据库获取GBM标本的RNASeqV2数据,从人类肿瘤相关基因表达汇编(GEO) 数据库下载GBM样本数据集GSE7696的表达谱数据。利用单因素Kaplan-Meier和多因素COX逐步回归法确定BMP2表达与GBM患者预后的关系。利用基因集富集分析方法预测BMP2相关的基因通路。结果低表达BMP2是GBM术后患者预后不良的独立因素。BMP2 低表达富集了干扰素α反应的相关通路。结论GBM组织中BMP2低表达预示患者预后不良,其作用机制可能是干扰素α反应基因异常。
骨形成蛋白2; 多形性胶质母细胞瘤; 癌症基因组图谱; 基因表达汇编
网络出版时间:
多形性胶质母细胞瘤(glioblastoma multiforme,GBM)是恶性程度最高的颅内恶性肿瘤,呈高度浸润性且血供丰富,还具有独特的免疫体系和较强的逃避免疫监视功能[1],深入研究GBM发生发展的基因分子机制,对于改善GBM的诊治以及患者的预后有重要的临床意义。
骨形成蛋白家族(bone morphogenetic proteins,BMPs)属于转化生长因子β超家族,BMPs在多种恶性肿瘤中表达并影响其发生、发展[2]。BMP2为活性较强的BMPs成员之一,与GBM关系密切,但作用机制不明[3]。本研究利用在线高通量数据,采用生物信息学分析方法探讨BMP2在GBM组织中的表达及意义。
1 材料与方法
1.1 资料收集
本研究利用癌症基因组图谱(the cancer genome atlas,TCGA) 数据库(https://tcga-data.nci.nih.gov/tcga/)下载并预处理GBM的RNASeqV2 数据( level 3)。TCGA 数据集共纳入有完整生存资料和mRNA表达谱的GBM患者152例(男98例、女54例,中位年龄60.5岁) 。利用美国国家生物信息技术中心(national center for biotechnology information,NCBI)的人类肿瘤相关基因表达汇编(gene expression omnibus,GEO) 数据库(http:://www.ncb.nlm.nih.gov/geo)下载GBM样本数据集GSE7696的表达谱数据,仅保留原发GBM且临床资料和生存信息完整的病例。GSE7696数据集共纳入GBM术后患者70例 (男51例、女19 例,中位年龄52.2岁)。
1.2 TCGA数据集BMP2 表达与患者预后的关系
提取BMP2的表达数据。评估的终点指标为患者的总生存。采用R的Maxstat函数包(常用统计学软件,可用于线性、非线性回归、多因素、相关及时间序列分析[4])确定区分BMP2表达水平分级的最佳界值[5]。根据该值,两分BMP2的表达数据为“高表达”和“低表达”2组。R/survival函数包用于生存分析。Kaplan-Meier法用于绘制生存曲线,多因素COX逐步回归法用于确定预后相关的独立因素。P < 0.05 为差异有统计学意义。
1.3 生存分析结果的外部验证
GSE7696数据集[6]以探针信号强度反映基因的相对表达量,若同一基因的多个探针信号强度不同,则取其中位数。由低到高对BMP2表达水平进行排序,<33%为低表达,33%~67%为中表达,>67%为高表达。利用多因素COX逐步回归法,以患者年龄、性别以及术后治疗方案等指标作为调整因素,研究BMP2表达是否是GBM术后患者的独立预后因素。P < 0.05 为差异有统计学意义。
1.4 BMP2基因集富集分析(gene set enrichment analysis,GSEA)
GSEA将芯片表达数据进行排序,然后与预先构建好的功能基因集进行比较,寻找这些基因在选定功能基因集中出现与否以及排序位置,分析是否具有共同的表达趋势,以此来解读数据中蕴含的生物学信息[7]。本研究采用GSEA2.2.2 版软件,根据TCGA 数据集BMP2 表达的中位值( 原始读长为2.97) 将患者分为低表达和高表达2组,选用GSEA网站MsigDB 数据库中的h.all.v5.2.symbols.gmt 数据集作为参照基因集,分析不同BMP2 表达对参照基因集各个通路的影响。进行GSEA时,采用缺省加权富集统计以及1 000次的随机组合次数,有统计学意义的富集基因集的确立标准是P < 0.05以及错误发现率(false discovery rate,FDR) < 0.25 。
2 结果
2.1 利用TCGA数据集分析不同BMP2 表达与GBM患者生存的关系
根据R的Maxstat函数包确定BMP2表达水平分级的最佳界值为6.4(图1),据此将GBM患者分为2个亚组,BMP2高表达组为21例,低表达组为131例。进一步进行生存分析,结果显示,在TCGA 数据集中BMP2 低、高表达者的中位生存时间分别为34.0和42.5个月,二者比较有统计学差异(P = 0.018),见图2 。
2.2 利用GSE7696 数据集进行外部验证
在GSE7696数据集的70例患者中,BMP2低、中、高表达者分别为23、24和23例。以年龄、性别、术后辅助治疗方案为调整因素,以BMP2表达水平为自变量,进行多因素COX分析。结果显示,BMP2是GBM术后患者的独立预后因素,低表达BMP2提示患者预后不佳(HR = 1.441,P = 0.029),见表1。

图1 利用R的maxstat函数包确定BMP2表达分级的最佳界值Fig.1 Cutoff for the significance of BMP2 expression calculated using the R maxstat package
2.3 BMP2 的功能基因集GSEA情况
根据本研究中富集基因集的确立标准,BMP2低表达样本所富集的是干扰素α(interferon α,IFN-α)反应上调的82个标志性基因(P < 0.01,FDR =0.000 4)。见图3。

图2 利用Kaplan-Meier法确定BMP2表达与患者预后的关系Fig.2 Kaplan-Meier analysis showing the correlation between BMP2 expression and survival
3 讨论
在目前发现的超过40种BMP中,BMP2为活性最高的多能细胞因子,可影响细胞的迁移、分化、增殖、凋亡以及基因的转录表达,参与调控中胚层形成、神经系统发生等多种生理过程[8],加速骨关节炎、骨质疏松症等多种疾病的进程[2-8]。BMP2 表达异常还影响肺癌、乳腺癌和结肠癌等多种恶性肿瘤的发生、发展或转归[9],肿瘤细胞增殖、凋亡与侵袭、转移以及肿瘤血管新生相关途径被确认为主要相关作用机制[10]。与正常脑组织相比较,BMP2在胶质瘤中表达量增高,且与恶性程度分级呈正相关[11]。进一步研究[12]证实,BMP通过拮抗多种与维持GBM干细胞特征相关的因子而影响GBM的发生与发展。缺氧是促进GBM的重要因素,而BMP2通过下调缺氧诱导因子1α的稳定性影响原代GBM细胞的稳定性[13],并增强GBM干细胞样细胞对替莫唑胺的敏感性,促进细胞凋亡[12]。但是,目前BMP2与GBM患者生存的关系及相关机制尚不明确。
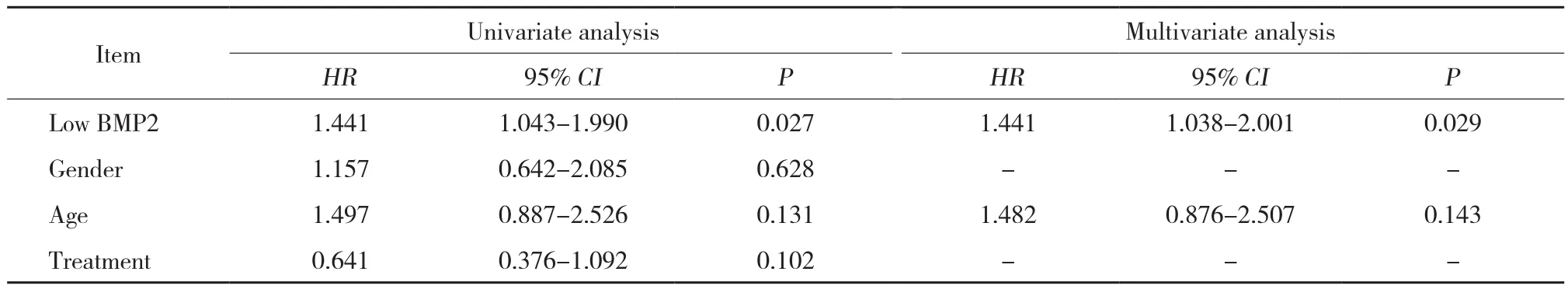
表1 BMP2表达与患者生存关系的单因素和多因素分析Tab.1 Univariate and multivariate Cox regression analysis of the relationship between BMP2 expression and survival

图3 GSEA确定BMP2 低表达富集到IFN-α反应相关基因Fig.3 GSEA identified that IFN-αresponse-genes were enriched in samples with low BMP2 expression
本研究利用TCGA 和GEO 数据集,结合生物信息学分析,证实在GBM组织中,BMP2 高表达患者的生存期更长,2个数据集的结果一致。因此,BMP2表达可作为评价GBM患者预后的指标。
干扰素家族蛋白是由宿主细胞产生并释放于机体内,应对多种病原,如病毒、细菌以及恶性肿瘤细胞等,调节机体免疫反应的重要治疗性细胞因子[14],包括Ⅰ型和 Ⅱ型两大类。作为Ⅰ型干扰素和重要的抗肿瘤性细胞因子,IFN-α已被广泛用于慢性髓细胞白血病和多发性骨髓瘤等多种血液病以及淋巴瘤和胃肠道肿瘤等实体肿瘤的治疗[15]。然而,IFN-α内源性抵抗是导致多种恶性肿瘤免疫逃逸,影响患者预后和免疫治疗疗效的重要因素[15]。与多种恶性肿瘤相比,GBM对干扰素原发耐药,但是机制不清。本研究GESA方法发现,BMP2低表达的样本中富集了IFN-α作用后上调的基因,提示BMP2低表达可能与IFN-α的内源性抵抗以及耐药有关。BMP2基因可能对抗GBM细胞中IFN-α内源性抵抗相关的标志性基因的上调,降低肿瘤细胞的IFN-α抵抗和免疫逃逸过程。
GBM呈现高度浸润性,并有血脑屏障保护,进行传统的手术、放疗或化疗的疗效差。免疫治疗可作为GBM的第4种治疗模式。然而,GBM的免疫逃逸生物学特性又是影响恶性肿瘤广泛浸润、治疗疗效和患者预后的重要因素。因此,深入研究GBM的免疫逃逸机制,对增强免疫治疗的疗效、改善GBM患者的预后至关重要。下阶段可以利用GBM临床标本,联合检测BMP2基因和IFN-α反应性基因的表达,评估其预后价值并进一步探讨相关分子机制。
综上所述,本研究利用TCGA及GEO数据库推测出GBM组织BMP2低表达提示GBM患者预后不佳,IFN-α反应相关基因的调节可能是BMP2在GBM中的作用机制。
and future of immunotherapy for glioblastoma [J]. Expert Opin Biol Ther,2016,16(10):1245-1264.
10.1080/14712598.2016.1212012.
[2] ZAID KW,CHANTIRI M,BASSIT G. Recombinant human bone morphogenetic protein-2 in development and progression of oral squamous cell carcinoma [J]. Asian Pac J Cancer Prev,2016,17(3):927-932.
[3] ELSTNER A,STOCKHAMMER F,NGUYEN-DOBINSKY TN,et al.Identification of diagnostic serum protein profiles of glioblastoma patients [J]. J Neurooncol,2011,102(1):71-80. DOI:10.1007/s11060-010-0284-8.
[4] HOTHORN T,ZEILEIS A. Generalized maximally selected statistics [J]. Biometrics,2008,64(4):1263-1269. DOI:10.1111/j.1541-0420.2008.00995.x.
[5] WRIGHT MN,DANKOWSKI T,ZIEGLER A. Unbiased split variable selection for random survival forests using maximally selected rank statistics [J]. Stat Med,2017,36 (8):1272-1284. DOI:10.1002/sim.7212.
[6] MURAT A,MIGLIAVACCA E,GORLIA T,et al. Stem cell-related“self-renewal” signature and high epidermal growth factor receptor expression associated with resistance to concomitant chemoradiotherapy in glioblastoma [J]. J Clin Oncol,2008,26(18):3015-3024.DOI:10.1200/JCO.2007.15.7164.
[7] SUBRAMANIAN A,TAMAYO P,MOOTHA VK,et al. Gene set enrichment analysis:a knowledge-based approach for interpreting genome-wide expression profiles [J]. Proc Natl Acad Sci USA,2005,102(43):15545-15550. DOI:10.1073/pnas.0506580102.
[8] KAMIYA N. The role of BMPs in bone anabolism and their potential targets SOST and DKK1 [J]. Curr Mol Pharmacol,2012,5(2):153-163.
[9] XU J,ROGERS MB. Modulation of bone morphogenetic protein (BMP)2 gene expression by Sp1 transcription factors [J]. Gene,2007,392(1/2):221-229. DOI:10.1016/j.gene.2006.12.032.
[10] ZAID KW,NHAR BM,GHADEER ALANAZI SM,et al. Lack of effects of recombinant human bone morphogenetic protein2 on angiogenesis in oral squamous cell carcinoma induced in the syrian hamster cheek pouch [J]. Asian Pac J Cancer Prev,2016,17(7):3527-3531.
[11] SCHNEIDER L,PELLEGATTA S,FAVARO R,et al. DNA damage in mammalian neural stem cells leads to astrocytic differentiation mediated by BMP2 signaling through JAK-STAT [J]. Stem Cell Reports,2013,1(2):123-138. DOI:10.1016/j.stemcr.2013.06.004.
[12] PERSANO L,PISTOLLATO F,RAMPAZZO E,et al. BMP2 sensitizes glioblastoma stem-like cells to Temozolomide by affecting HIF-1alpha stability and MGMT expression [J]. Cell Death Dis,2012,3:e412. DOI:10.1038/cddis.2012.153.
[13] PISTOLLATO F,RAMPAZZO E,ABBADI S,et al. Molecular mechanisms of HIF-1alpha modulation induced by oxygen tension and BMP2 in glioblastoma derived cells [J]. PLoS One,2009,4(7):e6206. DOI:10.1371/journal.pone.0006206.
[14] DE ANDREA M,RAVERA R,GIOIA D,et al. The interferon system:an overview [J]. Eur J Paediatr Neurol,2002,6 Suppl A:A41-46;discussion A55-48.
[15] LIU R,LUO F,LIU X,et al. Biological response modifier in cancer immunotherapy [J]. Adv Exp Med Biol,2016,909:69-138. DOI:10.1007/978-94-017-7555-7_2.
(编辑 于 溪)
[1] KAMRAN N,CALINESCU A,CANDOLFI M,et al. Recent advances
Analysis of the Clinical Significance of Bone Morphogenetic Protein 2 in Glioblastoma Multiforme
ZHANG Shaoxiao1,WU Ying2
(1. VIP Department,Liaoning Provincial Panjin City Centre Hospital,Panjin 124010,China; 2. General Practice Department,The First Hospital,China Medical University,Shenyang 110001,China)
ObjectiveTo investigate the prognostic significance of bone morphogenetic protein 2 (BMP2) expression in glioblastoma multiforme (GBM) and related pathways.MethodsRNASeqV2 data and GSE7696 series matrix data were downloaded from The Cancer Genome Atlas (TCGA) and The Gene Expression Omnibus (GEO) database,respectively. The correlation between BMP2 expression and prognosis was evaluated using Kaplan-Meier and multivariate COX analysis. Gene set enrichment analysis (GSEA) was used to predict the functional gene sets and/or pathways modulated by BMP2.ResultsDecreased expression of BMP2 is an independent predictor of poor prognosis. Furthermore,genes that are upregulated in response to interferon-αproteins were enriched in samples with low BMP2 expression.ConclusionLow expression of BMP2 indicates poor prognosis in GBM patients. Genes that are upregulated in response to interferon-α proteins may also be implicated in prognosis.
bone morphogenetic protein 2; glioblastoma multiforme; the cancer genome atlas; gene expression omnibus
R739.4
A
0258-4646(2017)11-0976-04
10.12007/j.issn.0258-4646.2017.11.004
国家自然科学基金( 81302023,81201801)
张少校(1978-),男,副教授,硕士.
吴瑛,E-mail:1779716865@qq.com
2017-04-14
