miR-218-1-3p对非小细胞肺癌细胞增殖、周期及凋亡的影响
2017-11-08栾岚张天戈韩斌罗文婷吴非廖鑫张君杰白阳程新宇滕猛王翠芳
栾岚,张天戈,韩斌,罗文婷,吴非,廖鑫,张君杰,白阳,程新宇,滕猛,王翠芳
(1. 沈阳医学院附属中心医院病理科,沈阳 110024; 2. 中国医科大学附属盛京医院泌尿外科,沈阳 110004)
miR-218-1-3p对非小细胞肺癌细胞增殖、周期及凋亡的影响
栾岚1,张天戈2,韩斌2,罗文婷2,吴非1,廖鑫1,张君杰1,白阳1,程新宇1,滕猛1,王翠芳1
(1. 沈阳医学院附属中心医院病理科,沈阳 110024; 2. 中国医科大学附属盛京医院泌尿外科,沈阳 110004)
目的探究miR-218-1-3p对非小细胞肺癌A549细胞周期和凋亡的影响。方法使用LipofectamineTM2000 Reagent将miR-218-1-3p模拟物转染入非小细胞肺癌A549细胞中,实时PCR检测细胞中miR-218-1-3p的表达,MTS法检测miR-218-1-3p对A549细胞增殖的影响,流式细胞仪检测转染miR-218-1-3p的A549细胞周期及凋亡的改变,荧光定量PCR检测细胞增殖、周期和凋亡相关指标变化。结果同对照组相比,miR-218-1-3p模拟物组细胞生长受到明显抑制(P < 0.05),S期和G2-M期细胞比例明显降低(P < 0.05),此外miR-218-1-3p模拟物组早期凋亡细胞比例较对照组明显增加(P < 0.05)。继续检测了与细胞增殖、周期和凋亡相关的指标,其中CYCLIN-D1和BCL-2的表达显著下调。结论miR-218-1-3p可能通过调控CYCLIN-D1和BCL-2,从而抑制非小细胞肺癌A549细胞的增殖,对其产生细胞周期阻滞并促进其凋亡。
miR-218-1-3p; 非小细胞肺癌; 增殖; 周期; 凋亡
网络出版时间:
肺癌是世界上第二常见的癌症,其中80%以上的肺癌是非小细胞肺癌[1]。其诊断和治疗虽然在近几年取得了一定的进步,但肺癌患者的总体生存率仍然不佳[2]。microRNA(miRNA)是一类能够参与调节生长、发育和细胞凋亡等多种生物过程的内源性非编码小分子RNA[3],它同时可以调控其靶基因参与细胞癌变并调节癌症的转移过程。miRNA的基因变异同癌症的发生风险、预后以及生存相关[4-6]。miR-218是重要的miRNA之一,它能够对多种肿瘤的发生与发展起到抑制作用[7]。本研究通过调节非小细胞肺癌A549细胞中miR-218-1-3p的表达,检测细胞增殖、周期和凋亡的变化,进而探讨miR-218-1-3p对非小细胞肺癌细胞增殖、周期及凋亡的影响。
1 材料与方法
1.1 材料
DMEM培养基,10%胎牛血清购自以色列bi公司,Trizol试剂和转染试剂LipofectamineTM2000购自美国Invitrogen公司,细胞周期检测试剂盒购自中国Keygentec公司,细胞凋亡检测试剂盒购自澳大利亚Bender Medsystem公司,人肺腺癌A549细胞购自中科院上海细胞库。
1.2 方法
1.2.1 实时PCR:根据操作说明采用Trizol (美国Invitrogen公司)提取细胞中的总RNA。以RNU6B作为内参对照,根据操作说明使用miR-218-1-3p特异引物在ABI 7900HT (美国Applied Biosystems公司)中运行检测miR-218-1-3p (中国RiboBio公司)的表达。以GAPDH作为内参对照,使用Primer 5软件设计普通基因引物,其序列参见下表。通过3次独立实验并采用公式RQ=2-∆∆Ct进行数据分析。

表1 目的基因序列Tab.1 Primer sequences
1.2.2 细胞培养和转染:使用含10%胎牛血清的高糖 DMEM培养基于37 ℃、5%CO2的细胞培养箱中常规传代培养。转染前将细胞种入6孔板,依照操作说明用LipofectamineTM2000 Reagent试剂盒进行细胞转染,将转染入miR-218-1-3p模拟物组设置为实验组,转染入对照模拟物组设置为对照组。
1.2.3 细胞生长曲线检测:将转染miR-218-1-3p模拟物组和对照组细胞分别接种于96孔板中,每孔设置3个复孔,取24、48、72、96和120 h 5个时间点,结束培养前2 h每孔加入20 μ L细胞增殖比色测定试剂(MTS Cell Proliferation Colorimetric Assay Kit),置于37 ℃、5%CO2细胞培养箱中。2 h后利用全自动酶标仪测490 nm波长的OD值,并绘制生长曲线。
1.2.4 细胞周期检测:按照操作说明使用细胞周期检测试剂盒,检测细胞周期。细胞在6孔板中转染48 h后,75%乙醇固定,PI染色,使用BD流式细胞仪检测,每组进行3次独立重复试验。
1.2.5 细胞凋亡检测:按照操作说明,使用细胞凋亡检测试剂盒检测细胞凋亡。细胞在6孔板中转染48 h后,Annexin V、PI染色,使用BD流式细胞仪检测,每组进行3次独立重复试验。
1.3 统计学分析
采用SPSS 16.0软件进行统计学分析。实时定量结果数据经过log2转换,使用x-±s进行描述。采用独立t检验分析转染miR-218-1-3p 模拟物组与对照组细胞增殖、周期和凋亡的差异。P < 0.05为差异有统计学意义。
2 结果
2.1 miR-218-3p抑制A549细胞增殖
将miR-218-1-3p 模拟物转染入A549细胞后48 h,实时定量PCR方法检测转染miR-218-1-3p,模拟物组中miR-218-1-3p的表达上调1 833倍(P < 0.01,图1A),说明转染有效。转染后连续5 d使用MTS方法检测细胞增殖,绘制细胞增殖曲线,与对照组相比,miR-218-1-3p 模拟物组细胞生长受到明显抑制(P <0.05,图1B),可见miR-218-1-3p能抑制A549细胞增殖。
2.2 miR-218-1-3p对A549细胞周期的影响
在A549细胞中转染miR-218-1-3p 模拟物,48 h后经过PI染色,使用流式细胞仪检测细胞周期变化,上调miR-218-1-3p组G0/G1期细胞比例同对照组相比上调了167%(P < 0.05),而S期和G2/M期细胞比例同对照组相比分别下降了16%和51% (P 均<0.05)。见图2。
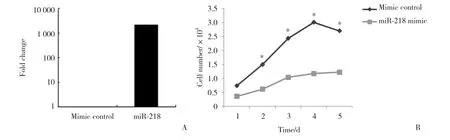
图1 A549细胞中转染miR-218-1-3p 模拟物后转染效率的验证以及对增殖能力的影响Fig.1 Validation of transfection efficiency of miR-218-1-3p mimic and effect of proliferation ability in A549 cells
2.3 miR-218-1-3p促进A549细胞凋亡
在A549细胞中转染miR-218-1-3p模拟物,48 h后经过PI/Annexin V双染,使用流式细胞仪检测细胞凋亡变化,上调miR-218-1-3p组早期凋亡细胞比例为2.19%,较对照组的1.03%明显增加(P < 0.05),可见在A549细胞中miR-218-1-3p可以促进细胞凋亡。见图3。

图2 A549细胞中转染miR-218-1-3p模拟物后细胞周期的变化Fig.2 Changes in cell cycle and in A549 cells after transfection with miR-218-1-3p mimic
2.4 A549细胞中上调miR-218-1-3p相关指标变化
将miR-218-1-3p模拟物转染入A549细胞中48 h后收集细胞,提取RNA,实时PCR检测细胞增殖、周期和凋亡相关指标Rho A,Rho B,Rho C,CYCLIN A1,CYCLIN B,CYCLIN D1,BCL-2 和 Caspase-3的变化,其中上调miR-218-1-3p组CYCLIN D1的表达水平降低至对照组的(0.58±0.20)倍(P < 0.05),BCL-2的表达水平降低至对照组的(0.65±0.15)倍(P <0.05)。
3 讨论
肺癌是世界上第二常见的肿瘤,也是全球癌症相关死亡的主要原因。尽管手术和药物治疗取得了一定的进展,但是肺癌患者的总体生存率仍然很低[8]。由于其增殖能力快速,导致被确诊时大多已经处于晚期而不可治愈[9],因此抑制肿瘤细胞的增殖对治疗肺癌起到至关重要的作用。
miRNA是一类非编码RNA,是基因表达的转录后调控子。miRNA可以同时调节多个基因或通路从而影响整个基因网络,调节生物过程,而miRNA的异常表达可以导致许多疾病的发生[9]。研究[10]表明,在非小细胞肺癌中存在14种miRNA的表达发生改变。

图3 A549细胞中转染miR-218-1-3p模拟物后细胞凋亡情况的变化Fig.3 Changes in apoptosis in A549 cells after transfection with miR-218-1-3p mimic
miR-218作为脊椎动物的特异miRNA,在肿瘤的发生发展中起着至关重要的作用,它通过结合受体蛋白质酪氨酸磷酸酶、高迁移率族蛋白B1、5’-氨基酮戊酸合成酶2等多个靶基因的3’非翻译区抑制靶基因的表达发挥生物学作用[11-13]。本研究组之前的研究[14]已经证实,miR-218-1-3p在非小细胞肺癌组织中低表达并与淋巴结转移相关。本研究中MTS实验测得转染miR-218-1-3p模拟物组细胞的OD值同对照组相比均有不同程度降低,说明转染miR-218-1-3p模拟物组细胞的活性下降,其增殖能力受到影响。本研究还使用流式细胞仪检测转染miR-218-1-3p模拟物组及对照组细胞周期与凋亡的变化,其中实验组G0/G1期细胞比例同对照组相比显著提高(P < 0.05),而S期和G2/M期细胞比例则有明显降低(P < 0.05),S期为DNA合成期,是细胞分裂增殖关键时期,细胞周期实验表明,miR-218-1-3p的上调抑制了A549细胞的增殖能力。同时,转染miR-218-1-3p模拟物组早期凋亡细胞比例为对照组的2.13倍(P < 0.05),说明miR-218-1-3p可以增加非小细胞肺癌细胞A549的凋亡率,差异有统计学意义。CYCLIN D1是细胞增殖的关键调节因子,作为主要的有丝分裂传感器,CYCLIN D1与CDK4/CDK6二聚化形成全酶的调节亚基,通过磷酸化pRb蛋白调控细胞的G1/S期的进展,在细胞信号网络和细胞周期中起到连接的作用。CYCLIN D1水平的改变对细胞增殖和细胞周期的影响非常明显,其过度表达可在多种肿瘤中检测到[15-16],BCL-2为抗凋亡家族成员,其通过约束促凋亡蛋白Bax和Bak来抑制细胞凋亡,BCL-2的过表达同样可在多种恶性肿瘤细胞中被检测到[17]。实时荧光定量PCR检测证实,转染miR-218-1-3p模拟物组CYCLIN D1和BCL-2表达均有明显下降,因此推测miR-218-1-3p可能通过调控CYCLIN D1和BCL-2的表达从而对A549细胞产生细胞周期阻滞并促进其凋亡。
综上所述,本研究初步证明miR-218-1-3p可以降低非小细胞肺癌细胞A549细胞S期比例,抑制A549细胞的增殖,促进其凋亡。下一步的研究方向将明确其促进细胞凋亡的具体途径,这对于寻找miR-218-1-3p在非小细胞肺癌A549细胞中的作用位点,进而探寻基因治疗非小细胞肺癌新的作用靶点有着非常重要的意义。
[1] FARHAT FS,HOUHOU W. Targeted therapies in non-small cell lung carcinoma:what have we achieved so far [J]. Ther Adv Med Oncol,2013,5(4):249-270. DOI:10.1177/1758834013492001.
[2] WANG D,NARULA N,AZZOPARDI S,et al. Expression of the receptor for hyaluronic acid mediated motility (RHAMM) is associated with poor prognosis and metastasis in non-small cell lung carcinoma[J]. Oncotarget,2016,7(26):39957-39969. DOI:10.18632/oncotarget.9554.
[3] WANG J,LI Z,GE Q,et al. Characterization of microRNA transcriptome in tumor,adjacent,and normal tissues of lung squamous cell carcinoma [J]. J Thorac Cardiovasc Surg,2015,149(5):1404-1414.DOI:10.1016/j.jtcvs.2015.02.012.
[4] WU S,SHEN W,PAN Y,et al. Genetic variations in key microRNAs are associated with the survival of nonsmall cell lung cancer[J]. Medicine (Baltimore),2015,94(47):e2084. DOI:10.1097/MD.0000000000002084.
[5] CHIU KL,KUO TT,KUOK QY,et al. ADAM9 enhances CDCP1 protein expression by suppressing miR-218 for lung tumor metastasis [J].Sci Rep,2015,5:16426. DOI:10.1038/srep16426.
[6] SHER YP,WANG LJ,CHUANG LL,et al. ADAM9 up-regulates N-cadherin via miR-218 suppression in lung adenocarcinoma cells [J].PLoS One,2014,9(4):e94065. DOI:10.1371/journal.pone.0094065.eCollection 2014.
[7] WANG G,FU Y,LIU G,et al. MiR-218 inhibits proliferation,migration,and EMT of gastric cancer cells by targeting WASF3 [J]. Oncol Res,2017,25(3):355-364. DOI:10.3727/096504016X147381142 57367.
[8] CUI R,MENG W,SUN HL,et al. MicroRNA-224 promotes tumor progression in nonsmall cell lung cancer [J]. Proc Natl Acad Sci USA,2015,112(31):E4288-E4297. DOI:10.1073/pnas.1502068112.
[9] QI J,MU D. MicroRNAs and lung cancers:from pathogenesis to clinical implications [J]. Front Med,2012,6(2):134-155. DOI:10.1007/s11684-012-0188-4.
[10] ZHU X,ZHANG X,WANG H,et al. MTA1 gene silencing inhibits invasion and alters the microRNA expression profile of human lung cancer cells [J]. Oncol Rep,2012,28(1):218-224. DOI:10.3892/or.2012.1770.
[11] ZHANG C,GE S,HU C,et al. MiRNA-218,a new regulator of HMGB1,suppresses cell migration and invasion in non-small cell lung cancer [J]. Acta Biochim Biophys Sin (Shanghai),2013,45(12):1055-1061. DOI:10.1093/abbs/gmt109.
[12] LAI X,CHEN Q,ZHU C,et al. Regulation of RPTPα-c-Src signalling pathway by miR-218 [J]. FEBS J,2015,282(14):2722-2734.DOI:10.1111/febs.13314.
[13] LI Y,LIU S,SUN H,et al. MiR-218 inhibits erythroid differentiation and alters iron metabolism by targeting ALAS2 in K562 cells [J]. Int J Mol Sci,2015,16(12):2856-2868. DOI:10.3390/ijms161226088.
[14] 栾岚,韩斌,王翠芳,等. MicroRNA-218-1-3p在非小细胞肺癌中的表达及临床意义[J]. 中国医科大学学报,2014,43(2):181-183.
[15] PYSZ MA,HAO F,HIZLI AA,et al. Differential regulation of cyclin D1 expression by protein kinase C α and ε signaling in intestinal epithelial cells [J]. J Biol Chem,2014,289(32):22268-22283.DOI:10.1074/jbc.M114.571554.
[16] CASIMIRO MC,DI SANTE G,JU X,et al. Cyclin D1 promotes androgen-dependent DNA damage repair in prostate cancer cells[J]. Cancer Res,2016,76(2):329-338. DOI:10.1158/0008-5472.CAN-15-0999.
[17] ZHANG Y,LIU C,BARBIER O,et al. Bcl2 is a critical regulator of bile acid homeostasis by dictating Shp and lncRNA H19 function [J].Sci Rep,2016,6:20559. DOI:10.1038/srep20559.
(编辑 于 溪)
Effects of miR-218-1-3p on Cell Proliferation,Cycle,and Apoptosis of Non-small Cell Lung Cancer
LUAN Lan1,ZHANG Tiange2,HAN Bin2,LUO Wenting2,WU Fei1,LIAO Xin1,ZHANG Junjie1,BAI Yang1,CHENG Xinyu1,TENG Meng1,WANG Cuifang1
(1. Department of Pathology,Central Hospital Affiliated To Shenyang Medical College,Shenyang 110024,China; 2. Department of First Urology Surgery,Shengjing Hospital,China Medical University,Shenyang 110004,China)
ObjectiveTo investigate the effect of miR-218-1-3p on the proliferation,cycle,and apoptosis of A549 cells in non-small-cell lung cancer.MethodsmiR-218-1-3p was transfected into non-small cell lung cancer A549 cells by LipofectamineTM2000 Reagent,and the expression of miR-218-3p was detected by real-time PCR. Invasion and migration were assayed using the Transwell method. The effect of miR-218-1-3p on the proliferation of A549 cells was assayed by the MTS method. Changes in the cell cycle and apoptosis of A549 cells transfected with miR-218-1-3p was detected by flow cytometry. Changes in indicators related to cell proliferation,cycle,and apoptosis were detected by fluorescence quantitative PCR.ResultsCompared to the control group,the cell proliferation of A549 cells was significantly inhibited (P < 0.05) and the proportion of cells in the S and G2-M phases was significantly decreased when miR-218-1-3p was up-regulated.In addition,compared with the control group,the early apoptotic rate was significantly increased by up-regulating miR-218-1-3p. We further detected indicators related to cell proliferation,cycle,and apoptosis and found that CYCLIN-D1 and BCL-2 were significantly downregulated.ConclusionmiR-218-1-3p may inhibit proliferation,induce cell cycle arrest,and promote cell apoptosis of non-small cell lung cancer A549 cells by regulating CYCLIN-D1 and BCL-2.
miR-218-1-3p; non-small cell lung cancer; proliferation; cycle; apoptosisin
R34
A
0258-4646(2017)11-0980-04
10.12007/j.issn.0258-4646.2017.11.005
国家自然科学基金(81401907);沈阳医学院青年基金(20102029)
栾岚(1977-),女,副主任医师,博士.
栾岚,E-mail:luanlan33@163.com
2017-05-24
