长链非编码RNA HOTAIR对外阴鳞状细胞癌A431细胞生物学行为的影响
2017-11-08赵晓宇程蓉蓉欧阳玲
赵晓宇,程蓉蓉,欧阳玲
(中国医科大学附属盛京医院妇产科,沈阳 110004)
长链非编码RNA HOTAIR对外阴鳞状细胞癌A431细胞生物学行为的影响
赵晓宇,程蓉蓉,欧阳玲
(中国医科大学附属盛京医院妇产科,沈阳 110004)
目的探讨长链非编码RNA (lncRNA) HOTAIR对外阴鳞状细胞癌A431细胞生物学行为的影响。方法采用实时荧光定量PCR检测外阴鳞状细胞癌A431细胞与正常表皮HaCaT细胞中HOTAIR的表达水平,转染HOTAIR siRNA至A431细胞后采用CCK-8法检测各组细胞活性,流式细胞术检测细胞凋亡,Transwell小室迁移实验检测细胞迁移情况,Transwell小室侵袭实验检测细胞侵袭情况。结果HOTAIR在A431细胞中的表达高于正常表皮HaCaT细胞;下调A431细胞中HOTAIR表达后,细胞增殖、迁移及侵袭能力均降低(P均<0.05),而凋亡率增加(P < 0.05)。结论lncRNA HOTAIR可能在调控外阴鳞状细胞癌细胞的增殖、凋亡、迁移及侵袭行为中起重要作用。
外阴鳞状细胞癌; HOTAIR; siRNA; 生物学行为
外阴鳞状细胞癌(简称外阴鳞癌)是外阴癌最常见的病理类型,约占90%,晚期患者5年生存率不超过20%[1]。目前其治疗强调个体化,更重视手术联合放化疗、靶向治疗等综合治疗以改善患者生活质量[2-3]。因此,探索治疗外阴鳞癌的靶点有重要意义。近年来研究发现长链非编码RNA (long non-coding RNAs,lncRNA) HOX基因转录反义基因间RNA (HOX transcript antisense intergenic RNA, HOTAIR)在多种疾病(肿瘤、心血管疾病和神经系统疾病等)中存在差异表达,尤其是与肿瘤性疾病相关。本课题组前期研究[4]提示lncRNA HOTAIR在外阴鳞癌组织中表达失调,但HOTAIR是否对外阴鳞癌细胞的生物学行为起作用尚不清楚。本研究旨在探讨lncRNA HOTAIR对外阴鳞癌细胞生物学行为的影响,为外阴鳞癌的治疗提供新靶点。
1 材料与方法
1.1 材料
1.1.1 细胞系来源:外阴鳞癌A431细胞购自上海富衡生物有限公司;正常表皮HaCaT细胞购自北京鼎国昌盛生物技术有限公司。
1.1.2 主要仪器及试剂:DMEM/高糖培养液购自美国Hyclone公司,胎牛血清购自以色列Bioind公司,HOTAIR siRNA序列及阴性对照(negative control,NC)siRNA序列购自苏州吉玛生物有限公司,脂质体转染试剂Lipofectamine 2000购自美国Invitrogen公司,总RNA提取试剂RNAiso plus、反转录试剂盒(Primescript RT reagent kit)及实时PCR试剂盒(SYBR Premix Ex Taq)均购自日本TaKaRa公司,PCR引物购自上海生工生物工程有限公司,CCK-8试剂盒购自日本同仁化学研究所,Annexin V-FITC/PI凋亡检测试剂盒购自美国ADL公司,Transwell小室购自美国Costar公司,Matrigel基质胶购自美国BD公司。
1.2 方法
1.2.1 细胞培养:外阴鳞癌A431细胞及正常表皮HaCaT细胞用适量含10%胎牛血清、1%青—链霉素的DMEM/高糖培养液,37 ℃、5% CO2条件下培养。选取对数生长期细胞进行实验。
1.2.2 检测2种细胞中HOTAIR的表达:按照说明书TRIzol法提取2种细胞的总RNA,按反转录试剂盒说明书1 μ g总RNA在10 μ L体系中用gDNA Eraser去除基因组DNA,在20 μ L反应体系中反转录成cDNA。根据实时PCR试剂盒说明书取适量cDNA产物在20 μ L反应体系中用Roche480机器进行扩增并获得HOTAIR的Ct值,以GAPDH的Ct值作内参,应用2-ΔΔCt法进行计算。
1.2.3 细胞转染及转染效率检测:对数生长期的A431细胞以4×105/孔接种于6孔板,待70%~80%融合时更换无血清培养基,按转染试剂说明书进行HOTAIR siRNA序列转染,分为空白对照组(A431组)、转染阴性对照组(A431-NC组)及转染HOTAIR siRNA实验组(A431-siHOTAIR组),转染6 h后更换成完全培养液继续培养。转染48 h时提取各组细胞的RNA检测HOTAIR的表达,实验重复3次。
1.2.4 CCK-8法检测细胞增殖情况:对数生长期的A431细胞以1×104/孔接种于96孔板,按前述方法转染各组细胞后,按CCK-8试剂盒说明书分别在转染0、24、48和72 h检测各组细胞活性。以时间为横轴,吸光度值(A值)为纵轴绘制细胞生长曲线,实验重复3次。
1.2.5 流式细胞术检测细胞凋亡情况:收集转染48 h后的A431细胞,按Annexin V-FITC/PI凋亡检测试剂盒说明书操作1 h内流式细胞仪测定、CellQuest Pro软件分析细胞凋亡,实验重复4次。
1.2.6 Transwell迁移实验检测细胞迁移能力:取转染24 h后的3组A431细胞制成单细胞悬液,调整密度为 5×105/mL。将3个Transwell小室放入24孔板中,每个小室加入对应细胞悬液100 μ L(即5×104/孔),小室下室加入600 μ L 20%胎牛血清的DMEM/高糖培养基,放入培养箱内24 h后取出,弃去上室内液体,PBS浸洗2次,预冷的甲醇固定30 min,倒置晾干后0.1%结晶紫染色30 min,PBS洗涤3次,拭去上室内未迁移细胞、风干。倒置显微镜下随机取6个视野(×400)照相,计数每个视野的穿膜细胞数,取平均值。
1.2.7 Transwell侵袭实验检测细胞侵袭能力:-20℃保存的Matrigel胶在4 ℃冰箱过夜融化。在冰上用预冷的枪头将Matrigel胶与培养基按1∶5稀释后,取60 μ L包被Transwell小室基底膜,37 ℃放置1.5 h待Matrigel胶凝固。细胞处理同迁移实验,24 h后固定、染色,拭去上室内的Matrigel胶及未侵袭的细胞、风干。倒置显微镜下随机取6个视野(×400)照相,计数每个视野的穿膜细胞数,取平均值。
1.3 统计学分析
采用SPSS 22.0软件进行分析,数据以x-±s表示,组间比较采用t检验。P < 0.05为差异有统计学意义。
2 结果
2.1 A431细胞和HaCaT细胞中HOTAIR 的表达情况
采用实时荧光定量PCR检测2种细胞中HOTAIR的表达,结果显示,HOTAIR在A431细胞中的表达水平为HaCaT细胞的(3.69±0.29)倍,显著高于HaCaT细胞,差异有统计学意义(P = 0.004)。选择沉默A431细胞的HOTAIR表达进行后续研究。
2.2 HOTAIR siRNA在A431细胞中的转染效率
采用实时荧光定量PCR检测HOTAIR siRNA在A431细胞中的转染效率,结果显示,相对于A431组,A431-NC组和A431-siHOTAIR组的HOTAIR表达水平分别为0.99±0.03(P =0.648)和0.34±0.02(P <0.001);A431-siHOTAIR组和A431-NC组间比较亦存在统计学差异(P < 0.001)。提示特异性HOTAIR siRNA在A431细胞中下调HOTAIR表达效果显著。
2.3 下调HOTAIR表达对A431细胞增殖的影响
转染24 h时A431-siHOTAIR组与A431组和A431-NC组相比细胞活性变化不明显,48 h开始A431-si-HOTAIR组细胞活性明显低于A431组和A431-NC组(P均<0.05);而A431组和A431-NC组比较,24、48和72 h的细胞活性均无统计学差异(P均>0.05),见图1。说明HOTAIR下调抑制A431细胞增殖。
2.4 下调HOTAIR表达对A431细胞凋亡的影响
A431-siHOTAIR组、A431组及A431-NC组细胞早期凋亡率分别为(5.51±1.28)%、(3.05±0.27)%和(3.77±0.90)%,A431-siHOTAIR组与A431组及A431-NC组比较凋亡率增加(P = 0.020,P = 0.012),见图2。提示HOTAIR下调促进A431细胞凋亡。
2.5 下调HOTAIR表达对A431细胞迁移及侵袭的影响
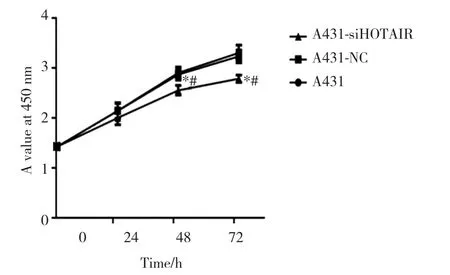
图1 CCK-8检测HOTAIR siRNA转染后A431细胞的增殖Fig.1 Effect of HOTAIR siRNA on A431 cell proliferation detected by CCK-8 assay
用Transwell实验检测转染后各组细胞的迁移、侵袭能力,结果显示,与A431-NC组及A431组相比,A431-siHOTAIR组细胞迁移力和侵袭力明显降低(P均<0.05),而A431组与A431-NC组相比,细胞迁移力和侵袭力无明显变化(P均>0.05),见图3、4。

图2 流式细胞术检测HOTAIR siRNA对A431细胞凋亡的影响Fig.2 Effect of HOTAIR siRNA on A431 cell apoptosis detected by flow cytometry

图3 Transwell实验检测HOTAIR siRNA对A431细胞迁移能力的影响 ×400Fig.3 Transwell assay showing the effect of HOTAIR siRNA on A431 cell migration ability ×400
3 讨论

图4 Transwell实验检测HOTAIR siRNA对A431细胞侵袭能力的影响 ×400Fig.4 Transwell assay showing the effect of HOTAIR siRNA on A431 cell invasion ability ×400
外阴鳞癌较罕见,但恶性程度高,晚期患者5年生存率不超过20%[1]。在治疗上以手术切除为主,传统的根治性手术需切除广泛外阴及腹股沟淋巴结,损伤范围大,围术期与术后近、远期并发症均多。据报道,行根治术后有89%的患者发生不同程度的性功能障碍[5],腹股沟淋巴结切除术后非性功能相关的近、远期并发症发生率高达84%[6]。虽然妇产科医生和学者们根据外阴癌病变特点及淋巴结转移规律,在改进手术方式方面做出了巨大努力,探索出多种改良型新手术方式,术后并发症有所下降,但仍居高不下。因此,近年来外阴癌的治疗倾向于缩小手术范围,早期患者以局部手术为主,中晚期重视手术联合放疗、手术联合化疗、靶向治疗等综合治疗及个体化治疗的应用,以提高患者治疗后生活质量[2-3]。也有学者开始注重术前治疗特别是术前同步放化疗的研究。MICHELETTI等[7]提出,当前浸润性外阴癌标准的根治性、致残性手术正逐渐被保守和个体化治疗所取代。
随着基因组学与蛋白质组学的发展,已发现外阴鳞癌内上千种lncRNA、miRNA、mRNA及蛋白质的表达水平存在差异。lncRNA是一组转录本长度超过200个核苷酸的ncRNA,在表观遗传水平、转录水平及转录后水平多个层面调控基因表达,参与细胞分化和个体发育等[8]。大量研究表明lncRNA在神经系统疾病、心血管疾病和肿瘤等危害人类健康的重大疾病中扮演重要角色,尤与肿瘤性疾病相关,成为学者关注的热点;其中lncRNA HOTAIR是目前认识较为深入的一种,研究[9]显示其几乎在机体各系统的肿瘤中都存在表达上调,并与肿瘤发生、侵袭转移、预后等密切相关,在调控肿瘤细胞的恶性生物学行为中发挥重要的促癌作用。本研究结果显示,外阴鳞癌A431细胞中HOTAIR的表达水平显著高于正常表皮HaCaT细胞,转染HOTAIR siRNA后的A431细胞中HOTAIR表达显著下调,明显低于空白对照组及转染阴性对照组,提示特异性HOTAIR siRNA能有效下调A431细胞HOTAIR的表达。
肿瘤的发生是细胞增殖与凋亡失衡的结果,癌基因常常通过直接或间接诱发细胞恶性增殖和(或)抵抗凋亡起促癌作用。QIU等[10]证实下调肿瘤细胞HOTAIR表达,CDK、Cyclin等多种细胞周期相关基因的表达水平发生变化,同时促细胞凋亡基因caspase-3、casepase-9等表达水平升高,抗凋亡基因Bcl-2的表达水平下降。本研究采取CCK-8法检测下调A431细胞HOTAIR表达水平后A431细胞的增殖情况,结果显示HOTAIR-siRNA转染组细胞在48~72 h生长速度低于空白对照组及转染阴性对照组;流式细胞术检测细胞凋亡结果显示HOTAIR siRNA转染组细胞的凋亡率较对照组有所增加,提示HOTAIR表达下调能一定程度上抑制A431细胞增殖、促进A431细胞凋亡。
侵袭与转移是恶性肿瘤最本质的特征,也往往预示肿瘤患者预后不良,严重危害人类生命健康。GUPTA等[11]发现HOTAIR表达水平在正常乳腺组织、乳腺癌原位癌和转移性乳腺癌手术标本中表达差异显著。过表达乳腺癌MDA-MB-231细胞中HOTAIR表达可以增加裸鼠肿瘤肺转移的机会,而HOTAIR在原位乳腺癌中的表达水平只有发生肺转移的组织中的十分之一。下调MDA-MB-231细胞中的HOTAIR表达明显抑制肿瘤肺转移的可能[11]。LIU等[12]报道下调非小细胞肺癌细胞的HOTAIR表达后细胞MMP-2、MMP-9的表达受抑制,最终抑制肿瘤细胞的侵袭转移。HOTAIR还参与肿瘤细胞的上皮间质转化,沉默HOTAIR表达肿瘤细胞上皮间质转化受到抑制[12-13]。本研究中Transwell迁移、侵袭实验结果显示,HOTAIR siRNA转染组细胞穿过Transwell小室基底膜的细胞数明显减少,表明HOTAIR可能促进A431细胞的迁移、侵袭能力,沉默HOTIAR明显降低A431细胞这方面能力。
综上所述,lncRNA HOTAIR基因下调能够抑制外阴鳞癌细胞A431的增殖、迁移和侵袭能力并促进细胞凋亡,提示HOTAIR可能对外阴鳞癌发展起促进作用,且在其浸润转移中作用可能更为明显。但HOTAIR影响外阴鳞癌细胞的生物学行为及其机制,还需要联合其他细胞系进行验证并深入研究。希望目前的研究为进一步探究HOTAIR在外阴鳞癌发生发展中的作用提供参考,并为外阴鳞癌的靶向治疗提供初步理论基础。
[1] SIEGEL RL,MILLER KD,JEMAL A. Cancer statistics,2016 [J]. CA Cancer J Clin,2016,66(1):7-30. DOI:10.3322/caac.21335.
[2] DEPPE G,MERT L,WINER IS. Management of squamous cell vulvar cancer:a review [J]. J Obstet Gyneacol Res,2014,40(5):1217-1225. DOI:10.1111/jog.12352.
[3] RAUH-HAIN JA,CLEMMER J,CLARK R,et al. Management and outcomes for elderly women with vulvar cancer over time [J]. BJOG,2014,121(6):719-727. DOI:10.1111/1471-0528.12580.
[4] NI S,ZHAO XY,OUYANG L. Long non-coding RNA expression profile in vulvar squamous cell carcinoma and its clinical significance [J].Oncol Rep,2016,36(5):2571-2578. DOI:10.3892/or.2016.5075.
[5] GUNTHER V,MALCHOW B,SCHUBERT M,et al. Impact of radical operative treatment on the quality of life in women with vulvar cancer-a retrospective study[ J]. Eur J Surg Oncol,2014,40(7):875-882. DOI:10.1016/j.ejso.2014.03.027.
[6] HINTEN F,VAN DEN EINDEN LC,HENDRIKS JC,et al. Risk factors for short-and long-term complications after groin surgery in vulvar cancer[ J]. Br J Cancer,2011,105(9):1279-1287. DOI:10.1038/bjc.2011.407.
[7] MICHELETTI L,PRETI M. Surgery of the vulva in vulva cancer[ J].Best Pract Res Clin Obstet Gynaecol,2014,28(7):1074-1087.DOI:10.1016/j.bpobgyn.2014.07.011.
[8] HARRIES LW. Long non-coding RNAs and human disease[ J]. Biochem Soc Trans,2012,40(4):902-906. DOI:10.1042/BST20120020.
[9] KIM K,JUTOORU I,CHADALAPAKA G,et al. HOTAIR is a negative prognostic factor and exhibits pro-oncogenic activity in pancreatic cancer[ J]. Oncogene,2013,32(13):1616-1625. DOI:10.1038/onc.2012.193.
[10] QIU JJ,WANG Y,DING JX,et al. The long non-coding RNA HOTAIR promotes the proliferation of serous ovarian cancer cells through the regulation of cell cycle arrest and apoptosis[ J]. Exp Cell Res,2015,333(2):238-248. DOI:10.1016/j.yexcr.2015.03.005.
[11] GUPTA RA,SHAH N,WANG KC,et al. Long non-coding RNA HOTAIR reprograms chromatin state to promote cancer metastasis[J]. Nature,2010,464(7291):1071-1076. DOI:10.1038/nature08975.
[12] LIU XH,LIU ZL,SUN M,et al. The long non-coding RNA HOTAIR indicates a poor prognosis and promotes metastasis in non-small cell lung cancer[ J]. BMC Cancer,2013,13:464. DOI:10.1186/1471-2407-13-464.
[13]UCZAK A, SUPERNAT A,APINNSKA-SZUMCZYK S, et al.HOTAIR in relation to epithelial mesenchymal transition and cancer stem cells in molecular subtypes of endometrial cancer[ J]. Int J Biol Markers,2016,31(3):e245-e251. DOI:10.5301/jbm.5000187.
(编辑 陈 姜)
Effects of Long Non-coding RNA HOTAIR on the Biological Behaviors of Vulvar Squamous Cell Carcinoma A431 Cells
ZHAO Xiaoyu,CHENG Rongrong,OUYANG Ling
(Department of Obstetrics and Gynecology,Shengjing Hospital,China Medical University,Shenyang 110004,China)
ObjectiveTo investigate the effects of long non-coding RNA (lncRNA) HOTAIR on the biological behavior of the vulvar squamous cell carcinoma A431 cells.MethodsThe expression level of HOTAIR in vulvar squamous cell carcinoma A431 cells and normal epidermis HaCaT cells were detected by real-time PCR. A431 cells were transfected with HOTAIR siRNA,then the proliferation,apoptosis,migration activities,and invasion activities were measured by CCK-8 assay,flow cytometry assay,transwell chamber migration test,and transwell chamber invasion test,respectively.ResultsAfter down-regulating the level of HOTAIR in A431 cells,the cell proliferation,migration,and invasion abilities were decreased (P < 0.05),while the cell apoptosis rate was increased (P < 0.05).ConclusionlncRNA HOTAIR may play an important role in the proliferation,apoptosis,migration,and invasion in vulvar squamous cell carcinoma.
vulvar squamous cell carcinoma; HOTAIR; siRNA; biological behavior
R737.35
A
0258-4646(2017)11-0990-05
10.12007/j.issn.0258-4646.2017.11.007
辽宁省教育厅科学研究一般项目(L2015585);沈阳市科学技术计划(P15-199-1-34)
赵晓宇(1987-),女,硕士研究生.
欧阳玲,E-mail:ouyang1964@163.com
2017-04-05
网络出版时间:
