脑缺血后处理对脑缺血再灌注大鼠Notch1信号通路及学习记忆功能的影响
2017-11-08刘瑶赵晓云韩颖赵雅宁李建民李佳宁
刘瑶,赵晓云,韩颖,赵雅宁,李建民,李佳宁
(1. 华北理工大学护理与康复学院社区护理学教研室,河北 唐山 063600; 2. 华北理工大学附属医院神经外科,河北 唐山 063600; 3. 唐山市人民医院急诊科,河北 唐山 063600)
脑缺血后处理对脑缺血再灌注大鼠Notch1信号通路及学习记忆功能的影响
刘瑶1,赵晓云1,韩颖1,赵雅宁1,李建民2,李佳宁3
(1. 华北理工大学护理与康复学院社区护理学教研室,河北 唐山 063600; 2. 华北理工大学附属医院神经外科,河北 唐山 063600; 3. 唐山市人民医院急诊科,河北 唐山 063600)
目的探讨脑缺血后处理(CIP)对全脑缺血大鼠Notch1信号通路及其学习记忆功能的影响。方法将128只健康的雄性SD大鼠随机分为假手术组(sham组)、脑缺血再灌注模型组(CIR组)、脑缺血后处理组(CIP组)、抑制剂组(DAPT组),每组32只。采用改良的Pulsinelli四血管阻断法制备全脑缺血模型;DAPT组是在实施CIP前腹腔注射γ分泌酶抑制剂(DAPT)。Morris 水迷宫测试检测大鼠学习记忆功能,HE染色观察海马CA1区神经细胞形态变化;免疫组织化学法、Western blotting法检测大鼠脑组织海马CA1区Notch1在海马区的表达情况。结果与sham组比较,CIR组海马区存活细胞率显著降低(P < 0.05),Notch1阳性细胞数及Notch1蛋白的表达水平明显升高 (P < 0.05);与CIR组比较,CIP组海马区存活细胞率显著升高(P < 0.05),Notch1阳性细胞数及Notch1蛋白的表达水平明显升高(P < 0.05);与CIP组比较,DAPT组海马区存活细胞率显著降低(P < 0.05),Notch1阳性细胞数及Notch1蛋白的表达水平明显降低。结论CIP可促进脑缺血再灌注大鼠学习记忆功能恢复,其机制可能与激活Notch1信号通路有关。
脑缺血再灌注损伤; 脑缺血后处理; Notch1; 学习记忆; 大鼠
随着人口老龄化的发展,缺血性脑卒中在我国的发病率和致残率逐年增加,严重增加了人们的生活负担。脑缺血再灌注损伤机制复杂,脑缺血后处理 (cerebral ischemic postconditioning,CIP)是诱导缺血耐受的新干预策略,CIP是指组织缺血后在再灌注的早期阶段给予一系列快速间歇性中断血流的操作,2006年ZHAO等[1]研究发现CIP可以减少脑缺血再灌注损伤,减少脑梗死面积。CIP的作用机制未明,已发现CIP与线粒体钙超载、避免氧自由基的过度产生、细胞外信号调节蛋白激酶信号通路等有关[2-4],但其是否影响Notch1信号通路尚未见报道。
Notch 信号通路是一条经典的依靠转录反应激活的信号通路,影响神经发育过程中的细胞分化、增殖与凋亡等多种程序。Notch1受体与配体JAG1相互作用,对神经干细胞的增殖分化发挥重要作用。已有研究[5]显示,Notch1参与缺血脑损伤后血管及神经元的新生过程。本研究建立大鼠全脑缺血再灌注损伤模型,应用CIP进行干预,从Notch1信号通路角度探讨CIP对缺血再灌注大鼠学习记忆能力的影响,为缺血性脑卒中早期救治提供理论依据。
1 材料与方法
1.1 材料
清洁级健康雄性SD大鼠128只,体质量300~350 g,购自北京维通利华实验动物中心,于华北理工大学医学实验中心饲养。实验室环境:温度22~26 ℃,相对湿度40%~70%,空气压力梯度20 Pa。在模型制造前让大鼠适应环境7 d,自由进食饮水。Notch1兔抗鼠多克隆抗体由美国Abcam公司提供,γ分泌酶抑制剂(DAPT)购自美国SELLECK生物科技有限公司,二甲基亚砜(dimethyl sulphoxide,DMSO)购自美国Sigma公司,伯乐电泳转印系统、凝胶成像系统购自美国Bio-Rad公司,Nikon摄影生物光学显微镜购自日本株式会社尼康。
1.2 动物模型建立
将128只大鼠采用随机数字法分为假手术组(sham组)、脑缺血再灌注模型组(CIR组)、CIP组、抑制剂组(DAPT组)。全脑缺血模型利用改良的Pulsinelli四血管阻断法(4-VO)制作。动物常规麻醉,颈正中切口,分离双侧颈总动脉,在其下置线备用。切开大鼠枕后部正中,暴露双侧第1颈椎横突翼孔,热凝椎动脉,每次电凝时间约2~4 s,将翼小孔后双侧椎动脉永久闭塞。术后大鼠缝皮回笼,造模后24 h,在大鼠清醒状态下以无创性微动脉夹夹闭两侧的颈动脉20 min,实行再灌注,最后完成缝合。CIP组大鼠先同CIR组大鼠一样采用改良的Pulsinelli四血管闭塞法制作大鼠全脑缺血模型,实现永久再灌注前,进行松开动脉夹15 s,夹闭15 s,如此进行3次缺血/再灌注循环,实现CIP。假手术组分离暴露血管,但不电凝椎动脉,不夹闭颈总动脉。
1.3 水迷宫检测空间学习记忆功能
模型制作完成后的48、72 h,采用Morris 水迷宫检测大鼠的空间学习记忆功能,Morris水迷宫是检测空间学习记忆功能切确、客观的一种方法,通过计算机系统记录大鼠的游泳轨迹,记下其找到平台时间和穿过平台的次数。根据计算机的记录仪记录大鼠游泳的轨迹、逃避潜伏期以及穿台次数,求各组均值。
1.4 HE染色检测神经细胞数目及形态结构
选取每组各时间点4只大鼠,以0.4%戊巴比妥纳麻醉大鼠,开胸、暴露心脏,进行4%多聚甲醛行心脏灌流后,断头取脑,4 ℃冰箱放置至少24 h。视交叉后1~6 mm 处冠状面切开, 4%多聚甲醛固定液固定,石蜡包埋,连续冠状切片,每只大鼠取5张海马区切片,片厚4 μ m。切片常规脱蜡,行HE染色。选用Motic-6.0图像采集以及分析系统计算每个视野存活的神经元数,以平均细胞存活密度表示。
1.5 免疫组化检测海马区Notch1的表达
切片常规脱蜡,枸橼酸盐微波修复,然后滴加一抗(Notch1,1∶150),湿盒中4 ℃过夜,滴加二抗,37 ℃恒温箱内孵育1 h;DAB 显色,苏木素复染,脱水、透明、封片。用光学显微镜(×400)观察并计数组织中阳性细胞数,每个大鼠取5 张切片,每个切片随机选取不重复的视野3~5个,计数视野下阳性细胞数量。
1.6 Western blotting检测海马区Notch1蛋白的表达
脱颈法处死大鼠,迅速取双侧海马区组织,4℃ PBS充分洗涤,加入裂解液,冰浴中匀浆,4 ℃、12 000 r/min离心15 min取上清。采用BCA法测定蛋白浓度,将0.8 mL蛋白标准配制液和BSA蛋白标准混合配制成浓度为25 mg/mL的蛋白标准液。依据电脑绘制出来的标准曲线计算待测蛋白的浓度。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜,封闭液中封闭1 h,加入CyclinD1、CDK4(1∶500)与actin (1∶1 000)的一抗,4℃孵育过夜,TBST洗膜,加二抗(1∶800),37 ℃孵育1 h,TBST洗膜,ECL显影,用数码成像分析系统软件分析各因子的平均灰度值,比较目的因子和内参的平均灰度值的比值。
1.7 统计学分析
应用SPSS 19.0统计分析软件进行统计学分析,采用Excel建立数据库,数据均采用x-±s表示,采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果
2.1 各组大鼠水迷宫检测结果
与sham组比较,CIR组大鼠逃避潜伏期时间明显延长、穿台次数明显减少(P < 0.05),大鼠的学习记忆能力呈明显下降趋势;与CIR比较,CIP组大鼠相应时间点的潜伏期明显缩短、穿台次数明显增加(P < 0.05),提示CIP可显著改善大鼠的学习记忆成绩;与CIP组比较,DAPT组大鼠相应时间点的逃避潜伏期明显延长、穿台次数明显减少(P < 0.05),大鼠的学习记忆能力明显下降。见表1、图1。
2.2 各组大鼠海马区神经元形态学变化
sham组大鼠海马区神经元结构完好、胞质淡染而均匀;与sham组比较,CIR组神经细胞存活率显著降低(P < 0.05),且CIR组大鼠海马区神经元损坏,表现为细胞正常结构消失,细胞形态异常;与CIR组比较,CIP组在相应时间点神经细胞存活率升高(P < 0.05),且CIP组神经元形态损伤程度减轻,胞质淡染,细胞核变性情况减轻;DAPT组神经细胞形态不完整,与CIR组相似,与CIP组比较,DAPT组相应时间点神经细胞存活率降低(P < 0.05)。见表2、图2。
表1 各组大鼠水迷宫潜伏期和穿台次数的比较(Tab.1 Comparison of the Morris water maze test results between each group(
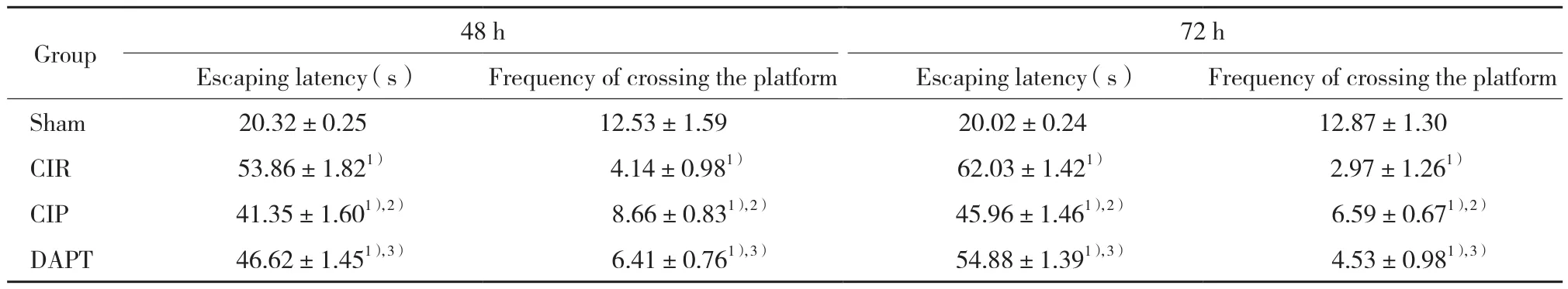
表1 各组大鼠水迷宫潜伏期和穿台次数的比较(Tab.1 Comparison of the Morris water maze test results between each group(
1) P < 0.05 vs sham group;2) P < 0.05 vs CIR group;3) P < 0.05 vs CIP group.
72 h Escaping latency (s)Frequency of crossing the platform Escaping latency (s)Frequency of crossing the platform Sham 20.32±0.25 12.53±1.59 20.02±0.24 12.87±1.30 CIR 53.86±1.821) 4.14±0.981) 62.03±1.421) 2.97±1.261)CIP 41.35±1.601),2) 8.66±0.831),2) 45.96±1.461),2) 6.59±0.671),2)DAPT 46.62±1.451),3) 6.41±0.761),3) 54.88±1.391),3) 4.53±0.981),3)Group 48 h

图1 各组大鼠水迷宫检测Fig.1 Morris water maze test of rats in each group
2.3 各组大鼠海马区Notch1免疫组化结果
sham组未见Notch1阳性细胞,其他组有不同程度的阳性产物表达,在48 h阳性细胞最多。与sham组比较,CIR组大鼠在各时间点Notch1阳性细胞数量显著增加(P < 0.05);与CIR组比较,CIP组各时间点Notch1阳性细胞数量进一步增加(P < 0.05);与CIP组比较,DAPT组相应时间点Notch1阳性细胞数量减少(P < 0.05)。见表3、图3。
2.4 各组大鼠海马区Notch1Western blotting结果
sham组Notch1蛋白表达量较少,其他组有不同数量的表达,均在48 h表达最高。与sham组比较,CIR组大鼠各时间点 Notch1蛋白的表达水平明显增加(P < 0.05);与 CIR 组比较, CIP 组各时间点 Notch1?蛋白表达水平进一步升高(P < 0.05);与CIP组比较,DAPT组各时间点Notch1蛋白表达水平降低 (P <0.05)。见表4、图4。
表2 各组大鼠海马区神经元存活率比较(%)Tab.2 Comparison of hippocampal nerve cell survival rates between each group(%)
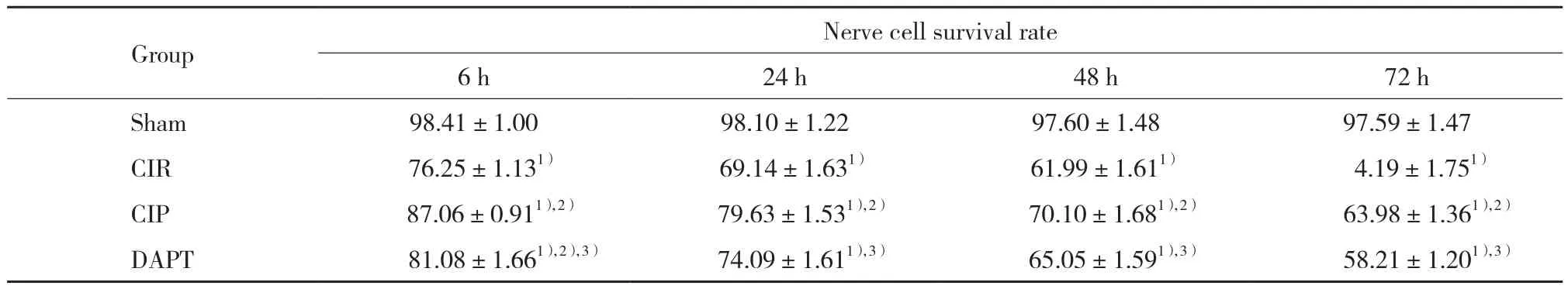
表2 各组大鼠海马区神经元存活率比较(%)Tab.2 Comparison of hippocampal nerve cell survival rates between each group(%)
1) P < 0.05 vs sham group;2) P < 0.05 vs CIR group;3) P < 0.05 vs CIP group.
Nerve cell survival rate 6 h 24 h 48 h 72 h Sham 98.41±1.00 98.10±1.22 97.60±1.48 97.59±1.47 CIR 76.25±1.131) 69.14±1.631) 61.99±1.611) 4.19±1.751)CIP 87.06±0.911),2) 79.63±1.531),2) 70.10±1.681),2) 63.98±1.361),2)DAPT 81.08±1.661),2),3) 74.09±1.611),3) 65.05±1.591),3) 58.21±1.201),3)Group

图2 大鼠海马区神经元细胞HE 染色 ×400Fig.2 HE staining of neuronal cells in the rat hippocampus ×400
表3 各组大鼠海马区Notch1阳性细胞数比较(,个/高倍镜视野)Tab.3 Comparison of Notch1-positive nerve cells between each group (,/HPF)
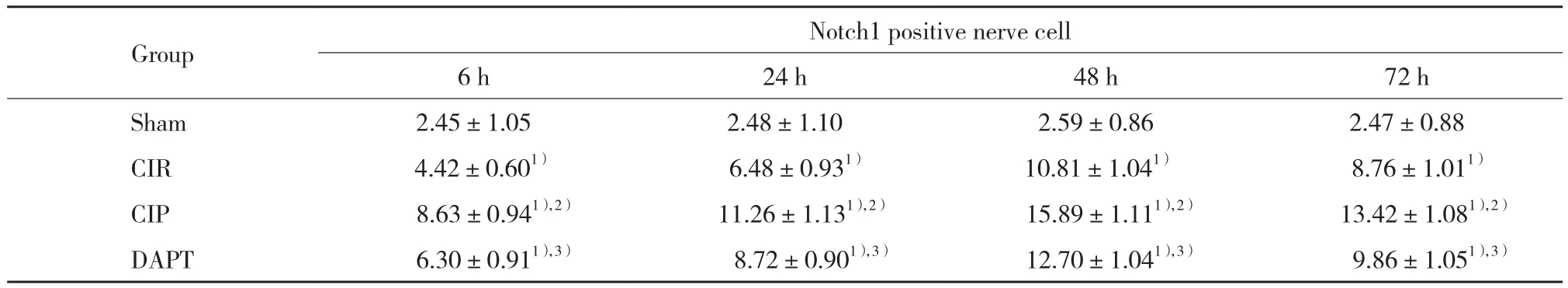
表3 各组大鼠海马区Notch1阳性细胞数比较(,个/高倍镜视野)Tab.3 Comparison of Notch1-positive nerve cells between each group (,/HPF)
1) P < 0.05 vs sham group;2) P < 0.05 vs CIR group;3) P < 0.05 vs CIP group.
Group Notch1 positive nerve cell 6 h 24 h 48 h 72 h Sham 2.45±1.05 2.48±1.10 2.59±0.86 2.47±0.88 CIR 4.42±0.601) 6.48±0.931) 10.81±1.041) 8.76±1.011)CIP 8.63±0.941),2) 11.26±1.131),2) 15.89±1.111),2) 13.42±1.081),2)DAPT 6.30±0.911),3) 8.72±0.901),3) 12.70±1.041),3) 9.86±1.051),3)
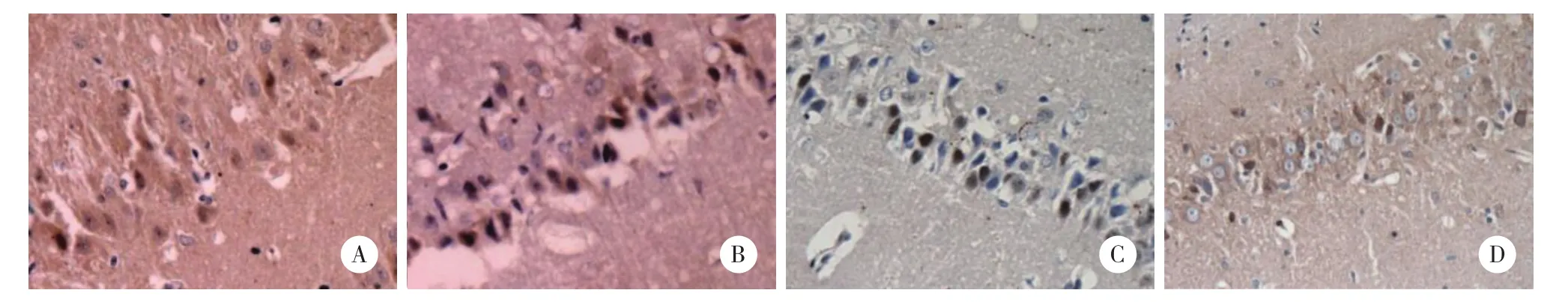
图3 大鼠海马区神经细胞免疫组织化学染色 ×400Fig.3 Immunohistochemical staining of hippocampal nerve cells in rats ×400
3 讨论
本研究结果显示,CIR组与sham组比较,大鼠海马区神经细胞存活率降低,神经细胞结构损伤严重,同时大鼠CIR所导致的脑损伤明显影响大鼠的学习记忆能力,而CIP组可以促进大鼠脑缺血再灌注后损害的学习功能恢复。CIP对脑缺血大鼠起到内源性保护作用,可以明显减轻缺血再灌注损伤。本研究中,与CIR组比较,CIP组各时间点海马区神经元损伤的细胞明显减少,且细胞形态较规整,说明CIP可明显减少脑缺血再灌注损伤。目前,CIP在缺血再灌注损伤的保护作用得到广泛证实,已广泛用于各种器官缺血再灌注损伤的研究之中,心肌、肾脏、肝脏等CIP可以明显减轻缺血再灌注损伤[6-8]。但CIP发生发展的细胞分子机制十分复杂,目前仍未得到统一的答案。 孔渝菡等[9]利用大鼠脑缺血模型进行CIP后检测发现,CIP组IL-1β、IL-6的表达降低,提示炎症介质参与CIP过程;NEMETHOVA等[10]应用脑片培养研究发现,CIP抑制脑组织中氧化应激损伤的发生;PATELIYA等[11]研究发现CIP的保护机制与ATP依赖的钾通道开放有关。因此,关于CIP对大鼠脑缺血再灌注损伤保护作用的确切机制还待进一步研究。
表4 各组大鼠海马区Notch1蛋白水平比较( Tab.4 Comparison of Notch1 protein levels between each group(
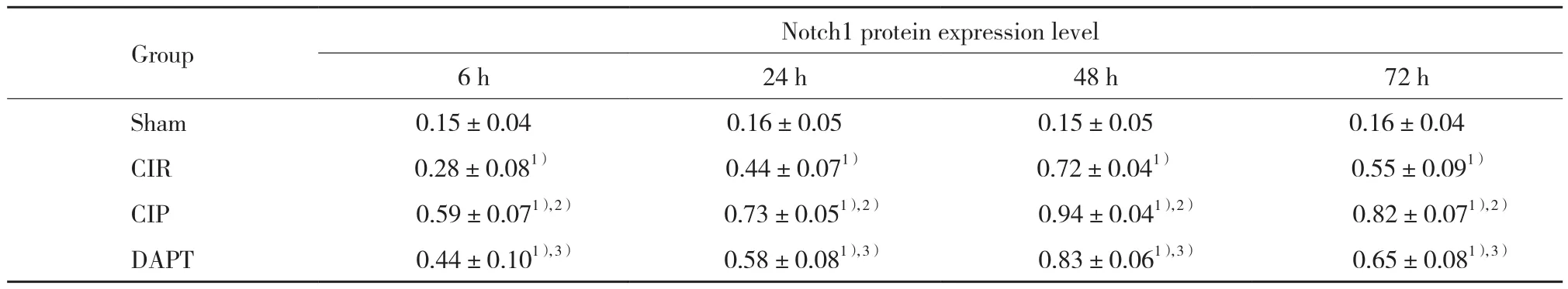
表4 各组大鼠海马区Notch1蛋白水平比较( Tab.4 Comparison of Notch1 protein levels between each group(
1) P < 0.05 vs sham group;2) P < 0.05 vs CIR group;3) P < 0.05 vs CIP group.
Group Notch1 protein expression level 6 h 24 h 48 h 72 h Sham 0.15±0.04 0.16±0.05 0.15±0.05 0.16±0.04 CIR 0.28±0.081) 0.44±0.071) 0.72±0.041) 0.55±0.091)CIP 0.59±0.071),2) 0.73±0.051),2) 0.94±0.041),2) 0.82±0.071),2)DAPT 0.44±0.101),3) 0.58±0.081),3) 0.83±0.061),3) 0.65±0.081),3)

图4 各组大鼠海马区Notch1蛋白表达Fig.4 Protein expression of Notch1 in the hippocampal cells of rats in each group
Notch信号是一种进化保守的信号通路,通过相邻细胞之间Notch受体与配体的结合,对于干细胞自我更新起着至关重要的作用。Notch信号通路主要由Notch受体、配体、核内CSL区与DNA结合,表达于多种组织和器官中,可调控细胞增殖、分化和凋亡。且在大鼠肝脏缺血再灌注损伤后,Notch1 信号通路能够通过增加超氧化物歧化酶表达来加强超氧阴离子等的清除从而抑制氧化应激,减轻肝脏缺血/再灌注损伤[12]。越来越多的研究指出Notch信号通路与神经系统关系密切,是缺血性脑损伤后神经发展的调控信号之一。研究[13]发现当成年小鼠发生脑缺血时Notch信号通路被激活,该通路激活后可促进缺血后神经干细胞的存活。陈娉婷等[14]发现通过上调脑缺血再灌注大鼠海马区Notch1、Notch2蛋白表达水平,调节Notch信号转导通路,促进脑缺血损伤后神经功能修复。陈晓梅[15]对脑卒中大鼠进行高压氧预处理,发现高压氧可以提前激活Notch信号通路,促进神经功能损伤,明显减轻梗死面积。本实验运用免疫组织化学和Western blotting观察CIP对大鼠海马区Notch1蛋白表达情况,结果显示CIP组各时间点的Notch1蛋白表达水平较CIR组明显升高,且学习记忆能力明显提高,说明CIP可以调节Notch信号通路的表达。CIP可减少脂质过氧化反应和超氧化物阴离子的产生,从而抑制氧自由基生成。而低氧环境可以激活Notch1信号通路并诱导其下游基因的表达。由此推测CIP对神经的保护作用可能是通过提高Notch1信号,降低缺血所引起的氧化应激损伤,从而减小对神经元细胞的伤害。
学习记忆是大脑最重要的神经功能之一,此功能的实现需要有完备的组织细胞形态结构和中枢神经系统突触结构的高度可塑性。SCHINDER等[16]提出了新生神经细胞参与学习、记忆能力的可能突触机制。王珏等[17]研究发现Notch信号通路对神经干细胞的增殖起关键作用。CIP提高了小鼠的学习记忆能力,其机制可能是CIP引起了Notch1的表达增加,调节神经干细胞增殖,改变突触可塑性,从而提高了学习记忆能力。
综上所述,本研究结果显示CIP可能通过改善Notch1信号通路,减少了神经细胞的凋亡,提高了学习记忆能力。因此认为CIP作为一种新的脑保护措施,可能从多机制途径发挥对脑组织形态结构的保护作用,给临床治疗提供了一种新的治疗策略。
[1] ZHAO ZQ,VINTEN-JOHANSEN J. Postconditioning:reduction of reperfusion-induced injury [J]. Cardiovasc Res,2006,70(2):200-211. DOI:10.1016/j.cardiores.2006.01.024.
[2] 孙雷,李文雅,刘文科,等. CIP对肺缺血再灌注损伤模型大鼠的保护作用[J]. 中国组织工程研究,2015,19(27):4271-4276.DOI:10.3969/j.issn.2095-4344.2015.27.002.
[3] 肖军,王洪叶,陈小刚,等. CIP对急性心肌梗死患者血清氧自由基的影响及意义[J]. 中国康复理论与实践,2014,20(5):470-473. DOI:10.3969/j.issn.1006-9771.2014.05.019.
[4] LIU XW,JI EF,HE P,et al. Protective effects of the p38MAPK inhibitor SB203580 on NMDA induced injury in primary cerebral cortical neurons [J]. Mol Med Rep,2014,10(4):1942-1948. DOI:10.3892/mmr.2014.2402.
[5] 吉亚杰,张博爱,刘荣丽,等.慢性脑缺血大鼠海马Notch1表达的动态变化[J]. 第三军医大学学报,2011,30(24):2621-2624.DOI:10.16016/j.1000-5404.2011.24.026.
[6] 陈效安,胡孟芬,宋达琳. 心肌缺血再灌注损伤与心肌保护[J]. 中国医刊,2016,11(51):23-26. DOI:10.3969/j.issn.1008-1070.2016.11.007.
[7] 李毅,张雪霞,周文英,等. CIP对梗阻性黄疸大鼠肾缺血再灌注损伤IL-6及ATP的影响[J]. 实用医学杂志,2016,32(15):2442-2444. DOI:10.3969/j.issn.1006-5725.2016.15.006.
[8] 陈海娥,马迎春,何金波,等. CIP对肺缺血/再灌注损伤的保护作用及其机制[J]. 中国应用生理学杂志,2014,30(3):251-256.DOI:10.13459/j.cnki.cjap.2014.03.017.
[9] 孔渝菡,秦新月. 不同CIP对缺血再灌注大鼠脑内IL-1β、IL-6表达的影响[J]. 中国老年学杂志,2012,32(14):2984-2986. DOI:10.3969 /j. issn. 1005-9202. 2012. 14. 035.
[10] NEMETHOVA M,DANIELISOVA V,GOTTLIEB M,et al.Post-conditioning exacerbates the MnSOD immune-reactivity after experimental cerebral global ischemia and reperfusion in the rat brain hippocampus [J].Call Biol Int,2008,32(1):128-135. DOI:10.1016/j.cellbi.2007.08.023.
[11] PATELIYA BB,SINGH N,JAGGI AS. Possible role of opioids and KATP channels in neuroprotective effect of postconditioning in mice[J]. Biol Pharm Bull,2008,31(9):1755-1760. DOI:10.1248/bpb.31.1755 .
[12] YU HC,QIN HY,HE F,et al.Canonical notch pathway protects hepatocytes from ischemia/reperfusion injury in mice by repressing reactive oxygen species production through JAK2/STAT3 signaling[J]. Hepatology,2011,54(3):979-988. DOI:10.1002/hep.24469.
[13] WANG L,ZHANG Z,WANG Y,et al. Treatment of stroke with erythropoietin enhances neurogenesis and angiogenesis and improves neurological function in rats [J]. Die Pharmazie,2004,50(7):459-460. DOI:10.1161/01.STR.0000132196.49028.a4 .
[14] 陈娉婷,周小青,曹泽标,等. 丹龙醒脑方对脑缺血再灌注大鼠海马区Notch信号通路相关蛋白表达的影响[J]. 湖南中医药大学学报,2016,36(1):10-14. DOI:10.3969/j.issn.1674-070x.2016.01.002 .
[15] 陈晓梅. Notch信号通路在重复HBO预处理脑保护效应中的作用研究[D]. 第四军医大学,2010.
[16] SCHINDER AF,GAGE FH. A hypothesis about the role of adult neurogenesis in hippocampal function [J]. Physiology,2004,19(5):253-261. DOI:10.1152/physiol.00012.2004.
[17] 王珏,邓宇斌,万勇. Notch信号通路对神经干细胞增殖分化的作用[J]. 中国细胞生物学学报,2014,36(5):708-712. DOI:10.11844/cjcb.2014.05.0362.
(编辑 武玉欣)
The Effect of Ischemic Postconditioning on the Notch1 Signaling Pathway and Learning and Memory in Rats with Cerebral Ischemia Reperfusion Injury
LIU Yao1,ZHAQ Xiaoyun1,HAN Ying1,ZHAO Yaning1,LI Jianmin2,LI Jianing3
(1. Department of Community Nursing,College of Nursing and Rehabilitation,North China University of Science and Technology,Tangshan 063000,China; 2. Department of Neurosurgery,Affiliated Hospital of North China University of Science and Technology,Tangshan 063000,China; 3. Department of Emergency,Tangshan People’s Hospital,Tangshan 063000,China)
ObjectiveTo assess the effect of ischemic postconditioning on the Notch1 signaling pathway,and learning and memory in rats with global cerebral ischemia.MethodsA total of 128 healthy male SD rats were randomly divided into the sham operation (sham),whole-brain ischemia(CIR),ischemic treatment(CIP),and inhibitor(DAPT) groups,with 32 rats in each group. A global cerebral ischemia model was generated using the modified Pulsinelli’s four-vascular occlusion model,and the inhibitor group was injected intraperitoneally with gamma secretase inhibitors (DAPT) before ischemic treatment. Rats’ learning and memory function results from the Morris water maze test were assessed by observing the changes in hippocampal CA1 neurons with HE staining. The expression of Notch1 in the CA1 area of the hippocampus was assessed using immunohistochemical and Western blotting methods in rats.ResultsCompared with the sham group,the hippocampal cell survival rate in the CIR group decreased significantly (P < 0.05) and the expression level of Notch1 increased significantly (P < 0.05). Compared with the CIR group,the CIP group revealed a significantly higher hippocampal cell survival rate (P < 0.05) and an increase in Notch1 expression (P < 0.05);compared with the CIP group,the hippocampal cell survival rate significantly decreased after DAPT administration (P < 0.05) and Notch1 expression decreased significantly.ConclusionIschemic postconditioning can promote the recovery of learning and memory ability,which may relate to the activation of the Notch1 signaling pathway.
cerebral ischemia reperfusion injury; cerebral ischemic postconditioning; Notch1; learning and memory; rat
R743
A
0258-4646(2017)11-0984-06
10.12007/j.issn.0258-4646.2017.11.006
河北省自然科学基金(H2012401007)
刘瑶(1992-),女,硕士研究生.
赵雅宁,E-mail:zyning789@126.com
2017-03-25
网络出版时间:
