球孢白僵菌在重金属Cd(Ⅱ)作用下抗氧化酶系变化
2017-11-07燕霞飞郑长英李凯月万方浩王俊平
燕霞飞,郑长英,李凯月,万方浩,2,王俊平*
(1.青岛农业大学植物医学学院,山东省植物病虫害综合防控重点实验室,山东青岛 266109;2.中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
球孢白僵菌在重金属Cd(Ⅱ)作用下抗氧化酶系变化
燕霞飞1,郑长英1,李凯月1,万方浩1,2,王俊平1*
(1.青岛农业大学植物医学学院,山东省植物病虫害综合防控重点实验室,山东青岛 266109;2.中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
测定球孢白僵菌Beauveriabassiana分生孢子在重金属镉Cd(Ⅱ)作用下不同时间段超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)及谷胱甘肽-S-转移酶(GST)活性的变化,以探讨球孢白僵菌分生孢子应对重金属胁迫时的生理生化反应。结果表明:Cd(Ⅱ)胁迫初始阶段(2-6 h),球孢白僵菌分生孢子中POD活性出现抑制现象,POD对Cd(Ⅱ)胁迫较敏感。Cd(Ⅱ)胁迫4 h后,GST、SOD、CAT酶活性均显著增加。GST活性在Cd(Ⅱ)胁迫早期酶活变化最为明显,对菌体细胞起到关键的保护作用。后期GST活性较低,因此其保护作用较弱;POD的活性变化则与GST相反,POD在Cd(Ⅱ)胁迫后期对菌体细胞起到关键的保护作用;Cd(Ⅱ)胁迫下,CAT活性稳定且变化不明显但仍高于正常状态下的CAT酶活;SOD始终保持高的酶活性,在这些抗氧化保护酶中,以SOD最为重要。结果表明,抗氧化酶活性的提高与维持是球孢白僵菌耐Cd(Ⅱ)胁迫的重要生理基础。
镉胁迫;球孢白僵菌;抗氧化酶系统;土壤修复
近年来,随着化学农药大量使用对农产品和环境带来的污染及社会经济的发展和人们对绿色食品要求的不断提高,虫生真菌生物防治应用正越来越受到人们的关注。球孢白僵菌Beauveriabassiana是一类重要的广谱性昆虫病原真菌,为世界上研究和应用最多的虫生真菌之一,已被广泛应用于农林业害虫防治中(Fangetal.,2008;Wraightetal.,2010)。球孢白僵菌不仅可以寄生昆虫,而且在寄主昆虫缺乏时,能够在不同生态环境中营腐生生活,土壤被公认为是昆虫病原真菌的重要蓄积库(Studdertetal.,1990;Pireiraetal.,1993)。
随着工业、农业的不断发展及各种化学产品、农药及化肥的广泛使用,重金属通过各种途径进入环境,造成土壤尤其是农田土壤的污染日益严重(Chaneyetal.,2004)。重金属是一种持久性的有毒污染物,进入土壤环境后不易被化学或生物降解,易通过食物链及其他途径进入植物、动物和人体内积累,对生态环境、食品安全和人体健康构成严重威胁,危害极大(Chaneyetal.,1999;Chaneyetal.,2013)。污染面积上看,国内专家认为镉污染最严重(陈同斌等,2003)。据新近发布的《全国土壤污染状况调查公报》(2014)统计,我国镉污染农田面积已超过28×104hm2,每年生产的镉含量超标农产品和动物造成的累积性毒害品达146万吨(易泽夫等,2014)。
国外一些学者研究发现,球孢白僵菌不仅能够防治害虫,还具有生物转化镉、铜等重金属的能力(Khalidetal.,2011)。球孢白僵菌的吸收和吸附作用将土壤中的重金属清除出土体或将其固定在土壤中降低其迁移性和生物有效性,对受重金属污染的土壤具有一定的修复作用。因此,大量高浓度的球孢白僵菌施用于农林业中时,部分会直接接触寄主昆虫,达到杀虫的效果;而部分会蓄积在土壤中,此时球孢白僵菌会作为一种镉吸附剂吸收和吸附土壤中的重金属镉。试验中发现,镉处理后的球孢白僵菌杀虫毒性略有降低但没有显著性变化,仍保持高的杀虫毒性,当土壤中的球孢白僵菌接触到寄主昆虫时,仍作为一种高毒力杀虫真菌起到杀虫的效果。
重金属胁迫可诱导产生大量活性氧(ROS)从而诱发生物机体损坏,真菌自身能够采取多种机制抵御重金属的毒害,分泌抗氧化胁迫的酶类物质来减轻重金属引起的生理毒害是一种重要的胞内防御机制(Banerjeeetal.,1999;徐勤松等,2006)。过氧化物酶(POD)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)是一个重要的ROS清除系统,SOD是细胞抵抗ROS胁迫的第一道屏障,可将其转化为氧化作用相对较弱的H2O2,再由POD和CAT将H2O2分解成H2O(Lietal.,2005;Sunetal.,2010)。谷胱甘肽-S-转移酶(GST)可催化还原型谷胱甘肽GSH结合过氧化产物或络合自由态Cd(Ⅱ),降低细胞中ROS物质的浓度,在防御Cd(Ⅱ)胁迫的过程中具有重要的作用(Adamisetal.,2001;胡延玲等,2009)。大量实验表明,低、中剂量Cd(Ⅱ)对生物体内抗氧化酶活性都有不同程度的诱导,而高剂量则导致活性显著下降(Stebbing,1982;Muradoetal.,2007)。此外,Cd(Ⅱ)对抗氧化酶活性影响还取决于处理时间、实验样品的来源及其发育阶段等因素。生物体内抗氧化酶系对重金属污染相当敏感,可作为环境监测的重要生物指标(Niuetal.,2010)。
在抗性机理研究中,SOD和POD等酶活性的变化已广泛作为指示抵御逆境伤害的指标。此外,有关研究表明白僵菌可通过氧化还原、甲基化和去甲基化等作用转化重金属,使重金属从有毒的游离态转化为无毒或低毒的结合态从而改善土壤质量(Borchetal.,2009)。
试验中发现,Cd(Ⅱ)浓度达到50 mg/L时,球孢白僵菌萌发率出现明显的降低,109个孢子/mL球孢白僵菌分生孢子对Cd(Ⅱ)的吸附率达到56.7%,而107个孢子/mL球孢白僵菌分生孢子对Cd(Ⅱ)的吸附率达到28.7%。因此本研究在50 mg/L Cd(Ⅱ)离子悬浮液中培养球孢白僵菌分生孢子,分析球孢白僵菌分生孢子随培养时间,活性氧清除体系中关键性酶SOD、POD、CAT及GST等含量的变化,以探讨在重金属污染条件下球孢白僵菌生长过程中活性氧代谢与酶活性之间的内在联系,为进一步研究其对Cd(Ⅱ)的解毒机制提供了一定的理论基础,并为球孢白僵菌在保持其高杀虫活性的同时吸附和转化土壤中的重金属,改善土壤质量提供了科学基础。
1 材料与方法
1.1 材料
1.1.1供试菌株
供试球孢白僵菌菌株Bb33A(KU517852),从野外感染球孢白僵菌的僵蚕体上分离获得,保存于青岛农业大学昆虫生态学实验室。
1.1.2试剂及仪器
POD、CAT测试盒为南京建成生物工程研究所生产,L-甲硫氨酸、Na2EDTA、NBT、核黄素、2,4-二硝基氯苯、GSH等均为国产分析纯及生化试剂。水浴锅,离心机(Hettich Zentrifugen,EBA20),酶标仪(Thermo Multiskan MK3),752N紫外可见分光光度计。
1.2 材料与处理
球孢白僵菌Bb33A分生孢子加入50 mg/L Cd(Ⅱ)溶液,分生孢子终浓度为2.0×107个孢子/mL,静置于25℃恒温箱。在预定的时间取出样品,每处理3个重复,并以0.1%吐温-80无菌水作为对照。样品12000 g离心5 min,去上清,灭菌的滤纸干燥管底的球孢白僵菌分生孢子。放入-80℃冰箱保存。
1.3 测定方法
1.3.1酶液的制备
(1)GST粗酶液制备:液氮充分研磨处理样,加500 μL预冷的0.1 mol/L磷酸缓冲液(pH7.5)匀浆。4℃,5000 g离心10 min,取上清液,即为酶的粗提液。
(2)SOD、CAT粗酶液制备:液氮充分研磨处理样,加500 μL预冷的0.05 mol/L磷酸缓冲液(pH7.0,含0.1 mmol/L EDTA,4%苯基硫脲)匀浆,4℃,12000 g离心20 min,取上清液,即为酶的粗提液。用于测定SOD、CAT活性。
(3)POD粗酶液制备:液氮充分研磨处理样,加500 μL预冷的0.1 mol/L Tris-HCl缓冲液(pH8.5)匀浆。4℃,4000 g离心15 min,取上清液,即为酶的粗提液(彭艳等,2006;张秀波等,2009)。
1.3.2GST、SOD、POD和CAT活性
GST测定参照Habig方法进行(Habigetal.,1974),通过检测GSH浓度的高低来反映GST活力的大小;SOD测定采用氮蓝四唑(NBT)还原法;POD活性测定采用南京建成POD测试盒;CAT活性测定采用南京建成CAT测试盒。GST活性由酶标仪(Thermo Multiskan MK3)测定,SOD、POD、CAT活性由752N紫外可见分光光度计测定。
1.3.3酶活力测定
蛋白质含量采用考马斯亮蓝比色法,用牛血清蛋白作标准曲线(Bradford,1976)。蛋白含量由酶标仪(Thermo Multiskan MK3)测定。
SOD与GST酶活力的计算公式如下:
POD与CAT酶活力的计算严格按照南京建成生物工程公司试剂盒的说明进行,具体计算公式如下:

1.4 数据统计分析
试验数据采用Excel软件对检测数据进行表格处理与制图,运用SPSS 21.0软件(SPSS Inc.,Chicago,IL,USA)Tukey检定法进行单因子显著性差异分析。以置信度0.95为差异显著,结果以均值表示。
2 结果与分析
2.1 球孢白僵菌在Cd(Ⅱ)胁迫下GST活性
球孢白僵菌Bb33A分生孢子在Cd(Ⅱ)胁迫下GST活性随时间呈现先上升后下降平稳最后下降,此时趋向未用Cd(Ⅱ)胁迫GST活性的趋势(图1)。Cd(Ⅱ)处理球孢白僵菌分生孢子2 h,GST活性无明显变化;Cd(Ⅱ)处理4 h,GST活性显著增加,6 h后达到最大值活性增加到466.54%;8 h后,GST酶活性相对6 h明显下降,处理8-24 h内,GST酶活性稳定变化不显著呈波动性,GST活性分别增加到290.58%,347.75%,371.33%,330.05%;48 h后GST活性随时间的延长而下降,趋向未用Cd(Ⅱ)胁迫时GST活性,分别增加到250.28%,216.90%,171.45%。
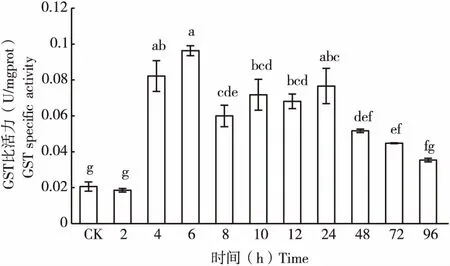
图1 球孢白僵菌分生孢子在Cd(Ⅱ)胁迫后GST比活力Fig.1 Effect of Cd(Ⅱ) on GST specific activity of Beauveria bassiana spores注:柱状图上不同小写字母表示组间差异显著(P<0.05),相同小写字母者表示组间差异不显著(P>0.05),各组酶活均为平均值,下图同。Note: The different letter superscripts means significant difference (P<0.05), the same letter denoted not significant difference (P>0.05), each enzyme activity were average, the following pictures were the same.
2.2 球孢白僵菌在Cd(Ⅱ)胁迫下SOD活性
球孢白僵菌Bb33A分生孢子在Cd(Ⅱ)胁迫后SOD活性随时间呈现先上升后稳定的趋势(图2)。Cd(Ⅱ)处理球孢白僵菌分生孢子4 h后,SOD活性提高,10 h后达到稳定。SOD活性由467.34%增加到868.68%;Cd(Ⅱ)处理10-96 h内,SOD酶活稳定保持较高水平,活性维持在868.68%-1009.5%。

图2 球孢白僵菌分生孢子在Cd(Ⅱ)胁迫后SOD比活力Fig.2 Effect of Cd(Ⅱ) on SOD specific activity of Beauveria bassiana spores
2.3 球孢白僵菌在Cd(Ⅱ)胁迫下POD活性
球孢白僵菌Bb33A分生孢子在Cd(Ⅱ)胁迫下POD活性随时间波动较大并且表现出一定的滞后性(图3)。Cd(Ⅱ)处理球孢白僵菌分生孢子2-6 h内,POD活性明显低于对照组POD酶活,仅为对照组POD活性的20.45%-28.77%,POD活性明显受到抑制;Cd(Ⅱ)处理8 h,POD活性逐渐恢复至正常水平;Cd(Ⅱ)处理10 h,POD活性显著性升高,GST活性提高到283.78%;随后POD活性随时间呈现上升的趋势,在48 h达到最大值,POD活性增长到573.50%;Cd(Ⅱ)处理72 h后POD活性显著性下降,在96 h时POD活性又恢复至正常水平。POD活性的变化表现出一定的滞后性,变化幅度较大,表明POD对Cd(Ⅱ)胁迫的响应较灵敏。

图3 球孢白僵菌分生孢子在Cd(Ⅱ)胁迫后POD比活力Fig.3 Effect of Cd(Ⅱ) on POD specific activity of Beauveria bassiana spores
2.4 球孢白僵菌在Cd(Ⅱ)胁迫下CAT活性
球孢白僵菌Bb33A分生孢子在Cd(Ⅱ)胁迫下CAT酶活力(图4)显示,CAT活性随时间波动较小。Cd(Ⅱ)处理球孢白僵菌分生孢子2 h,CAT活性未出现明显变化;Cd(Ⅱ)处理4 h后,CAT活性提高,但增长率均维持在101.28%-202.78%,变化较小。

图4 球孢白僵菌分生孢子在Cd(Ⅱ)胁迫后CAT比活力Fig. 4 Effect of Cd(Ⅱ) on CAT specific activity of Beauveria bassiana spores
2.5 Cd(Ⅱ)胁迫对白僵菌分生孢子GST、SOD、POD与CAT活性影响对比分析
球孢白僵菌Bb33A分生孢子在Cd(Ⅱ)胁迫下GST、SOD、POD、CAT活性增长率对比(图5)显示,Cd(Ⅱ)胁迫初始阶段(2 h),GST、CAT、SOD酶活性没有明显变化,而POD酶活性受到严重抑制,持续时间长(2-6 h),因此POD对Cd(Ⅱ)胁迫敏感性最高;SOD活性增长率均大于其他三种酶;GST在Cd(Ⅱ)胁迫的初期(4-8 h)增长率较大;而POD活性在Cd(Ⅱ)胁迫中期(10-72 h)增长率较大;Cd(Ⅱ)胁迫后,CAT活性增长率维持在1.01-2.03,活性提高并保持稳定。

图5 球孢白僵菌分生孢子在Cd(Ⅱ)胁迫后GST、SOD、POD与CAT比活力增长率Fig.5 The growth rate of antioxidant enzymes of Beauveria bassiana spores after Cd(Ⅱ) stress
3 结论与讨论
球孢白僵菌Bb33A(KU517852)是本实验室分离纯化的一种高杀虫毒性菌株(2×107个孢子/mL白僵菌Bb33A第9天对西花蓟马的致死率达94.93%),镉处理后其杀虫毒性会略有降低但仍保持高的杀虫毒性(致死率由94.93%降至89.66%),遇到寄主昆虫时仍具有高的杀虫效果。研究中发现其对Cd(Ⅱ)有较强的吸附能力。109孢子/mL球孢白僵菌Bb33A在第4天对Cd(Ⅱ)的吸附率达到56.7%(数据未发表);同时还发现一方面Cd(Ⅱ)会影响、抑制球孢白僵菌Bb33A的生长及代谢活动。另一方面,球孢白僵菌Bb33A自身能够采取多种机制抵御Cd(Ⅱ)的毒害,对Cd(Ⅱ)有较强的抗性(在一定Cd(Ⅱ)浓度范围内,球孢白僵菌Bb33A萌发率、产孢量及径向生长保持较高水平)。细胞内产生抗氧化酶类物质以减轻重金属引起的氧化胁迫是一种重要的抵御机制。
经Cd(Ⅱ)胁迫后,球孢白僵菌分生孢子体内的各种抗氧化酶活性均出现明显提高,这可能是由于球孢白僵菌分生孢子在逆境条件下,胞内的保护酶系统原有的平衡遭到破坏,导致自由基清除能力减弱,体内自由基水平发生变化,各种抗氧化酶参与调节而活性升高(鲁双庆等,2002;何洁等,2013)。有关研究发现重金属耐性品种(玉米、玉豆等)在重金属(铝、镉等)胁迫下抗氧化酶活性显著高于重金属敏感性品种(彭艳等,2006;李冬琴等,2015)。可见,生物体内抗氧化防御系统的能力强弱可能是其对重金属胁迫耐性差异的关键因素。
Cd(Ⅱ)胁迫初始阶段,POD酶活性受到严重抑制,持续时间长(2-6 h),因此POD对Cd(Ⅱ)胁迫敏感性最高。一方面重金属干扰物质在细胞中的运输过程,抑制蛋白质的合成,进而抑制细胞内一些保护酶的活性,导致大量的超氧阴离子自由基产生(Liu,2010;Gusmanetal.,2013)。另一方面Cd(Ⅱ)可以与蛋白质分子中的羟基(—OH)、氨基(—NH2)、巯基(—SH)等结合,使蛋白质产生不可逆转的变性,从而破坏酶系统的正常生理功能(Romero-Puertasetal.,2004)。此外Cd(Ⅱ)和巯基的亲和力比锌大,可与锌蛋白酶发生亲合反应,置换出锌离子,使其酶活性丧失(Smeetsetal.,2005)。镉处理2 h时,各种抗氧化酶由于以上原因酶活性或多或少受到影响,此时机体的解毒机制未开启或受到抑制,因此更能反映出各种酶对镉的敏感性,根据2 h时各种酶的活性的增长率,4种抗氧化酶对Cd(Ⅱ)胁迫的敏感性顺序为POD>SOD>GST>CAT,这与几种酶的空间结构相关。
GST分子具有细胞解毒和抗氧化双重功效。有研究证实,GST参与重金属解毒的过程主要通过两种方式:一是GST基因能够催化还原型谷胱甘肽(GSH)直接与Cd(Ⅱ)离子共价结合,将Cd(Ⅱ)转运到液泡或质外体,从而达到解毒的目的(Perrinetal.,1971;Adamisetal.,2009);二是GST还具有谷胱甘肽过氧化物酶GPOX活性,降低细胞中活性氧物质的浓度,从而减少氧化胁迫引起的损伤(Edwardsetal.,2000)。有关研究通过半定量表达分析发现,铜和镉胁迫均能促使厚壳贻贝GST基因表达量升高为对照的6.95倍,且表现为时间依赖型(刘慧慧等,2014)。本试验中GST在Cd(Ⅱ)胁迫初期(4-24 h)活性呈明显上升,说明GST参与球孢白僵菌分生孢子的解毒过程,是该过程中关键抗氧化酶,对于球孢白僵菌防御Cd(Ⅱ)胁迫起到至关重要的作用。
从各酶系间变化差异来看,4种酶中SOD对Cd(Ⅱ)胁迫的应激性最强,自Cd(Ⅱ)胁迫4 h后,SOD活力一直呈激活状态,SOD酶活性可达到对照的10倍左右;POD酶自Cd(Ⅱ)胁迫8 h后随时间的延长增加,在48 h时达到最大,是对照的5.7倍,该生态效应得到来自国外的有关资料的支持。SOD和POD是抗氧化防御系统最重要的抗氧化酶之一,其活性越高,机体对ROS伤害的防御能力越强(彭艳等,2006;李冬琴等,2015)。SOD能将ROS转化为氧化作用相对较弱的H2O2,再由POD和CAT将H2O2分解成H2O,因此SOD是细胞抵抗ROS胁迫的第一道屏障(Banerjeeetal.,1999;胡延玲等,2009;Sunetal.,2010)。Cd(Ⅱ)胁迫后,球孢白僵菌分生孢子内POD及SOD酶激活至较高水平,这说明受Cd(Ⅱ)胁迫的球孢白僵菌分生孢子对体内的Cd(Ⅱ)成分有了一定的耐受性,POD及SOD活性提高清除ROS的能力增强,对维持细胞正常生理功能起到了一定保护作用,表现出对Cd(Ⅱ)毒害的缓慢适应。
Cd(Ⅱ)胁迫4 h后,CAT活性增长率维持在1.01-2.03,活性提高并保持稳定,说明在Cd(Ⅱ)胁迫时,球孢白僵菌分生孢子体内的CAT保护酶发挥作用以消除多余自由基,来维持生命活动的正常进行。
当重金属浓度过大或处理时间过长,胁迫性加剧,生物体内产生的ROS超过生物体的清除能力时,便产生“毒物抑制效应”,对组织和细胞造成损伤,影响生物体的正常生理活动,使酶活性降低和丧失,甚至导致细胞或者生物体死亡(徐楠等,2003)。球孢白僵菌Bb33A中POD及GST两种抗氧化酶活性随Cd(Ⅱ)胁迫时间的延长最终会出现减少的趋势,这可能是因为随着Cd(Ⅱ)胁迫的持续,过多的ROS影响了POD及GST酶活性,而Foyer等(2000)认为可能是非酶促系统的应激反应加强的结果,即当一类抗氧化物质被大量消耗后,细胞就会启动其他解毒过程来维持其正常生命状态。
综合以上分析可以得知球孢白僵菌Bb33A分生孢子在受到Cd(Ⅱ)胁迫后可以快速适应,及时调节(Cd(Ⅱ)胁迫4 h后,GST、CAT、SOD活性明显提高)体内抗氧化酶系统防御Cd(Ⅱ)胁迫对其造成的毒害,以保障细胞正常生长发育及生理功能的完成。该研究中4种抗氧化酶协同抗Cd(Ⅱ)胁迫,共同组成防御过氧化系统,及时有效地清除体内的ROS以抵抗环境不良条件对机体的破坏。但机体在Cd(Ⅱ)胁迫下的调节能力是临时和有限的,抗氧化酶POD、GST活性并没有无限地提高,随着时间的延长,胁迫性加剧远远超过机体所能耐受的能力,细胞内多种活性物质包括抗氧化酶系受到损伤而使活性下降甚至失活(曾晓敏等,2002)。
此外,有关研究表明微生物可通过氧化还原、甲基化和去甲基化等作用转化重金属,使重金属从有毒的游离态转化为无毒或低毒的结合态(Borchetal.,2009)。因此探讨在重金属污染条件下球孢白僵菌生长过程中活性氧代谢与酶活性之间的内在联系,为进一步研究重金属污染对球孢白僵菌的损伤及球孢白僵菌对Cd(Ⅱ)抗性机制提供依据,从而为球孢白僵菌在保持其高杀虫活性的同时吸附和转化土壤中的重金属,改善土壤质量提供了科学基础。
镉污染越来越成为世界性的环境问题,已引起人们的广泛关注。研究Cd(Ⅱ)胁迫对球孢白僵菌抗氧化酶的影响为进一步研究球孢白僵菌对Cd(Ⅱ)的解毒机制提供了一定的理论基础,并为球孢白僵菌在保持其高杀虫活性的同时吸附和转化土壤中的重金属,改善土壤质量提供了科学基础。Cd(Ⅱ)胁迫诱导球孢白僵菌Bb33A中ROS累积,高水平的抗氧化酶活性是白僵菌33A耐重金属Cd(Ⅱ)的重要机制之一,在这些抗氧化保护酶中,以SOD最为重要。这些抗氧化保护酶活性不可能无限地提高,其在Cd(Ⅱ)胁迫下的调节能力是临时和有限的。
References)
Adamis PDB, Mannarino SC, Eleutherio ECA. Glutathione and gamma-glutamyl transferases are involved in the formation of cadmium-glutathione complex [J].FEBSLetters, 2009, 583 (9): 1489-1492.
Adamis PDB, Gomes DS, Pinto MLCC. The role of glutathione transferases in cadmium stress [J].ToxicologyLetters, 2001, 154 (2): 81-88.
Banerjee BD, Seth V, Bhattacharya A. Biochemical effects of some pesticides on lipid peroxidation and free-radical scavengers [J].ToxicologyLetters, 1999, 107 (1-3): 33-47.
Borch T, Kretzschmar R, Kapple A,etal. Biogeochemical redox processes and their impact on contaminant dynamics [J].EnvironmentalScience&Technology, 2009, 44 (1): 15-23.
Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J].AnalyticalBiochemistry, 1976, 72 (1-2): 248-254.
Chaney RL, Reeves PG, Ryan JA,etal. An improved understanding of soil Cd risk to humans and low cost methods to phytoextract Cd from contaminated soils to prevent soil Cd risks [J].Biometals, 2004, 17 (5): 549-553.
Chaney RL, Ryan JA, Reeves PG. Cadmium in soils and its transfer to plants and the human food chain. In: Proc. Eighth International Cadmium Conference (Nov. 10-13, 2011, Kunming, China) [R]. Brussels, Belgium: International Cadmium Association, 2013: 175-212.
Chaney RL, Ryan JA, Li YM,etal. Soil Cadmium as A Threat to Human Health Cadmium in Soils and Plants(McLaughlin MJ,etal.eds.)[M]. Dordrecht: Kluwer Academic Publishers, 1999: 219-256.
Chen TB, Huang QF, Gao D,etal. Heavy metal concentrations and their decreasing trends in sewage sludges of China [J].ActaScientiaeCircumstantiae, 2003, 23 (5): 561-569. [陈同斌, 黄启飞, 高定, 等. 中国城市污泥的重金属含量及其变化趋势[J]. 环境科学学报, 2003, 23 (5): 561-569]
Edwards R, Dixon DP, Walbot V. Plant glutathione S-transferases: Enzymes with multiple functions in sickness and in health [J].TrendsinPlantScience, 2000, 5 (5): 193-198.
Fang WG, Scully LR, Zhang L,etal. Implication of a regulator of G protein signalling (BbRGS1) in conidiation and conidial thermotolerance of the insect pathogenic fungusBeauveriabassiana[J].FemsMicrobiologyLetters, 2008, 279 (2): 146-156.
Foyer CH, Christine H, Noctor G,etal. Oxygen processing in photosynthesis: Regulation and signaling [J].NewPhytologist, 2000, 146 (3): 359-388.
Gusman GS, Oliveira JA, Farnese FS,etal. Mineral nutrition and enzymatic adaptation induced by arsenate and arsenite exposure in lettuce plants [J].PlantPhysiologyandBiochemistry, 2013, 71 (2): 307-314.
Habig WH, Pabst MJ, Jakoby WB. Glutathione S-transferases: The first enzymatic step in mercapturic acid formation [J].JournalofBiologicalChemistry, 1974, 249: 7130-7139.
He J, Gao YT, He X,etal. The effect of Zn and Cd on growth and antioxidant enzymes activity ofSuaedaheteropterakitagawa[J].ActaScientiaeCircumstantiae, 2013, 33 (1): 312-320. [何洁, 高钰婷, 贺鑫, 等. 重金属Zn和Cd对翅碱蓬生长及抗氧化酶系统的影响[J]. 环境科学学报, 2013, 33 (1): 312-320]
Hu YL, Zhang CH, Ju T,etal. Differential responses of GSH and GST in two rice cultivars under Cd stress [J].JournalofAgro-environmentScience, 2009, 28 (2): 305-310. [胡延玲, 张春华, 居婷, 等. 镉胁迫下两种水稻GSH和GST应答差异的研究[J]. 农业环境科学学报, 2009, 28 (2): 305-310]
Khalid AH, Sedky HAH, Jin HJ. Potential capacity ofBeauveriabassianaandMetarhiziumanisopliaein the biosorption of Cd2+and Pb2+[J].JournalofGeneralandAppliedMicrobiology, 2011, 57 (6): 347-355.
Li DQ, Chen GK, Zheng H,etal. Effects of cadmium on growth and antioxidant enzyme activities of two kidney bean (PhaseolusvulgarisL.) cultivars [J].JournalofAgro-environmentScience, 2015, 34 (2): 221-226. [李冬琴, 陈桂葵, 郑海, 等. 镉对两品种玉豆生长和抗氧化酶的影响[J]. 农业环境科学学报, 2015, 34 (2): 221-226]
Li LJ, Liu XM, Guo YP,etal. Activity of the enzymes of the antioxidative system in cadmium-treated Oxya chinensis (OrthopteraAcridoidae) [J].EnvironmentalToxicologyandPharmacology, 2005, 20 (3): 412-416.
Liu DL, Zhang SP, Chen Z,etal. Soil cadmium regulates antioxidases in sorghum [J].AgriculturalSciencesinChina, 2010, 9 (10): 1475-1480.
Liu HH, He JY, Zhao RT,etal. Molecular expression pattern of glutathions-transferase gene inMytiluscoruscusexposed to heavy metals [J].OceanologiaetLimnologiaSinica, 2014, 45 (2): 274-280. [刘慧慧, 何建瑜, 赵荣涛, 等. 重金属胁迫下厚壳贻贝谷胱甘肽S-转移酶基因表达分析[J]. 海洋与湖沼, 2014, 45 (2): 274-280]
Lu SQ, Liu SJ, Liu HY,etal. Effects of Cu2+on activities of protecting enzymes SOD, CAT and GSHPX in liver tissue ofMonopterusalbus[J].JournalofFisherySciencesofChina, 2002, 9 (2): 138-141. [鲁双庆, 刘少军, 刘红玉, 等. Cu2+对黄鳝肝脏保护酶SOD、CAT、GSHPX活性的影响[J]. 中国水产科学, 2002, 9 (2): 138-141]
Murado MA, Vazquez JA. The notion of hormesis and the dose-response theory: A unified approach [J].JournalofTheoreticalBiology, 2007, 244 (3): 489-499.
Niu YQ, Zheng JF, Wang HL. Progress in effect of lead on anti-oxidative damage enzyme of aquatic animal [J].EnvironmentalScience&Technology, 2010, 23 (2): 74-78.
Peng Y, Li Y, Yang GX,etal. Effects of aluminum stress on the activities of SOD, POD, CAT and the contents of MDA in the seedlings of different wheat cultivars [J].Biotechnology, 2006, 16 (3): 42. [彭艳, 李洋, 杨广笑, 等. 铝胁迫对不同小麦SOD、CAT、POD活性和MDA含量的影响[J]. 生物技术, 2006, 16 (3): 42]
Perrin DD, Watt AE. Complex formation of zinc and cadmium with glutathione [J].BiochimicaetBiophysicaActa, 1971, 230 (1): 96-104.
Pireira RM, Alvas SB, Stimac JL. Growth ofBeauveriabassianain fire ant nest soil with amendments [J].JournalofInvertebratePathology, 1993, 62 (1): 9-12.
Romero-Puertas MC, Rodriguez-Serrano M, Corpas FJ,etal. Cadmium-induced subcellular accumulation of O2-and H2O2in pea leaves [J].Plant,CellandEnvironment, 2004, 27 (9): 1122-1134.
Smeets K, Cuypers A, Lambrechts A,etal. Induction of oxidative stress and antioxidative mechanisms inPhaseolusvulgarisafter Cd application [J].PlantPhysiologyandBiochemistry, 2005, 43 (5): 437-444.
Studdert JP, Kaya HK. Water potential, temperature, and soil type on the formation ofBeauveriabassianasoicolonies [J].JournalofInvertebratePathology, 1990, 56 (3): 380-386.
Stebbing ARD. Hormesis-The stimulation of growth by low levels of inhibitors [J].TheScienceoftheTotalEnvironment, 1982, 22 (3): 213-234.
Sun SQ, He M, Wang GX,etal. Heavy metal-induced physiological alterations and oxidative stress in the mossBrachytheciumpiligerumchad [J].EnvironmentalToxicology, 2010, 26 (5): 453-458.
Wraight SP, Ramos ME, Avery PB,etal. Comparative virulence ofBeauveriabassianaisolates against lepidopteran pests of vegetable crops [J].JournalofInvertebratePathology, 2010, 103 (3): 186-199.
Xu QS, Shi GX, Wang X,etal. Generation of active oxygen and change of antioxidant enzyme activity inHydrillaverticillataunder Cd, Cu and Zn stress [J].ActaHydrobiologicaSinica, 2006, 30 (1): 107-112. [徐勤松, 施国新, 王学, 等. 镉、铜和锌胁迫下黑藻活性氧的产生及抗氧化酶活性的变化研究[J]. 水生生物学报, 2006, 30 (1): 107-112]
Xu N, Shi GX, Zeng XM,etal. Damage to primary structure and antioxidant enzymes inLemnaminorincluded by Hg2+[J].ActaPhytoecologicaSinica, 2003, 27 (3): 299-303. [徐楠, 施国新, 曾晓敏, 等. Hg2+胁迫对浮萍体细胞DNA一级结构和抗氧化酶系的损伤[J]. 植物生态学报, 2003, 27 (3): 299-303]
Yi ZF, Yu X, Wu J. Research advance of remediation technologies of the cadmium contaminated soil [J].ModernAgriculturalSciencesandTechnology, 2014, 9: 251-253. [易泽夫, 余杏, 吴景. 镉污染土壤修复技术研究进展[J]. 现代农业科技, 2014, 9: 251-253]
Zeng XM, Shi GX, Xu QS,etal. The defense of protective system inTrapellasinensisoliveunder Hg2+、Cu2+stress [J].ChineseJournalofApplied&EnvironmentalBiology, 2002, 8 (3): 250-254. [曾晓敏, 施国新, 徐勤松, 等. Hg2+、Cu2+胁迫下茶菱保护酶系统的防御作用[J]. 应用与环境生物学报, 2002, 8 (3): 250-254]
Zhang XB, Tang F, Liu YS,etal. Induction of glutathione S-transferases by tannic acid inMicromelalophatroglodyta[J].ChineseBulletinofEntomoligy, 2009, 46 (4): 579-584. [张秀波汤方, 刘玉生, 等. 单宁酸对杨小舟蛾谷胱甘肽-S-转移酶活性的诱导[J]. 昆虫知识, 2009, 46 (4): 579-584]
TheeffectofCd(Ⅱ)onantioxidantenzymescctivityofBeauveriabassiana
YAN Xia-Fei1, ZHENG Chang-Ying1, Li Kai-Ye1, WAN Fang-Hao1,2, WANG Jun-Ping1*
(1. Key Laboratory of Integrated Crop Pest Management of Shandong Province, College of Plat Health and Medicine, Qingdao Agricultural University, Qingdao 266109, China; 2. Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
The effects of heavy metals Cd(Ⅱ) on antioxidant enzyme (SOD, CAT, POD and GST) activities ofBeauveriabassianawere studied.B.bassianaspores were exposed to Cd(Ⅱ) at different times in order to evaluate the responses of the spores to heavy metal stress. The enzyme activity of POD was decreased at the inception phase of Cd(Ⅱ) stress, and it was more sensitive to Cd(Ⅱ) stress. The enzyme activities of GST, SOD, CAT were significant increased after four hours of Cd(Ⅱ) stress. The change activity of GST was most evident at the early stress of Cd(Ⅱ), and it may play a key role in the protection ofB.bassianacell. Otherwise, it has no significant effect on cell later on; The change activity of POD was reversed, POD may play a key role in the protection ofB.bassianacell at the late stage of stress; The activity of CAT was stability and did not change significantly, it’s still higher than the activity of CAT in the normal state; SOD has always maintained a high enzyme activity. Among these antioxidant protection enzymes, SOD has the greatest importance. This indicted that the improve and maintain in the activities of antioxidant system were one of the physiological basis for the tolerance to Cd(Ⅱ) stress inB.bassianaspores.
Cd(Ⅱ) stress;Beauveriabassiana; antioxidant system; soil remediation
燕霞飞,郑长英,李凯月,等.球孢白僵菌在重金属Cd(Ⅱ)作用下抗氧化酶系变化[J].环境昆虫学报,2017,39(5):992-999.
Q956.9;S476
A
1674-0858(2017)05-0992-08
国家自然科学基金(31201577);青岛农业大学高层次人才科研基金(630609);山东省“泰山学者”建设工程专项经费
燕霞飞,女,1992年生,山东东营人,硕士研究生,研究方向为农业昆虫与害虫防治,E-mail:1572514891@qq.com
*通讯作者Author for correspondence, E-mail: junpingwang@qau.edu.cn
Received: 2016-09-22; 接受日期Accepted: 2016-11-22
