白僵菌属分类研究进展
2019-04-25郭东升翟颖妍任广伟成巨龙安德荣
郭东升,翟颖妍,任广伟,成巨龙 ,刘 云 ,安德荣
(1.西北农林科技大学 植物保护学院,陕西杨凌 712100;2.中国烟草总公司 青州烟草研究所,山东青州 262500;3.陕西省烟草公司,西安 710000;4.陕西省烟草公司 宝鸡市公司, 陕西宝鸡 721000)
白僵菌(Cordycipitaceae:Beauveria) 在180多年前作为家蚕病原物第一次被报道。当然,那时候人们还不叫这种病原物为白僵菌。在菌物分类还没有发展的年代里,人们认为这种“病原物”是有害的,因为它对家蚕养殖业造成巨大打击。现在提到白僵菌就要说明一下它是哪种白僵菌了。
1912年,Beauverie建立白僵菌属后,白僵菌的属内种不断增加。目前所说的白僵菌除从智利火山灰中分离的B.vermiconia和中国青藏高原土壤样品中分离的B.malawiensis还未发现昆虫寄主,其余都属于兼性死体营养型的昆虫病原真菌。白僵菌可以存在于多种生态环境中。从现在的报道可以看到白僵菌可在土壤中[1]及植物根际存活[2];也可以内生于植物[3];当然,最多的是作为昆虫病原物在昆虫上被发现报道。白僵菌以腐生菌丝或休眠的繁殖体存在于土壤或内生于植物中,直到它在周围的微环境中黏附到合适的寄主上[4-5]。和近似属的绿僵菌一样,白僵菌也是最常见的昆虫病原真菌,拥有广泛寄主范围,能够侵染超过700多个种类的昆虫[6]。白僵菌的寄主范围已早不局限于家蚕了,它寄主范围内的昆虫还包括能给农业和森林带来巨大经济损失的重要害虫[7]、一些病害媒介昆虫[8]、蟑螂[9]、蜱[10]和蜘蛛[11]。而白僵菌菌株的分离一般是利用选择培养基或昆虫诱饵法(如,大蜡螟诱饵法,菜粉虫诱饵法等)从土壤或昆虫尸体中分离出来的[12]。
昆虫致病真菌的研究始于18世纪80年代初,主要是出于对欧洲蚕养殖业的疾病管理的需要。一开始的研究发现,白僵菌是引起蚕僵化病的病原,而进一步的研究证实,白僵菌也可能感染其他昆虫[13-16],这也激发了人们使用白僵菌控制害虫的想法。但之前尝试用昆虫病原物来防治昆虫的想法和实践被逐渐发展起来的化学农药所阻滞[4]。直到现在,原先效果好的化学农药逐渐显露出它的弊端:新的杀虫药剂更新缓慢,抗药性昆虫群体的扩大;化学农药的长期使用和不合理使用对生态环境造成的破坏;最重要的是这些化学农药最终会流向食物链顶端的人类。在最常见的白僵菌属内种中,B.brongniartii和B.bassiana用于控制害虫以保护作物和根除人类疾病的媒介,已在世界范围内被广泛开发和利用[17-18]。据统计,2002年到2007年,全球范围内共有171种基于昆虫致病真菌的产品已注册为商业真菌杀虫剂,其中关于白僵菌的产品有63种,占到38%[6]。
早在19世纪80年代的中国,在政府的支持下用B.bassiana控制森林病害昆虫的面积已经达到了80~130万hm2[19]。 2003年前后,浙江大学开发的针对茶叶害虫中蝉和蚱蜢的白僵菌的杀虫剂的销售标志着白僵菌在中国的市场化[20]。在世界范围内,如19世纪80年代的巴西、俄罗斯、捷克斯洛伐克、波兰和19世纪90年代的古巴都有一些没有商业化的优质白僵菌剂的生产[6]。虽然说白僵菌的应用前景一片大好,但是不得不承认它的应用仍然面临着很多问题:白僵菌产品生产厂家多但规模小,管理模式落后,技术薄弱,防效不稳定,政府支持力度不够大[21]。2015年起中国颁布一系列倡导生物防治和绿色防控的法令,这些法令的颁布为解决这一系列问题提供强大动力。虽然说中国生物防治的研究还不够成熟,但这也同时代表着它还有很大的发展空间。针对白僵菌药效不稳定的问题,混合生防菌剂的研究和新的高效菌系的筛选不失为一个好的解决方案。例如,Prabhukarthikeyan等[22]利用白僵菌和芽孢杆菌联合防治香蕉镰刀菌枯萎病和一些水果穿孔病,取得良好效果。但对于新种的发现,高效白僵菌菌株的筛选,依然存在以下问题:在白僵菌属分类中白僵菌属内种寄主范围的混杂,形态特征的多变性影响白僵菌属内种的分类,命名[23-24]及生防制剂的开发。例如,1989年Saccardo 在非洲阿尔及利亚的沙漠蝗虫(直翅目)上分离出的Botrytisbrongniartii,后来在白僵菌属的分类命名发展中被归到Beauveriabrongniartii, 虽然说Beauveriabrongniartii的寄主范围很广,但至今还没有发现它能侵染直翅目昆虫,所以Botrytisbrongniartii这个命名就建议被保留而不是修改[25]。白僵菌属的分类研究不仅对它的生防应用前景和生物多样性研究具有重大意义,而且为整个菌物的多样性研究提供了参考模板。
1 白僵菌的侵染过程
因为白僵菌有特殊的昆虫致病机理(图1)且寄主范围广[26-27],能够相对简单地大量生产等优点,几乎所有的白僵菌都有作为生防制剂防治害虫的潜力。白僵菌不像细菌和病毒那样,它们能够直接穿透和破坏寄主昆虫的皮层从而在昆虫体内寄生,逐渐杀死寄主昆虫[28]。侵染过程的关键步骤就是白僵菌可以通过自身菌丝萌发产生的压力和分泌的可以溶解昆虫皮层组分的酶类(如脂酶,几丁质酶,蛋白酶等)来破坏寄主昆虫皮层组织[29]。在白僵菌芽管萌发突破昆虫表皮后,菌丝逐渐在昆虫组织内扩展,在最后突破血淋巴膜后,进入血淋巴。
在血淋巴内白僵菌先以菌丝体的形式或通过小的独立繁殖体快速扩繁。在血淋巴内吸取虫体养分并不断产生和释放毒性物质,以创造出自己需要的物质。这也最终导致寄主昆虫的死亡[30]。虫体养分被耗尽后白僵菌菌丝突破虫体长出,随后发育成产孢细胞,产生分生孢子去侵染其他寄主昆虫。
2 白僵菌的分类历史
2.1 白僵菌的发现
对于白僵菌的发现还要追溯到18世纪初,一种病害使得意大利和法国的家蚕养殖业蒙受近乎毁灭性的打击。1807年,意大利科学家Agostino Bassi di Lodi (1773-1856)通过对这个病害近30 a的研究[31],于1835年发表了一篇名为《 Del mal Del segno, calcinaccio or moscardino》的文章,得出是一种微生物引起这个发生在家蚕上的病害[14-15,31]。他也是第一个定义微生物引发病害理论的人[31-33]。
2.2 白僵菌属无性型和有性型
在过去,白僵菌属的分类地位一直是半知菌亚门-丝孢纲-丛梗孢目-丛梗孢科-白僵菌属。由于过去普遍认为白僵菌属是没有有性型而只有无性型的属[23,34]。直到发现虫草属的亚洲有性型,随后用分子系统发育证明其与白僵菌属的密切联系[23,35]。现在很多研究已经发现虫草属有性型和白僵菌属无性型之间的密切联系。例如,B.bassiana和C.bassiana[36],B.brongniartii和C.brongniartii[37],B.sobolifera和C.sobolifera[34],B.sungii和C.scarabaeicola[35]。
白僵菌的有性型在自然状态下很少发现,仅有少数的一些在亚洲国家被找到。例如,在日本和中国发现的C.brongniartii[38-39];在中国和韩国发现的C.bassiana[36,40 ];也有的,例如,C.scarabaeicola在新几内亚被报道的同时[41],随后又在日本[42]、中国台湾[43]、中国大陆[44]和韩国[45]被发现。有趣的是,近年来,一些白僵菌的有性型在南美洲被找到。这表明在世界范围内,一些白僵菌的属内种极有可能存在完整的生活史或者有些被发现物种的全型可能包含某些白僵菌的无性型阶段[46]。对于以前的白僵菌属的分类结果,现在已经逐步开始用分子系统发育重新进行划分。由于白僵菌属有性型的发现和分子系统发育结果的支持。最终根据Kirk[47]的结果,从 NCBI (http://www.ncbi.nlm.nih.gov/)上可以看到,现在的白僵菌属已被划分到子囊菌门-子囊菌纲-肉座菌目-虫草菌科内。
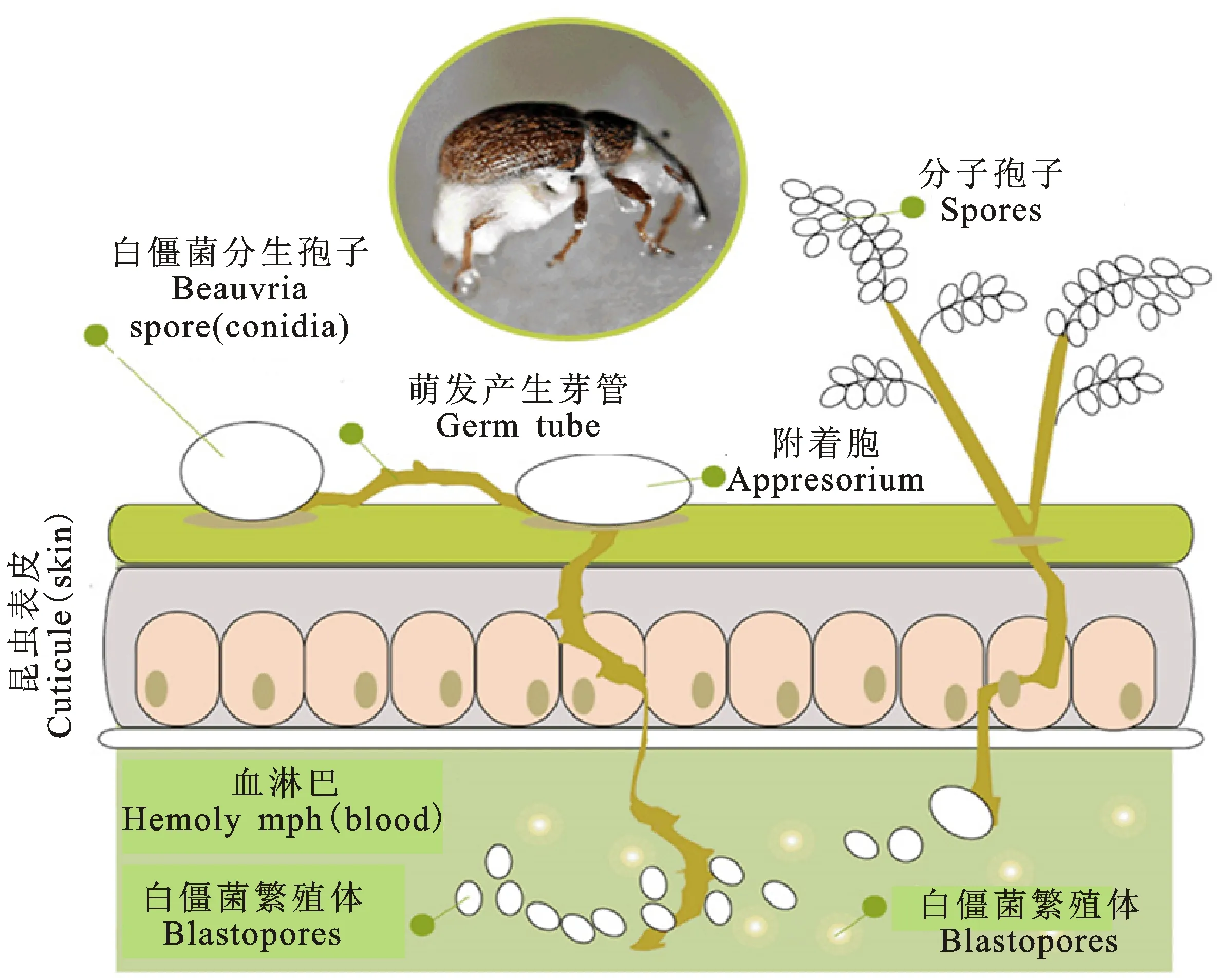
图1 白僵菌的侵染过程Fig.1 Infection process of Beauveria(From http://www.anatisbioprotection.com)
2.3 以形态学特征为主要分类标准的白僵菌分类历史
在以形态学特征作为白僵菌属内种主要划分依据的时代里,关于白僵菌的命名和属内划分一直是没有明确定论的。在白僵菌属的分类历史中,它有过许多不同的名字。如,Botrytis,Sporotrichum和Isaria,同时也被认为是其他属的无性型[48-50]。
第一个给白僵菌命名的人是Balsamo-Crivelli,在1835年为了纪念白僵菌的发现者Agostino Bassi di Lodi,随将其命名为BotrytisbassianaBals.-Criv[51]。而真正建立白僵菌属的人则是Beauverie。在1911年,Beauverie指出该白僵菌应属于一个尚未被描述的新属,1912 年Vuillemin 以Botrytisbassiana为模式标本将该菌的属名定为白僵菌属(GenusBeauveria),为了认可Beauverie在该属上的巨大贡献,在1914年将Botrytisbassiana更名为Beauveriabassiana[23,51]。
白僵菌属建立后,有很多菌物学家通过培养特性和形态学特征对白僵菌属进行属内分类研究。1926年,Petch对先前被认为是白僵菌属内8个近似种的样本进行分类研究,结果通过孢子形态特征将这8个种分成B.bassiana和B.densa(Link) F. Picard 2个种[52]。1954年,MacLeod 通过对白僵菌属内16个近似种的培养特性和形态学特征研究,最终确定2个种B.bassiana和B.tenella。这2个种之一的B.tenella是对Petch命名属B.densa的修改[49]。1972年,De Hoog向外界发表他对于白僵菌的各个研究方向的研究成果,其中包括他个人总结的白僵菌属间划分的关键识别特征。他像Petch和MacLeod一样将白僵菌属内划分为2个种,不同的是用B.brongniartii代替B.densa和B.tenella。1978年,在先前的基础上,De Hoog根据他的研究结果又增加1个B.alba,不过随后De Hoog又将其划分到Engyodontium[50]。1975年,De Hoog和Rao从智利火山灰分离出孢子形态为逗号状的B.vermiconia[1]。1982年,Samson 和Evans从厄瓜多尔的鳞翅目幼虫上分离出孢子形状为椭圆形且孢子表面带有粘性胶质层的B.velata[53],随后他们又从巴西鞘翅目昆虫上分离出孢子形状为圆柱形的B.amorpha[53]。1988年,Bisset和Widden从新西兰沼泽地土壤中分离出孢子形状为短圆柱状的B.caledonica[54]。2006年,Rehner等在这些基础上又从马拉维双斑弗天牛/桉嗜木天牛上分离出孢子形状为圆柱状的B.malawiensis。截至2018年1月10日,已报道的白僵菌属内种共有18种,它们的具体形态学特征见表1。
3 形态学特征在白僵菌属内种鉴定中的局限性
利用形态学特征可以很容易地在属的层面上识别白僵菌。白僵菌的分生孢子梗无隔膜,由轮生、致密、透明、细胞壁平滑的产孢细胞团簇组成;产孢细胞合轴分枝,短球状或长颈瓶状;轴顶为人字形,表面呈锯齿状,在上面可见一连串无色,透明,全分裂的分生孢子[25,50]。在培养过程中,白僵菌一般生长缓慢,菌落表面有绵毛状物。很少形成菌丝束,白色或淡黄色,偶有粉红色。气生菌丝透明,细胞壁薄且光滑,松散,有时丛生。由于白僵菌可产生大量的球形、近球形和椭圆形到圆柱形等形状不一且可变形的[55]分生孢子,老熟菌落表面呈粉状[24,50]。还有一些白僵菌的属内种能够分泌色素,例如,在一些培养基中产生红色的二苯醌卵胞素[50,56]。值得一提的是,1994年,Eyal从B.bassianaNov. EO-1 菌株上分离的红色色素对植物昆虫(如,粉虱)和土壤昆虫(如,橡皮虫)有很高的毒力,具有很好的防治一些害虫的前景[57]。
在过去的近2个世纪里,尽管有研究证明分生孢子形状可能随着培养而改变[55]。培养特性和分生孢子的形状、大小依然是识别、鉴定白僵菌并进行属内分类的主要方法。可随着研究的深入,白僵菌属孢子形状大小的重叠,缺乏特征性识别特征的问题逐渐凸显出来,这也导致一些种的误判或者把一些种错误地归到更大范围的类群[49,58]。因此,白僵菌属的形态学分类存在的这些问题降低了它在白僵菌属内分类的有效性。到目前为止只有从智利火山灰中分离出的B.vermiconia的逗号形状的分生孢子与白僵菌属内其他种的分生孢子形态差异巨大,可以用形态学分类来准确区分。
在2005年后,随着一些形态学相似但分子系统发育相差甚远的种和一些神秘种的发现[23-24,59-60]让人们意识到:传统的分类方法在白僵菌属内的分类应用上显得越来越不方便,不准确;菌物的分类在分子时代正面临着变革,白僵菌属正是其中不可或缺的一员[4]。
4 白僵菌属的分子生物学鉴定
4.1 探索阶段的白僵菌属的分子时代分类史
1989年,Mugnai等运用白僵菌的主要生物化学成分对白僵菌属内种进行分类[61]并从B.bassiana复合种里成功分出B.alba。并鉴别出B.alba,B.amorph,B.bassiana,B.brongniartii,B.velata,B.vermiconia。在这之后,陆续也有对白僵菌生物化学成分进行研究的报道[55,62-63]。这些报道对于白僵菌孢子和菌丝的代谢路径研究以及白僵菌生物防控的优化是具有重要意义的,但是作为白僵菌种间划分的依据还不够精确。现在关于白僵菌属划分依据更多倡导多基因位点分子系统发育的鉴定方法。从19世纪开始分子生物学技术就已经运用到白僵菌的分类研究中。如,DNA探针技术[64],随机扩增片段多态性(RAPD)技术[65],单链形态多态性(SSCP)技术[66],端粒指纹技术[67],限制性片段长度多态性 (RFLPs) 技术[68],扩增片段长度多态性 (AFLPs)技术[69],序列特异扩增区域(SCAR)技术[70],简单序列重复多态性(SSR)技术[71],线粒体DNA 技术和简单序列重复区间(ISSR)技术[72]等。现在看来这些技术没有在白僵菌的分类研究中建立权威的标准分类模式,但却成功地应用到白僵菌在环境土壤中接种释放后的持续和可追溯性评估中[72-73]。另外,这些技术还成功运用于对一些真菌群体结构特征[74]、基因多样性[75]或者一些自然状态下特异真菌种群的发生[76]等方面的研究。
随着分子技术的不断革新与进步,白僵菌的属内很多根据形态学特征划分的种到现在被证明包含一些独立亲缘关系的种[23-24]。因此,根据形态学特征的分类已不足以评估白僵菌的生物多样性了。庆幸的是,面临的问题正驱使菌物学家们探究,提议更多更好的可选择方案来更加精确地划分白僵菌的属内种,而绝不是仅仅通过形态学特征来划分属内近缘种[24,77]。

4.2 核糖体转录间隔区ITS
真菌中,核糖体转录区从3′到5′端依次是18S小亚基(SSU)、5.8S、28S大亚基(LSU)。转录间隔区从3′到5′依次是ITS1和ITS2,被5.8S区段分开。由于核糖体DNA的ITS区域变异水平高,而转录区域比较保守[78];测序花费比较低;引物在所有真菌里基本通用,容易扩增且测序方便。所以是目前应用最广泛的分子系统发育研究位点[79-81]。自20世纪90年代以来,ITS-rDNA区域是真菌鉴定和分子分类学上最常见的遗传标记,近年也成为真菌研究的常用DNA条码[79-80,82]。然而,仅以ITS区域作为真菌属种间划分依据,已经被许多菌物学家所诟病;因为它没有足够的变异度来解决一些——诸如,白僵菌和绿僵菌等相近物种间的区分[23,83-85]——问题。另外,在白僵菌的属内种的区分上,近年来,很多报道也强调仅用核糖体ITS序列也是远远不够的[71,86]。如,在Imoulan等的报道中,白僵菌属内,只有ITS序列差异大的种仅能用ITS序列来区分 (如,B.bassiana,B.hoplocheli,B.malawiensis,B.sungii,B.sinensis,B.amorpha,B.caledonica,B.vermiconia,B.varroae,B.kipukae和B.lii),这也间接说明单独特定片段的DNA条码的功能是有一定限度的。
4.3 转录延长因子EF-1a(TEF)
在2005年,TEF首次被Rehner 和 Buckley应用在一项区分分子系统发育不同的白僵菌属内种的综合研究中,随后的类似研究均把该位点作为一个优质位点多次采用[11-12,23-24,58,71,86-88]。在2005年的这篇论文中,5个与它们之前的形态学特征描述密切相关的种被划分出来[71]。其中,广义B.bassiana分生孢子有球形和亚球形,它的分子系统发育不是单一的,是由2种不相关的,但形态上无法区分的2个谱系组成,分别位于2个不同的分支A和C上,所以被认为是2个独立的种。分支A在全球范围内分布,与狭义B.bassiana,以及与分支C密切相关,分支C中包含与分支A形态学特征不同的菌株。后来被鉴定定名为B.pseudobassiana[24]。分支B包括B.brongniartii的分离物,这是一种分生孢子为椭圆形的欧亚物种。分支D种有两种,B.caledonica和B.vermiconia,分别产生圆柱形和逗号形状的分生孢子。分支F由孢子形状为圆柱形的B.amorpha组成[23]。
在这之后又有报道说明,由于狭义B.bassiana和B.pseudobassiana两者的TEF序列对比差异太小,它们的区分仅通过TEF序列数据的话是不准确的[23-24,59]。在分析2个来自摩洛哥和中国种的数百个样品后,发现两者的差异最显著的地方是,气生菌丝在产生分生孢子阶段一个是灰白色,一个是黄褐色,从而导致它们的菌落颜色不一[89]。
4.4 多基因位点分析
在系统发育学科兴起以来,人们逐渐认识到,在真菌中用某物种的单基因位点的谱系来反映整个物种的系统发育过程是没有代表性的[90]。通过分析不同的单个基因位点推断出的系统发育结果可能是矛盾或是拓扑的结果。另外,已有理论研究表明,多基因联合分析可以对单基因分析产生的结果有实质性的补充改进[91]。因此,为了更准确地提供真正的系统发育关系,近年对于物种间的差异性研究,多使用多基因位点联合分析方法[92]。同样的,许多研究认为通过组合一个物种内相对多的基因位点联合分析可以提高物种的界定和识别的准度。在菌物中,采用综合的多位点基因条码的方法来识别和界定物种已经成为趋势[5,24,91,93]。菌物分类学家们也通过自己的实验探究和同行间的交流,总结出菌物多基因位点分析系统实施的可靠方案,以此划定和鉴别一些神秘物种,并避免对一些物种的错误识别[24,60,85,94]。
在一些可选择的分子标记[如,RNA聚合酶Ⅱ大亚基基因(RPB1),RNA聚合酶Ⅱ第二大亚基基因(RPB2),转录延长因子1a基因(TEF),核基因间隔区block(bloc)]已经被成功的应用来处理白僵菌属内复杂的种间划分问题[24,60]。bloc是专门为鉴定非洲新热带的广义B.bassiana系统发育起源设计的[60]。之后bloc被用作单基因位点成功地划分出B.malawiensis[60]。在这之前,Rehner用TEF和ITS两个基因位点对白僵菌属内进行分子系统划分[23]。RPB1和RPB2也经常和一些其他不同的基因(例如,nucSSU,nucLSU和5.8S)联合起来,用于分析解释菌物分类的系统发育关系[5,60,95-96],其中包括白僵菌[24]。
2011年,Rehner用以上所描述的4个基因位点对从不同地理位置,栖息地和寄主所取的68株白僵菌样本进行种的划分[24]。结果用这个方法划分出12种白僵菌(B.bassiana,B.australis,B.kipukae,B.pseudobassiana,B.varroae,B.brongniartii,B.asiatica,B.sungii,B.amorpha,B.caledonica,B.malawiensis和B.vermiconia)。随后又有新种被陆续报道,如,B.lii[12],B.sinensis[87],B.rudraprayagi[88],B.hoplocheli[58]。还有最近报道的新种,从中国青藏高原分离的B.medogensis[86],从中国贵州分离的B.araneola[11]。所以,到现在白僵菌的属内种增加到18个。自2011年后,这6个新种的发现和界定主要也是依靠多基因位点的联合分析的结果。整理所有通过多基因位点DNA条码的方法鉴定且报道的白僵菌的种(图2),然而结合图3可知,有些不同种的白僵菌分享着相同的孢子形状,但是分子系统发育分析结果却相差很大。如,2011年Rehner等,利用分子系统发育的方法在广义B.bassiana里分出3个种(B.varroae,B.pseudobassiana和B.kipukae);从广义B.brongniartii里分出2个种(B.asiatica和B.australis)。
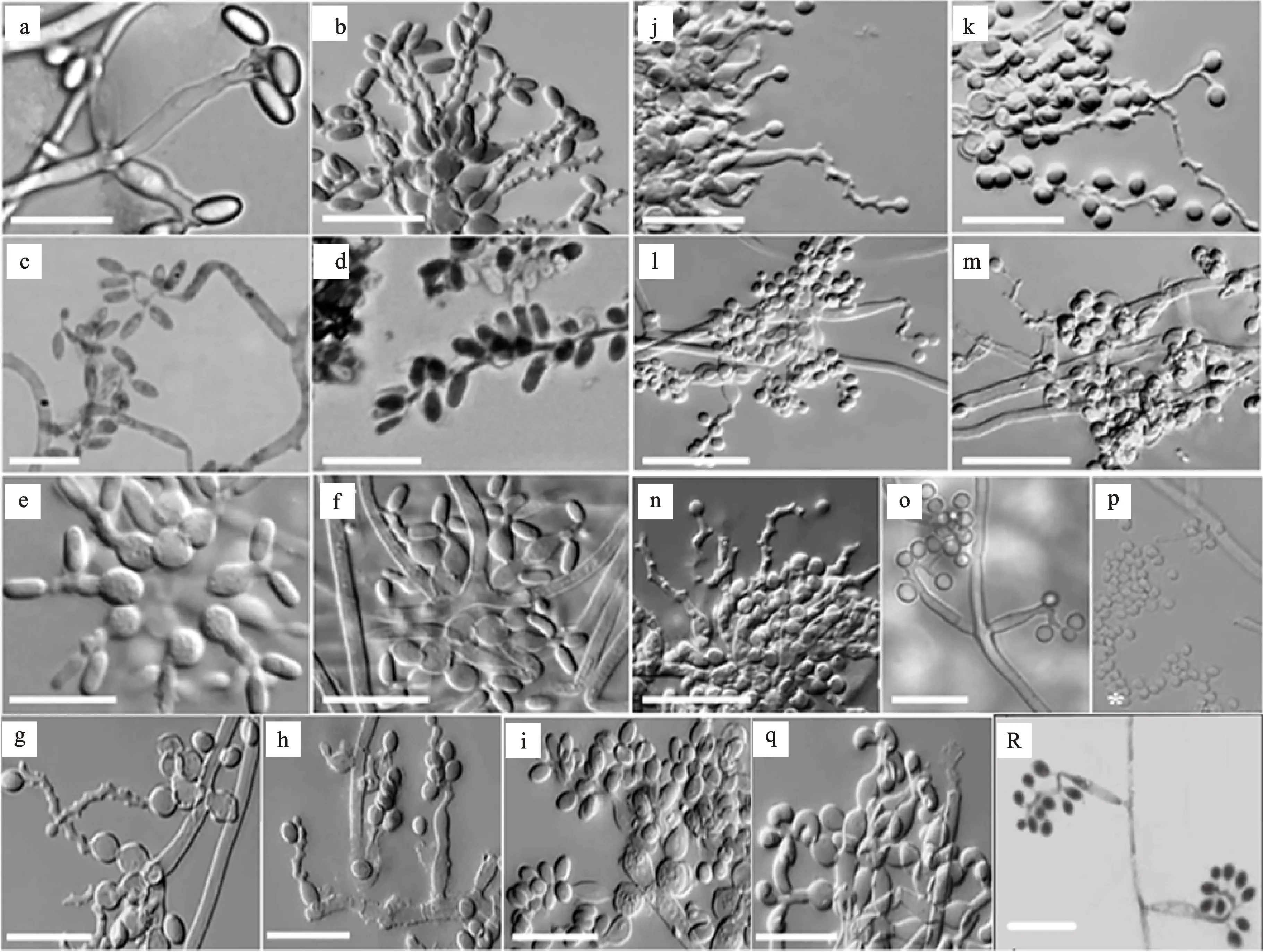
a-f.长椭圆形或圆柱形分生孢子。a.B.lii; b.B.amorpha; c.B.sinensis; d.B.hoplocheli; e.B.malawiensis; f.B.caledonica. g-i.椭圆形分生孢子。g.B.asiatica; h.B.sungii; i.B.brongniartii. j-p,R.球形或亚球形分生孢子。j.B.australis; k.B.bassiana; l.B.kipukae; m.B.varroae; n.B.pseudobassiana; o.B.medogensis; p.B.rudraprayagi. R.B.araneola. q.B.vermiconia.比例尺:10 μm,*表示比例尺不可用。
a-f.Beauveriaspecies with elongate ellipsoidal to cylindrical conidia; a.B.lii; b.B.amorpha; c.B.sinensis; d. B.hoplocheli; e.B.malawiensis; f.B.caledonica. g-i.Beauveriaspecies with ellipsoidal conidia, g.B.asiatica; h.B.sungii; i.B.brongniartii. j-p, R.Beauveriawith globose to sub-globose conidia, j.B.australis; k.B.bassiana; l.B.kipukae; m.B.varroae; n.B.pseudobassiana; o.B.medogensis; p.B.rudraprayagi.Beauveriawith comma-shaped conidia, R.B.araneola, q.B.vermiconia(Rehneretal. 2006,2011; Chenetal. 2013; Zhangetal. 2012; Agrawaletal. 2014; Imoulanetal. 2016b; CHEN W Hetal. 2017). Scale bars: 10 μm, * indicates scale bar not available.
图218种已被鉴别白僵菌的分生孢子形态
Fig.2ConidiashapeoftheseventeenrecognizedBeauveriaspecies

引导值(p50%)和后验概率(=100%)被标记在分支上并被“/”分隔开。分支末端的ARSEF标记是Rehner 2011年报道中分离的单个菌株的登入号。除了RCEF5500, RCEF3903, Bt98, Bt121, Bt128 ,strain2898 和GZU0317。这些是2011年后新发现种的登入号(Zhang等,2012; Chen等,2013; Robène等,2015; Imoulan等,2016; CHEN W H等,2017)。
Bootstrap values (P50%) and posterior probabilities (=100%) are labeled above branches and separated by “/”.Terminal clades are labeled according to ARSEF accession numbers of individual isolates reported in Rehneretal. (2011), except RCEF5500, RCEF3903, Bt98, Bt121, Bt128 ,strain2898 and GZU0317, which are newly accession number of those discovered species after 2011. (Zhangetal. 2012; Chenetal. 2013; Robèneetal. 2015; Imoulanetal. 2016; CHEN W Hetal. 2017).
图3运用TEF1,RPB1,RPB2和Bloc多基因位点联合分析的方法,基于最大似然法和贝叶斯定律对于白僵菌属内的18个种建立的系统发育树
Fig.3Phylogenetictreeof18BeauveriabasedonMaximumparsimonyandBayesianinferenceofcombinedTEF1,RPB1,RPB2andBloc
多基因位点分子系统发育分类得到的结果比形态学分类得到的结果更能反映白僵菌属的生物多样性[24,60]。这些研究证明多位点DNA条码的方法在分析和鉴定未知的白僵菌上的前景,也为其他与白僵菌属相类似的属的分类提供参考依据。
5 孢子形状
自从1912年Vuillemin建立白僵菌属,现在共有18个属内种用多基因位点联合分析的方法被划分出来。根据分生孢子的形态 (表1,图3),白僵菌属内主要被划分为4个类群。第1个类群中包含6个种:B.amorpha,B.caledonica,B.malawiensis,B.lii,B.sinensis和B.hoplocheli(图3-a~3-f),它们的分生孢子形态是加长的椭圆形或圆柱形。第2个群体包含3个种:B.brongniartii,B.asiatica和B.sungii,它们分生孢子的形态是椭圆形 (图3-g~3-i)。第3个群体包含8个种:B.bassiana,B.australis,B.kipukae,B.pseudobassiana,B.varroae,B.rudraprayagi,B.medogensis和B.araneola(图3-i~3-p,3-R),分生孢子形态是球形到亚球形。第4个群体包含1个种:B.vermiconia(图3-q),分生孢子形态是逗号形。
6 总结和展望
总的来说,白僵菌属内分类混乱的问题给白僵菌的生物多样性及其应用研究带来很大问题和挑战,而分子系统发育的方法是解决这一问题的有效手段。如,在应用白僵菌的过程中很多人会认为白僵菌是不是会感染家蚕,从而在控制其他害虫的同时对家蚕养殖业造成打击。Wang等[97]通过研究中国西南部家蚕养殖业病原白僵菌的多样性,发现家蚕养殖业中的病原白僵菌和生防所用的病原白僵菌分子系统发育差异较大,是不同的种类。从而在一定程度上推广了白僵菌的应用。
由于白僵菌属的分生孢子形态的重叠,导致该属缺乏精确的形态学识别特征。如,之前用传统的形态学分类方法只划分出2个种B.bassiana和B.brongniartii[49,50,52]。所以,仅用形态学特征进行分类的方法被认为是不准确的。
在大规模DNA测序技术问世之前,传统的形态学分类方法一直缺乏批判性的观点[23-24]。但是仅用ITS序列这一单一的基因位点,在一些种的分类上是没有代表性或者说是不合适的。现在,白僵菌属内划分采用的是除形态学以外,联合ITS的多基因位点或ITS以外的单或多基因位点分析的方法。多基因位点联合分析的方法也被许多菌物学家提倡作为种间或种内划分的有效工具[24,86],也是识别鉴定隐含种极其有效的工具[98]。
一直以来,分生孢子形态是绝大多数菌物的属内种的形态学划分依据,也是比较有效的划分依据。可随着学科的发展,发现在白僵菌属中用分生孢子特征进行白僵菌属内分类的方法是不够准确和全面的。所以在白僵菌属内和其他的菌物属内,分生孢子形态更多的是作为菌物分类中最重要的形态学特征扮演着辅助分子系统发育,从而精确划分种的角色。
目前,已经有18个白僵菌的种通过多基因条码的方法被划分出来。然而在index of fungorum(www.indexfungorum.org; 2018-01-10)上可以看到61种关于白僵菌的分类命名,其中尚有43种有待通过多基因条码来验证。
分子系统学分类方法可以通过发现白僵菌新种和了解它们的地理分布[99],从而共同增加现有的白僵菌的生物多样性,进而拓展白僵菌的应用。同样的,一些其他用于多基因位点联合分析的有效位点的增加也会极大地帮助人们对白僵菌基因结构的全面理解,当然也会为种的识别和划分提供有力的帮助。另外,新一代基因测序技术(NGS)出现后已经在一些研究中得到应用,它能够快速测序整个基因组,并增加所测序目标区域的深度。这个新技术的出现,使研究者在整个基因组层面上做分子系统发育成为可能[100-101]。这种新技术的出现将显著改变菌物分类学家们分析和研究白僵菌以及其他真菌群之间进化关系的方式。
致谢:首先感谢实验室的陈雅寒师姐,李晓宇师姐,程睿君师姐,邱珂师姐和汝冰璐师兄给予的支持。其次要特别感谢孙广宇老师,张荣老师,江聪老师和梁晓飞老师提供的帮助。最后还要感谢原晨虹同学给予的鼓励和对论文完成的帮助。
