6-BA对葡萄果实中有机酸积累及相关基因表达的影响
2017-11-04王西成钱亚明吴伟民赵密珍周蓓蓓王壮伟巫建华
王西成,钱亚明,吴伟民,赵密珍,周蓓蓓,王壮伟,巫建华
(1.江苏省农业科学院 果树研究所,江苏省高效园艺作物遗传改良重点实验室,江苏 南京 210014;2.江苏现代园艺工程技术中心,江苏 句容 212400)
6-BA对葡萄果实中有机酸积累及相关基因表达的影响
王西成1,钱亚明1,吴伟民1,赵密珍1,周蓓蓓1,王壮伟1,巫建华2
(1.江苏省农业科学院 果树研究所,江苏省高效园艺作物遗传改良重点实验室,江苏 南京 210014;2.江苏现代园艺工程技术中心,江苏 句容 212400)
为探究6-BA对葡萄果实中有机酸积累的影响,及其调控果实有机酸合成的分子机制,以里扎马特葡萄为试材,花前5 d、花后3 d和花后10 d连续3次对花序与果穗进行6-BA处理,研究6-BA对葡萄果实中有机酸积累及其代谢相关基因表达的影响。结果表明,成熟果实中有机酸含量与6-BA处理浓度密切相关,30 mg/L处理后,成熟果实中的酒石酸和总酸含量均显著低于对照,但对苹果酸、柠檬酸和草酸含量并未产生较大影响;对于10,20 mg/L 6-BA处理而言,处理与对照成熟果实中的各种有机酸含量均不存在显著差异。基因表达结果表明,6-BA处理对IDH、MDH和PEPC基因的表达总体表现为抑制,但对于ME基因的表达则主要表现为促进。据此分析,6-BA处理抑制果实中有机酸合成的原因可能与其影响部分有机酸代谢相关基因的表达有关。
葡萄;6-BA;有机酸;基因表达
葡萄是世界范围内重要的果树树种之一,具有较高的经济学与生物学应用价值,在果品市场中占有重要地位。有机酸的组分及含量是构成果实风味品质的重要因素,直接影响着果实的商品与经济价值[1]。通常情况下有机酸会在果实生长过程中逐步积累,在果实成熟过程中又作为三羧酸循环(TCA循环)、糖酵解等呼吸基质和糖原异生作用基质而被消耗。已有研究表明,葡萄果实从着色期至成熟期,其呼吸商约增大为1.3,这表明此时果实是以苹果酸为呼吸底物进行氧化脱羧反应[2]。成熟果实中的有机酸含量是有机酸合成、液泡内贮存及转移的综合平衡结果,因此,如何通过对葡萄果实中有机酸含量的调控进而实现果实品质的改善,已成为我国葡萄工作者较为关注的问题[3]。
植物内源激素是由植物体自身合成的激素,其在果实生长发育和品质形成过程中均发挥着重要作用,使用外源植物生长调节物质可在一定程度上对其进行调节,进而达到改善果实品质的目的[4-5]。6-苄基腺嘌呤(6-benzyladenine,6-BA)是一种人工合成的细胞分裂素,具有促进细胞分裂、促进植物新陈代谢、调节营养物质运输、改善果实品质、促进坐果等多种功能[6-7]。Turk等[8]研究发现,幼果期喷施6-BA对于苹果单果重的提高具有较大的促进作用。Bound等[9-11]也发现,外源6-BA处理不仅能够显著提高梨果实的单果重和可溶性固形物含量,同时对于苹果产量和品质的提高同样具有积极的意义。目前,在葡萄上有关6-BA的应用也已见诸报道,赵权等[12]认为6-BA处理可显著提高葡萄果实花色苷及可溶性固形物含量,降低果实有机酸含量,进而提高果实品质。也有研究发现,6-BA可通过影响葡萄果实中相关转化酶的活性进而改变果实中的可溶性糖含量[13-14]。此外,6-BA处理对于葡萄果实中碳氮同化物运输[15-16]、果实贮藏生理特性[17]、叶片衰老及活性氧代谢[18]等也会产生较大影响。但有关6-BA处理对葡萄果实中有机酸组分、含量及相关基因表达所产生影响的研究仍未见报道。鉴于此,本研究以里扎马特葡萄为试材,通过分析3种不同浓度的6-BA对葡萄果实中有机酸组分、含量及苹果酸脱氢酶(MDH)、磷酸烯醇式丙酮酸羧化酶(PEPC)、L-艾杜糖脱氢酶(IDH)、苹果酸酶(ME)等有机酸代谢相关酶编码基因表达的影响,进而为6-BA在葡萄生产中的应用提供理论依据。
1 材料和方法
1.1试验材料
试验于2015年5-7月在江苏省果树种质资源圃内进行,以9 年生里扎马特葡萄为试材,株行距采用1 m×3 m,架势为双十字V型架,采用设施避雨栽培模式。供试葡萄植株长势健壮、均一,管理水平为常规田间管理。
1.2试验处理与取样方法
试验共设置4个处理:10,20,30 mg/L 6-BA,对照(CK)为清水处理,每个处理都选取6株生长势较为一致且健壮的植株,2株作为1 次重复,每个处理设置3 次重复,植株生长过程中除处理因素以外,其管理措施和生长环境均一致。分别于花前5 d(5月7日)、花后3 d(5月15日)和花后10 d(5月22日)分3次进行浸蘸花(果)穗处理,处理后从6月19日开始每隔7 d取样一次,直至果实成熟(7月31日)。
取样方法:分别从不同处理植株的东、南、西、北4个方位各取10粒果实,每个处理取果量约为240粒/次。所取样品一部分立即进行液氮速冻,之后保存于-70 ℃超低温冰箱中,主要用于基因表达时各个样品的RNA提取;另一部分则放入冰盒中,主要用于不同处理果实中单果重、可溶性固形物含量,以及各种有机酸酸含量的测定。
1.3不同处理果实单果重与可溶性固形物含量的测定
从每棵树上随机选取20粒果实,置于电子天平上称其总重量,然后求其平均值即为单果重。从完成单果重测定的果实中,随机选取10粒,利用手持糖度测定仪完成其可溶性固形物含量的测定,并求平均值。
1.4有机酸的提取与测定
葡萄果实中有机酸提取参照王海波等[19]的方法:首先将果肉加液氮充分研磨,取出0.8 g,加入0.2%(m/V)偏磷酸7 mL,超声波提取2 h,10 000 r/min离心10 min。取上清液,用0.2%(m/V)偏磷酸定容至10 mL。经0.22 mm有机滤头过滤后进色谱柱,用于有机酸含量及组分测定。试验共设置3次重复。本研究所采用的HPLC系统为Agilent 1100系列,色谱柱为ZORBAX Eclipse XDBC18 (416 mm×250 mm,5 μm)。色谱条件为:以0.2%(m/V)偏磷酸溶液为流动相;流速为0.5 mL/min,柱温25 ℃,进样量5 μL,使用Shimadzu SPD-20A紫外检测器,检测波长为214 nm。采用外标法进行定量分析。试验所用的草酸、酒石酸、柠檬酸及苹果酸等均购自Sigma公司。
1.5有机酸代谢相关基因qRT-PCR表达分析
用于葡萄果实中总RNA提取的试剂盒为Quick RNA isolation Kit,购自北京华越洋生物科技有限公司。以提取的果实中总RNA为反转录模板,同时参考TaKaRa Prime ScriptTMRT-PCR试剂盒说明反转录成cDNA。
葡萄内参基因UBI(XM_002266714),有机酸代谢相关基因IDH、ME、MDH和PEPC荧光定量PCR引物序列均参考已有报道(UBI-F:5′-GCTCGCTGTTTTGCAG
TTCTAC-3′,UBI-R:5′-AACATAGGTGAGGCCGCACTT-3′;Me-F:5′-CAACTGTTGGTGAGGCTTGC-3′,Me-R:5′-CCAGAATCCGCTCACCATCA-3′;IDH-F:5′-CCTGTGAG
AAGCTGAGACCG-3′,IDH-R:5′-GTCTTGATGCCCAGAA
GCCA-3′;MDH-F:5′-GCTGAGGCCAATGTACCAGT-3′,MDH-R:5′-ATGCCATTGAGAGGGTTGCA-3′;PEPC-F:5′-TACCTTCCGAGTTGCTGCTG-3′,PEPC-R:5′-GCTCCC
CTCAAGTCCTTCAC-3′)[20]。基因的表达分析主要参照SYBR Premix Ex TaqTM实时定量PCR试剂盒说明书进行,实时荧光定量PCR反应体系为:cDNA模板1 μL,上下游引物各0.8 μL,2×SYBR Premix Ex-TaqTM10 μL,ddH2O补足至20 μL。95 ℃预变性1 min;95 ℃变性 10 s,55 ℃退火 20 s,72 ℃延伸30 s,共40个循环;每个样品设置3次重复,采用ΔΔCt法对荧光定量PCR结果进行初步分析,而目的基因最终的相对表达量则通过2-ΔΔCt法计算获得[21]。
本试验采用随机区组设计,相关数据分别采用Excel 2007和SPSS 17.0软件进行处理与分析。
2 结果与分析
2.1不同浓度6-BA对葡萄单果重和可溶性固形物含量的影响
果实质量测定结果表明,6-BA处理与对照果实的生长发育都表现为线性增长。与对照相比,6-BA处理35 d后可以显著提高葡萄果实的单果重(图1)。可溶性固形物含量测定结果则表明,在果实达到完熟状态前,其可溶性固形物含量会随着果实的进一步发育而逐步提高。6-BA处理后49 d内,处理与对照间可溶性固形物含量并未表现出显著性差异,但自处理后56 d开始,处理果实中的可溶性固形物含量多显著高于对照,且待果实完熟后,
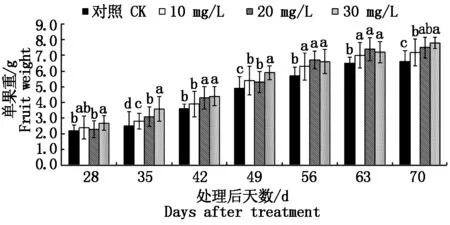
不同小写字母表示不同处理之间差异显著(P<0.05)。图2-4同。
30 mg/L 6-BA处理与对照间差异最为显著(图2)。
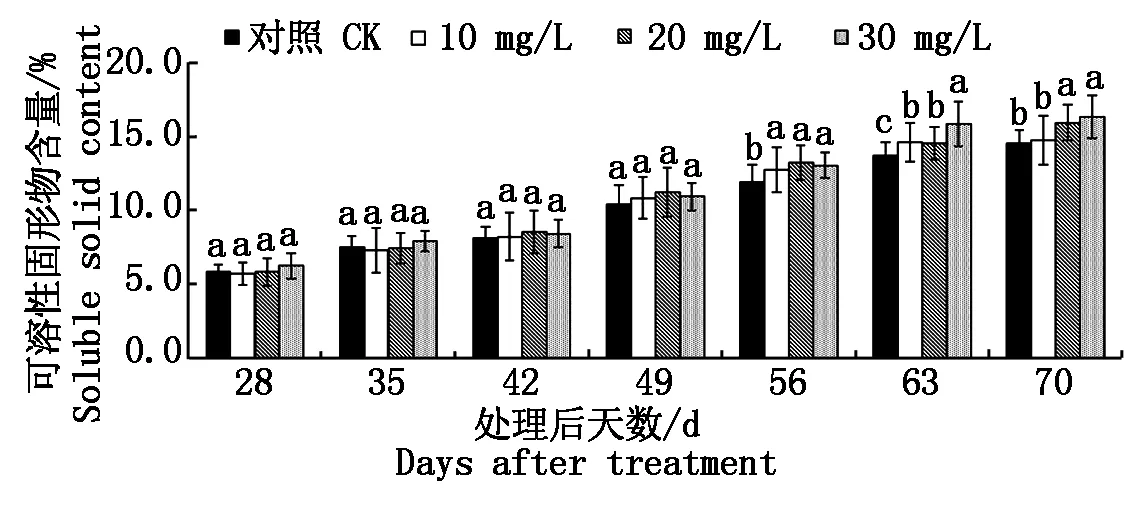
图2 不同浓度6-BA处理对葡萄果实可溶性固形物含量的影响Fig.2 Effects of different concentrations of 6-BA on grape soluble solids content
2.2不同浓度6-BA对葡萄果实中有机酸含量的影响
由图3可知,伴随着葡萄果实的逐步发育与成熟,除草酸外,其他种类有机酸的含量都表现为逐渐下降。对于总酸含量(以鲜质量计),不同浓度6-BA处理对其含量所产生的影响存在较大差异,10,20 mg/L6-BA处理多数时期并未对总酸含量产生较大影响,而30 mg/L 6-BA处理则显著降低了成熟果实中总酸含量。与总酸含量变化相似,成熟果实中酒石酸的合成同样受到30 mg/L 6-BA处理的显著抑制,而其他2种浓度6-BA处理则未对成熟果实中酒石酸含量(以鲜质量计)产生显著影响。苹果酸与柠檬酸含量(以鲜质量计)变化趋势较为一致,且在处理49 d(7月10日)后,处理与对照果实间基本不存在显著差异。与上述有机酸相比,草酸含量(以鲜质量计)变化较为复杂,但总体呈现出先升高后降低的变化趋势,且在处理后70 d时(7月31日)的成熟果实中基本检测不到草酸的存在。
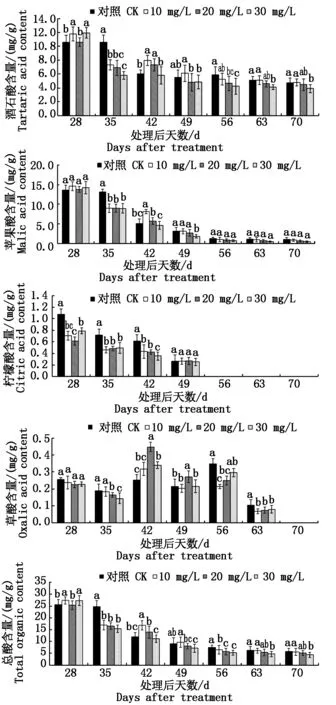
图3 不同浓度6-BA处理对葡萄果实中有机酸含量的影响Fig.3 Effects of different concentrations of 6-BA on grape organic acids content
2.36-BA对葡萄果实中有机酸代谢相关基因表达量的影响
qRT-PCR分析结果表明,6-BA处理对4个有机酸代谢相关基因的表达均产生了一定影响(图4)。处理后28 d(6月19日),6-BA处理抑制了PEPC基因的表达,但却促进了ME基因的表达,对于IDH和MDH的表达则表现为高浓度处理抑制,低浓度处理影响较小。处理后35 d,30 mg/L 6-BA处理抑制了IDH和MDH表达,对PEPC影响不显著,但却促进了ME基因的表达。处理后42 d,6-BA处理对IDH、ME和PEPC表达多表现为抑制,但对MDH基因表达则主要表现为促进。处理后49~56 d时,不同浓度的6-BA处理会对相关基因的表达产生较大差异。处理后63~70 d时,6-BA处理主要表现为促进ME基因的上调表达,但对于其他基因的表达则会有不同程度的抑制。总体分析发现,外源6-BA处理对IDH、MDH和PEPC的表达总体表现为抑制,但对于ME基因的表达则主要表现为促进作用。
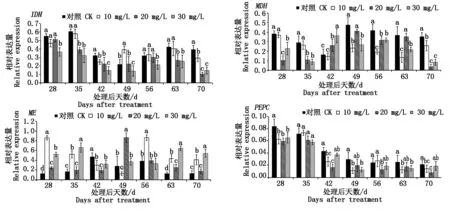
图4 6-BA处理对葡萄果实有机酸代谢相关基因表达量的影响Fig.4 Effects of 6-BA on the relative expression of organic acid metabolism related genes in grape berries
3 讨论
果实内的有机酸主要包括:苹果酸、酒石酸、柠檬酸、琥珀酸、奎宁酸、抗坏血酸及莽草酸等。不同种类果树的果实中其有机酸组分和比例存在一定差异,而恰恰是这种差异使得不同种类果实呈现出各自独特的风味[22]。已有研究表明,酒石酸、柠檬酸、苹果酸、草酸及琥珀酸等是构成葡萄果实中有机酸的主要成分[23-24],这与本研究中酒石酸和苹果酸含量较高、柠檬酸和草酸含量较低的情况较为一致。同时也说明外源6-BA处理仅仅改变了葡萄果实中有机酸组分所占比例,并未影响其组成类型。
有机酸的含量与种类不仅会直接影响葡萄果实的风味口感、营养价值,同时对于酿造出的葡萄酒品质也会产生较大影响。酒石酸作为葡萄果实中重要的有机酸之一,其不仅能够为葡萄酒提供骨架物质,同时也是葡萄酒酸味的主要来源[25-26]。本研究结果表明,3种不同浓度的6-BA处理中仅30 mg/L处理对成熟果实中的总酸和酒石酸含量产生了显著的抑制作用,而10,20 mg/L 6-BA处理则未对成熟果实中酒石酸、苹果酸、柠檬酸、草酸,以及总酸含量等产生显著影响。据此分析认为,外源6-BA处理可抑制果实有机酸的合成,但其效果与处理浓度之间存在紧密联系。
植物有机酸的合成与代谢是一个复杂的过程,需要多种酶体系的共同参与,因此,明确6-BA处理对于葡萄果实中有机酸代谢相关基因表达所产生的影响,会对其在葡萄生产中的应用带来重要帮助。L-艾杜糖脱氢酶(IDH)是葡萄酒石酸合成的限速酶,其编码基因调控着酒石酸的生物合成[27]。本研究结果表明,6-BA处理对于IDH基因的表达主要表现为抑制,尤其对于30 mg/L 6-BA处理而言,该情况与此处理果实中酒石酸含量显著低于对照的实际情况表现一致。对于MDH和PEPC基因,其编码酶主要与苹果酸的合成有关,而ME基因的表达则与苹果酸的降解密切相关。基因表达分析结果表明,6-BA处理对MDH和PEPC的表达总体表现为抑制作用,对于ME的表达主要表现为促进作用,但这与处理和对照果实中苹果酸含量不存在显著差异的情况存在一定差异。究其原因可能在于6-BA处理在影响上述基因表达的同时,对于其他与苹果酸代谢相关基因的表达也产生了影响,结果导致处理与对照果实中的苹果酸含量并未表现出显著差异。
[1] 郑丽静,聂继云,闫 震. 糖酸组分及其对水果风味的影响研究进展[J]. 果树学报,2015,32(2):304-312.
[2] Koch R,Alleweldt G. Der gaswechsel reifender weinbeeren[J]. Vitis,1978,17(1):30-44.
[3] 成 冰,张京芳,徐洪宇,等. 不同品种酿酒葡萄有机酸含量分析[J]. 食品科学,2013,34(12):223-228.
[4] Rademacher W. Plant growth regulators:backgrounds and uses in plant production[J]. J Plant Growth Regul,2015,34(4):845- 872.
[5] Milic B,Cabilovski R,Keserovic Z A,et al. Nitrogen fertilization and chemical thinning with 6-benzyladenine affect fruit set and quality of golden delicious apples[J]. Scientia Horticulturae,2012,140(6):81-86.
[6] Stover E,Fargione M,Risio R,et al. Fruit weight,cropload,and return bloom of′empire′apple following thinning with 6-benzyladenine and NAA at several phenological stages[J]. HortScience,2001,36(6):1077-1081.
[7] Curetti M,Rodriguez R,Magdalena C,et al. Effect of concentration,application volume and addition of a surfactant on response to benzyladenine as thinning agent in Williams pears[J]. Acta Horticulturae,2011,909(909):395- 402.
[8] Turk B A,Stopar M. Effect of 6-benzyladenine application time on apple thinning of cv.′Golden Delicious′and cv.′Idared[J]. Acta Agriculturae Slovenica,2010,95(1):69-73.
[9] Bound S. The influence of endothal and 6-benzyladenine on crop load and fruit quality of red′Delicious′apple[J]. Journal of Horticultural Science & Biotechnology,2001,76(6):691-699.
[10] Bound S A,Wilson S J. Ammonium thiosulphate and 6-benzyladenine improve the crop load and fruit quality of ′Delicious′apple[J]. Australian Journal of Experimental Agriculture,2007,47(5):635-644.
[11] Bound S A. Optimising crop load and fruit quality of′Packham′s Triumph′ pear with ammonium thiosulfate,ethephon and 6-benzyladenine[J]. Scientia Horticulturae,2015,192:187-196.
[12] 赵 权,高 静. NAA和6-BA对山葡萄果实着色及相关品质的影响[J]. 安徽农业科学,2011,39(30):18443-18445.
[13] 肖年湘,郁松林,王春飞. 6-BA对“全球红”葡萄果实发育过程中糖分含量和转化酶活性的影响[J]. 植物生理学通讯,2008,44(3):495-497.
[14] 郑强卿,郁松林,孟 凤,等. 6-BA+GA3对葡萄果实发育过程中糖积累及转化酶活性的影响[J]. 西北农业学报,2009,18(5):266-271.
[15] 张 平,黄卫东. 6-BA在葡萄植株体内的转运和分配[J]. 果树学报,2002,19(3):153-157.
[16] 黄卫东,张 平,李文清. 6-BA 对葡萄果实生长及碳,氮同化物运输的影响[J]. 园艺学报,2002,29(4):303-306.
[17] 于建娜,任小林,陈 柏,等. 采前6-苄基腺嘌呤处理对葡萄品质和贮藏生理特性的影响[J]. 植物生理学报,2012,48(7):714-720.
[18] 王 帅,王海波,王孝娣,等. 施硒和6-BA对葡萄叶片衰老与活性氧代谢的影响[J]. 果树学报,2015,32(2):206-214.
[19] 王海波,李林光,陈学森,等. 中早熟苹果品种果实的风味物质和风味品质[J]. 中国农业科学,2010,43(11):2300-2306.
[20] 王西成,吴伟民,赵密珍,等. NAA对葡萄果实中糖酸含量及相关基因表达的影响[J]. 园艺学报,2015,34(3):425-434.
[21] Livak K J,Schmittgen T D. Analysis of relative gene expression data using Real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods,2001,25(4):402-408.
[22] 陈发兴,刘星辉,陈立松. 果实有机酸代谢研究进展[J]. 果树学报,2005,22(5):526-531.
[23] Lamikanra O,Inyang I D,Leong S. Distribution and effect of grape maturity on organic acid content of red muscadine grapes[J]. Journal of Agricultural and Food Chemistry,1995,43(12):3026-3028.
[24] 刘 蕊,高 茜,段长青,等. 避雨栽培对酿酒葡萄有机酸的影响[J]. 热带生物学报,2013,4(3):251-256.
[25] Debolt S,Cook D R,Ford C M. L-tartaric acid synthesis from vitamin C in higher plants[J]. Proceedings of the National Academy of Sciences of the United States of America,2006,103(14):5608-5613.
[26] 陈虹颖,樊梦原,问亚琴,等. 几个酿酒葡萄品种及品系的有机酸分析[J]. 中外葡萄与葡萄酒,2012(3):12-15.
[27] Wen Y Q,Li J M,Zhang Z Z,et al. Antibody preparation,gene expression and subcellular localization of L-idonate dehydrogenase in grape berry[J]. Bioscience Biotechnology and Biochemistry,2010,74(12):2413-2417.
Effectof6-BAonOrganicAcidContentandRelatedGenesExpressioninGrapeBerry
WANG Xicheng1,QIAN Yaming1,WU Weimin1,ZHAO Mizhen1,ZHOU Beibei1,WANG Zhuangwei1,WU Jianhua2
(1.Institute of Pomology,Jiangsu Academy of Agricultural Sciences,Jiangsu Key Laboratory for Horticultural Crop Genetic Improvement,Nanjing 210014,China;2.Jiangsu Engineering and Technology Center for Modern Horticultural,Jurong 212400,China)
In order to study the effect of 6-BA on grape fruit organic acid accumulation,and the possible molecular mechanism of 6-BA regulating organic acid synthesis,a grape cultivar,Rizamat was selected to study the effect of 6-BA on fruit organic acid accumulation and related genes expression. The inflorescences and fruit clusters were treated with 6-BA at 5 days before blooming,3 and 10 days after anthesis respectively.The results showed that organic acid content of the mature grape fruit was closely related to treatment concentration of 6-BA. Tartaric acid and total organic acid content of the mature fruits that treated by 30 mg/L 6-BA was significantly lower than control. But it didn′t play important roles in the content of malic acid,citric acid and oxalic acid. For 10,20 mg/L 6-BA treatment,all kinds of organic acid didn′t show significant difference between treated and control mature fruits. Gene expression result showed that the expression ofIDH,MDHandPEPCwere mainly suppressed by 6-BA treatment,but it also promoted the expression ofME. Therefore,we speculated that the reason for inhibiting organic acid synthesis was that parts of the organic synthesis related genes expression were affected by 6-BA treatment.
Grape;6-BA;Organic acid;Gene expression
2017-06-11
江苏省自然科学基金项目(BK20160587)
王西成(1982-),男,安徽亳州人,副研究员,博士,主要从事葡萄育种及分子生物学研究。王西成、钱亚明为同等贡献作者。
赵密珍(1964-),女,江苏苏州人,研究员,硕士,主要从事草莓、葡萄育种及分子生物学研究。
S663.03
A
1000-7091(2017)05-0149-05
10.7668/hbnxb.2017.05.023
