烟草磷酸酶基因NtPP2C16的克隆、表达载体构建及表达分析
2017-11-04张雪薇鲁黎明李立芹
张雪薇,刘 仑,鲁黎明,李立芹
(四川农业大学 农学院,四川 成都 611130)
烟草磷酸酶基因NtPP2C16的克隆、表达载体构建及表达分析
张雪薇,刘 仑,鲁黎明,李立芹
(四川农业大学 农学院,四川 成都 611130)
2C型丝氨酸/苏氨酸蛋白磷酸酶(PP2C-type protein phosphatases,PP2C)是ABA信号转导途径中的关键组分,在植物生长发育、细胞周期调节及应对逆境胁迫的过程中发挥重要的作用。为探究PP2C基因在烟草适应非生物胁迫中的功能,从烟草栽培品种K326中克隆到了一个PP2C同源基因,该基因开放阅读框为1 617 bp,编码538个氨基酸残基。同源性分析结果显示,该基因所编码的蛋白与绒毛状烟草PP2C16的亲缘关系最近,故命名为NtPP2C16。生物信息学分析表明,NtPP2C16催化区域上具有PP2C家族进化中相对保守的11个结构亚区。qRT-PCR研究分析结果表明:该基因的表达显著受ABA和H2O22种信号分子诱导,并且响应干旱、高盐、低温和低钾胁迫。成功构建NtPP2C16-pBI121过表达载体,为解析NtPP2C16参与烟草非生物逆境胁迫响应提供一定的理论依据。
烟草;NtPP2C16;克隆;序列分析;表达
蛋白磷酸酶和蛋白激酶参与催化的蛋白质可逆磷酸化反应不仅是存在于生物体内的一种最为普遍的调节方式,也是植物细胞信号转导过程中的重要机制之一[1]。蛋白磷酸酶根据底物分子去磷酸化氨基酸残基的不同,主要可分为三大类:Ser/Thr型蛋白磷酸酶(Protein serine/threonine phosphatases,PSPs)、Tyr型蛋白磷酸酶(Protein tyrosine phosphatases,PTPs)和双重底物特异性蛋白磷酸酶(Dual specific protein phosphatase,DSPs ),近年研究还发现His型蛋白磷酸酶,能催化His残基的去磷酸化,PP2C蛋白是一类依赖Mg2+或Mn2+的单体Ser/Thr蛋白磷酸酶[2-3]。PP2Cs是一类多基因家族,广泛的参与逆境信号的传递过程,目前已经从模式植物拟南芥和水稻中分别鉴定到80,78个PP2C家族成员[4]。
研究发现,拟南芥中PP2C类蛋白磷酸酶参与脱落酸(Abscisic acid,ABA)、茉莉酸(Jasmonic acid,JA)、水杨酸(Salicylic acid,SA)等多种信号转导途径[5-7]。拟南芥PP2C类蛋白A亚族成员ABI1、ABI2、HAB1、HAB2、AHG1、PP2CA等,能与一种正调控因子SnRK2(SNF1-related protein kinase)蛋白激酶互作,在ABA信号通路参与的植物对逆境胁迫的适应性反应过程中起负调控作用[8-10]。拟南芥中G类PP2C蛋白AtPP2CG1能够调控拟南芥对盐胁迫的响应,且该调控依赖于ABA,AtPP2CG1是盐胁迫和ABA信号转导的正调控因子[11]。拟南芥中AtPP2CA能够与保卫细胞外向K+通道GORK相互作用,调节K+的转运和气孔关闭[12]。水稻中编码一类PP2C蛋白的基因OsPP18过表达能增强水稻对渗透和氧化胁迫的耐受性,该途径不依赖于ABA[13]。玉米ZmPP2C2基因过表达能提高转基因植株对低温的耐受性,通过激活抗氧化系统降低胞内H2O2的积累量[14]。拟南芥PP2C蛋白能与一种微管相关蛋白MASP1结合,在干旱胁迫中起负调控作用[15]。综上所述,PP2C家族基因的功能与ABA信号转导、非生物逆境胁迫以及细胞内H2O2水平密切相关。
烟草作为我国重要的经济作物之一,保障我国烟草产区的产量和质量对于我国财政收入以及烟区农业经济发展尤为重要。低钾、干旱、盐碱、冷害等非生物胁迫严重影响烟叶的产量及品质[16]。PP2C类蛋白磷酸酶在植物适应或抵制非生物胁迫的过程中发挥着重要作用,本研究从烟草K326中克隆到一个NtPP2C16基因,对NtPP2C16基因编码的蛋白进行生物信息学相关分析,运用qRT-PCR分析该基因在不同组织中的表达水平以及在信号分子和非生物逆境胁迫下的表达模式,并成功构建NtPP2C16-pBI121过表达载体。对于阐明烟草响应外界非生物胁迫的分子机制和相关信号转导途径具有重要意义,为有效利用基因工程技术改良品种提供一定的理论基础和科学依据。
1 材料和方法
1.1试验材料及主要试剂
供试植物材料为烟草栽培品种K326(Nicotianatabacumcv.K326),由四川农业大学农学院保存。将烟草种子进行表面消毒,75%乙醇1 min,20%次氯酸钠溶液20 min,无菌水反复清洗5次,随后将种子置于MS培养基上发芽生长15 d,挑取长势一致的烟草幼苗分别进行H2O2、ABA、干旱、高盐、低温及低钾处理,每个处理设有3个重复,处理相应时间(0,3,6,12,24 h)后进行整株取样。H2O2、ABA、干旱、高盐处理培养基是在MS培养基中分别加入H2O2(10 mmol/L)、ABA(1 μmol/L)、PEG6000(5%)、NaCl(200 mmol/L)。低温处理时将待处理材料放置4 ℃的光照培养箱中。低钾处理时将待处理材料转移至低钾MS培养基中,低钾MS培养基是将MS培养基中的KH2PO4替换为NH4H2PO4,并去掉KNO3。其余成分相同,经测定钾离子浓度为10 μmol/L。
E.coli感受态DH5α购自Vazyme Biotech公司,TRIzol试剂、高保真酶Pfu、pMD19-T和pBI121载体、cDNA 合成试剂盒,SYBR Green Master Mix、限制性内切酶、DNA Ligation Kit 2.0等试剂购自TaKaRa,通用型DNA纯化回收试剂盒购自TIANGEN,引物合成与测序由上海生工生物工程技术有限公司完成。
1.2试验方法
1.2.1 目的基因克隆 运用同源克隆的方法,根据GenBank数据库收录的绒毛状烟草PP2C16序列(LOC104108656),设计一对NtPP2C16引物:NtPP2C16-F:5′-TCTAGAATGGAGGAGTTGTCTCCAGC-3′,
NtPP2C16-R:5′-CCCGGGTTAACATTTGCTCTTGAATT-3′,下划线部分分别为XbaⅠ和SmaⅠ酶切位点。以烟草叶片RNA反转录的cDNA第一条链为模板,PCR扩增NtPP2C16的ORF全长,扩增反应条件为:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,34 个循环;72 ℃ 10 min。目的片段经回收纯化、补A、连接pMD19-T克隆载体、转化E.coliDH5α 后,氨苄青霉素抗性筛选,菌落PCR 鉴定阳性克隆,送至上海生工生物工程技术有限公司进行测序。
1.2.2 生物信息学分析 ProtParam(http://web.expasy.org/protparam/)预测NtPP2C16蛋白的分子量、等电点等理化性质;SOPMA(https://npsa-prabi.ibcp.fr/)和SWISS-MODEL (https://swissmodel.expasy.org/)在线预测NtPP2C16蛋白的二三级结构;SMART(http://smart.embl-heidelberg.de/)分析蛋白的保守结构域;NetPhos3.1(http://www.cbs.dtu.dk/services/NetPhos/)分析蛋白磷酸化位点;PSORT(http://psort1.hgc.jp/form.html)预测NtPP2C16的亚细胞定位;Signal-P4.1(http://www.cbs.dtu.dk/services/SignalP/)预测蛋白信号肽;BlastP比对分析,MEGA5软件以Neighbor-joining法构建系统进化树。
1.2.3 表达分析 Primer 5.0设计NtPP2C16基因qRT-PCR引物:NtPP2C16-qF:5′-GCCTCTGAACCTATT
GCC-3′,NtPP2C16-qR:5′-TGCCACGATAAAGGACTG-3′;
烟草18 SrRNA为内参,引物序列为18S-F:5′-CCTACGCTCTGTATACATTAGC-3′;18S-R:5′-GTGTTGA
GTCAAATTAAGCCGC-3′。基因的相对表达量计算方法为2-ΔΔCt法,每组样品设置3个重复。
1.2.4 构建过表达载体 重组克隆载体NtPP2C16-pMD19-T与表达载体pBI121用内切酶XbaI和SmaⅠ进行双酶切,酶切体系10 μL:10×T Buffer 1 μL,BSA 1 μL,XbaⅠ 1 μL,SmaⅠ 1 μL,NtPP2C16-pMD19-T/pBI121载体4 μL,ddH2O 2 μL。目的片段回收纯化、连接pBI121表达载体,转化E.coliDH5α,卡那霉素抗性筛选,菌落PCR检测鉴定阳性克隆,摇菌提取质粒,酶切检测并送至上海生工生物工程技术有限公司进行测序。
2 结果与分析
2.1NtPP2C16基因克隆
以烟草幼苗叶片RNA反转录的cDNA第一条链为模板,PCR扩增,1%琼脂糖凝胶电泳结果表明,PCR产物大小为1 500~2 000 bp(图1),长度大小与预期目标相符。回收纯化目的片段后,连接pMD19-T载体,转化E.coliDH5α。运用菌落PCR方法鉴定阳性克隆,挑选阳性克隆送至上海生工生物工程有限公司进行测序,测序结果显示:目的片段大小为1 617 bp。

M.Marker 2000 bp;1.NtPP2C16基因。M.Marker 2000 bp;1.NtPP2C16 gene PCR product.
2.2构建NtPP2C16-pBI121过表达载体
将重组克隆载体NtPP2C16-pMD19-T与表达载体pBI121分别进行双酶切,连接转化E.coli感受态后,挑选单菌落进行菌落PCR,筛选构建成功的阳性克隆,摇菌提取质粒,XbaⅠ和SmaⅠ双酶切进行检测(图2)。并送至上海生工生物工程有限公司进行测序,测序结果显示:目的片段大小为1 617 bp,表明NtPP2C16-pBI121过表达载体构建成功。
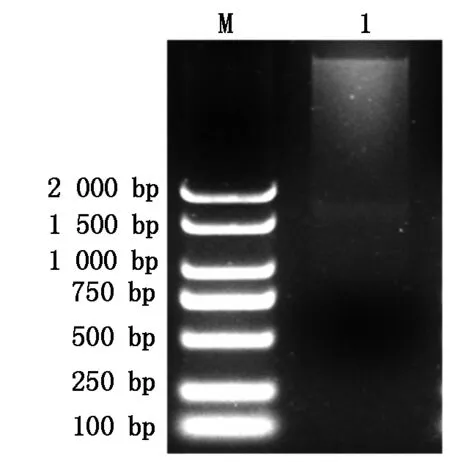
M.Marker 2000 bp;1.NtPP2C16基因酶切片段。M.Marker 2000 bp;1.NtPP2C16 gene digested fragments.
2.3NtPP2C16蛋白序列分析
2.3.1 NtPP2C16蛋白理化性质及疏水性分析 ProtParam预测NtPP2C16蛋白的理化性质分析结果表明,该蛋白编码538个氨基酸残基:丝氨酸Ser (55,10.2%)、缬氨酸Val(51,9.5%)、亮氨酸Leu(48,8.9%)、谷氨酸Glu(46,8.6%)、丙氨酸Ala(38,7.1%),而酪氨酸Tyr(7,1.3%)和色氨酸Trp(7,1.3%)含量较低。该蛋白预测的分子量为58.4 kDa,理论等电点pI为4.82,不稳定系数(Instability index)是43.17,该蛋白可能是一个不稳定的蛋白。该蛋白总的亲水性平均指数为-0.108,DNAMAN软件进行的疏水性分析结果显示,预测该蛋白属于亲水性蛋白(图3)。
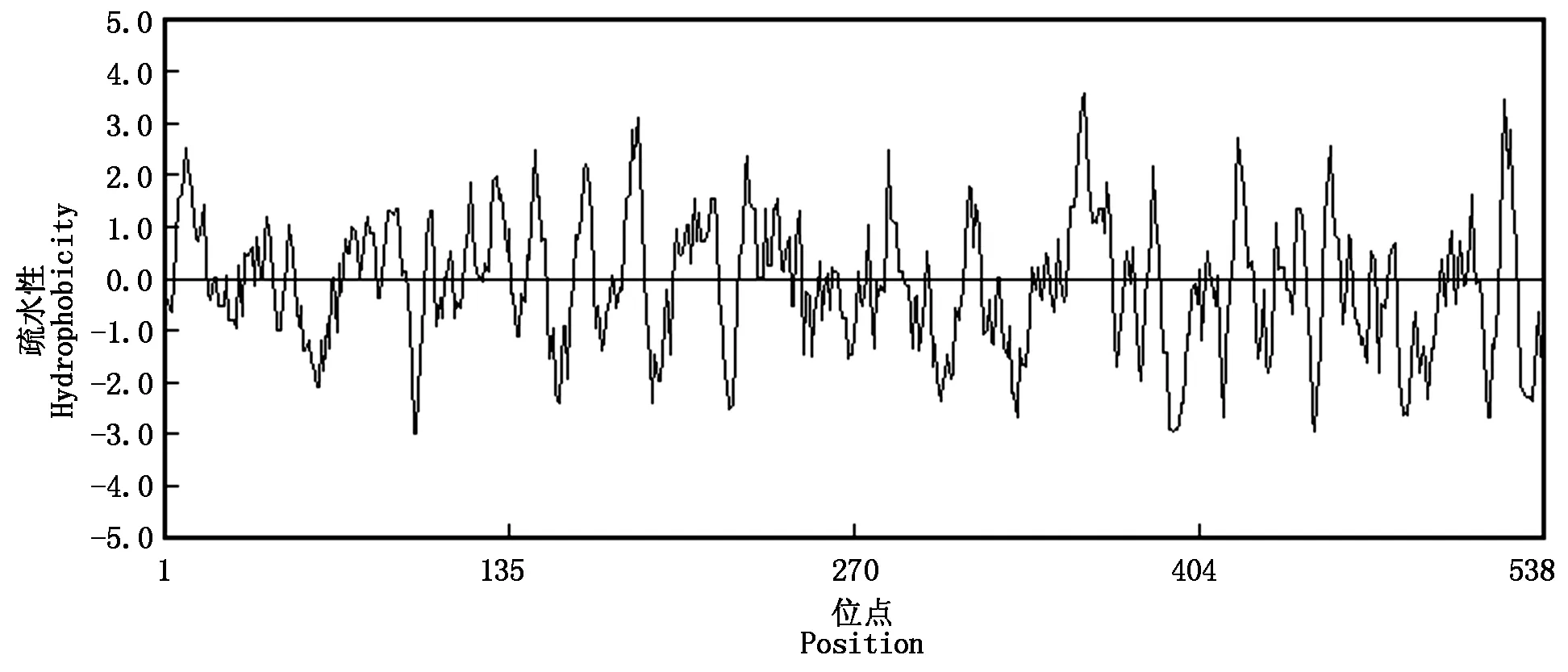
图3 NtPP2C16疏水区预测Fig.3 Hydrophobic region prediction of NtPP2C16
2.3.2 NtPP2C16蛋白二三级结构预测 IBCP在线工具SOPMA预测NtPP2C16蛋白二级结构,结果显示:该蛋白中36.99%的氨基酸参与无规则卷曲(Random coil),31.41%氨基酸参与α-螺旋(Alpha helix),22.49%的氨基酸参与延伸链(Extended strand),仅有9.11%的氨基酸参与β-转角(Beta turn),由此可见,该蛋白二级结构的最大元件为无规则卷曲。SWISS-MODEL预测NtPP2C16蛋白三级结构,与二级结构预测进行比照,结果较为统一(图4)。

A.二级结构;B.三级结构。A.Secondary structure;B.Tertiary structure.
2.3.3 NtPP2C16蛋白磷酸化位点分析 NetPhos 3.1是利用神经网络预测真核细胞蛋白质中丝氨酸(Serine) 、苏氨酸(Threonine)和酪氨酸(Tyrosine)磷酸化位点工具,NetPhos中的内设阈值为0.5,高于0.5,被认为是可能的磷酸化位点。NetPhos 3.1对NtPP2C16蛋白中磷酸化位点分析结果表明(图5),NtPP2C16中含有35个Ser激酶磷酸化位点,5个Thr激酶磷酸化位点和3个Tyr激酶磷酸化位点。说明NtPP2C16蛋白能被激酶所磷酸化,从而参与非生物逆境胁迫响应过程的调控。

图5 NtPP2C16的磷酸化位点预测Fig.5 Phosphorylation site prediction of NtPP2C16
2.3.4 NtPP2C16蛋白保守结构域及亚细胞定位分析 SMART软件分析NtPP2C16蛋白保守结构域,结果表明(图6),该蛋白含有PP2C家族典型的结构域,位于第210-528位氨基酸。对蛋白质信号肽的分析有助于蛋白质功能域的区分及蛋白质的细胞定位,利用Signal-P4.1软件预测结果表明:该蛋白不是分泌蛋白,不存在信号肽。利用PSORT在线预测NtPP2C16的亚细胞定位,结果显示,在质膜上占0.460,在内质网膜上占0.100,在内质网腔中占0.100,预测NtPP2C16可能定位在质膜上。
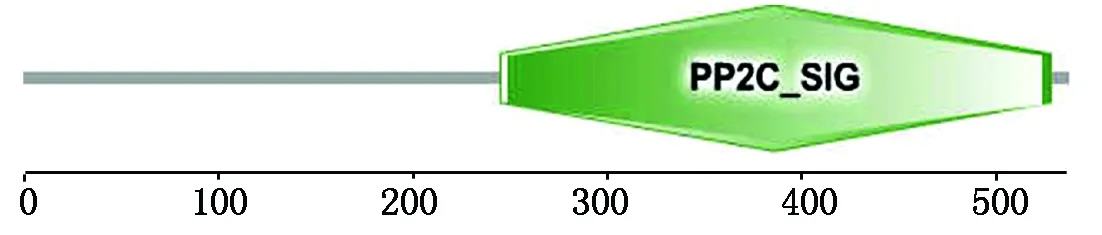
图6 NtPP2C16的结构域分析Fig.6 Structure domain analysis of NtPP2C16
2.3.5 NtPP2C16同源性分析 通过与模式植物拟南芥中PP2C蛋白ABI1、ABI2、HAB1和HAB2进行多重序列对比,发现NtPP2C16具有PP2C家族典型的结构特征,即催化区域上含有进化中相对保守的11个结构亚区[17](图7-A),NtPP2C16蛋白的C端比较保守,N端含有一段保守性较弱的延伸区域。将NtPP2C16氨基酸序列与其他植物同源性比较近的PP2C16序列进行聚类分析,结果表明,NtPP2C16与绒毛状烟草PP2C16、林烟草PP2C16、渐窄叶烟草PP2C16等具有较高的氨基酸序列同源性,分别为99%,99%,97%;与中国白梨PP2C16、苹果PP2C16的同源性最低,为61%(图7-B)。
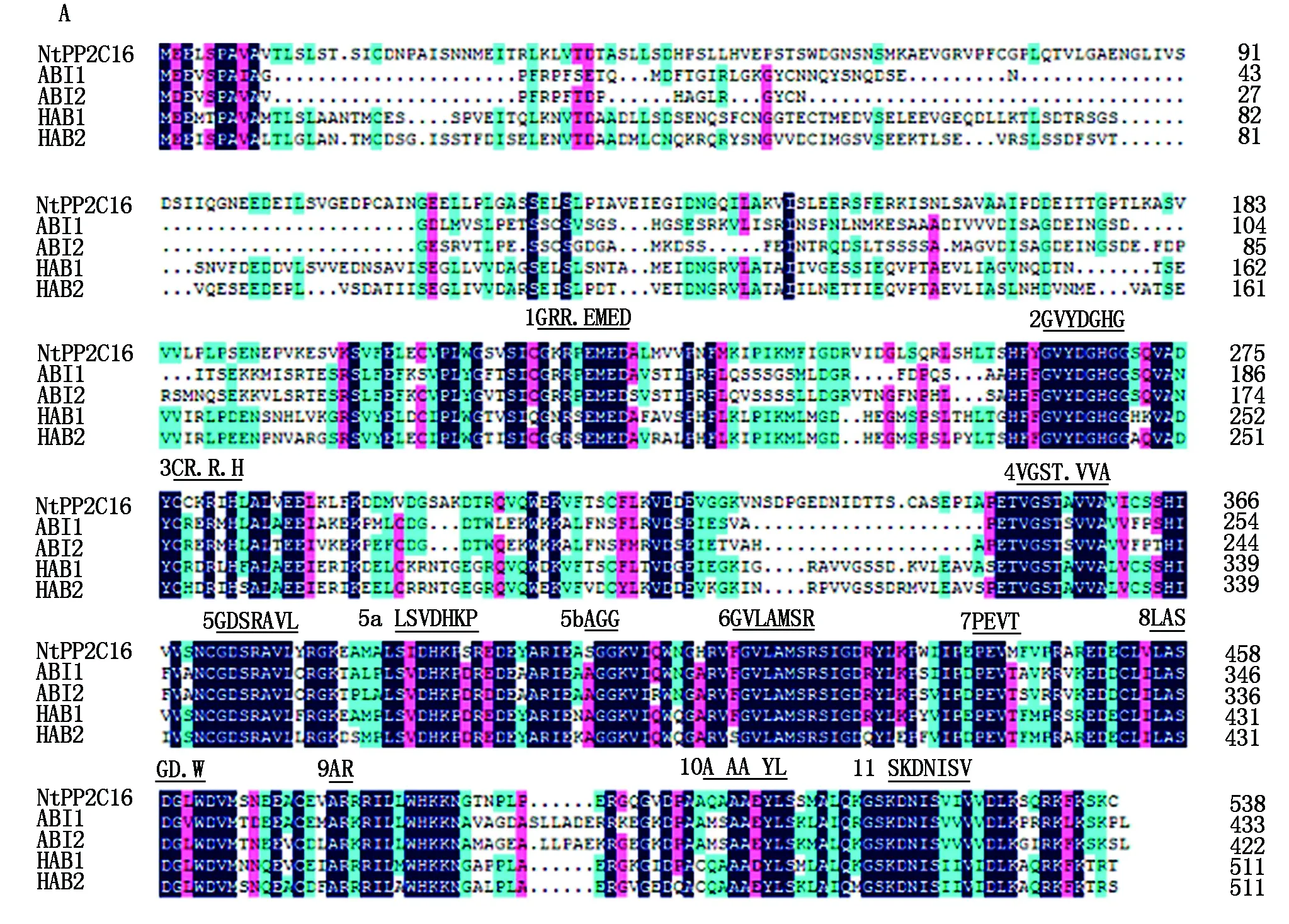
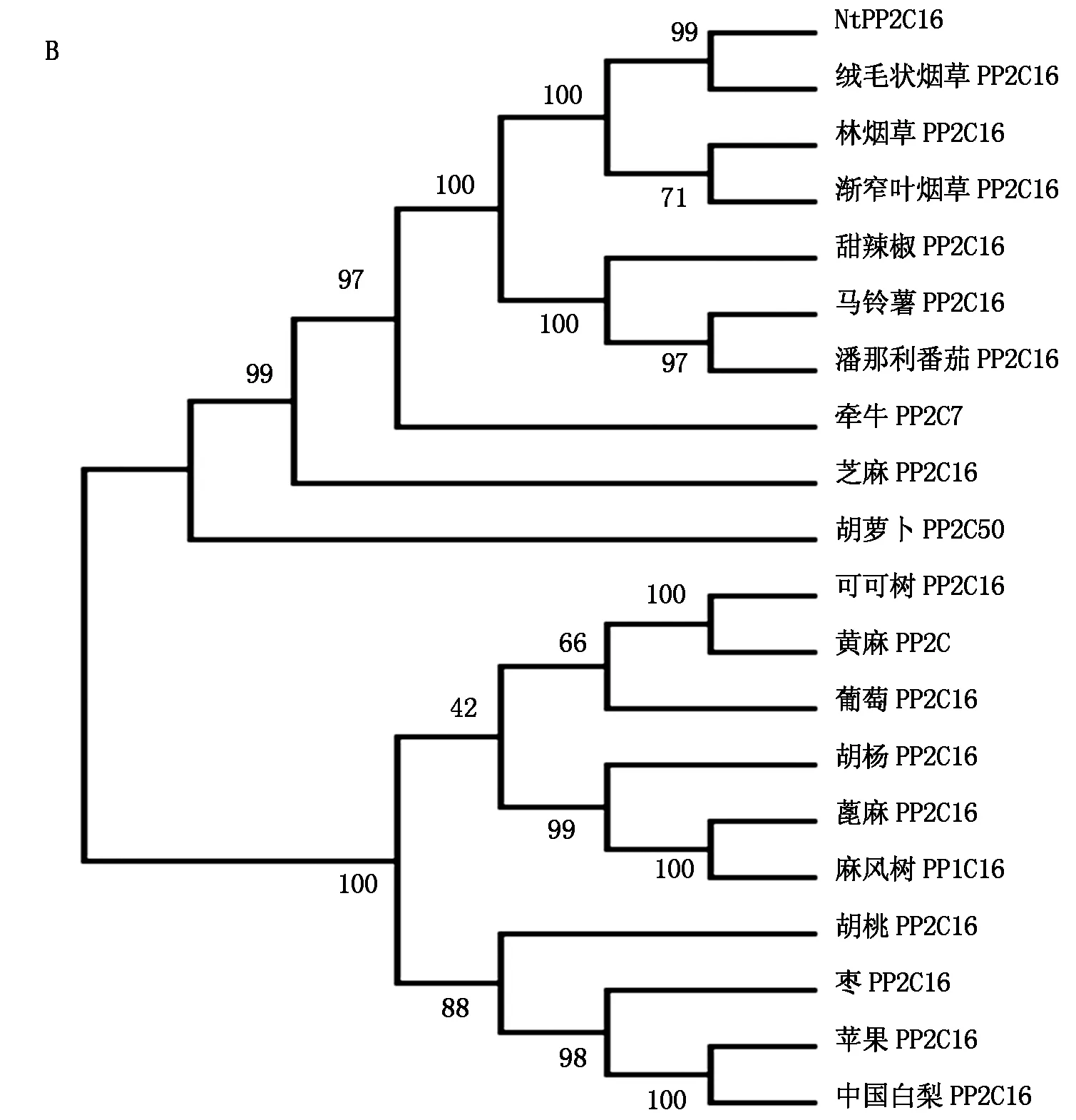
A.NtPP2C16蛋白多重序列比对;B.NtPP2C16蛋白系统进化树。A.Multiple sequence alignment of NtPP2C16;B. Phylogenetic tree of NtPP2C16.
2.4NtPP2C16的组织表达分析
提取K326幼苗期的根、茎、叶以及成熟期的花RNA,反转录成cDNA为模板,进行qRT-PCR反应,分析NtPP2C16在各个组织的表达量,分析结果表明(图8-A),NtPP2C16的表达量在叶中较高,茎中次之,根中表达量最低。说明NtPP2C16基因在烟草K326各个组织中均有表达,但主要在烟草植株的叶和茎中表达,在不同组织中的表达丰度不同表明该基因的表达存在组织特异性。
2.5NtPP2C16在信号分子处理下的表达分析
10 mmol/L H2O2及1 μmol/L ABA处理烟草K326幼苗,对NtPP2C16基因的表达进行分析。结果表明,H2O2和ABA处理的早期3 h时,NtPP2C16基因的表达量都上升到最大值,分别为对照(0 h)的3.19倍(图8-B)和2.99倍(图8-C)。这些结果表明,NtPP2C16能够响应逆境胁迫相关的信号分子调控,其表达显著受到H2O2和ABA的诱导(P<0.05)。

图8 NtPP2C16的不同组织及信号分子处理下的表达模式Fig.8 Expression pattern of NtPP2C16 in different tissues and under signal molecular treatment
2.6NtPP2C16在非生物逆境胁迫处理下的表达分析
5%PEG6000、200 mmol/L NaCl、4 ℃及10 μmol/L K+模拟干旱、高盐、低温及低钾胁迫,对NtPP2C16在逆境胁迫下的表达模式进行分析。结果表明,PEG、NaCl和低温处理后,该基因的表达量都在6 h时达到最大值,分别为对照(0 h)的2.19倍(图9-A)、8.60倍(图9-B)和4.70倍(图9-C)。低钾处理下,NtPP2C16的表达在处理早期3 h受到显著抑制(P<0.05),仅为对照(0 h)的0.24倍(图9-D)。上述结果表明,NtPP2C16基因能够参与非生物逆境胁迫,其表达响应干旱、高盐、低温以及低钾处理。

图9 NtPP2C16在非生物逆境胁迫下的表达模式Fig. 9 Expression pattern of NtPP2C16 under abiotic stress
3 讨论
本研究从普通烟草栽培品种K326中克隆到一个PP2C家族成员NtPP2C16的cDNA序列,其ORF为1 617 bp,编码538个氨基酸。SMART分析和多重序列对比发现,该基因编码的蛋白具有PP2C家族保守的功能结构域,包含11个蛋白激酶催化结构域,其中包括与二价金属离子结合的MED、DGH、DG、D残基和与磷酸盐离子结合的R残基。该蛋白的氨基酸同源区域主要位于C端的催化结构域,而N端的保守性相对较弱,含有一段延伸区域,此区域可能参与调控PP2C的活性或者在底物的特异性识别过程中起作用,包括一些转录因子特征序列和激酶互作区域等,PP2C结构的复杂性赋予它不同的功能[18]。
组织表达分析结果表明,NtPP2C16基因的表达具有组织特异性,在烟草叶和茎中的表达量较高,在根中的表达量最低,与水稻OsBIPP2C1和OsBIPP2C2的组织表达模式较为一致[19]。白菜BcABI1的表达量在花和叶片中较高,在茎中最低[20],拟南芥AtPP2C46基因的表达量在花中最高,在根中最低[21]。尽管PP2C同源基因序列较为保守,但PP2C家族中不同成员的组织表达模式存在差异,不同物种间PP2C同源基因的功能也存在差异,并发挥着特定的作用。
植物遭受外界逆境胁迫会引起体内代谢水平的变化,ABA、H2O2、乙烯等一些信号分子会显著积累,这些信号分子通过参与多种信号转导途径的交互作用,形成复杂的信号网络调控植物对逆境胁迫的应答,在植物应对生物和非生物逆境胁迫的适应性过程中发挥着至关重要的作用。qRT-PCR分析结果表明:ABA信号分子处理后,NtPP2C16的表达受到显著诱导,与欧美杨PdPP2C在ABA处理后的表达模式类似[22],而玉米ZmPP2C在ABA处理后的表达却受到显著抑制[23]。H2O2信号分子处理后,NtPP2C16在诱导的早期转录水平就达到最大值,与二穗短柄草BdPP2C1在H2O2处理后的表达模式不同,BdPP2C1的表达受到H2O2的显著抑制[24]。
非生物逆境胁迫下,NtPP2C16的转录水平均出现显著变化,该基因的表达受干旱、高盐和低温胁迫诱导,这一结果与双子叶植物拟南芥中的一些PP2C基因的表达模式相似。大多数的拟南芥A类PP2C家族基因的转录水平都能被渗透、高盐、低温等非生物胁迫和ABA诱导[25]。而与小麦、水稻、玉米等单子叶植物中的一些PP2C基因的表达模式不同,小麦TaPP2C59的表达受到低温和高盐胁迫抑制[26],水稻中5个A类PP2C基因能被低温胁迫抑制[27],玉米ZmPP2C的表达受干旱抑制[23]。因此,猜测PP2C基因家族的表达模式可能在单子叶和双子叶植物中发生了分化。NtPP2C16的表达还显著受低钾胁迫的抑制,拟南芥中AtPP2CA能与钾离子通道AKT2和AKT3互作,调控钾离子的转运和膜极化[28-29]。因此,猜测NtPP2C16参与烟草抵御干旱、高盐、低温及低钾非生物胁迫刺激的应答反应,调控着相关信号分子的转导途径。研究NtPP2C16将有助于理解烟草对逆境胁迫的应答机制。在随后的研究工作中,将利用CRISPR基因编辑技术或过量表达的方法构建转基因株系。通过分析转基因株系应对非生物胁迫的表型,并测定相关的生理指标和检测Marker 基因的表达,同时利用酵母双杂交试验验证与钾离子通道蛋白的互作,阐明NtPP2C16在非生物逆境胁迫中的功能及作用机制。
[1] Hunter T. Protein kinases and phosphatases:the yin and yang of protein phosphorylation and signaling[J]. Cell,1995,80(2):225-236.
[2] Cohen P. The structure and regulation of protein phosphatases[J]. Annual Review of Biochemistry,1989,58(1):453-508.
[3] Cohen P T. Novel protein serine/threonine phosphatases:variety is the spice of life[J]. Trends in Biochemical Sciences,1997,22(7):245-251.
[4] Xue T,Wang D,Zhang S,et al. Genome-wide and expression analysis of protein phosphatase 2C in rice andArabidopsis[J]. BMC Genomics,2008,9(1):550.
[5] Meyer K,Leube M P,Grill E. A protein phosphatase 2C involved in ABA signal transduction inArabidopsisthaliana[J]. Science,1994,264(5164):1452-1455.
[6] Schweighofer A,Kazanaviciute V,Scheikl E,et al. The PP2C-type phosphatase AP2C1,which negatively regulates MPK4 and MPK6,modulates innate immunity,jasmonic acid,and ethylene levels inArabidopsis[J]. The Plant Cell,2007,19(7):2213-2224.
[7] Nishimura N,Okamoto M,Narusaka M,et al. ABA hypersensitive germination2-1 causes the activation of both abscisic acid and salicylic acid responses inArabidopsis[J]. Plant & Cell Physiology,2009,50(12):2112-2122.
[8] Gosti F,Beaudoin N,Serizet C,et al. ABI1 protein phosphatase 2C is a negative regulator of abscisic acid signaling[J]. The Plant Cell,1999,11(10):1897-1910.
[9] Soon F F,Ng L M,Zhou X E,et al. Molecular mimicry regulates ABA signaling by SnRK2 kinases and PP2C phosphatases[J]. Science,2012,335(664):85-88.
[10] Komatsu K,Suzuki N,Kuwamura M,et al. Group a PP2Cs evolved in land plants as key regulators of intrinsic desiccation tolerance[J]. Nature Communications,2013,4(7):375-381.
[11] Liu X,Zhu Y,Zhai H,et al. AtPP2CG1,a protein phosphatase 2C,positively regulates salt tolerance ofArabidopsisin abscisic acid-dependent manner[J]. Biochemical and Biophysical Research Communications,2012,422(4):710-715.
[12] Lefoulon C,Boeglin M,Moreau B,et al. TheArabidopsisAtPP2CA protein phosphatase inhibits the GORK K+efflux channel and exerts a dominant suppressive effect on phosphomimetic-activating mutations[J]. The Journal of Biological Chemistry,2016,291(12):6521-6533.
[13] You J,Zong W,Hu H,et al. A stress-responsive NACl-regulated protein phosphatase gene rice protein phosphatase18 modulates drought and oxidative stress tolerance through abscisic acid-independent reactive oxygen species scavenging in rice[J]. Plant Physiology,2014,166(4):2100-2114.
[14] Hu X,Liu L,Xiao B,et al. Enhanced tolerance to low temperature in tobacco by over-expression of a new maize protein phosphatase 2C,ZmPP2C2[J]. Journal of Plant Physiology,2010,167(15):1307-1315.
[15] Bhaskara G B,Wen T N,Nguyen T T,et al. Protein phosphatase 2Cs and microtubule-associated stress protein 1 control microtubule stability,plant growth,and drought response[J]. The Plant Cell,2017,29(1):169-191.
[16] 司丛丛,刘好宝,曲平治. 烟草钾离子通道及转基因烟草抗逆性的研究进展[J]. 中国农学通报,2010,26(2):45-49.
[17] Bork P,Brown N P,Hegyi H,et al. The protein phosphatase 2C (PP2C) superfamily:detection of bacterial homologues[J]. Protein Science:a Publication of the Protein Society,1996,5(7):1421-1425.
[18] Shi Y. Serine/threonine phosphatases:mechanism through structure[J]. Cell,2009,139(3):468-484.
[19] 胡学博. 水稻蛋白磷酸酶2C基因OsBIPP2C1和OsBIPP2C2的克隆鉴定与功能分析[D]. 杭州:浙江大学,2004.
[20] 胡 帅. 白菜蛋白磷酸酶2C基因BcABI1的分离与表达分析[D]. 杭州:浙江大学,2012.
[21] 邓克勤,郭新红,汪启明,等. 拟南芥磷酸酶基因亚细胞定位与组织表达[J]. 西北植物学报,2009,29(2):234-239.
[22] 郭 鹏,张士刚,邢 鑫,等. 欧美杨PdPP2C基因的克隆与功能分析[J]. 北京林业大学学报,2015,37(2):100-106.
[23] 徐云峰. 玉米根系蛋白磷酸酶ZmPP2C基因的克隆,表达特性及转化的研究[D]. 泰安:山东农业大学,2005.
[24] 颜 彦,胡 伟. 二穗短柄草2C型蛋白磷酸基因BdPP2C1的克隆及表达分析[J]. 热带作物学报,2014,35(12):2391-2396.
[25] Chan Z. Expression profiling of ABA pathway transcripts indicates crosstalk between abiotic and biotic stress responses inArabidopsis[J]. Genomics,2012,100(2):110-115.
[26] 胡 伟,颜 彦,何艳臻. 小麦TaPP2C59基因的克隆及表达分析[J]. 麦类作物学报,2014,34(10):1334-1340.
[27] Singh A,Giri J,Kapoor S,et al. Protein phosphatase complement in rice:genome-wide identification and transcriptional analysis under abiotic stress conditions and reproductive development[J]. BMC Genomics,2010,11(1):435.
[28] Chérel I,Michard E,Platet N,et al. Physical and functional interaction of theArabidopsisK(+) Channel AKT2 and phosphatase AtPP2CA[J]. The Plant Cell,2002,14(5):1133-1146.
[29] Vranová E,Tähtiharju S,Sriprang R,et al. The AKT3 potassium channel protein interacts with the AtPP2CA protein phosphatase 2C[J]. Journal of Experimental Botany,2001,52(354):181-182.
Cloning,ConstructionofExpressionVectorandExpressionAnalysisofNtPP2C16inNicotianaTabacum
ZHANG Xuewei,LIU Lun,LU Liming,LI Liqin
(College of Agronomy,Sichuan Agricultural University,Chengdu 611130,China)
2C protein phosphatase (PP2C) is a key component in the ABA signal transduction pathway and plays a pivotal role in plant growth and development,cell cycle regulation and adaptation to adversity stresses.To explore the function of thePP2Cgene in tobacco adaptation to abiotic stress,aPP2Chomologous gene was cloned from the tobacco cultivar K326,which contained a 1 617 bp ORF encoding 538 amino acid. The homology analysis showed that the gene had high homology with PP2C16 ofNicotianatomentosiformis. So it was namedNtPP2C16. Bioinformatics analysis showed that the NtPP2C16 catalytic region had 11 structural sub-regions which were relatively conservative in the PP2C family evolution. qRT-PCR analysis revealed that the expression of this gene was significantly induced by ABA and H2O2signal molecules,and responded to drought,high salt,low temperature and low potassium stresses.NtPP2C16-pBI121 overexpression vector was constructed successfully,the results provided some basis for analysis ofNtPP2C16 responsing to abiotic stresses in tobacco.
Tobacco;NtPP2C16;Cloning;Sequence analysis;Expression
2017-08-11
植物生理学与生物化学国家重点实验室开放课题(SKLPPBKF1505;SKLPPBKF1506)
张雪薇(1993-),女,四川自贡人,在读硕士,主要从事烟草分子生物学研究。
李立芹(1974-),女,山东东阿人,副教授,博士,硕士生导师,主要从事植物分子生物学研究。
Q78;S572.03
A
1000-7091(2017)05-0078-08
10.7668/hbnxb.2017.05.012
