大豆低温诱导启动子GmERF9P的克隆及活性鉴定
2017-11-04任巍巍张梅娟
翟 莹,张 军,任巍巍,张 闯,赵 艳,张梅娟
(1.齐齐哈尔大学 生命科学与农林学院,黑龙江 齐齐哈尔 161006;2.黑龙江省兽医科学研究所,黑龙江 齐齐哈尔 161005)
大豆低温诱导启动子GmERF9P的克隆及活性鉴定
翟 莹1,张 军2,任巍巍1,张 闯1,赵 艳1,张梅娟1
(1.齐齐哈尔大学 生命科学与农林学院,黑龙江 齐齐哈尔 161006;2.黑龙江省兽医科学研究所,黑龙江 齐齐哈尔 161005)
为获得低温诱导基因GmERF9启动子,并分析该启动子的功能,利用PCR技术从大豆叶片基因组DNA中克隆1 885 bp的GmERF9启动子序列GmERF9P。序列分析表明,GmERF9P序列中含有多种与逆境相关的顺式作用元件。将GmERF9P构建到植物表达载体pCAMBIA1301上并转化烟草。通过PCR检测共获得6株T1阳性转基因烟草株系。对野生型烟草和转基因烟草进行低温处理2 h,通过GUS组织化学染色和实时荧光定量PCR检测GUS基因的表达量。结果显示GmERF9P在低温处理下能够提高GUS基因的表达量,具有低温诱导启动活性。
大豆;GmERF9P;启动子;低温诱导;转基因烟草
启动子是DNA分子上位于结构基因上游,具有多种顺式作用元件的一段DNA序列,能够结合RNA多聚酶从而启动结构基因的转录[1]。内源或外源基因的表达效率主要取决于启动子的活性。按照基因的表达方式,植物基因启动子可以分为组成型启动子、组织特异型启动子及诱导型启动子[2]。组成型启动子虽然能够有效地驱动外源抗逆基因过量表达,但这种无组织、无环境、无时间特异性的表达不仅会造成植物营养和能源的浪费,甚至会引起植物生理代谢紊乱,进而影响植物的正常生长发育。例如应用CaMV35S启动子改良植物抗逆性时,引起了植株的矮化畸形[3-4]。而逆境胁迫诱导启动子在正常环境下不影响植物的正常生长代谢,只在植物遭受不良环境时启动抗逆基因的超量表达,使植物表现出一定的抗逆性。因此,特定条件下的植物遗传改良才是未来植物基因工程的研究方向。
目前,国内外存在一些有关低温诱导启动子的报道。例如拟南芥rd29A启动子是目前抗寒基因工程中应用最广泛的诱导型启动子,由rd29A驱动DREB1A基因在烟草中表达可以提高转基因烟草对低温的抗性,并且不会影响植株的正常生长[5]。分别将CaMV35S组成型启动子和冷诱导rd29A启动子驱动的CBF基因在转基因烟草中表达,发现在低温环境下由rd29A驱动CBF的转基因植株比由CaMV35S驱动CBF的转基因植株表型要正常[5]。拟南芥低温诱导cor15a启动子在马铃薯中也同样具有低温诱导表达的能力,暗示不同植物的低温反应可能具有相同或相似的遗传调控机制[6-7]。这些都为植物低温诱导启动子的克隆及应用提供了理论依据。
由于ERF类转录因子在植物应对逆境环境时起重要的调控作用[8-9],ERF基因的研究也越来越受到人们的关注。但是目前大部分研究仍停留在基因的功能和调控等方面,对其抗逆分子机制研究仍然欠缺,尤其是ERF启动子的相关研究很少。2013年于晓惠等[10]克隆了巴西橡胶的HbERF3启动子,但并未做功能验证。齐齐哈尔大学植物分子育种实验室在2014年克隆大豆的GmERF5启动子序列并进行了初步的活性分析,发现其具有干旱和低温诱导启动活性,但也未在植物中进行稳定表达验证[11]。本实验室在前期研究工作中证实大豆GmERF9基因在低温(4 ℃)处理下表达量升高,且在处理2 h时表达量升高最显著[12]。本研究克隆GmERF9基因的启动子序列,与GUS基因融合构建植物表达载体并转化烟草,进而鉴定该启动子在低温诱导下的启动活性,为其在植物抗寒基因工程育种中的应用提供理论依据。
1 材料和方法
1.1试验材料
试验中所用大豆品种合丰46、烟草NC89、植物表达载体pCAMBIA1301、大肠杆菌DH5α菌株及根癌农杆菌EHA105菌株均由本实验室保存。所用引物的合成及测序工作均由上海生工公司完成。
1.2启动子克隆及序列分析
将已克隆的大豆乙烯响应因子基因GmERF9的cDNA序列于大豆基因组数据库GmGDB(http://www.plantgdb.org/GmGDB/)中进行Blast搜索,获得其上游大概2 000 bp 的启动子序列。利用引物设计软件Primer 5设计该启动子序列引物(F:5′-ACGCGTCGACCCGTGCAACTTGATATTCGT-3′,下划线代表SalⅠ酶切位点;R:5′-GGCCATGGTTTTTGG
TTGTGAAATTGAGG-3′,下划线代表NcoⅠ酶切位点)。采用植物基因组DNA提取试剂盒(购自北京鼎国生物技术公司)提取大豆叶片基因组DNA。以基因组DNA为模板,进行PCR扩增。PCR 程序:94 ℃ 8 min ;94 ℃ 40 s,56 ℃ 40 s,72 ℃ 1 min,进行30个循环;72 ℃ 延伸8 min。将上述扩增片段回收后与克隆载体pMD18-T(购自TaKaRa公司)连接并测序。利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)和PLACE(http://www.dna.affrc.go.jp/PLACE/signalup.html)数据库对启动子中的顺式作用元件进行预测分析。
1.3植物表达载体构建
用SalⅠ和NcoⅠ2种限制性内切酶(各种限制性内切酶均购自TaKaRa公司)双酶切pMD18-T-GmERF9P质粒,将酶切产物经琼脂糖凝胶DNA纯化回收试剂盒(购自北京鼎国生物技术公司)纯化后,与同样用SalⅠ和NcoⅠ双酶切的pCAMBIA1301载体(目的为切除CaMV35S启动子)连接,连接产物经热激法转化大肠杆菌DH5α。菌液扩繁后经质粒提取试剂盒(购自北京鼎国生物技术公司)提取质粒。质粒经SalⅠ和NcoⅠ双酶切验证后转化根癌农杆菌EHA105。
1.4烟草转化及筛选
利用农杆菌侵染烟草叶盘法将pCAMBIA1301-GmERF9P重组载体转化烟草NC89[13],同时转化pCAMBIA1301空载体作为阳性对照。经潮霉素(8 mg/L)筛选,获得T0抗性转化苗。提取抗性转化苗叶片DNA作为模板,提取野生型烟草叶片DNA作为阴性对照模板,以pCAMBIA1301-GmERF9P质粒作为阳性对照模板,进行PCR扩增,筛选T0阳性转基因植株。单株收获T0阳性转基因植株的种子,将其在MS培养基(含潮霉素6 mg/L)中继续筛选,获得T1转基因植株。对T1转基因植株再次进行PCR检测(方法同上),取T1阳性转基因烟草植株进行功能鉴定。
1.5GUS组织化学染色
将6周T1转基因烟草置于4 ℃培养箱中进行低温处理。剪取未处理的T1转基因烟草叶片和低温处理2 h的T1转基因烟草叶片,同时剪取未处理和低温处理2 h的野生型烟草叶片作为阴性对照,进行GUS组织化学染色:加入GUS染色液,于37 ℃温育过夜,用75%的乙醇脱色至底色完全消失[14]。
1.6实时荧光定量PCR分析
将6周T1转基因烟草置于4 ℃培养箱中低温处理2 h。剪取低温处理2 h和未处理的T1转基因烟草叶片0.1 g,同时剪取pCAMBIA1301 T1转基因烟草叶片作为阳性对照,迅速置于液氮中,-80 ℃保存备用。提取烟草叶片总RNA并反转录成cDNA第一链(试剂盒均购自北京鼎国生物技术公司)。以cDNA作为模板,选取烟草组成型表达基因α-tubulin(GenBank登录号:AB052822)作为内参基因(F:5′-ATGAGAGAGTGCATATCGAT-3′;R:5′-TTCACTGAAGAAGGTGTTGAA-3′),在BIO-RAD CFX96 Real-time PCR仪上进行实时荧光定量PCR。GUS基因扩增引物如下,F:5′-GATCGCGAAAACTGTGGAAT-3′;R:5′-TAATGAGTGACCGCATCGAA-3′[15]。反应体系参照Zhai等[12]进行,各处理均做3次重复,采用2-ΔΔCt法计算基因的相对表达量。
2 结果与分析
2.1GmERF9P克隆及序列分析
经PCR扩增得到GmERF9 基因启动子序列,命名为GmERF9P,长度1 885 bp(图1)。将GmERF9P序列在NCBI数据库中进行同源性Blast,没有得到与其具有较高同源性的启动子序列,表明GmERF9P是一个新的启动子序列。利用在线数据库PlantCARE和PLACE对GmERF9P进行序列分析,结果显示(图2),GmERF9P序列中含有4个可能赋予GmERF9基因高转录水平的5′ UTR Py-rich stretch元件,2个水
杨酸响应元件TCA-element,3个防御与胁迫响应元件TC-rich repeats,1个厌氧诱导元件ARE、10个MYB转录因子结合位点、4个MYC转录因子结合位点和4个WRKY转录因子结合位点。以上结果表明GmERF9P可能对逆境胁迫存在响应。
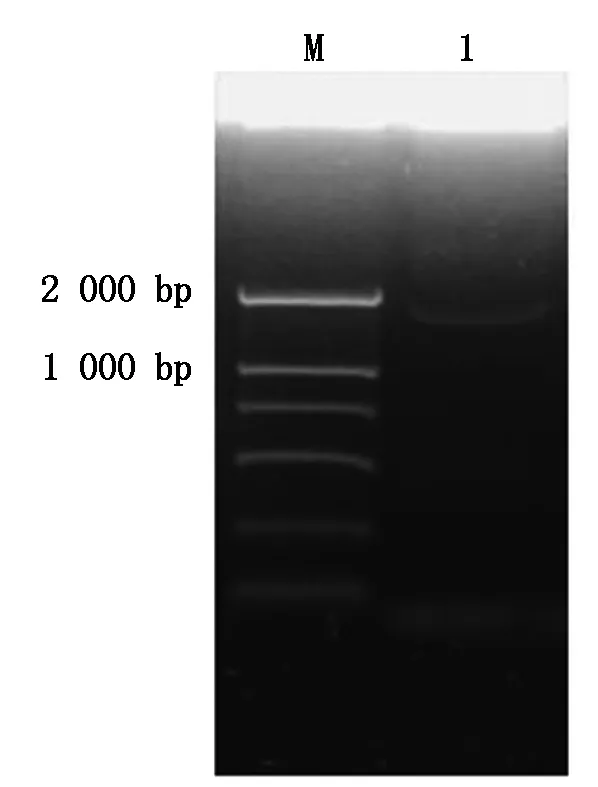
M.DL2000 Marker;1.GmERF9P PCR扩增产物。

图2 GmERF9P序列
2.2植物表达载体构建
通过SalⅠ和NcoⅠ 2个限制性内切酶位点,将GmERF9P构建到植物表达载体pCAMBIA1301上,替换pCAMBIA1301载体上GUS基因上游的CaMV35S启动子。经质粒双酶切,获得与目的基因大小相同的酶切条带(图3),表明目的基因已整合进植物表达载体。将含有目的基因的重组载体转化根癌农杆菌EHA105。
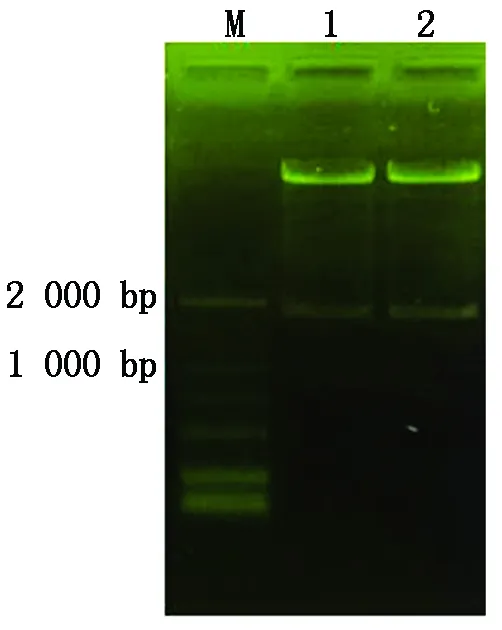
M.DL2000 Marker;1~2.GmERF9P质粒双酶切产物。M.DL2000 Marker;1-2.Products of GmERF9P plasmid double digestion.
2.3烟草遗传转化及转基因植株筛选
取无菌烟草叶片进行遗传转化,在愈伤组织中筛选抗性芽,待抗性芽生长至1 cm左右时(图4-A),将其分离并转到生根培养基中。4~5周后抗性芽长出根系并逐渐成苗(图4-B)。经PCR检测(图5),GmERF9P序列成功整合到烟草基因组中,共获得GmERF9P阳性转基因烟草6株。

图4 GmERF9P转基因烟草筛选
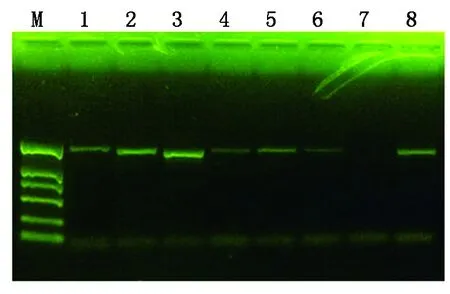
M.DL2000 Marker;1~6.GmERF9P转基因烟草;7.野生型烟草;8.pCAMBIA1301-GmERF9P阳性质粒。M.DL2000 Marker;1-6.Transgenic tobacco of GmERF9P;7. Wild typetobacco;8. Positive plasmid of pCAMBIA1301-GmERF9P.
2.4GmERF9P的低温诱导启动活性分析
前期研究表明,低温处理可使GmERF9表达量升高,且处理2 h效果最明显。所以对GmERF9P转基因烟草低温处理2 h并进行GUS组织化学染色和实时荧光定量PCR分析。首先,烟草叶片的GUS组织化学染色结果如图6所示,未处理和低温处理2 h的野生型烟草叶片没有被染成蓝色;未处理的T1转基因烟草叶片被染成蓝色,但着色较浅,表明GmERF9P具有启动子的启动活性;低温处理2 h的T1转基因烟草叶片被染成蓝色且着色较深,表明GmERF9P的启动活性在低温处理2 h时被诱导,使下游报告基因GUS的表达量增高。
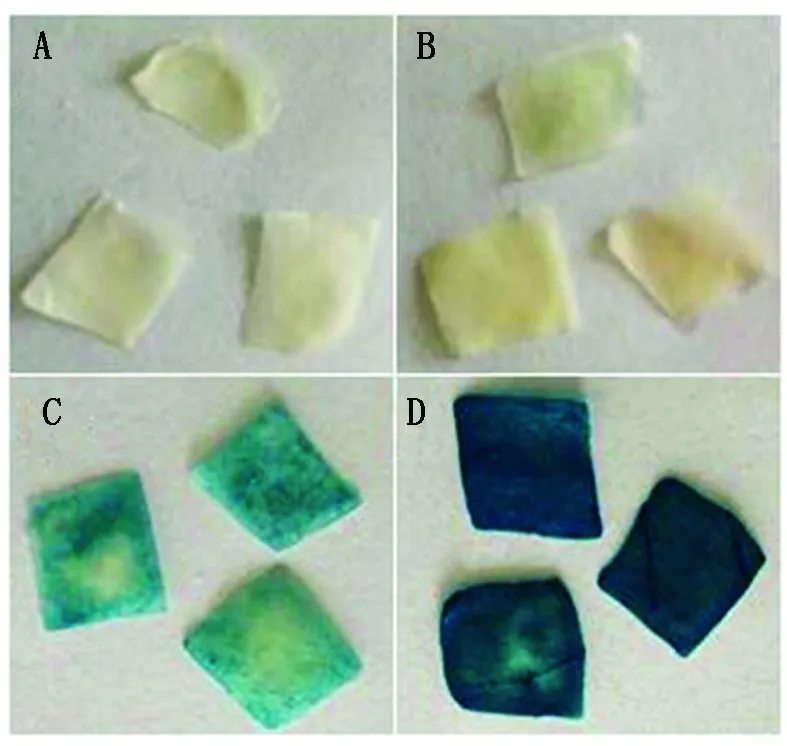
A.未处理野生型烟草叶片;B.低温处理2 h野生型烟草叶片;C.未处理T1转基因烟草片;D.低温处理2 h T1转基因烟草片。A.Leaves of untreatment wild type tobacco;B.Leaves of wild type tobacco under cold treatment for 2 h;C.Leaves of untreatment T1 transgenic tobacco;D.Leaves of T1 transgenic tobacco under cold treatment for 2 h.
另外,GUS基因实时荧光定量PCR结果如图7所示,在正常条件下GmERF9P转基因烟草中GUS基因的表达量较低,低温处理2 h时GmERF9P转基因烟草中GUS基因的表达量明显升高,再次证明GmERF9P具有低温诱导启动活性。

图7 低温处理 2 h转基因烟草中GUS基因表达量Fig.7 The expression of GUS in GmERF9P transgenic tobacco under cold treatment for 2 h
3 讨论
本研究采用生物信息学和PCR方法对大豆ERF转录因子GmERF9基因5′端调控区进行了克隆,得到了1 885 bp的GmERF9基因启动子序列。对该序列进行在线软件预测分析,结果显示,该序列含有多种胁迫相关的顺式作用元件。例如MYB元件在拟南芥抗逆相关基因rd22、rd17和rd19启动子中均存在[1,16];拟南芥中受低温诱导表达的CBF1、CBF2和CBF3基因启动子中均含有MYC元件[17];旋蒴苣苔BhGolS1基因启动子中含有4个WRKY元件与WRKY基因一起参与植物的脱水胁迫[18]。表明MYB、MYC和WRKY转录因子可能调节GmERF9基因的表达[19]。根据以上预测结果推测,GmERF9P可能与逆境胁迫诱导相关,具有逆境诱导启动活性,当然还需进一步的试验验证。此推论与大豆中GmERF9基因在高盐、干旱和低温处理下表达量升高的结果相吻合[12],这些表达量的升高可能与GmERF9P序列中存在响应逆境胁迫的顺式作用元件相关。以往研究也表明,ERF家族基因广泛参与植物的多种逆境应答。例如,玉米ZmERF1的表达可以被高盐、高温和渗透胁迫共同诱导[20]。大豆中的另一个ERF转录因子GmERF5可以被大豆疫霉菌、乙烯、脱落酸和水杨酸诱导表达,其启动子的启动活性还可以被高盐和干旱胁迫所诱导[21]。
为了明确GmERF9P的低温诱导表达特性,将该启动子与GUS基因相连,构建成植物表达载体并转化烟草。在低温处理条件下,转基因烟草中GUS基因表达量增加,证明该启动子具有低温诱导表达特性。同时也说明GmERF9P启动子序列中的顺式作用元件与转录因子相互作用,在分子水平上调节植物对低温胁迫的抗性[1,22]。但是由于植物内基因表达调控方式非常复杂,在这些预测的顺式作用元件中到底哪些发挥了作用还需进一步的验证。另外我们也对GmERF9P在干旱和高盐处理2 h下的诱导活性进行了鉴定,但与对照相比并没有显示出明显差异,说明GmERF9P对非生物胁迫的响应是多方面而且复杂的,还可能涉及启动子序列长度以及逆境处理时间等因素的影响,这方面仍需做进一步研究。本研究对了解逆境胁迫下植物ERF转录因子的分子调控机制具有重要的理论意义,同时为植物抗寒育种提供有利工具。
本研究利用PCR技术从大豆叶片基因组DNA中克隆1 885 bp的GmERF9P启动子。序列分析表明GmERF9P序列中含有多种与逆境相关的顺式作用元件。将GmERF9P构建到植物表达载体pCAMBIA1301上并转化烟草。GUS组织化学染色和实时荧光定量PCR结果显示,GmERF9P在低温处理下能够提高GUS基因的表达量,具有低温诱导启动活性。
[1] 郭晋艳,郑晓瑜,邹翠霞,等. 植物非生物胁迫诱导启动子顺式元件及转录因子研究进展[J]. 生物技术通报,2011(4):16-20.
[2] 汤 方,涂慧珍. 真核启动子研究进展[J]. 林业科技开发,2015,29(2):7-12.
[3] Dinkins R,Pflipsen C,Thompson A,et al. Expression of an single Zinc finger gene in tobacco results in dwarf plants[J]. Plant and Cell Physiology,2002,43(7):743-750.
[4] Kasuga M,Liu Q,Miura S,et al. Improving plant drought,salt,and freezing tolerance by gene transfer of a single stress-inducible transcription factor[J]. Nature Biotechnology,1999,17(3):287-291.
[5] Kasuga M,Miura S,Shinozaki K,et al. A combination of theArabidopsisDREB1Agene and stress-inducible rd29A promoter improved drought- and low-temperature stress tolerance in tobacco by gene transfer[J]. Plant & Cell Physiology,2004,45(3):346-350.
[6] 朱 青,宋波涛,柳 俊,等. 拟南芥低温诱导基因的启动子克隆及在转基因马铃薯中的表达[J]. 农业生物技术学报,2004,12(5):500-504.
[7] Thomashow M F. Plant cold acclimation:Freezing tolerance genes and regulatory mechanisms[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1999,50(50):571-599.
[8] Thirugnanasambantham K,Durairaj S,Saravanan S,et al. Role of ethylene response transcription factor (ERF) and its regulation in response to stress encountered by plants[J]. Plant Molecular Biology Reporter,2015,33(3):347-357.
[9] Jisha V,Dampanaboina L,Vadassery J,et al. Overexpression of an AP2/ERF type transcription factor OsEREBP1 confers biotic and abiotic stress tolerance in rice[J]. PLoS One,2015,10(6):e0127831.
[10] 于晓惠,朱家红,徐 靖,等. 巴西橡胶HbERF3启动子的克隆与分析[J]. 广东农业科学,2013,40(5):127-130.
[11] 翟 莹,张 军,赵 艳,等. 大豆转录因子GmERF5启动子的克隆及活性分析[J]. 生物技术通报,2014(1):100-104.
[12] Zhai Y,Shao S L,Sha W,et al. Overexpression of soybeanGmERF9 enhances the tolerance to drought and cold in the transgenic tobacco[J]. Plant Cell,Tissue and Organ Culture,2017,128(3):607-618.
[13] Hoekema A,Hirsch P R,Hooykaas P J,et al. A binary plant vector strategy based on separation of vir-and T-region of theAgrobacteriumtumefaciensTi-plasmid[J]. Nature,1983,303(5913):179-180.
[14] Zhao Y,Sha W,Wang Q Y,et al. Molecular cloning and activity analysis of a seed-specificFAD2-1Bgene promoter fromGlycinemax[J]. Cellular and Molecular Biology,2015,61(4):85-89.
[15] Acharya S,Ranjan R,Pattanaik S,et al. Efficient chimeric plant promoters derived from plant infecting viral promoter sequences[J]. Planta,2014,239(2):381-396.
[16] Iwasaki T,Yamaguchi-Shinozaki K,Shinozaki K. Identification of a cis-regulatory region of a gene inArabidopsisthalianawhose induction by dehydration is mediated by abscisic acid and requires protein synthesis[J]. Molecular & General Genetics,1995,247(4):391-398.
[17] Agarwal M,Hao Y,Kapoor A,et al. A R2R3 type MYB transcription factor is involved in the cold regulation of CBF genes and in acquired freezing tolerance[J]. The Journal of Biological Chemistry,2006,281(49):37636-37645.
[18] Wang Z,Zhu Y,Wang L,et al. A WRKY transcription factor participates in dehydration tolerance inBoeahygrometricaby binding to the W-box elements of the galactinol synthase (BhGolS1) promoter[J]. Planta,2009,230(6):1155-1166.
[19] Bouaziz D,Charfeddine M,Jbir R,et al. Identification and functional characterization of ten AP2/ERF genes in potato[J]. Plant Cell,Tissue and Organ Culture,2015,123(1):155-172.
[20] Shi Q L,Dong Y B,Qiao D H,et al. Isolation and characterization of ZmERF1 encoding ethylene responsive factor-like protein 1 in popcorn (ZeamaysL.) [J]. Plant Cell,Tissue and Organ Culture,2015,120(2):747-756.
[21] Dong L,Chen Y,Wu J,et al. Overexpression ofGmERF5,a new member of the soybean EAR motif-containing ERF transcription factor,enhances resistance toPhytophthorasojaein soybean[J]. Journal of Experimental Botany,2015,66(9):2635-2647.
[22] 吕兆勇,赵春梅,薛仁镐. 葡萄逆境胁迫诱导启动子的克隆及表达分析[J]. 华北农学报,2016,31(1):77-82.
CloningandActivityAnalysisofColdInducedGmERF9PPromoterfromSoybean
ZHAI Ying1,ZHANG Jun2,REN Weiwei1,ZHANG Chuang1,ZHAO Yan1,ZHANG Meijuan1
(1.College of Life Science and Agro-Forestry,Qiqihar University,Qiqihar 161006,China; 2.Heilongjiang Institute of Veterinary Science,Qiqihar 161005,China)
Promoters play a key role in the regulation of gene expression. The objective of this study is to isolate and characterize theGmERF9 promoter (GmERF9P) from soybean. TheGmERF9Pwas amplified with PCR from the genome DNA of soybean,which had a length of 1 885 bp. Sequence analysis indicated thatGmERF9Pcontained a number of stress-related elements. TheGmERF9Pwas cloned into plant expression vector of pCAMBIA1301 and transformed into tobacco NC89. The regenerated plants were analyzed by PCR and showed that the promoter fragments were integrated into six genomes of tobacco plants. Histochemical staining of GUS activity and Real-time fluorescent quantitative PCR of the transgenic plants showed that the expression ofGUSgene was increased under cold treatment for 2 h,which proved thatGmERF9Pwas an efficient cold-inducible promoter.
Soybean;GmERF9P;Promoter;Cold induced;Transgenic tobacco
2017-06-21
国家自然科学基金项目(31301335);黑龙江省教育厅科学技术研究项目(12541889);黑龙江省自然科学基金项目(C201458);黑龙江省普通本科高等学校青年创新人才培养计划(UNPYSCT_2016090)
翟 莹(1982-),女,吉林人,副教授,博士,主要从事大豆分子育种研究。
Q78;S565.03
A
1000-7091(2017)05-0013-06
10.7668/hbnxb.2017.05.003
