小桐子HXT基因家族的全基因组鉴定及表达分析
2017-11-04王海波
王海波,高 永,辛 胡
(1.曲靖师范学院,云南高原生物资源保护与利用研究中心,生物资源与食品工程学院,云南 曲靖 655011;2.曲靖师范学院,云南省高校云贵高原动植物多样性及生态适应性进化重点实验室,云南 曲靖 655011)
小桐子HXT基因家族的全基因组鉴定及表达分析
王海波1,2,高 永1,2,辛 胡1
(1.曲靖师范学院,云南高原生物资源保护与利用研究中心,生物资源与食品工程学院,云南 曲靖 655011;2.曲靖师范学院,云南省高校云贵高原动植物多样性及生态适应性进化重点实验室,云南 曲靖 655011)
为了进一步理解己糖转运蛋白基因家族的结构特征以及其在植物逆境信号转导过程中的作用,基于小桐子基因组数据,鉴定到15个小桐子己糖转运蛋白基因,并对其基因结构、进化关系、密码子偏性及低温表达特性进行了分析。结果表明,15个小桐子HXT基因聚类为5个亚组,包含2~5个外显子,且在基因上游调控区包含ABA、乙烯、干旱及低温等逆境响应元件。编码蛋白质都富含疏水性氨基酸,具有典型的12个α-螺旋跨膜区。另外,部分小桐子HXT基因存在交叉共线性关系及基因倍增现象,且密码子的第3位碱基偏好使用U或A。荧光定量分析显示,JcHXT_13L与JcHXT_C基因在小桐子的各器官中都有表达,其中,JcHXT_13L在茎中表达量较高,而JcHXT_C在根中表达量较高,JcHXT_13L与JcHXT_C在根与叶片中受低温诱导上调表达明显,与小桐子的抗冷性形成直接相关。为进一步探索小桐子HXT基因的生物学功能及参与小桐子抗冷分子机制奠定了理论基础。
小桐子;己糖转运蛋白;己糖信号;基因组;表达分析
大量积累己糖等可溶性糖从而降低细胞的渗透势是植物在逆境下缓解次生水分胁迫的重要途径[1]。植物体一般通过促进淀粉降解与胞内转运2种方式积累己糖,且转运方向与转运速率受到严格的调节。植物己糖转运蛋白(Hexose transporter,HXT)作为一种单糖转运蛋白(Monosaccharide transporter,MST)主要执行植物己糖等单糖的跨膜转运过程,其属于主要易化子超家族(Major facilitator superfamily,MFS),与酵母己糖转运蛋白(ScHxts、ScGal2)、哺乳动物葡萄糖转运蛋白(GLUTs)以及植物蔗糖转运蛋白(SUTs)有较高的同源性[2-4]。具有典型的MFS家族成员特征,从N端到C端存在连续12次同源性较高的跨膜结构,可能来源于具有6个跨膜区的蛋白家族在进化中的分子扩增[5],而其他区域氨基酸序列保守性较差。
己糖转运蛋白的己糖转运能力依赖膜上H+-ATPase所建立的跨膜质子动力势能,与pH值变化直接相关,且Boorer等[6]的研究表明己糖转运蛋白转运己糖时,己糖与H+是有次序分2步连续完成的,这与哺乳动物的葡萄糖转运蛋白机制不同。根据己糖与H+转运方向的差异,HXT包括H+/同向转运蛋白、H+/异向转运蛋白、己糖单向易化转运蛋白、H+/同向转运蛋白定位细胞膜、H+/异向转运蛋白定位液泡膜,都对外界pH值与跨膜质子梯度解偶联剂(羰基氰化物间氯苯腙CCCP、四苯基磷TPP+)敏感,而己糖单向易化转运蛋白定位液泡膜,对外界pH值不敏感且具有双向运输性[7]。
第一个高等植物的HXT基因来自于小球藻(Chlorellakessleri)[8]。迄今已经从拟南芥中鉴定到己糖转运蛋白家族的14个基因(AtSTP1~AtSTP14)[9],但对于其家族分类、进化特征、己糖转运的差异性及功能调节还没有进行详细研究,而对于小桐子己糖转运蛋白以及其与抗冷性的关系研究也未见报道。小桐子属大戟科(Euphorbiaceae)多年生木本油料植物,因其种子含油量高可生产生物柴油而备受关注[10],本研究基于最新GenBank小桐子基因组数据库,利用生物信息学方法共鉴定到15个小桐子HXT基因,在此基础上对该家族基因及蛋白的基因结构、系统发生关系及低温表达特性进行了分析,为进一步研究小桐子HXT基因的生物学功能提供了理论依据。
1 材料和方法
1.1试验材料及处理
选取饱满的小桐子种子(采自云南省楚雄州元谋县),按照李忠光等[11]的方法进行发芽处理,将发芽的种子播于消毒的培养土中并于恒温培养箱(温度26 ℃、相对湿度(RH)75%、光周期16 h/8 h)中生长15 d至第2片真叶展开,每天用无菌水润湿培养土。将生长15 d的小桐子幼苗置于12 ℃、相对湿度75%、16 h/8 h光周期的低温培养箱中进行低温胁迫处理,分别取低温胁迫0.5,3.0,12.0,24.0,48.0 h与对照(CK,正常培养)的小桐子第2片真叶、茎及根,液氮速冻后保存于-80 ℃冰箱中用于RNA的提取。
1.2试验方法
1.2.1 小桐子HXT基因家族的鉴定 通过模式植物拟南芥数据库(http://www.arabidopsis.org/)检索并下载拟南芥已经鉴定出的14个HXT基因的蛋白序列,以此序列为种子序列对GenBank小桐子基因组数据库(登录号:915)进行tBlastN相似性检索(阈值设置E<1e-10,序列相似性50%),得到候选的小桐子HXT蛋白序列,通过Excel工具去除重复序列,之后将非冗余的HXT蛋白序列利用Pfam与GenBank CDD在线工具进行结构域鉴定,得到鉴定的小桐子HXT家族的蛋白序列,同时下载其对应基因序列与mRNA序列。
1.2.2 小桐子HXT基因家族的序列分析 利用在线软件GSDS(Gene Structure Display Server,http://gsds.cbi.pku.edu.cn/)进行小桐子mRNA与基因序列比对以确定基因内含子与外显子的结构并绘制基因结构图。将鉴定的小桐子HXT蛋白序列与拟南芥的HXT蛋白序列利用ClustalX(Version 2.0)进行序列相似性比对,然后用MEGA 6.0软件通过邻接法(NJ)构建系统进化树,并采用自展法(Bootstrap)进行检验,同时利用GenDOC软件对比对文件进行结构域分析。另外,利用ExPaSy提供的在线工具ProtParam(http://web.expasy.org/protparam/)对得到的小桐子HXT蛋白质序列进行基本参数的分析。根据HXT的编码区序列(Coding sequence,CDS)对小桐子基因组序列进行BlastN相似性检索得到各HXT基因起始密码子ATG上游1 500 bp的调控序列,并通过PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对其顺式作用元件进行鉴定。利用软件CodonW(Version1.4.2)对小桐子HXT基因的CDS序列进行密码子偏性分析,计算简并密码子的相对使用度(Relative synonymous codon usage,RSCU)值。利用Mauve(Version 2.4)进行小桐子HXT家族基因的复制共线性分析,同时利用Circos绘制HXT家族基因在小桐子基因组(JatCur_1.0)Scaffold的位置及基因间的共线性关系。
1.2.3 小桐子HXT基因家族的表达分析 利用两步裂解法提取各组织材料的总RNA,并利用DNase Ⅰ(TianGen公司)消化RNA中的残余基因组DNA,得到纯化的总RNA。分别取3 μg总RNA,以混合逆转录引物(Random primer 0.1 μg/μL与Anchored Oligo(dT)18primer 0.5 μg/μl各占50%),利用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix(TransGen公司)合成第一链cDNA。以18SrRNA为内参(GenBank登录号:AY823528),进行小桐子HXT基因的RT-qPCR扩增(表1),20 μL反应体系,每个样品重复3次。扩增条件为:94 ℃预变性30 s;94 ℃变性10 s,53 ℃退火15 s,72 ℃延伸15 s,45个循环,之后增加溶解曲线程序:95 ℃ 10 s,65 ℃ 60 s,97 ℃ 1 s,连续检测信号。采用2-ΔΔCt法进行相对表达量分析。
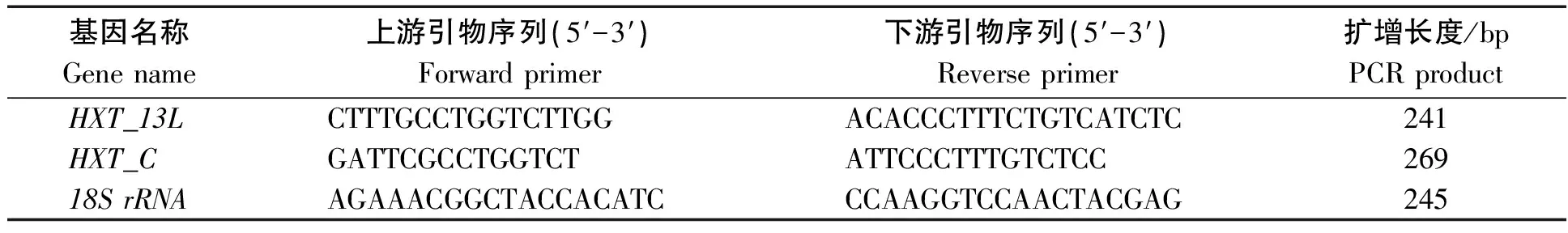
表1 小桐子HXT基因RT-qPCR表达分析引物序列Tab.1 Primers used in J.curcas HXT gene expression analysis
2 结果与分析
2.1小桐子HXT的鉴定及系统进化分析
以报道的拟南芥14个STP蛋白[9]为查询序列对GenBank小桐子蛋白质数据库进行BlastP相似性检索,共鉴定到15个小桐子HXT基因(JcHXT)(表2),基因家族进化分析(图1)与拟南芥联合进化分析(图2)显示,HXT基因家族共分支为3个亚家族及5个亚组,除JcHXT_10L单独为1个亚组外,其他4个亚组都包含3~4个成员,同时,存在少数基因串联排列及原始基因复制进化的现象,如JcHXT_CL(GenBank ID:105646066)与JcHXT_CL1(105646067)。GSDS基因结构分析表明,小桐子HXT基因家族属于小型基因,长度分布在1 800(JcHXT_CL)~3 498 bp(JcHXT_13L),具有2~5个外显子(11个基因具有4个外显子、JcHXT_6L具有2个外显子、JcHXT_13L具有5个外显子)(表2),其中有10个基因包含5′-UTR或3′-UTR区域(JcHXT_6L1与JcHXT_8仅含有3′-UTR)。另外,各亚组内基因的UTR区域有逐渐丢失的进化趋势,如亚组Ⅱ中,JcHXT_C具有5′-UTR与3′-UTR区,而组内JcHXT_CL与JcHXT_CL1的第1与第4外显子长度与JcHXT_C剔除5′-UTR与3′-UTR的长度基本相同,说明其在进化中失去了5′-UTR与3′-UTR区;亚组V中,JcHXT_13L具有5′-UTR与3′-UTR区,JcHXT_8丢失了5′-UTR 区,而JcHXT_8L却丢失了5′-UTR与3′-UTR区(图1)。

图1 小桐子HXT 基因家族的基因结构及进化关系Fig.1 Gene structure and phylogenetic relationship of HXT gene family in J.curcas
2.2小桐子HXT的理化性质及结构特征分析
小桐子15个HXT蛋白单体序列长度为501~528 aa,与拟南芥报道的STP蛋白长度范围相似[9]。除JcHXT_8(等电点为7.05)外,等电点为8.71(JcHXT_14L2)~9.60(JcHXT_5L1)(表2)。聚类及多序列比对显示,小桐子HXT蛋白都包含典型的12个α-螺旋跨膜区,α-螺旋内氨基酸残基数量为19~23个,与ProtParam分析的小桐子HXT蛋白序列富含疏水性氨基酸(Val、Leu、Ile、Ala及Gly)的结果吻合。 TMHMM分析表明,第1,2 α-螺旋、第6,7 α-螺旋之间分别存在38,65个氨基酸残基(以JcHXT_C为例)的长蛋白序列,其中,第1,2 α-螺旋之间还存在一段-MFGYDVGISGGV-保守序列。可能与HXT蛋白的转运底物特异性有关[7]。而6次跨膜N端与6次跨膜C端α-螺旋序列存在较高的同源性(图3),推测小桐子HxT基因家族可能是由编码6次跨膜蛋白基因的复制而形成的[5,12]。

表2 小桐子HXT蛋白的理化性质及基因调控元件Tab.2 Physicochemical property and gene cis-acting elements of HXT in J.curcas
注:A.脱落酸ABA应答元件;B.乙烯应答元件;C.干旱胁迫应答元件;D.低温胁迫应答元件;+.有;-.无。
Note:A. ABA responsive element (ABRE);B. Ethylene responsive element (ERE);C. Drought responsive element (MBS);D. Cold responsive element (LTR);+. Yes ;-.None.

小桐子的GenBank登录号:XP_012091482、XP_012087224、XP_012087225、XP_012067145、XP_012067863、XP_012090476、XP_012090768、XP_012071435、XP_012069672、XP_012088637、XP_012077517、XP_012069596、XP_012069594、XP_012068718、XP_012068027;拟南芥的GenBank登录号:NP_172592.1、NP_172214.5、NP_200960.2、NP_188627.1、NP_174718.1、NP_187247.1、NP_192114.1、NP_197997.1、NP_175449.1、NP_188628.1、NP_197718.1、NP_193879.4、NP_198006.1、NP_177845.1。
GenBank accession number ofJatrophacurcas(Jc):XP_012091482,XP_012087224,XP_012087225,XP_012067145,XP_012067863,XP_012090476,XP_012090768,XP_012071435,XP_012069672,XP_012088637,XP_012077517,XP_012069596,XP_012069594,XP_012068718,XP_012068027;GenBank accession number ofArabidopsisthaliana(At):NP_172592.1,NP_172214.5,NP_200960.2,NP_188627.1,NP_174718.1,NP_187247.1,NP_192114.1,NP_197997.1,NP_175449.1,NP_188628.1,NP_197718.1,NP_193879.4,NP_198006.1,NP_177845.1.
图2通过邻接法构建的小桐子与拟南芥HTX蛋白进化树
Fig.2PhylogeneticanalysisofJ.curcasHXTproteinwithArabidopsisthaliana

螺旋线表示HXT蛋白的12个α-螺旋区(α-螺旋1~α-螺旋12);三角形(▲)表示影响己糖转运蛋白活性的关键氨基酸残基Asp(位于第1与第2 α-螺旋区之间)。Helical lines indicate 12 alpha helical regions (α-helix1-α-helix12) of J.curcas HXT protein;Key Asp residue associated with HXT activity is marked by triangle (located between 1th and 2nd α-helix).
简并密码子的相对使用度(RSCU)表示同一氨基酸的不同简并密码子实际使用个数与理论使用个数的比值,RSCU=1(表示密码子不存在偏好性);RSCU1(表示密码子偏性较强),是出现频率较高的密码子;RSCU<1(表示密码子偏性较低),是基因较少使用的密码子。利用CodonW软件计算15个小桐子HXT基因62个密码子(去除编码甲硫氨酸与色氨酸的密码子)的RSCU值(表3)。结果表明,RSCU1的密码子有26个,且多以U(14个)或A(10个)结尾,说明小桐子HXT基因偏好使用以U或A结尾的密码子。另外,计算结果还显示,小桐子HXT基因终止密码子偏好使用UAA(RSCU=1.40)。统计编码小桐子HXT蛋白的氨基酸的密码子总数表明,疏水性氨基酸如Leu(823个)、Gly(743个)、Ala(657个)、Ile(649个)、Val(624个)的密码子数量较高,这与HXT蛋白包含12段α-螺旋疏水跨膜区域相一致。
将15个小桐子HXT基因在小桐子基因组Scaffold上定位,结果表明,小桐子HXT基因在基因组中分布较为分散,15个HXT基因分布于10条Scaffold上,其中Scaffold119分布有3个,Scaffold660、Scaffold906、Scaffold23各分布有2个,其余6条Scaffold各分布1个。共线性分析显示,部分HXT基因存在交叉共线性关系及复制关系,如JcHXT_C与JcHXT_8、JcHXT_6L、JcHXT_5L1,JcHXT_5L1与JcHXT_6L、JcHXT_14L2、JcHXT_8L1等(图4),表明小桐子HXT基因在进化过程中,含有这些HXT基因的Scaffold或染色体片段发生了倍增(Paleopolyploidy)[5]。

表3 利用CodonW程序分析小桐子HXT家族基因密码子偏性
注:下划线加粗数字(RSCU1)表示该密码子使用频率高;*.终止密码子。
Note:Bold numbers with underline(RSCU 1)means codon usage with high frequency;*.The stop codon of UAA,UAG,and UGA.
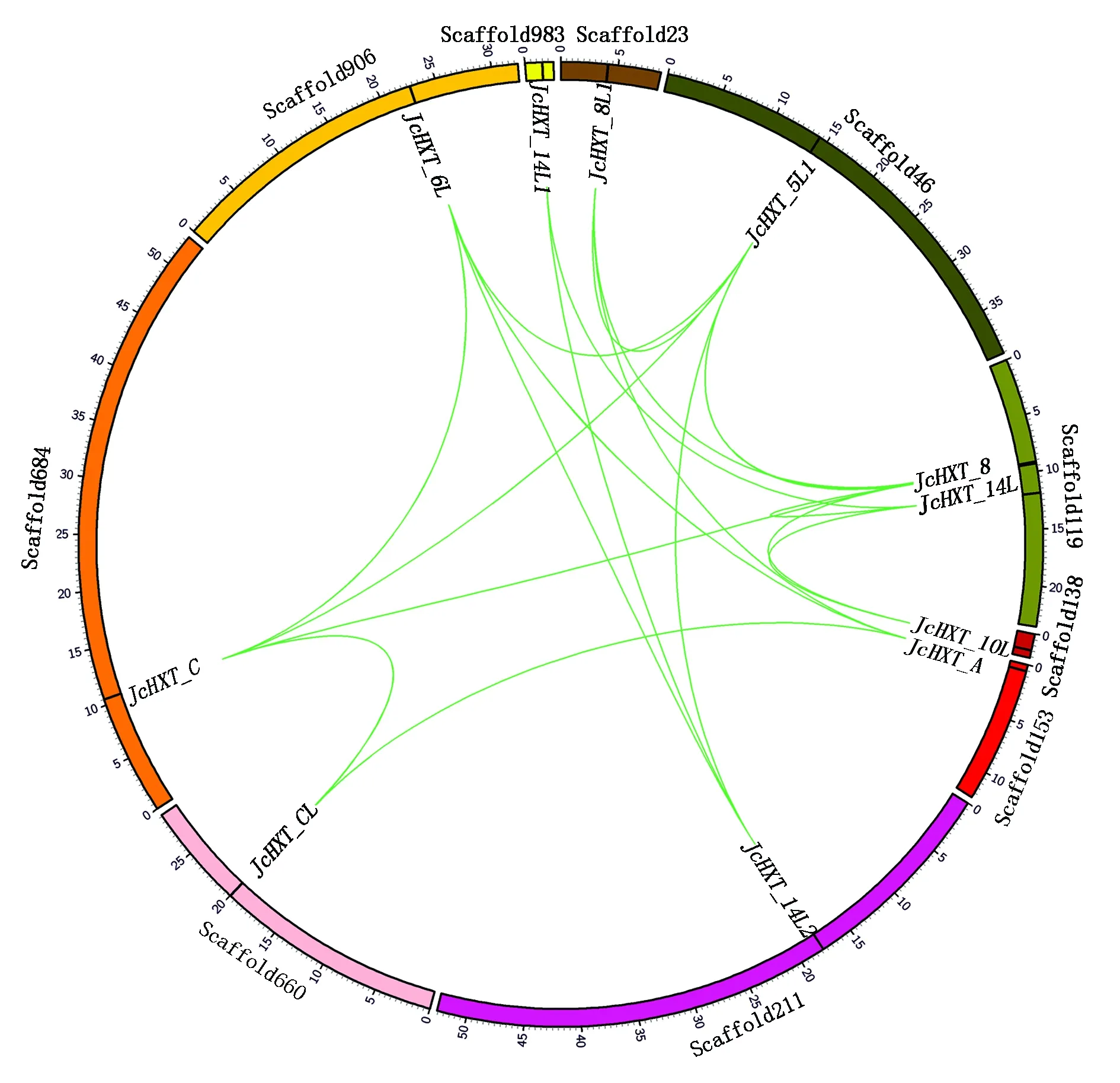
外圈表示Scaffold;内圈曲线表示基因间存在共线性。
2.3小桐子HXT基因家族的差异表达分析
PlantCARE分析表明,小桐子HXT基因的上游都包含大量调控序列,参与JcHXT基因的诱导表达。其中,有9个JcHXT基因包含干旱应答元件,7个JcHXT基因包含ABA应答元件,而JcHXT_13L与JcHXT_C基因都包含ABA应答元件,响应小桐子的低温、干旱及其他逆境胁迫过程,并参与依赖ABA的低温信号转导过程。荧光定量分析显示,JcHXT_13L与JcHXT_C在小桐子的叶片中表达量都较低,而JcHXT_13L在茎中表达量较高,JcHXT_C在根中表达量较高(图5)。另外,JcHXT_13L与JcHXT_C都属于低温诱导表达基因(图6,7),随着低温胁迫的进行,与对照相比,JcHXT_13L在茎中24 h达到最大表达量,较对照提高6.67倍,JcHXT_C在叶片中12 h达到最大表达量,较对照提高363.56倍,而在根中,JcHXT_13L与JcHXT_C在低温胁迫的初始阶段(12 h以内)上调表达都较弱,之后上调表达明显,且表现出持续上调表达的趋势。
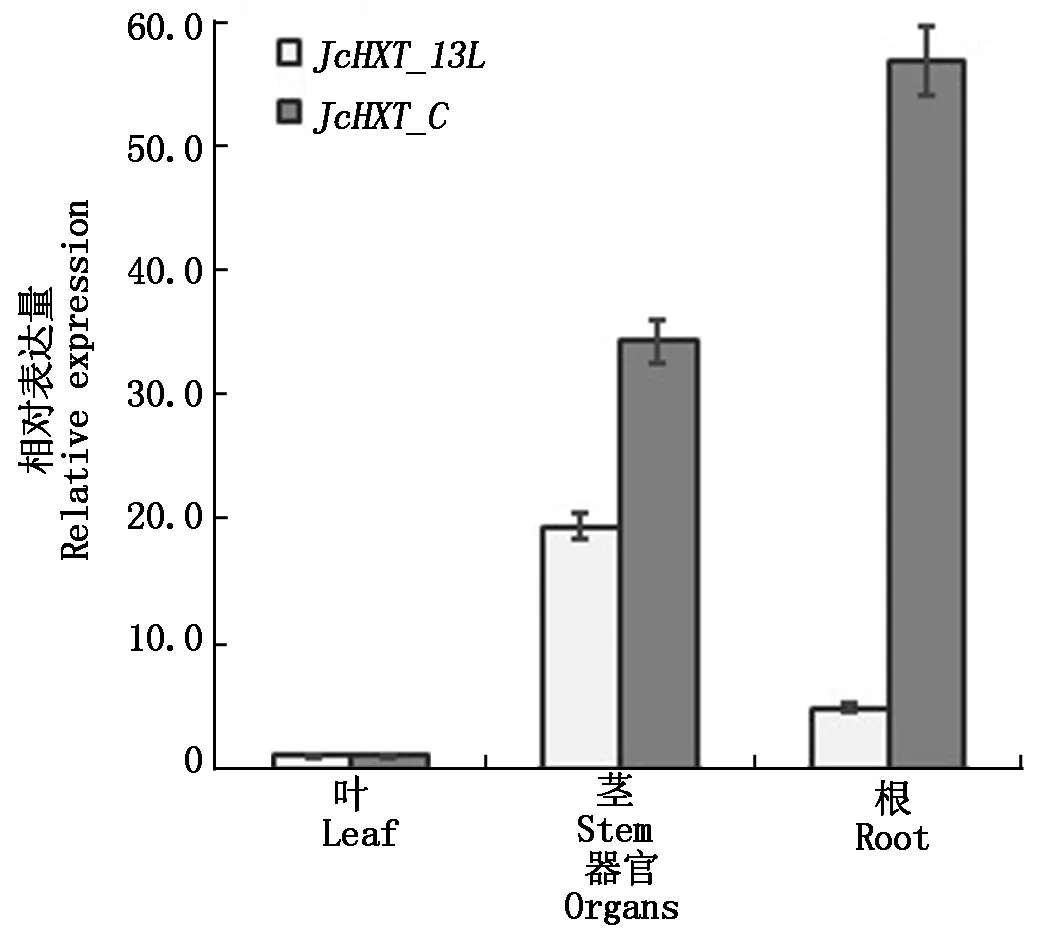
图5 小桐子不同组织中JcHXT_13L与JcHXT_C基因的差异表达分析
3 讨论
研究表明:跨膜pH值变化(ΔpH)主要通过改变己糖转运蛋白结合己糖的Km值、调节己糖转运蛋白的活性、影响己糖转运蛋白基因的表达3个方面影响己糖转运蛋白对己糖的转运效率。对于高亲和力己糖转运蛋白(Km值为0.3 mmol/L)随着pH值升高会降低对己糖的吸收,而低亲和力己糖转运蛋白(Km值为50 mmol/L)随pH值升高会促进对己糖的转运[7],如转拟南芥己糖转运蛋白基因AtSTP1的非洲爪蟾卵母细胞随外界pH值升高己糖转运蛋白对己糖的亲和力增加[6]。而pH值对己糖转运蛋白活性的影响可能与巯基/二硫键的互变相关,且连接第1,2个跨膜区的胞外环上的保守Asp具有重要的作用[12-13],本研究中在所有小桐子HXT蛋白的第1,2 α-螺旋区也发现了保守的Asp残基,且该Asp残基存在于保守序列(-MFGYDVGISGGV-)之中,推测可能参与HXT蛋白的活性调节,也与HXT蛋白的转运底物特异性相关[7]。

图6 小桐子JcHXT_13L基因在低温胁迫下的相对表达量Fig.6 Relative expression levels of J.curcas JcHXT_13L under low chilling stress

图7 小桐子JcHXT_C基因在低温胁迫下的相对表达量Fig.7 Relative expression levels of J.curcas JcHXT_C under chilling stress
此外,pH值变化可以作为信号影响己糖转运蛋白基因的表达,如拟南芥液泡单糖转运蛋白基因AtTMT1与AtTMT2,同时受到低温胁迫的诱导[14]。另外,单糖转运蛋白基因受多种逆境胁迫的调节,Bourque等[15]研究表明,烟草葡萄糖转运蛋白在逆境下吸收葡萄糖受到抑制,加快细胞程序性死亡以增强抗逆性,与Mamun等[16]研究水稻在冷害中OsMST8基因表达受到抑制从而影响雄性配子体发育的结果类似[16],同时,Norholm等[17]发现拟南芥己糖转运蛋白AtSTP13也有增加抗逆性的作用,而AtSTP3可被创伤诱导[18],细菌角斑病可促进AtSTP4与细胞壁转化酶(Cell wall invertase)的表达[19],证明质外体中蔗糖的水解和单糖的转运吸收与逆境应答有密切的关系[20]。本研究中鉴定到的15个小桐子HXT基因都包含不同的逆境响应元件,表明HXT基因广泛参与小桐子多种逆境胁迫的应答过程,而JcHXT_13L与JcHXT_C在小桐子不同器官中都受到低温胁迫的诱导表达,且基因上游存在ABA响应元件,推测其可能通过依赖ABA的低温信号转导途径进行调控。
[1] Miura K,Furumoto T. Cold signaling and cold response in plants[J]. International Journal of Molecular Sciences,2013,14(3):5312-5337.
[2] Yamada K,Osakabe Y,Mizoi J,et al. Functional analysis of anArabidopsisthalianaabiotic stress-inducible facilitated diffusion transporter for monosaccharides[J]. The Journal of Biological Chemistry,2010,285(2):1138-1146.
[3] 袁进成,刘颖慧. 植物糖转运蛋白研究进展[J]. 中国农学通报,2013,29(36):287-294.
[4] Hadley B,Maggioni A,Ashikov A,et al. Structure and function of nucleotide sugar transporters:Current progress[J]. Computational and Structural Biotechnology Journal,2014,10(16):23-32.
[5] Spetea C,Schoefs B. Solute transporters in plant thylakoid membranes[J]. Communicative & Integrative Biology,2010,3(2):122-129.
[6] Boorer K J,Loo D D,Wright E M. Steady-state and presteady-state kinetics of the H+/hexose cotransporter (STP1) fromArabidopsisthalianaexpressed inXenopusoocytes[J]. The Journal of Biological Chemistry,1994,269(32):20417-20424.
[7] Slewinski T L. Diverse functional roles of monosaccharide transporters and their homologs in vascular plants:a physiological perspective[J]. Molecular Plant,2011,4(4):641-662.
[8] Sauer N,Tanner W. The hexose carrier from Chlorella. cDNA cloning of a eucaryotic H+-cotransporter[J]. FEBS Letters,1989,259(1):43-46.
[9] Büttner M. The monosaccharide transporter(-like) gene family inArabidopsis[J]. FEBS Letters,2007,581(12):2318-2324.
[10] Navarro-Pineda F S,Baz-Rodríguez S A,Handler R. Advances on the processing ofJatrophacurcastowards a whole-crop biorefinery[J]. Renewable & Sustainable Energy Reviews,2016,54(11):247-269.
[11] 李忠光,龚 明. 不同化学消毒剂对小桐子种子萌发和幼苗生长的影响[J]. 种子,2011,30(2):4-7,12.
[12] Yan N. Structural advances for the major facilitator superfamily (MFS) transporters[J]. Trends in Biochemical Sciences,2013,38(3):151-159.
[13] Nordbo E,Luoto H H,Baykov A A. Membrane-bound pyrophosphatases acquired twice the physiological Sodium and proton co-transport function[J]. Biochimica et Biophysica acta,2016,1857(8):69-70.
[14] Felle H H. pH:signal and messenger in plant cells[J]. Plant Biology,2001,3(6):577-591.
[15] Bourque S,Lemoine R,Sequeira-Legrand A,et al. The elicitor cryptogein blocks glucose transport in tobacco cells[J]. Plant Physiology,2002,130(4):2177-2187.
[16] Mamun E A,Alfred S,Cantrill L C,et al. Effects of chilling on male gametophyte development in rice[J]. Cell Biology International,2006,30(7):583-591.
[17] Norholm M H,Nour-Eldin H H,Brodersen P,et al. Expression of theArabidopsishigh-affinity hexose transporter STP13 correlates with programmed cell death[J]. FEBS Letters,2006,580(9):2381-2387.
[18] Truernit E,Schmid J,Epple P,et al. The sink-specific and stress-regulatedArabidopsisSTP4 gene:enhanced expression of a gene encoding a monosaccharide transporter by wounding,elicitors,and pathogen challenge[J]. The Plant Cell,1996,8(12):2169-2182.
[19] Fotopoulos V,Gilbert M J,Pittman J K,et al. The monosaccharide transporter gene,AtSTP4,and the cell-wall invertase,Atβfruct1,are induced inArabidopsisduring infection with the fungal biotrophErysiphecichoracearum[J]. Plant Physiology,2003,132(2):821-829.
[20] Sturm A,Chrispeels M J. cDNA cloning of carrot extracellular beta-fructosidase and its expression in response to wounding and bacterial infection[J]. The Plant Cell,1990,2(11):1107-1119.
Genome-wideIdentificationandExpressionAnalysisofHXTGeneFamilyinJatrophacurcas
WANG Haibo1,2,GAO Yong1,2,XIN Hu1
(1.Qujing Normal University,Center for Yunnan Plateau Biological Resources Protection and Utilization,College of Biological Resource and Food Engineering,Qujing 655011,China;2.Qujing Normal University,Key Laboratory of Yunnan Province Universities of the Diversity and Ecological Adaptive Evolution for Animals and Plants on YunGui Plateau,Qujing 655011,China)
In order to further understand the structure characteristic of hexose transporter and its functions in plant stress signal transduction,15HXTgenes were identified based on complete genome data ofJatrophacurcas,then the gene structure,evolutionary relationship,codon bias,and chilling expression feature were analyzed. The results showed that 15J.curcasHXTgenes were classified to 5 subgroups,and owned 2-5 exons,cis-acting elements response to ABA,ethylene,drought and cold were found in the gene upstream. Encoding proteins with abundant hydrophobic amino acids possess typical 12 α-helix transmembrane regions. Gene location analysis revealed that someHXTgenes were observed the phenomenons of cross-collinearity and gene paleopolyploidy. Codon bias analysis showed thatHXTgenes inJ.curcaswere biased toward the synonymous codons with U or A at the third codon position. RT-qPCR analysis revealed thatJcHXT_13LandJcHXT_Cexpressed differently in different tissues,with abundant in stem and root,and remarkably cold-induced expression in root and leaf,respectively. This study laid a theoretical foundation for further dissection on biological function and chilling-resistance molecular mechanism ofHXTfamily inJ.curcas.
Jatrophacurcas;Hexose transporter;Hexose signal;Genome;Expression analysis
2017-07-08
国家自然科学基金项目(31460179)
王海波(1980-),男,山西长治人,副教授,博士,主要从事植物逆境分子生物学研究。
Q78
A
1000-7091(2017)05-0097-09
10.7668/hbnxb.2017.05.015
