内镜下黏膜切除术与内镜黏膜下剥离术治疗消化道神经内分泌肿瘤的对比研究
2017-11-03王保健顾文芬胡忠卓薛林
王保健,顾文芬,胡忠卓,薛林
(攀钢集团总医院 1.消化内科;2.病理科,四川 攀枝花 617023)
内镜下黏膜切除术与内镜黏膜下剥离术治疗消化道神经内分泌肿瘤的对比研究
王保健1,顾文芬1,胡忠卓1,薛林2
(攀钢集团总医院 1.消化内科;2.病理科,四川 攀枝花 617023)
目的探讨内镜下黏膜切除术(EMR)和内镜黏膜下剥离术(ESD)对消化道神经内分泌肿瘤患者围手术期临床指标、完全切除率及并发症的影响。方法研究对象选取该院2009年6月-2016年6月消化道神经内分泌肿瘤患者共40例,根据手术方案不同分为A组(20例)和B组(20例),分别采用EMR(A组)和ESD(B组)治疗,比较两组患者手术时间、治疗费用、病变组织直径、病变组织厚度、肿物完全切除率、垂直切缘阴性率及并发症发生率等。结果A组患者手术时间和治疗费用均明显优于B组(P<0.05);两组患者病变组织直径和厚度比较差异无统计学意义(P>0.05);B组患者肿物完全切除率明显高于A组(P<0.05);两组患者垂直切缘阴性率比较差异无统计学意义(P>0.05);B组患者并发症发生率明显高于A组(P<0.05)。结论两种内镜术式治疗消化道神经内分泌肿瘤在肿物切除效果方面较为接近,EMR具有操作时间短、经济负担轻及并发症少等优势;而ESD应用则有助于提高肿物彻底清除效果。
内镜下黏膜切除术;内镜黏膜下剥离术;神经内分泌肿瘤
神经内分泌肿瘤是临床常见胃肠道肿瘤类型之一,具有进展缓慢,早期症状隐匿及漏诊率高等特点[1]。近年来随着消化道内镜技术不断发展成熟,消化道神经内分泌肿瘤早期检出率显著提高,而针对此类疾病内镜治疗方案亦逐渐普及[2]。目前临床对于消化道神经内分泌肿瘤患者内镜治疗多采用内镜下黏膜切除术(endoscopic mucosal resection,EMR)和内镜黏膜下剥离术(endoscopic submucosal desection,ESD)两种方案,但对于何者可使患者获得更佳临床受益尚无明确定论[3]。本次研究以本院2009年6月-2016年6月消化道神经内分泌肿瘤患者共40例作为研究对象,分别采用EMR和ESD治疗,探讨两种内镜术式对消化道神经内分泌肿瘤患者围手术期临床指标、完全切除率及并发症的影响。现报道如下:
1 资料与方法
1.1 一般资料
研究对象选取2009年6月-2016年6月消化道神经内分泌肿瘤患者共40例,根据手术方案分别采用EMR(A组)和ESD(B组)治疗,每组各20例。A组患者中,男13例,女7例,年龄30~62岁,平均为(48.40±5.92)岁,其中直肠病变19例,结肠病变1例,直径>7.0 mm共4例,占总数8%。B组患者中,男14例,女6例,年龄32~63岁,平均为(48.52±5.96)岁,其中直肠病变18例,结肠病变2例,直径>7.0 mm共4例,占总数8%。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 纳入和排除标准
1.2.1 纳入标准 ①符合《中国胃肠胰神经内分泌肿瘤病理学诊断共识意见》诊断标准[4];②年龄18~65岁;③病灶均发生黏膜下层浸润,且局限于黏膜下层;④病灶直径≤2.0 cm;⑤研究方案经医院伦理委员会批准;⑥患者或家属知情同意。
1.2.2 排除标准 ①远处及淋巴结转移;②感染性肠道疾病;③家族性肠道息肉;④恶性肿瘤;⑤肝肾功能障碍;⑥凝血功能障碍;⑦精神系统疾病;⑧妊娠哺乳期女性;⑨临床资料不全。
1.3 治疗方法
入选患者术前采用智能分光比色技术(fuji telligent chromo endoscopy,FICE)对病灶进行染色定位,确定肿瘤范围和累及深度;氩离子凝固术(argon plasma coagulation,APC)标记肿瘤病灶外扩0.5 cm区域[5],在该区域黏膜下多点注射亚甲蓝2 mg+甘油果糖肾上腺素混合液,直至黏膜面明显抬起;A组患者采用EMR治疗,即负压吸引病灶组织至内镜透明帽内,释放并收紧圈套器,切除病灶组织,切除频率28 W;B组患者则采用ESD治疗,即采用Dual-knife依据标记点进行黏膜切开,并在病灶下方剥离黏膜下层,必要时给予混合液补充黏膜下注射,保证剥离层次位于黏膜下层,最终完整剥除病灶。电子内镜采用日本奥林巴斯公司生产CLV-260SL型,手术器械采用日本奥林巴斯公司生产KD-650Q型。
1.4 观察指标
①记录患者围手术期临床指标值,包括手术时间、治疗费用、病变组织直径及病变组织厚度,计算平均值;②记录患者肿物完全切除和垂直切缘阴性例数,计算百分比;其中肿物完全切除指病理活检基底及切缘未见病变残留作为判定标准[4];垂直切缘阴性指肿物基底切缘无肿瘤细胞残留[4];③记录患者并发症发生例数,包括术中出血、穿孔及迟发出血,计算百分比。
1.5 统计学方法
采用SPSS 20.0软件进行数据分析;其中计量资料以均数±标准差(±s)表示,采用t检验,计数资料以百分比(%)表示,采用χ2检验,检验水准为α=0.05。
2 结果
2.1 两组患者围手术期临床指标比较
相关临床指标中,A组患者的手术时间、治疗费用、病变组织直径及厚度分别为(8.82±1.70)min,(2 130.83±476.25) 元、(15.82±2.40)mm 和(0.28±0.04)mm;B组患者的手术时间、治疗费用、病变组织直径及厚度分别为(30.58±4.66)min,(5 708.54±968.02)元、(16.28±2.66)mm 和(0.31±0.06)mm;A组患者手术时间和治疗费用均明显优于B组(P<0.05);两组患者病变组织直径和厚度比较差异无统计学意义(P>0.05)。见表1。
表1 两组患者围手术期临床指标比较 (±s)Table 1 Comparison of clinical index in peri-operative period between the two groups (±s)
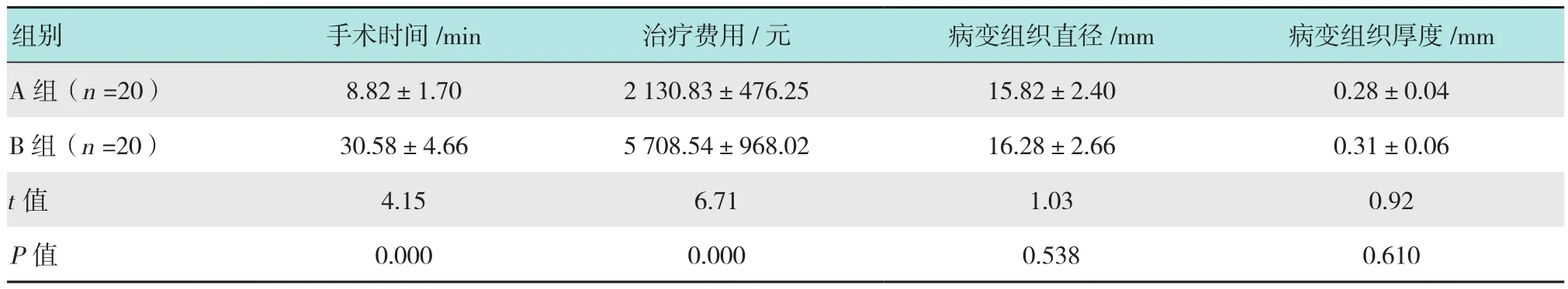
表1 两组患者围手术期临床指标比较 (±s)Table 1 Comparison of clinical index in peri-operative period between the two groups (±s)
组别 手术时间/min 治疗费用/元 病变组织直径/mm 病变组织厚度/mm A 组(n =20) 8.82±1.70 2 130.83±476.25 15.82±2.40 0.28±0.04 B组(n =20) 30.58±4.66 5 708.54±968.02 16.28±2.66 0.31±0.06 t值 4.15 6.71 1.03 0.92 P值 0.000 0.000 0.538 0.610
2.2 两组肿物完全切除率和垂直切缘阴性率比较
A组患者肿物完全切除率和垂直切缘阴性率分别为70%(14/20),95%(19/20);B组患者肿物完全切除率和垂直切缘阴性率分别为95%(19/20),90%(18/20);B组患者肿物完全切除率明显高于A组(P<0.05);两组患者垂直切缘阴性率比较差异无统计学意义(P>0.05)。见表 2。
2.3 两组患者并发症发生率比较
A组和B组患者并发症发生率分别为5%(1/20)和20%(4/20);B组患者并发症发生率明显高于A组(P<0.05)。见表 3。
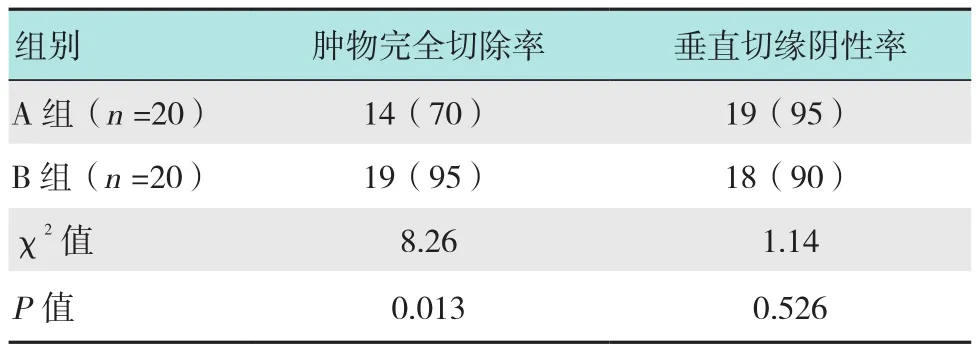
表2 两组肿物完全切除率和垂直切缘阴性率比较例(%)Table 2 Comparison of total resection rate and negative margin of vertical resection between the two groups n(%)
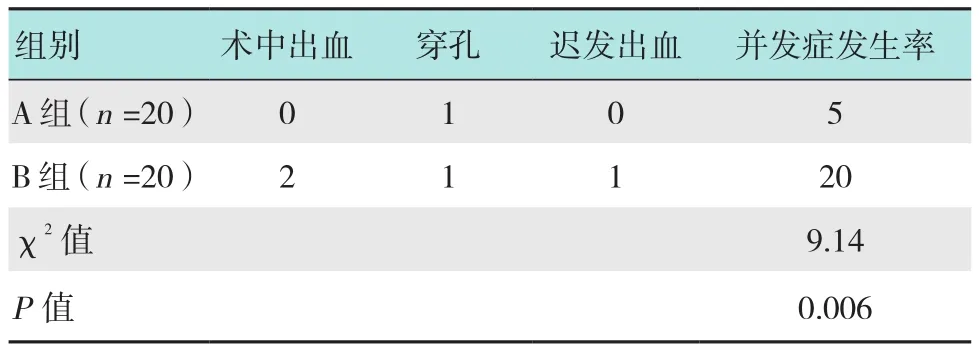
表3 两组患者并发症发生率比较 例(%)Table 3 Comparison of complication incidence between the two groups n(%)
3 讨论
人民健康体检意识提高和疾病检查技术进步使得消化道神经内分泌肿瘤检出率和检出例数均逐年增加;但国内外相关诊疗指南在该病治疗特别是消化内镜微创治疗方面尚无统一标准,而采用传统息肉切除术因肿瘤组织多合并黏膜下浸润,故总体治疗效果较差[5];部分学者报道显示,传统息肉切除术治疗后肿瘤彻底切除率仅为30%~35%;其中行息肉切除或活检钳钳除后再行内镜切除或剥除治疗,切缘阳性率仍高达40%~50%,难以满足临床治疗需要[6]。近年来消化内镜下EMR和ESD术被广泛用于直径≤2.0 cm的消化道神经内分泌肿瘤临床治疗,并取得令人满意效果[7];但对于两种治疗方法选择尚缺乏相关前瞻性研究证实。
EMR术自上世纪80年代开始被应用于消化道小肿瘤切除,其术中侵袭损伤较传统开放手术更低,术后并发症明显降低[8];ESD术在内镜直视下以专用器械将病灶与下方正常黏膜完全剥离;而病变完全切除被认为是彻底治愈疾病和避免复发关键[9]。ESD术式在完整剥离病灶方面具有优势,在提供全面病理诊断资料的同时,更有助于提高疾病彻底治愈率,降低远期复发风险[10];国外学者研究显示,ESD手术治愈性切除率约为75%~95%,而穿孔率则低于5%,且治疗费用较外科手术切除明显降低[11];
本次研究结果中,A组患者手术时间和治疗费用 分 别 为(8.82±1.70)min和(2 130.83±476.25)元;B组患者手术时间和治疗费用分别为(30.58±4.66)min和(5 708.54±968.02)元;A组患者手术时间和治疗费用均明显优于B组(P<0.05),提示EMR术应用于消化道神经内分泌肿瘤在缩短手术用时和减轻治疗费用方面具有优势,与既往报道基本一致[12];DINC等[13]认为ESD术后创面较EMR范围更大可能是导致手术时间延长主要原因,与笔者想法一致。而A组患者病变组织直径和厚度分别为(15.82±2.40)和(0.28±0.04)mm;B组患者病变组织直径和厚度分别为(16.28±2.66)和(0.31±0.06)mm;两组患者病变组织直径和厚度比较差异无统计学意义(P>0.05),则与ESD术治疗过程中对于病灶灼烧更多导致标本皱缩难以展开密切相关[14]。同时A组患者肿物完全切除率和垂直切缘阴性率分别为70%(14/20)和95%(19/20);B组患者肿物完全切除率和垂直切缘阴性率分别为95%(19/20)和90%(18/20);B组患者肿物完全切除率明显高于A组(P<0.05);两组患者肿物完全切除率比较差异无统计学意义(P>0.05),显示ESD术式治疗消化道神经内分泌肿瘤在保证肿瘤完全切除方面较EMR具有优势,与以往报道基本一致[15]。
本次研究结果中,A组和B组患者并发症发生率分别为5%(1/20)和20%(4/20);B组患者并发症发生率明显高于A组(P<0.05),则证实消化道神经内分泌肿瘤患者行EMR术治疗可有效降低相关并发症发生概率,与以往报道基本一致[16];但因入选样本量过少,随访时间短,故这一结论还有待进一步研究证实。ESD术中可见1例延迟性穿孔,经内科保守治疗及内镜下抗生素喷洒后愈合;笔者认为在手术剥除和电凝过程中,应尽量缩短对直肠固有肌层电凝时间,避免因凝结时间过长导致肠壁坏死或穿孔。
综上所述,两种内镜术式治疗消化道神经内分泌肿瘤在肿物切除效果方面较为接近,EMR具有操作时间短、经济负担轻及并发症少等优势;而ESD应用则有助于提高肿物彻底清除效果。
[1]邝胜利, 李修岭, 杨玉秀. 超声内镜辅助内镜黏膜下剥离术治疗直肠类癌38例分析[J]. 中华消化内镜杂志, 2015, 32(1): 50-52.
[1]KUANG S L, LI X L, YANG Y X. Endoscopic ultrasonography assisted endoscopic submucosal dissection for rectal carcinoid: an analysis of 38 cases[J]. Chinese Journal of Digestive Endoscopy,2015, 32(1): 50-52. Chinese
[2]KIM H H, PARK S J, LEE S H, et al. Efficacy of endoscopic submucosal resection with a ligation device for removing small rectal carcinoid tumor compared with endoscopic mucosal resection: analysis of 100 cases[J]. Dig Endosc, 2012, 24(3): 159-163.
[3]GOTO O, URAOKA T, HORII J, et al. Expanding indications for ESD: submucosal disease (SMT/ carcinoid tumors)[J]. Gastrointest Endosc Clin N Am, 2014, 24(2): 169-181.
[4]中国胃肠胰神经内分泌肿瘤病理专家组. 中国胃肠胰神经内分泌肿瘤病理学诊断共识意见[J]. 中华病理学杂志, 2011, 40(4):257-262.
[4]Chinese Expert Group on Pathology of Gastrointestinal Neuroendocrine Tumors. Chinese pathologic consensus for standard diagnosis and pancreatic neuroendocrine neoplasm[J].Chinese Journal of Pathology, 2011, 40(4): 257-262. Chinese
[5]KANG S H, LEE K, LEE H W. Delayed perforation occurring after endoscopic submucosal dissection for early gastric cancer[J]. Clin Endosc, 2015, 48(3): 251-255.
[6]ZHOU X, XIE H, XIE L, et al. Endoscopic resection therapies for rectal neuroendocrine tumors: a systematic review and metaanalysis[J]. J Gastroenterol Hepatol, 2014, 29(2): 259-268.
[7]KIM Y D, LEE J, CHO J Y, et al. efficacy and safety of 0.4 percent sodium hyaluronate for endoscopic submucosal dissection of gastric neoplasms[J]. World J Gastroenterol, 2013, 19(20): 3069-3076.
[8]MANSVELT B, DILI A, MOLLE G, et al. Transanal endoscopic microsurgery for rectal tumors using a single incision laparoscopic port[J]. Acta Chir Belg, 2013, 113(4): 245-248.
[9]BUCHNER A M, GUARNER-ARGENTE C, GINSBERG G G.Outcomes of EMR of defiant colorectal lesions directed to an endoscopy referral center[J]. Gastrointest Endosc, 2012, 76(2):255-263.
[10]GOH C, BURKE J P, MCNAMARA D A, et al. Endolaparoscopic removal of colonic polyps[J]. Colorectal Dis, 2014, 16(4): 271-275.
[11]JEON J H, CHEUNG D Y, LEE S J, et al. Endoscopic resection yields reliable outcomes for small rectal neuroendocrine tumors[J]. Dig Endosc, 2014, 26(4): 556-563.
[12]NODA H, OGASAWARA N, IZAWA S. Risk factors for bleeding evaluated using the Forrest classi fication in Japanese patients after endoscopic submucosal dissection for early gastric neoplasm[J].Eur J Gastroenterol Hepatol, 2015, 27(9): 1022-1029.
[13]DINC S, CAYDERE M, AKGUL G. Methylene Blue inhibits the in flammatory process of the acetic acid-induced colitis in the rat colonic mucosa[J]. Int Surg, 2015, 100(11-12): 1364-1374.
[14]CAPLIN M, SUNDIN A, NILLSON O, et al. ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: colorectal neuroendocrine neoplasms[J]. Neuroendocrinology, 2012, 95(2): 88-97.
[15]SALYERS W J, VEGA K J, MUNOZ J C, et al. Neuroendocrine tumors of the gastrointestinal tract case reports and literature review[J]. World J Gastroenterol Oncol, 2014, 6(8): 301-310.
[16]ZHANG X B, MA L, BAO H D, et al. Clinical pathological and prognostic characteristics of gastro entero pancreatic neuro endocrine neoplasms in China aretrospective study[J]. BMC Endocr Disord, 2014, 14: 54.
Comparison of EMR and ESD in treatment of patients with neuroendocrine tumors of digestive tract
Bao-jian Wang1, Wen-fen Gu1, Zhong-zhuo Hu1, Lin Xue2
(1.Department of Gastroenterology; 2. Department of Pathology, General Hospital of Panzhihua Iron and Steel Group, Panzhihua, Sichuan 617023, China)
ObjectiveTo investigate the in fluence of EMR and ESD of endoscopic surgery on perioperative clinical parameters, complete resection rate and complications of patients with neuroendocrine tumors of digestive tract.Methods40 patients with neuroendocrine tumors of digestive tract were chosen from June 2009 to June 2016 and randomly divided into 2 groups: A group (20 patients) with EMR and B group (20 patients) with ESD; and the operation time, the treatment cost, the lesion size, the lesion thickness, the complete resection of tumor, the negative rate of vertical margin and the complication incidence of the two groups were compared.ResultsThe operation time and the treatment cost of B group were signi ficant better than A group (P< 0.05). There was no signi ficant difference in the lesion size and the lesion thickness between the two groups (P< 0.05). The completed resection rate of B group were signi ficant higher than A group (P< 0.05). There was no signi ficant difference in the negative rate of vertical margin between the two groups (P< 0.05). The complication incidence of B group were signi ficant higher than A group (P< 0.05).ConclusionEMR and ESD of endoscopic surgery in the treatment of patients with neuroendocrine tumors of digestive tract possess the same clinical effects; EMR application can ef ficiently shorten the operation time and decrease the economic burden and ESD application maybe helpful to reduce the complication risk.
endoscopic mucosal resection (EMR); endoscopic submucosal desection (ESD); neuroendocrine tumors
R735
A
10.3969/j.issn.1007-1989.2017.09.014
1007-1989(2017)09-0075-04
2017-06-12
(彭薇 编辑)
