结直肠侧向发育型肿瘤的诊治分析(附17例报告)
2017-11-03高志强张学松宋毓飞李波董显文
高志强,张学松,宋毓飞,李波,董显文
(浙江省宁波市医疗中心李惠利医院 消化内科,浙江 宁波 315040)
结直肠侧向发育型肿瘤的诊治分析(附17例报告)
高志强,张学松,宋毓飞,李波,董显文
(浙江省宁波市医疗中心李惠利医院 消化内科,浙江 宁波 315040)
目的探讨结直肠侧向发育型肿瘤(LST)内镜下的形态特征、腺管开口形态(pit pattern)分型与病理学类型的关系,为治疗方式的选择提供依据,并探讨内镜下治疗的价值。方法回顾性分析该院2015年1月-2016年12月常规内镜检查发现的17例LST病例,首先行染色放大内镜检查,并进行pit pattern分型,对所有LST均采用内镜黏膜下剥离术(ESD)或外科手术治疗,术后病理回顾分析。结果17例病例中15例行ESD,2例行外科手术,均治疗成功,无穿孔、出血等并发症。术后3个月~2年内镜复查无复发。结论术前的pit pattern分型能为治疗方式提供依据;ESD治疗结直肠LST疗效好,复发率低,安全性较好。
侧向发育型肿瘤;内镜下黏膜剥离术;腺管开口形态
结直肠侧向发育型肿瘤(laterally spreading tumor,LST)[1-2]是指起源于大肠黏膜的一类平坦型病变,直径在10 mm以上,此类病变极少向肠壁深层垂直侵犯,而主要沿黏膜表面呈侧向浅表扩散。LST在病变形态及发生、发展上不同于一般腺瘤,与大肠癌关系密切,但与一般结直肠腺瘤相比,它具有更高的恶变潜能[3]。LST常用的治疗方法有内镜下黏膜切除术(endoscopic mucosal resection,EMR)、内镜下分片黏膜切除术(endoscopic piecemeal mucosal resection,EPMR)、 内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)及外科手术治疗等[4]。现对我院2015年1月-2016年12月常规肠镜检查发现并治疗的17例LST进行回顾性分析。现报道如下:
1 资料和方法
1.1 一般资料
选取我院2015年1月-2016年12月常规肠镜检查发现并治疗的17例LST病例。其中,男13例,女4例,年龄46~77岁,平均(63.35±9.37)岁。17例患者中多以腹痛、腹泻和便血等不适来我院就诊行肠镜检查而发现,有4例因结肠肿瘤术后定期复查肠镜而发现。
1.2 仪器和设备
内镜主机系统为:Olympus Evis Lucera CV-260SL/Olympus Evis Lucera Elite CV-290; 内 镜为 :Olympus PCF-Q260AZI、Olympus CF-HQ290I、Olympus CF-H260AI;ESD治疗器件包括:IT刀(KD-610L)、Hook 刀(KD-620LR)、Dual刀(KD-650U)、电凝止血钳(FD-410LR)、Olympus附冲水装置、NM-4L-注射针、Olympus CO2气泵、ESD治疗过程中内镜头端附加透明帽、ERBE VIO-200S高频电切装置、氩离子凝固器(argon plasma coagulation,APC)和南京微创(Micro-tech Nanjing)Accu-Clip金刚夹等。
1.3 内镜检查和治疗
1.3.1 术前准备 术前常规检查,排除手术禁忌;予复方聚乙二醇电解质散剂(舒泰清)2盒+3 000 ml水+二甲基硅油行肠道准备,术前予丁溴东莨菪碱解痉后进行内镜操作,所有病例均为单人肠镜操作。
1.3.2 内镜分型 LST病变内镜下大体分型按工藤进英教授[5]提出的分型法分为2型,即LST颗粒型(LST granular,LST-G)和LST非颗粒型(LST non-granular,LST-NG)。每一型又可分为两个亚型:LST-G型分为颗粒均一型(LST-G homogeneous,LST-GH)及结节混合型(LST-G nodularmixed,LSTGM);LST-NG型则包括平坦型(LST-NG flat,LSTNG-F)及假凹陷型(LST-NG pseudo-depressed,LSTNG-PD)。
1.3.3 pit pattern分型 内镜下对病灶予靛胭脂或结晶紫染色后,于放大肠镜下观察腺管开口形态(pit pattern),根据工藤进英提出的分型标准[5]:Ⅰ型为类圆形的pit pattern,多为正常腺管;Ⅱ型呈现星芒状较大的pit pattern,多为增生性病变;ⅢL型由管状的pit组合而成,一般提示管状腺瘤;Ⅲs型:由比正常腺管开口小的pit组合而成,病理为早期癌或腺瘤;Ⅳ型:树枝状或脑回状pit pattern,多见于绒毛状腺瘤;Ⅴi型为pit pattern不规则,多提示早期癌(浸润深度不超过黏膜下1 000μm);ⅤN型为腺管开口消失或无结构,绝大多数为黏膜下深浸润癌或进展期癌。
1.3.4 结直肠ESD操作 内镜前端置透明帽,观察病变边界,用APC标记,确定病变切除范围,用1∶10 000肾上腺素美兰注射液进行黏膜下注射,可见病灶抬举,利用Dual刀沿病变外侧0.5 cm作环形黏膜切开,再予Dual刀、IT刀或Hook刀等进行黏膜下剥离,直至剥离整个病变。剥离过程中予电凝或电凝止血钳止血。术后创面用氩气刀、电凝止血钳或钛夹处理。病变标本用大头针展开固定置于福尔马林液中送检。对送检标本采用连续切片的全瘤组织病理学分析,病理医师在观察切片时应观察肿瘤基底和周围切缘是否有肿瘤累及、是否有淋巴管和血管浸润等,根据病理结果判断是否需追加外科手术。
1.4 术后的处理和方法
术后常规禁食24~72 h,常规预防性应用抗生素、止血、补液及对症支持治疗,观察腹痛、血便等情况;一般术后5~7 d出院。术后3、6、12和24个月复查肠镜。
2 结果
17例患者共发现18处病灶(其中1例患者有2处病灶),病变直径12~60 mm,平均直径(23.22±14.08)mm;病变部位分布:直肠7处、乙状结肠2处、横结肠4处、升结肠3处、盲肠2处,全结肠均可分布,以直肠为最多。LST病变内镜下大体分型:LST-G共7处(其中LST-G-H 3处,LSTG-M 4处);LST-NG共11处(其中LST-NG-F 6处,LST-NG-PD 5处)。pit pattern分型:Ⅱ型2处;ⅢL型10处;ⅢL+Ⅳ型4处;Ⅳ型1处;ⅤN型1处。17例病例中1例因直肠病变部分与肛管相连行外科手术,另1例因pit pattern为ⅤN型,提示深浸润,无内镜下治疗指征,转外科行手术治疗。其余15例(16处病灶)均行ESD术,手术过程顺利,术后2例患者出现发热不适,但仅持续1天。余均无发热、出血和穿孔等并发症。术后病理:增生性息肉2处;管状腺瘤10处;绒毛状管状腺瘤5处;中分化腺癌1处。15例ESD治疗患者均未追加手术。术后定期肠镜复查,未见复发或残留。术后3个月~2年内镜复查无复发。病变的术前内镜检查、ESD治疗及术后病理情况见图1和2。
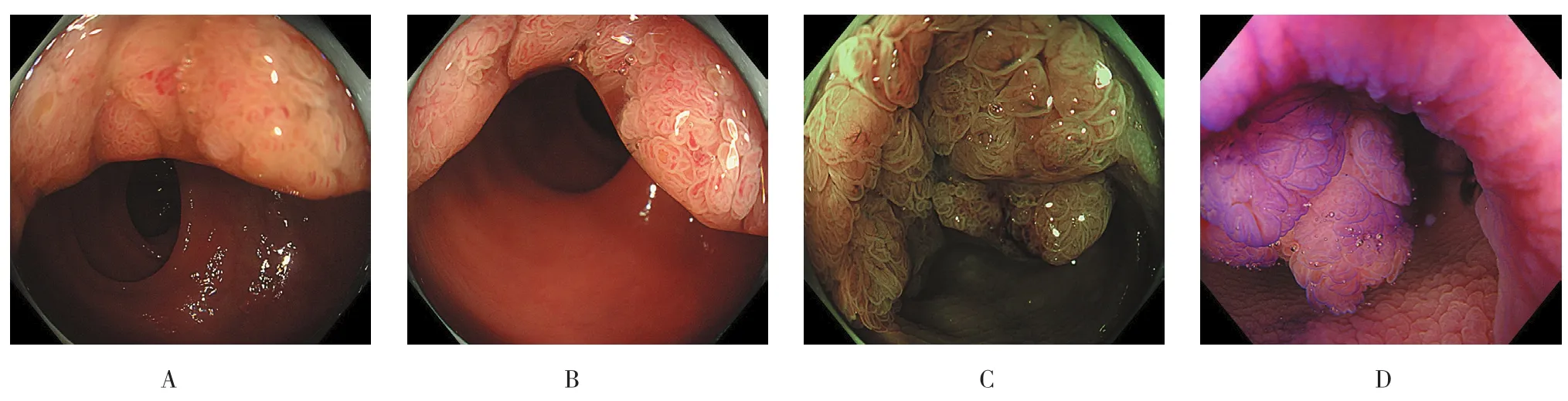
图1 直肠LST的术前内镜检查Fig.1 Preoperative endoscopic examination of rectal LST
3 讨论
LST的定义最先由日本学者工藤进英[5]提出,因其为起源于大肠黏膜的一类平坦型病变,主要沿黏膜表面呈侧向浅表扩散,故称为LST。由于其形态学特征是侧向生长,与通常所见的大肠隆起型肿瘤完全不同,临床常规内镜检查容易漏诊。与一般的息肉状腺瘤相比,LST有更高的恶变可能[3],因而发现LST并对其早期治疗有助于预防结肠癌的发生。本研究中17例LST病例中,有4例是因结肠癌术后内镜复查中发现。
关于LST的治疗[4],一般认为<2.0 cm病变可用EMR治疗,但易导致肿瘤切除不完全;>2.0 cm需要采用EPMR,但其破坏病灶整体性,影响术后的病理诊断评判,而且残留复发率较一次性切除高。ESD虽然操作较为复杂,具有较高的技术要求,且有一定的并发症发生率,但其对于较大的病灶也可一次性完整剥离,而且通过整块切除可获得完整的病理学资料[6]。有研究表明ESD的完整性切除率和治愈性切除率均明显高于EMR[7]。ESD治疗后的复发率远低于EPMR[8-9]。但对于病变浸润较深(黏膜下浸润深度≥1 000μm)者可考虑外科手术治疗。
ESD术前准确判断肿瘤浸润深度、范围及有无淋巴结侵犯是选择合理的治疗方式的关键,尤其是浸润深度的判断。对深度的判断则主要依靠病变大体形态、放大染色内镜观察病变pit pattern分型和NBI分型等[4]。日本工藤进英教授所提出的pit pattern分型与病理诊断的高度相关已得到公认[10]。内镜超声术也可以判断肿瘤是否突破黏膜肌层而浸润黏膜下层或固有肌层,但其特异性只有14.3%[11]。
本报道对17例病例共18处病灶术前放大染色内镜观察pit pattern分型以ⅢL型与Ⅳ型为主,前者以管状腺瘤及绒毛管状腺瘤为主,后者病理以绒毛管状腺瘤及绒毛状腺瘤为主,2例pit pattern分型为Ⅱ型者,术后病理证实为增生性病变。而1例pit pattern分型为ⅤN者,未行ESD直接外科手术治疗,术后病理证实为中分化腺癌,且浸润至黏膜下层。提示pit pattern分型和病理有高度相关性。
ESD手术的主要并发症为出血和穿孔。术中一旦发生较大量出血,应对创面进行冲洗(此时附送水装置是方便有效的),明确出血点后应用电凝止血钳钳夹出血点电凝止血,必要时也可以采用止血夹夹闭出血点。在整个ESD过程中要时刻注意采取预防性止血措施,对显露的血管随时应用切开刀或电凝止血钳进行电凝处理,预防大出血的发生。术后迟发性出血多发生在术后2周以内,其发生率为3.0%~4.0%[12],术中创面处理可以减少出血发生[4],持续性出血时建议再次进镜观察及内镜下止血。文献报道ESD治疗LST的穿孔发生率约达1.4%~10.4%[13-14]。术中穿孔多是由于操作视野不清,或切开刀的长度及角度控制不好所致,主要表现为出现气腹,并见肠壁外脂肪等。一旦发生穿孔应尽可能用金属夹将穿孔完整封闭,并加强术后保守治疗一般均能成功。相对于普通空气泵,CO2气泵可减轻患者治疗后的腹胀症状,尤其是发生穿孔时,使用CO2气泵更为安全。本研究中15例患者行ESD治疗,除2例发生术后发热外,均未出现出血、穿孔等严重并发症,提示ESD治疗LST是安全的。而术后的病理及肠镜随访也表明ESD是治疗LST的有效方式。
pit pattern分型与病理诊断的高度相关性,能为进一步的治疗方式的选择提供依据。与EMR相比,ESD存在着一些不足[15],如操作难度大、耗时长和相对较高的穿孔率,但是常规EMR局部复发率为0.8%~7.2%,特别是病变较大(>1.0 cm)时行EMR或EPMR时复发率更高,有研究报道EPMR复发率高达20.0%,而ESD的局部切除复发率仅为0.0%~2.0%[16]。因而国内有学者认为ESD是治疗直径大于2.0 cm的LST的最佳方法[17]。ESD治疗与腹腔镜辅助外科手术疗效相当,而并发症发生风险更小[18]。
综上所述,ESD治疗结直肠LST是安全有效的。
[1]KUDO S E, LAMBERT R, ALLEN J I, et al. Nonpolypoid neoplastic lesions of the colorectal mucosa[J]. Gastrointest Endosc,2008, 68(4 Suppl): S3-S47.
[2]FACCIORUSSO A, ANTONINO M, DI MASO M, et al. Nonpolypoid colorectal neoplasms: classi fication, therapy and followup[J]. World J Gastroenterol, 2015, 21(17): 5149-5157.
[3]汪旭, 谢莹, 周环, 等. 68例大肠侧向发育性肿瘤内镜下腺管开口类型与病理的对比研究[J]. 现代肿瘤医学, 2010, 18(5):935-937.
[3]WANG X, XIE Y, ZHOU H, et al. The comparative study of endoscopic pit patterns and pathology of 68 cases of colorectal laterally spreading tumor (LST)[J]. Journal of Modern Oncology,2010, 18(5): 935-937. Chinese
[4]中华医学会消化内镜学分会. 中国早期结直肠癌筛查及内镜诊治指南(2014, 北京)[J]. 中华医学杂志, 2015, 95(28): 2235-2252.
[4]Chinese Society of Digestive Endoscopy. Guidelines for early screening and endoscopic diagnosis and treatment of colorectal cancer in China[J]. National Medical Journal of China, 2015,95(28): 2235-2252. Chinese
[5]KUDO S, RUBIO C A, TEIXERIA C R, et al. Pit pattern in colorectal neoplasia: endoscopic magnifying view[J]. Endoscopy,2001, 33(4): 367-373.
[6]SHIMURA T, SASAKI M, KATAOKA H, et al. Advantages of endoscopic submucosal dissection over conventional endoscopic mucosal resection[J]. J Gastroenterol Hepatol, 2007, 22(6): 821-826.
[7]LEE E J, LEE J B, LEE S H, et al. Endoscopic submucosal dissection for colorectal tumors--1,000 colorectal ESD cases: one specialized institute’s experiences[J]. Surg Endosc, 2013, 27(1):31-39.
[8]YOKOI C, GOTODA T, HAMANAKA H, et al. Endoscopic submucosal dissection allows curative resection of locally recurrent early gastric cancer after prior endoscopic mucosal resection[J].Gastrointest Endosc, 2006, 64(2): 212-218.
[9]SAITO Y, FUKUZAWA M, MATSUDA T, et al. Clinical outcome of endoscopic suhmucosal dissection versus endoscopic mueosal resection of large colorectal tumors as determined by curative resection[J]. Surg Endosc, 2010, 24(2): 343-352.
[10]KUDO S, TAMURA S, NAKJIMA T, et al. Diagnosis of colorectal tumorous lesions by magnifying endoscopy[J]. Gastrointest Endosc, 1996, 44(1): 8-14.
[11]TANABE R, HIGAKI S, GONDO T, et al. Preoperative evaluation of early colorectal cancer using an ultrasound mini probe[J].Hepatogastroenterology, 2012, 59(118): 1794-1799.
[12]钟芸诗, 姚礼庆, 周平红, 等. 内镜黏膜下剥离术治疗结直肠扁平癌前期病变和黏膜内癌的临床价值[J]. 第三军医大学学报, 2009, 31(16): 1539-1541.
[12]ZHONG Y S, YAO L Q, ZHOU P H, et al. Endoscopic submucosal dissection for fiat colorectal precancer or cancer in-situ lesions[J].Acta Academiae Medicinae Militaris Tertiae, 2009, 31(16): 1539-1541. Chinese
[13]TANAKA S, OKA S, KANEKO I, et al. Endoscopic submucosal dissection for colorectal neoplasia: possibility of tandardization[J].Gastrointest Endosc, 2007, 66(1): 100-107.
[14]FUJISHIRO M, YAHAGI N, KAKUSHIMA N, et al. Outcomes of endoscopic submucosal dissection for colorectal epithelial neoplasms in 200 consective cases[J]. Clin Gastroentrol Hepatol,2007, 5(6): 678-683.
[15]ACQUISTAPACE F, MATERINI F, SNIDER L, et al. Endoscopic treatment of superficial colorectal neoplasms. Retrospective analysis of a single center technique and results[J]. G Chir, 2015,36(6): 247-250.
[16]NAKAJIMA T, SAITO Y, TANAKA S, et al. Current status of endoscopic resection strategy for large, early colorectal neoplasia in Japan[J]. Surg Endosc, 2013, 27(9): 3262-3270.
[17]金燕, 龚镭, 唐学军, 等. 预切开内镜黏膜切除术诊治结肠侧向发育型肿瘤的临床疗效评价[J]. 中国内镜杂志, 2016, 22(8):94-98.
[17]JIN Y, GONG L, TANG X J, et al. Clinical evaluation of pre-cutendoscopic mucosal resection in treatment of colorectal lateral spreading tumor[J]. China Journal of Endoscopy, 2016, 22(8): 94-98. Chinese
[18]KIRIYAMA S, SAITO Y, YAMAMOTO S, et al. Comparison of endoscopic submucosal dissection with laparoscopicassisted colorectal surgery for early-stage colorectal cancer: a retrospective analysis[J]. Endoscopy, 2012, 44(11): 1024-1030.
Diagnosis and treatment of 17 laterally spreading tumors
Zhi-qiang Gao, Xue-song Zhang, Yu-fei Song, Bo Li, Xian-wen Dong
(Department of Digestive Diseases, Lihuili Hospital of Ningbo Medical Treatment Center,Ningbo, Zhejiang 315040, China)
ObjectiveTo investigate the relationship between the morphological features, pit pattern classification and pathological types of colorectal laterally spreading tumor (LST). To provide a basis for the selection of treatment modalities, and to explore the value of endoscopic treatment.MethodsRetrospective analysis of 17 cases of LST from January 2015 to December 2016 detected by conventional endoscopy. 17 cases of LST first underwent dyeing magnifying endoscopy and pit pattern typing. Endoscopic submucosal dissection (ESD)or surgical treatment was performed in all patients with LST. Postoperative pathologic findings were analyzed retrospectively.ResultsOf the 17 cases, ESD was performed in 15 patients, and other 2 patients underwent surgical treatment. All of the 17 cases were treated successfully without complications such as bleeding or perforation. No recurrence was found under endoscopy in the 3-month to 2-year postoperative review.ConclusionThe preoperative pit pattern classi fication can provide the basis for treatment. ESD has good curative effect, low recurrence rate and good safety in the treatment of colorectal LST.
laterally spreading tumor (LST); endoscopic submucosal dissection (ESD); pit pattern
R735.35;R735.37
B
10.3969/j.issn.1007-1989.2017.09.020
1007-1989(2017)09-0103-05
2017-02-09
(曾文军 编辑)
