核转录因子NF-κB、RET/PTC在桥本甲状腺炎合并甲状腺乳头状癌中的表达及其意义*
2017-11-01李建英王娟红李秀萍
李建英,王娟红,鱼 军,牛 健,李秀萍,张 毓,陈 巍
西安市中心医院(西安 710003)
△通讯作者
核转录因子NF-κB、RET/PTC在桥本甲状腺炎合并甲状腺乳头状癌中的表达及其意义*
李建英,王娟红△,鱼 军,牛 健,李秀萍,张 毓,陈 巍
西安市中心医院(西安 710003)
目的:探讨核转录因子NF-κB与RET/PTC在桥本甲状腺炎(HT)合并甲状腺乳头状癌(PTC)患者中的表达、两者的相关性及其可能的致癌机制。方法:对20例HT,20例PTC、15例HT合并PTC患者手术切除的甲状腺组织及18例甲状腺腺瘤患者腺瘤旁正常甲状腺组织(NTT)用免疫组织化学(IHC)方法检测RET/PTC癌基因和NF-κB p65蛋白表达情况,并研究两者表达的相关性;用免疫荧光双标记法和激光共聚焦显微镜检测并观察NF-κB与RET/PTC的共表达情况。结果:IHC结果显示HT、HT合并PTC、PTC中RET/PTC阳性率分别为30%(6/20)、60%(9/15)和65%(13/20),NF-κB p65 阳性率分别为90%(18/20,9例核转位)、93.3%(14/15,13例出现核转位)和95%(19/20,16例出现核转位),18例NTT中RET/PTC癌基因蛋白表达均为阴性,NF-κB 阳性率为27.8%(5/18,无1例出现核转位)。RET/PTC和NF-κB p65在HT、HT合并PTC和PTC中的表达均显著高于NTT组(均P<0.05),而且NF-κB p65的表达及活化和RET/PTC蛋白的表达密切相关(P<0.01)。免疫荧光双标记和激光共聚焦显微镜检测结果显示NF-κB与RET/PTC共表达于HT及PTC病变甲状腺滤泡上皮细胞内。结论:HT及PTC患者甲状腺组织中RET/PTC与NF-κB均显著高于NTT,两者表达与活化相关且共表达于甲状腺滤泡上皮细胞内,提示核转录因子NF-κB p65可能通过RET/PTC活化在桥本甲状腺炎滤泡上皮癌变中发挥重要的作用。
桥本甲状腺炎(Hashimoto’s thyroiditis,HT)是世界范围内最常见的器官特异性自身免疫性疾病之一[1],大量的临床观察和实验研究发现HT与甲状腺乳头状癌(Papillary thyroid carcinoma,PTC)关系密切[2]。HT中甲状腺滤泡上皮细胞可发生癌变[3]。RET/PTC癌基因重排通常被认为是PTC发生的特征性基因[4],但是在HT非癌性甲状腺滤泡上皮细胞中该基因的检出率也非常高,甚至达到90%以上[5],说明RET癌基因重排是HT癌变的分子学基础。核转录因子NF-κB(NF-κB)可调节细胞增殖基因及抗凋亡基因的表达,在肿瘤的发生中具有重要作用[6]。有研究发现RET/PTC癌基因产物可以诱导NF-κB的活化[7-8],推测NF-κB p65活化及过表达在甲状腺上皮细胞的恶性转化过程中起着很重要的作用[9]。然而,HT患者易患PTC的机理至今仍不十分明了,本研究旨在通过检测HT及PTC中RET/PTC癌基因蛋白表达及其与NF-κB表达活化的关系及共表达情况,进一步探讨NF-κB p65在HT癌变中的作用及机制。
材料与方法
1 标本来源 20例HT,15例HT合并PTC,20例PTC石蜡组织标本均来自西安市中心医院病理科2010-2014年存档蜡块。其中,女49例,男6例,年龄24~74岁,平均年龄43.3岁。同期18例甲状腺腺瘤旁正常甲状腺石蜡组织标本作为对照组(NTT),其中,女17例,男1例,年龄25~67岁,平均年龄46.5岁。
2 主要试剂 鼠抗人RET/PTC癌基因单抗、鼠抗人NF-κB p65单抗及兔抗人NF-κB p65多克隆抗体均购自美国Santa Cruz 公司,Texas Red标记的羊抗兔二抗及FITC标记的羊抗鼠二抗均购自丹麦DAKO公司,SP试剂盒购自福州迈新公司,DAB显色试剂盒购自武汉博士德公司。
3 实验方法 ①免疫组化检测RET/PTC和NF-κB蛋白表达:免疫组化染色采用常规链霉菌素亲生物素-过氧化酶连接法(SP法)。RET/PTC单抗1∶100稀释,NF-κB p65单抗1∶400稀释,RET/PTC以胞浆呈棕黄色为阳性,NF-κB以胞浆/核呈棕黄色为阳性。阴性对照为用PBS代替一抗或用含有小鼠单抗IgG1的神经胶质酸性蛋白(Glial fibrillary acidic protein,GFAP,Dako)稀释至与一抗相同IgG1浓度代替单抗。②NF-κB和RET/PTC抗原免疫荧光双标记及激光共聚焦显微镜观察:免疫组化采用SP法,滴加适当稀释的第一抗体混合液(NF-κB p65兔多抗1∶50,RET/PTC鼠单抗1∶50),4℃过夜。37℃复温1 h,PBS洗涤,5 min × 3次,滴加适当稀释的第二抗体混合液(Texas Red标记的羊抗兔1∶50;FITC标记的羊抗鼠1∶50),37℃孵育40 min,PBS洗涤,DAPI衬染细胞核,PBS充分洗涤,无荧光缓冲甘油封片,用Olympus FV1000的激光共聚焦显微镜观察并照相,用于FITC的激发波长为488 nm,用于Texas-Red的激发波长为543 nm,用于DAPI的激发波长为340 nm。两种免疫组化分别设相应的阳性对照和阴性对照。
4 统计学方法 用SPSS 11.0版统计学软件,对实验组及对照组年龄差异采用非配对t检验,性别差异及每两组间实验结果阳性率差异采用Pearson χ2检验或Fisher精确检验,用卡方检验研究甲状腺组织中NF-κB与 RET/PTC表达及活化的相关性,以P<0.05为差异有统计学意义。
结 果
1 RET/PTC免疫组化结果 RET/PTC阳性信号主要存在于HT及PTC病变组织甲状腺滤泡上皮细胞胞浆内(见图1)。HT、HT合并PTC、PTC疾病性甲状腺组织中RET/PTC阳性率分别为30%(6/20)、60%(9/15)和65%(13/20),18例正常甲状腺组织RET/PTC癌基因蛋白表达均为阴性。统计学分析,RET/PTC在HT、HT合并PTC和PTC中的表达均显著高于对照组正常甲状腺组织(均P<0.05)(见表1),但是,RET/PTC在HT合并PTC和PTC组中的表达无统计学差异(P>0.05)。在HT中的表达与所有PTC病例(包括HT合并PTC组)中的表达有统计学差异(P<0.05)。
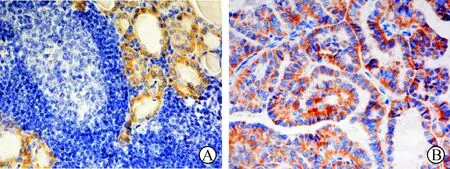
图1 HT患者(A)及PTC患者(B)RET/PTC抗体免疫组化染色结果(SP法×40)
2 NF-κB p65免疫组织化学结果 NF-κB阳性信号主要位于甲状腺滤泡上皮细胞胞浆和(或)胞核。HT标本中,NF-κB p65阳性信号位于淋巴滤泡间甲状腺上皮细胞胞浆和胞核内,少数表达于浸润在甲状腺组织中的淋巴细胞(见图2A)。PTC标本中,阳性信号表达于肿瘤细胞胞浆和胞核内(见图2B)。在对照组正常甲状腺组织中阳性信号均表达于甲状腺上皮细胞胞浆,但是大多数正常甲状腺组织(13/18)上皮表达阴性。HT、HT合并PTC、PTC和正常甲状腺组织中NF-κB p65 免疫组化阳性率分别为90%(18/20,9例核转位)、93.3%(14/15,13例出现核转位)、95%(19/20,16例出现核转位)和27.8%(5/18,无1例出现核转位),它们与RET/PTC蛋白共同表达率分别为30%(6/20)、60%(9/15)、65%(13/20)和0(RET阳性病例全部出现NF-κB 核转位)。统计学分析,NF-κB p65在HT、HT合并PTC和PTC中的表达均显著高于正常对照组,而且NF-κB p65的表达和RET/PTC蛋白的表达密切相关(见表1,Pearson χ2检验,P<0.01)。与正常甲状腺组织中NF-κB蛋白表达相比较,发现在疾病性甲状腺组织中NF-κB表达升高并且在HT、HT合并PTC及PTC病人甲状腺组织中表达RET蛋白的病例均出现了明确的NF-κB核转位,即NF-κB活化状态。
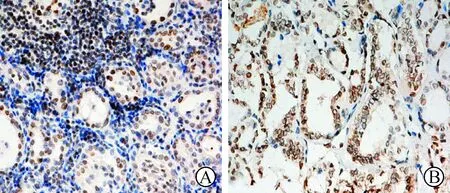
图2 HT患者(A)及PTC患者(B) NF-κB p65抗体免疫组化染色结果(SP法×40)
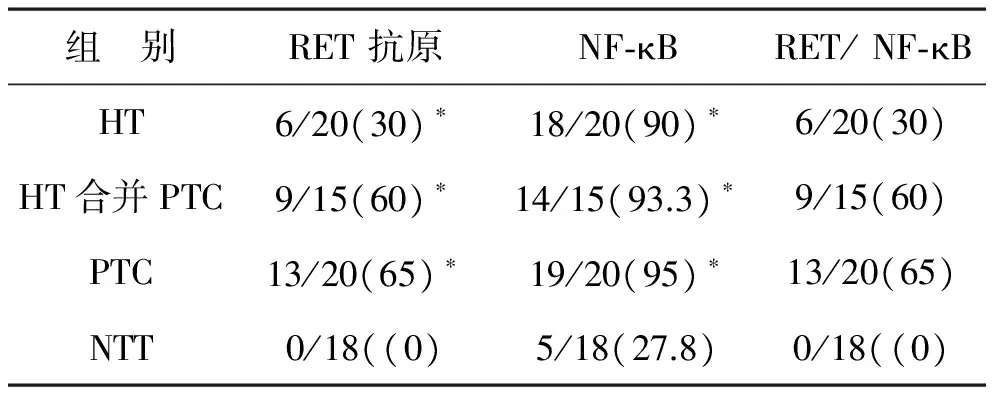
组 别RET抗原NF⁃κBRET/NF⁃κBHT6/20(30)∗18/20(90)∗6/20(30)HT合并PTC9/15(60)∗14/15(93.3)∗9/15(60)PTC13/20(65)∗19/20(95)∗13/20(65)NTT0/18((0)5/18(27.8)0/18((0)
注:与NTT组比较,*P<0.05
3 免疫荧光双标记及激光共聚焦显微镜结果 在HT和PTC组织标本中,均见红色的NF-κB阳性信号位于甲状腺滤泡上皮细胞内(图3A),阳性上皮细胞同时表达RET/PTC蛋白绿色着色(图3B),激光共聚焦图象迭合后发现绝大部分细胞共定位于甲状腺滤泡上皮细胞内(图3C,黄白色)。
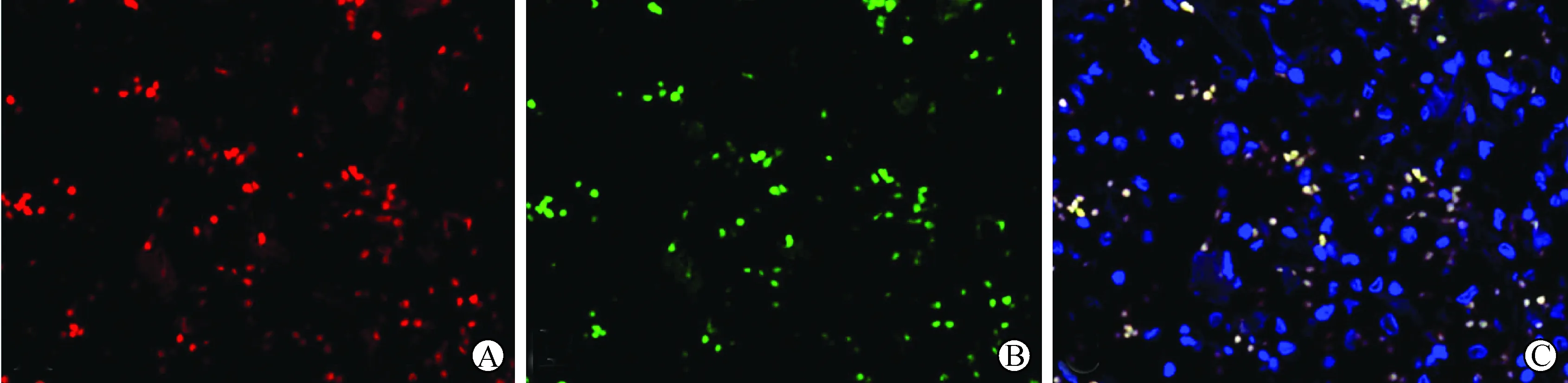
A:NF-κB的表达(红色荧光)(Texas Red,×600);B:RET/PTC抗原的表达(绿色荧光)(FITC,×600);C:激光共聚焦结果,显示NF-κB和RET/PTC抗原共表达于甲状腺滤泡上皮细胞胞浆和/或胞核(黄白色,蓝色为DAPI衬染细胞核)(激光共聚焦,×600)
图3 RET/PTC抗原和NF-κB的免疫荧光双标记及激光共聚焦结果
讨 论
在本研究中,我们通过免疫组化及免疫荧光双标记激光共聚焦两种方法在人体甲状腺组织中发现HT及PTC中RET/PTC和NF-κB高表达,共表达、共定位。利用免疫组化方法,我们发现HT及PTC患者甲状腺组织中RET/PTC癌基因表达率明显高于对照组,并发现NF-κB p65在HT、HT合并PTC和PTC中的表达均显著高于正常对照组,而且NF-κB p65的表达和RET/PTC蛋白的表达密切相关,进一步通过免疫荧光双标记法和激光共聚焦显微镜检测观察发现NF-κB与RET/PTC抗原共表达于HT及PTC甲状腺滤泡上皮细胞内。因此,我们认为核转录因子NF-κB p65可能通过RET/PTC活化在桥本甲状腺炎癌变中发挥重要的作用。
核转录因子NF-κB是Rel蛋白家族成员,是广泛存在于真核细胞浆中的核转录因子,在各种细胞因子相互影响和相互作用的复杂网络中,NF-κB作为转录因子,起着中心调控作用[6]。静息时NF-κB通常以同源或异源二聚体p65和p50的形式与抑制蛋白IκB结合成无活性的复合物滞留于胞浆中。多种因素可激活NF-κB,如细胞因子、丝裂原、环境变化、病毒或细菌产物等。当细胞受到活化刺激后,NF-κB与其抑制蛋白IκB解离,然后自胞浆进入胞核与其靶基因的启动子或增强子的κB位点结合,调控靶基因的表达。NF-κB一方面可调控与炎症和免疫反应有关的许多炎症介质基因的表达[9],在炎症反应的复杂调控网络中起着中心调控的作用;另一方面它还可调节细胞增殖基因及抗凋亡基因的表达,从而在肿瘤的发生中具有重要作用[7-8]。近年来的研究发现,NF-κB p65 过表达在甲状腺上皮细胞的恶性转化过程中起着很重要的作用[9]。
RET/PTC癌基因被认为是PTC发生的特征性基因[4],但是近年来在HT非癌性甲状腺滤泡上皮细胞中该基因的检出率也非常高,甚至达到90%以上[8],提示共同的分子机制可能存在于PTC发展的早期阶段。细胞培养和动物实验研究表明RET/PTC癌基因产物可以诱导NF-κB的活化[8-9]。活化的NF-κB一方面能够进一步诱导正常上皮细胞发生恶性转化,另一方面,它可以促进许多致炎细胞因子如单核细胞趋化蛋白MCP1、白介素-6(IL-6)等的转录,引起肿瘤发生部位炎细胞浸润,细胞免疫失衡,介导炎症相关性肿瘤的形成。在HT中,是否RET/PTC的出现是导致肿瘤发生的早期因素,这一基因的蛋白表达是否通过诱导NF-κB的活化进一步诱导甲状腺上皮细胞癌变,导致PTC的发生?目前,国内外这方面的研究及对这一致癌途径的推测都是基于动物实验或者细胞培养水平所得,人体内NF-κB活化与肿瘤发生、发展和转移的关系还很不清楚。本研究中我们通过免疫组化技术 发现RET/PTC癌基因蛋白表达主要存在于甲状腺乳头状癌组织中,也存在于非癌性HT病人的甲状腺组织中,而正常组织中RET/PTC癌基因代表表达全部阴性。这一结果说明PTC病人中大部分发生RET/PTC重排,正常甲状腺组织无此癌基因重排,而HT病人中也存在相当多的RET/PTC重排病患。出现RET/PTC癌基因重排是HT与PTC共同早期病变,这一结果为RET/PTC癌基因产物可能诱导NF-κB活化,导致HT癌变为PTC提供了理论基础。通过统计分析,我们进一步发现NF-κB p65表达和RET/PTC蛋白的表达密切相关,RET/PTC抗原阳性的病例均出现了NF-κB核转位,即NF-κB活化状态,这一结果支持RET/PTC具有对NF-κB的活化作用。应用免疫荧光剂激光共聚焦检测,我们发现NF-κB与RET/PTC抗原共表达于HT及PTC甲状腺滤泡上皮细胞内,这一结果进一步提示RET/PTC能够活化NF-κB,从而在桥本甲状腺炎癌变中发挥重要的作用。我们的研究结果不但有助于更进一步地研究PTC的发病机制,而且对临床上治疗及预防PTC提供了新的思路。
[1] Yoo WS,Chung HK.Recent advances in autoimmune thyroid diseases[J].Endocrinol Metab,2016,31(3):379-385.
[2] 郭 卫,刘 翔,钟毓杰.慢性淋巴细胞性甲状腺炎31例临床分析[J].陕西医学杂志,2008,37(6):679-680,723.
[3] Noureldine SI,Tufano RP.Association of Hashimoto's thyroiditis and thyroid cancer[J].Curr Opin Oncol,2015,27(1):21-25.
[4] Prescott JD,Zeiger MA.The RET oncogene in papillary thyroid carcinoma[J].Cancer,2015,121(13):2137-2146.
[5] Rhoden KJ,Unger K,Salvatore G,etal. RET/papillary thyroid cancer rearrangement in nonneoplastic thyrocytes: follicular cells of Hashimoto’s thyroiditis share low-level recombination events with a subset of papillary carcinoma [J]. J Clin Endocrinol Metab,2006,91:2414-2423.
[6] Stoffel A,Chaurushiya M,Singh B,etal.Activation of NF-kappaB and inhibition of p53-mediated apoptosis by API2/mucosa-associated lymphoid tissue 1 fusions promote oncogenesis[J].Proc Natl Acad Sci USA,2004,101:9079-9084.
[7] Puxeddu E,Knauf JA,Sartor MA,etal. RET/PTC-induced gene expression in thyroid PCCL3 cells reveals early activation of genes involved in regulation of the immune response[J]. Endocrine-Related Cancer,2005,12: 319-334.
[8] Robert JN,Marcia SB,Carolyn MG,etal. The RET/PTC-3 oncogene activates classical NF-κB by stabilizing NIK[J]. Oncogene,2011,30(1): 87-96.
[9] Visconti R,Cerutti J,Battista S,etal.Expression of the neoplastic phenotype by human thyroid carcinoma cell lines requires NF kappaB p65 protein expression [J]. Oncogene,1997,15:1987-1994.
*国家自然科学基金资助项目(81372857)
陕西省科学技术研究发展计划项目(2008K09-09)
西安市科技计划项目[SF09027(9)]
甲状腺炎 甲状腺肿瘤 NF-κB 基因表达调控,肿瘤 @RET/PTC
R736.1
A
10.3969/j.issn.1000-7377.2017.10.002
(收稿:2017-02-24)
