通脑液的质量标准研究
2017-11-01王秀琴钱秋玉王东兴陆军总医院263临床部药剂科北京101149
王秀琴 ,钱秋玉,王东兴,石 蕾,陈 军(陆军总医院263临床部药剂科,北京 101149)
通脑液的质量标准研究
王秀琴 ,钱秋玉,王东兴,石 蕾,陈 军(陆军总医院263临床部药剂科,北京 101149)
目的:建立通脑液的质量标准。方法:采用薄层色谱法(TLC)对处方中西红花进行定性鉴别;采用HPLC法测定西红花中西红花苷Ⅰ和西红花苷Ⅱ的含量,色谱柱:Agilent ZORBAX SB-C18柱(250 mm × 4.6 mm,5 µm),甲醇-水(48∶52)为流动相,流速1.0 mL·min-1,柱温30 ℃,检测波长440 nm,进样量10 μL。结果:薄层鉴别专属性强,分离效果好。西红花苷Ⅰ在9.66 ~ 57.94 µg·mL-1呈良好的线性关系(r = 1),西红花苷Ⅱ在5.91 ~ 35.48 µg·mL-1呈良好的线性关系(r = 0.9999),平均回收率分别为98.4%(RSD = 1.21%,n = 9),99.4%(RSD = 1.70%,n = 9)。结论:该方法简便、准确、重复性好,可作为通脑液的质量控制方法。
西红花;西红花苷Ⅰ;西红花苷Ⅱ;高效液相色谱法
[KEY WORDS]Saffron; Crocin Ⅰ; Crocin Ⅱ; HPLC
通脑液由西红花、石菖蒲、川芎、水蛭等九味药材研制而成,主要用于治疗脑梗死、脑缺血、脑卒中恢复期、脑外伤及脑炎后遗症、脑瘫等症状。原标准中鉴别川芎[1]、西红花不足以控制通脑液的质量,增加该制剂中石菖蒲、水蛭的薄层鉴别,以更好的控制本品质量,该实验另文有报道。国内外大量研究表明,西红花提取物在抗心血管系统疾病、抗氧化、抗动脉粥样硬化、防治糖尿病并发症等方面有明确的生物活性[2-3]。本实验采用薄层色谱法(TLC)对处方中君药西红花进行定性鉴别;采用高效液相色谱法(HPLC)测定西红花苷Ⅰ和西红花苷Ⅱ的含量,作为通脑液的质量控制指标。
1 仪器与试药
Agilent 1100型高效液相色谱仪(美国Agilent公司);BT125D型电子天平(德国赛多利斯公司);色谱柱:Agilent ZORBAX SB-C18柱(250 mm × 4.6 mm,5µm);LDZ5-2型离心机(北京京立离心机有限公司);ZF-2型紫外灯(上海嘉鹏科技有限公司);851-2型远红外快速干燥箱(上海向阳无线电元件厂)。甲醇(色谱纯,天津市康科德科技有限公司);纯化水(自制);西红花苷Ⅰ对照品(中国食品药品检定研究院,纯度:91.1%,批号:111588-201202,本品需冷冻遮光保存,使用前无需处理);西红花苷Ⅱ对照品(中国食品药品检定研究院,纯度:92.4%,批号:111589-201304,本品需冷冻遮光保存,使用前无需处理)。 通脑液(解放军第二五五医院配制,每支8 mL,批号:20141117、20150309、20150415)。
2 方法与结果
2.1 西红花TLC鉴别
取西红花对照药材0.02 g,加甲醇4 mL,密塞,振摇,静置30 min,取上清液作为药材对照溶液。再另取缺西红花的通脑液阴性样品10 mL,浓缩至约2 mL,作为阴性对照溶液。吸取上述三种溶液各5 µL,分别点于同一硅胶G薄板上,以醋酸乙酯-甲酸-水(5 : 1 : 0.6)的上层溶液为展开剂,展开检视。实验表明,供试品溶液在与对照药材色谱相应的位置上,显相同黄色的荧光斑点,阴性样品未见干扰。
2.2 色谱条件
色谱柱:Agilent ZORBAX SB-C18柱(250 mm×4.6 mm,5 µm);流动相:甲醇-水(48 : 52);检测波长:440 nm;流速:1.0 mL·min-1;柱温:30 ℃;进样体积:5 µL;理论塔板数按照西红花苷Ⅰ峰计算应不低于3500。
2.3 溶液的制备
(1)西红花苷Ⅰ和西红花苷Ⅱ对照品溶液的制备:取西红花苷Ⅰ对照品10 mg,精密称定,置50 mL量瓶中加稀乙醇溶解并稀释至刻度,摇匀,即得西红花苷Ⅰ对照品储备液。精密量取1 mL西红花苷Ⅰ对照品储备液置10 mL量瓶中加稀乙醇稀释至刻度,摇匀,即得西红花苷Ⅰ对照品溶液(10 ℃以下保存)。再另取西红花苷Ⅱ对照品12 mg,精密称定,置100 mL量瓶中加稀乙醇溶解并稀释至刻度,摇匀,即得西红花苷Ⅱ对照品储备液。精密量取1 mL西红花苷Ⅱ对照品储备液置10 mL量瓶中加稀乙醇溶解并稀释至刻度,摇匀,即得西红花苷Ⅱ对照品溶液(10 ℃以下保存)。精密量取西红花苷Ⅰ和西红花苷Ⅱ对照品储备液各1 mL于10 mL量瓶中稀释至刻度,摇匀,即得(10 ℃以下保存)。(2)供试品溶液的制备:精密量取本品1 mL于10 mL量瓶中,加稀乙醇至刻度,摇匀,即得。(3)阴性样品溶液的制备:精密吸取缺西红花的通脑液阴性样品1 mL置10 mL量瓶中,加稀乙醇至刻度,摇匀,即得。
2.4 系统适用性实验
分别精密吸取“2.3”项下对照品溶液、供试品溶液及阴性样品溶液各5 µL,按“2.2”项下色谱条件进样。结果显示,在西红花苷Ⅰ和西红花苷Ⅱ[4]对照品色谱峰的保留时间处,供试品溶液具有色谱峰,且色谱峰与相邻峰得到基线分离,而阴性样品溶液没有色谱峰,共存的其他药味对测定没有干扰,表明该方法对通脑液中西红花苷Ⅰ和西红花苷Ⅱ的测定具有专属性。对照品、供试品及阴性样品色谱见图1。
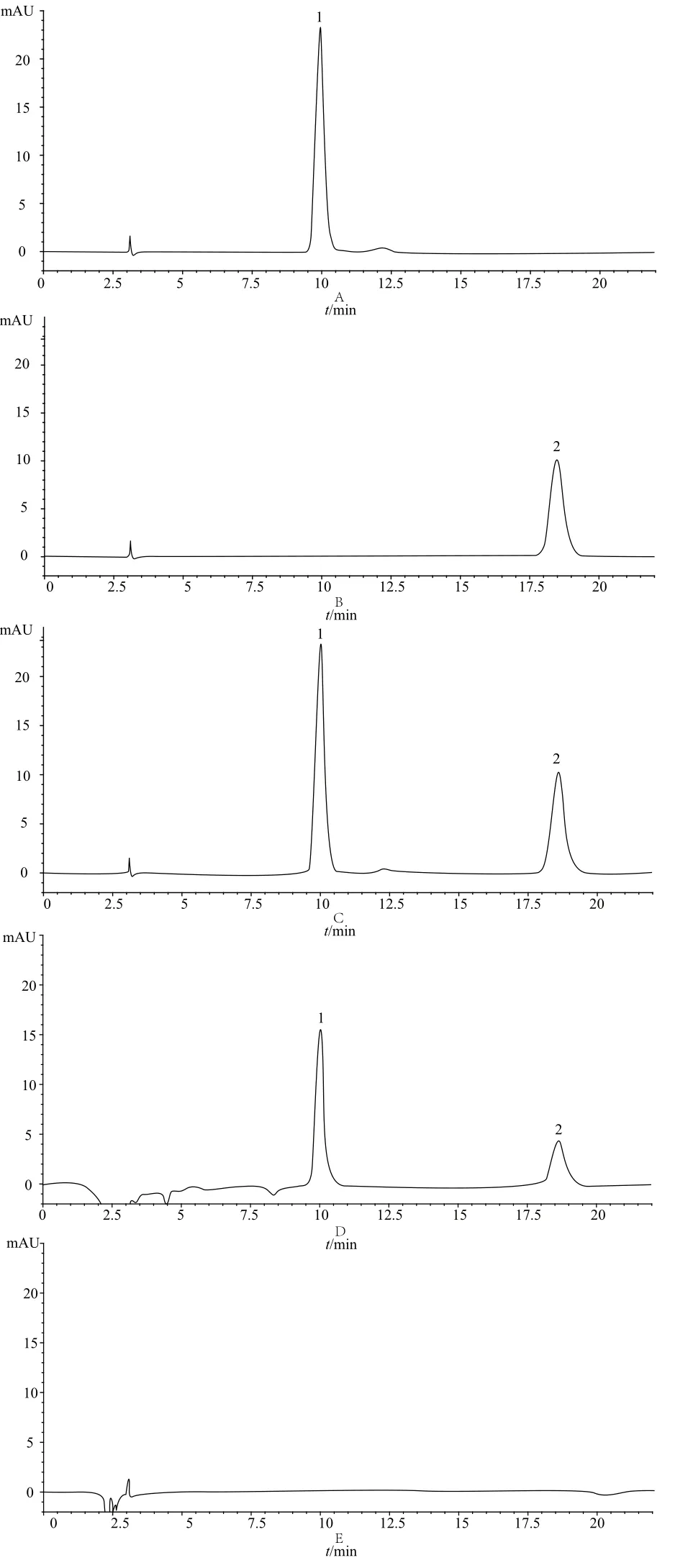
图1 高效液相色谱图Fig 1 HPLC chromatograms
2.5 方法学验证
2.5.1 线性关系考察 精密称取西红花苷Ⅰ对照品10.60 mg置于50 mL量瓶中加稀乙醇溶解并稀释至刻度,摇匀,作为西红花苷Ⅰ对照品储备液。再分别精密量取西红花苷Ⅰ对照品储备液0.5、0.6、0.8、1.0、2.0、3.0置10 mL量瓶中;精密称取西红花苷Ⅱ对照品12.80 mg置于100 mL量瓶中,加稀乙醇溶解并稀释至刻度,摇匀,作为西红花苷Ⅱ对照品储备液。再分别精密量取西红花苷Ⅱ对照品储备液0.5、0.6、0.8、1.0、2.0、3.0分别置上述10 mL量瓶中,用稀乙醇定容,摇匀,即得系列浓度西红花苷Ⅰ和西红花苷Ⅱ对照品混合溶液。分别精密吸取西红花苷Ⅰ和西红花苷Ⅱ对照品系列浓度混合溶液各5 µL,注入高效液相色谱仪,记录色谱图。实验表明,西红花苷Ⅰ在9.66~ 57.94 µg·mL-1浓度范围内峰面积与进样浓度的关系为:A= 26.717C– 0.0693(r= 1),西红花苷Ⅱ在5.91 ~35.48 µg·mL-1浓度范围内峰面积与进样浓度的关系为:A= 28.673C– 7.1746(r= 0.9999),表明西红花苷Ⅰ在9.66 ~ 57.94 µg·mL-1范围内线性关系良好,西红花苷Ⅱ在5.91 ~ 35.48 µg·mL-1范围内线性关系良好。
2.5.2 精密度实验 按“2.3”项下方法配制西红花苷Ⅱ对照品储备液。分别精密吸取上述储备液各1.0 mL于10 mL量瓶中,用稀乙醇定容,摇匀,即得。进样,按“2.2”项下方法进行分析,重复进样6次,记录色谱图,计算峰面积的RSD。实验表明,西红花苷Ⅰ和西红花苷Ⅱ峰面积的RSD分别为0.36%(n= 6)和1.02%(n= 6),表明仪器精密度良好。
2.5.3 重复性实验 取同一批样品(批号:20150415)6份,按“2.3”项下方法制备,依法测定,记录色谱图。实验结果表明,通脑液中西红花苷Ⅰ和西红花苷Ⅱ含量平均值分别为131.24 µg·mL-1(RSD = 1.02%,n= 6)和50.17 µg·mL-1(RSD = 1.75%,n= 6),表明该方法重复性良好。
2.5.4 稳定性实验 取同一批样品(批号:20150415)制备的供试品溶液,分别于0、2、4、6、10、12 h进样测定。实验结果表明,通脑液中西红花苷Ⅰ和西红花苷Ⅱ峰面积的RSD分别为0.47%(n= 6)和1.79%(n=6),表明供试品溶液在12 h内基本稳定。
2.5.5 回收率实验 精密称取西红花苷Ⅰ和西红花苷Ⅱ对照品稀释制成浓度分别为93.29 g·mL-1和56.62 g·mL-1的加样用西红花苷Ⅰ和西红花苷Ⅱ溶液。分别取0.8、1.0、1.2 mL加样用西红花苷Ⅰ和西红花苷Ⅱ溶液按低(80%)、中(100%)、高(120%)三个剂量组置于10 mL量瓶再分别精密称取同一批已知含量的样品(批号:20150415)9份,每份0.5 mL,加稀乙醇稀释至刻度,摇匀后依法测定,记录色谱峰值。结果表明该法适用于西红花苷Ⅰ和西红花苷Ⅱ含量测定,见表1。
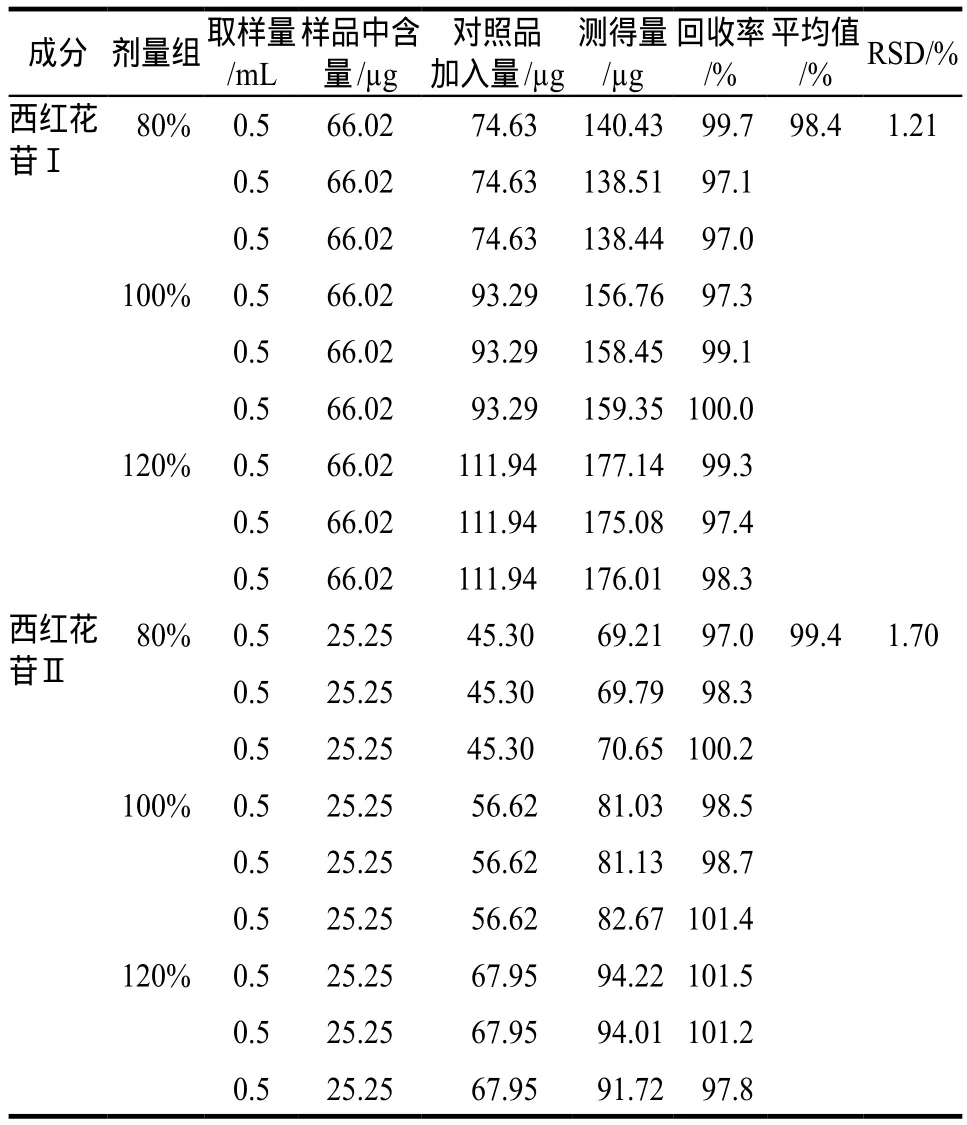
表1 西红花苷Ⅰ和西红花苷Ⅱ加样回收率实验结果. n = 9Tab 1 Results of recovery test for crocinⅠand crocinⅡ. n = 9
2.6 含量测定
取通脑液三批样品(批号:20141117;20150309;20150415)按供试品溶液制备方法项下制备,依法测定峰面积,按外标法计算西红花苷Ⅰ和西红花苷Ⅱ的含量[5-7]。测定数据与结果见表2。

表2 西红花苷Ⅰ和西红花苷Ⅱ含量测定结果. n = 3Tab 2 Contents determination of crocinⅠand crocinⅡ. n = 3
3 讨论
3.1 通脑液指标成分及含量测定方法的选择
君药之一西红花为鸢尾科植物番红花(Crocus sativus L.)的干燥柱头,性味甘、平,归心、肝经,具有活血化瘀、凉血解毒、解郁安神的功效[1]。国内外大量研究表明,西红花提取物在抗心血管系统疾病、抗氧化、抗动脉粥样硬化、防治糖尿病并发症等方面有明确的生物活性[2-3],其药理作用明显,开发潜力大,颇受医药界青睐。2010年版《中国人民解放军医疗机构制剂规范》未对通脑液进行含量测定,及未对制剂中组成成分石菖蒲、水蛭进行鉴别。 根据《中国药典》[3]、参考相关文献[4-8]及课题专家审批建议,选定处方组成中的君药西红花的有效成分西红花苷Ⅰ、Ⅱ作为指标成分,采用HPLC法对其进行含量测定,本实验所建立的方法操作简便、专属性强,精密度、重复性、回收率均满足要求,可作为通脑液的质量控制方法。
3.2 通脑液含量限度的确定
本制剂为中药制剂,进行含量限度测定须注意:在保证药物成分对临床安全和疗效稳定的情况下,并基于足够的具有代表性的样品实验数据,结合药材含量及工艺收率综合分析制定。我们所测成分的原料为粉末、提取物入药,该成分的转移率应不低于85%,且所测成分的原料在制备工艺中经溶剂提取时,该成分转移率一般应不低于30%。
3.3 HPLC法测定条件的优化
3.3.1 检测波长选择 参考文献[5,9]并采用二级管阵列检测器(DAD)进行全波长扫描显示,西红花苷Ⅰ和西红花苷Ⅱ在440 nm波长范围处有最大吸收,因此选择440 nm作为检测波长。
3.3.2 流动相的选择 经过多次实验确定了以甲醇-水(48 : 52)为西红花苷Ⅰ和西红花苷Ⅱ含量测定的流动相,峰形好,西红花苷Ⅰ理论塔板数达5000以上,可作为通脑液的质量控制方法。由于西红花苷Ⅰ、Ⅱ的结构中有多个共轭双键,对pH、光照、温度、氧等影响因素十分敏感,稳定性差[2,7],因此在实验中应保持温度不变,所以选择柱温与外界温度相一致。
[1] 张业昊,丛伟红,刘建勋.西红花苷的药理作用研究进展[J].中药药理与临床,2015,31(2):124-127.
[2] 钱勇,许纪锋,诸晨,等.西红花中西红花苷Ⅰ和苷Ⅱ的含量测定[J].食品安全质量检测学报,2015,6(7):2822-2827.
[3] 国家药典委员会.中国药典[S].北京:中国医药科技出版社,2010:120.
[4] Caballero-Ortegaa H, Pereda-Mirandab R, Abdullaeva FI. HPLC quantification of major active components from 11 different saffron (Crocus sativus L.) sources[J]. Food Chem, 2007, 100:1126-1131.
[5] Si W, Yang W, Guo D, et al. Selective ion monitoring of quinochalcone C-glycoside markers for the simultaneous identif i cation of Carthamus tinctorius L. in eleven Chinese patent medicines by UHPLC/QTOF MS[J]. J Pharm Biomed Anal, 2016,117: 510-521.
[6] Sang GL, Vance TM, Nam TG, et al. Evaluation of pH differential and HPLC methods expressed as cyanidin-3-glucoside equivalent for measuring the total anthocyanin contents of berries[J]. J Food Meas Charact, 2016, 10(3): 1-7.
[7] 邓绍勇,贺义昌,朱培林,等.栀子野生群体栀子苷及西红花苷-1含量分析[J].中药材,2016,39(7):1493-1498.
[8] 沈健,张诚贤.HPLC梯度洗脱法同时测定小儿暑感宁糖浆中的香荆芥酚、麝香草酚、和厚朴酚及厚朴酚[J].中国药物应用与监测,2016,13(4):217-220.
[9] 韩亚亮,古今,何新荣,等.HPLC法测定血塞通软胶囊中三七皂苷R1及人参皂苷Rg1、Re、Rb1的含量[J].中国药物应用与监测,2015,12(5):268-271.
Quality standard studies of Tongnaoye
WANG Xiu-qin, QIAN Qiu-yu, WANG Dong-xing, SHI Lei, CHEN Jun(Pharmacy of 263 Clinical Department of the Army General Hospital, Beijing 101149, China)
Objective:To establish the quality standard of Tongnaoye.Methods:Thin layer chromatography (TLC) was used to identify crocus sativus in the prescription. High performance liquid chromatography (HPLC) was used to determine the content of crocin Ⅰ and crocin Ⅱ. Chromatographic conditions were as follows: Agilent ZORBAX SB-C18column (250 mm × 4.6 mm,5 µm) was used, the mobile phase consisted of methanol-water (48 : 52) with the fl ow rate of 1.0 mL·min-1, the detection wavelength was set at 440 nm, the temperature was 30 ℃ and the sample volume was 10 μL.Results:The TLC method showed good specif i city and separation effect. CrocinⅠshowed a good linear relationship (r = 1) in the range of 9.66 – 57.94 µg·mL-1, while crocinⅡ showed a good linear relationship (r = 0.9999) in the range of 5.91 – 35.48 µg·mL-1. Their average recovery rates were 98.4% (RSD = 1.21%, n =9) and 99.4% (RSD = 1.70%, n = 9) respectively.Conclusion:This method was simple, accurate and reproducible, which could be used to control the quality of Tongnaoye.
R917
A
1672 – 8157(2017)05 – 0271 – 04
军队十二五面上项目(14ZJZ06-1)
王东兴,男,主管药师,研究方向:药品分析与药品质量控制。E-mail:13910864566@139.com
王秀琴,女,副主任药师,主要从事药事管理及临床药学工作。E-mail:wangxq69@163.com
2017-04-10
2017-06-06)
