基于数据挖掘技术对氟喹诺酮类药物相关神经系统不良反应的分析研究
2017-11-01杨鸿溢贾王平郭代红赵粟裕重庆医科大学药学院重庆40006解放军总医院医保部药品保障中心北京00853
杨鸿溢,贾王平,郭代红,范 琦,赵粟裕(.重庆医科大学药学院,重庆 40006;.解放军总医院医保部药品保障中心,北京 00853)
·不良反应监测·
基于数据挖掘技术对氟喹诺酮类药物相关神经系统不良反应的分析研究
杨鸿溢1,贾王平2,郭代红2,范 琦1,赵粟裕2(1.重庆医科大学药学院,重庆 400016;2.解放军总医院医保部药品保障中心,北京 100853)
目的:挖掘和评价氟喹诺酮类药物(FQNs)中相关神经系统药品不良反应(ADR)的风险信号,为临床提供用药参考。方法:调取解放军ADR数据库中FQNs相关ADR报告,对涉及神经系统ADR报告相关信息进行统计分析,并采用比例报告比法、报告比值比法、英国药品和保健产品管理局的综合标准法和贝叶斯可信区间递进神经网络法4种数据挖掘方法,获取FQNs相关神经系统ADR风险信号,及中枢神经系统(CNS)和周围神经系统(PNS)的风险信号。结果:研究共纳入2008年7月到2017年6月期间FQNs相关的有效ADR报告11988例,涉及神经系统的1322例。相关FQNs共14种,其中引发神经系统ADR频次最高的前5种药物为左氧氟沙星、莫西沙星、加替沙星、环丙沙星和依诺沙星。出现神经系统ADR阳性信号的药物为莫西沙星、氟罗沙星和芦氟沙星。结论:FQNs相关神经系统ADR的主要引发药物为莫西沙星、氟罗沙星和芦氟沙星,应针对性强化临床应用中相关警戒意识并予以防范。
氟喹诺酮类;神经系统;药品不良反应;药物警戒;数据挖掘
[KEY WORDS]Fluoroquinolones; Neurological system; Adverse drug reaction; Pharmacovigilance; Data mining
氟喹诺酮类药物(fluoroquinolones,FQNs)是一种高效、低毒、抗菌谱广的抗感染药物。随着这类药物在临床的广泛应用,其药品不良反应(adverse drug reaction,ADR)相关报道也不断增加,并引起高度关注。多个国家药监部门多次警告这类药物可引起神经系统病变、肌腱断裂、肝损害等不可逆转的严重ADR。我国食品药品监督管理总局(CFDA)曾在2011年与2013年两次发布药品ADR信息通报,提示关注FQNs的ADR[1-2]。2017年7月CFDA又发布了关于修订全身用FQNs药品说明书的公告,将包括神经系统ADR在内的各严重ADR加入到黑框警告[3]。本研究基于解放军ADR数据库中的ADR报告,以数据挖掘技术为手段,挖掘和评价FQNs中出现比例较高的神经系统相关 ADR的风险信号,旨为临床合理安全用药提供参考。
1 资料与方法
1.1 数据来源及处理
1)数据来源:2008年7月 – 2017年6月,解放军ADR数据库中FQNs相关ADR报告12820例的全部信息。
2)纳入标准:患者基本情况、药品、ADR等相关信息清晰明确,且关联性评价结果为肯定、很可能、可能的ADR报告,共计11988例。
3)数据清洗:由于ADR报告者的医学术语表达习惯不同,相同监测结果可能会出现不同或不规范的表达方式,致使信号分散、降低检测灵敏度[4]。筛选的数据采用《WHO的不良反应术语集》(WHO-ART)对ADR记录进行统一规整,并对其累及器官/系统进行分类。并依据《新编药物学》(17版),对ADR报告中所涉及的药品名称按照通用名进行规范化整理和分类。
1.2 风险信号挖掘
数据清洗规整后,以其中一种FQNs为目标药物,其他FQNs为非目标药物。如果一份ADR报告涉及多种ADR,则按照药物-ADR组合对其进行拆分,将与神经系统ADR相关的报告纳入神经系统ADR组,其他报告纳入非神经系统ADR组。
按表1所示对数据资料进行整理后,采用比例失衡法对FQNs相关神经系统ADR信号进行挖掘,并对中枢神经系统(central nervous system,CNS)和周围神经系统(peripheral nervous system,PNS)的ADR分别进行信号检测。
表1 ADR信号检测四格表Tab 1 Four fold table of ADR signal detection
比例失衡法主要数据挖掘方法有四种,分别是比例报告比法[5](proportional reporting ratio,PRR)、报告比值比法[6](reporting odd ratio,ROR)、英国药品和保健产品管理局的综合标准法[7](MHRA)和贝叶斯可信区间递进神经网络法[8](Bayesian confidence propagation neural network,BCPNN),判断是否生成风险信号的标准分别为PRR-1.96SE > 1、ROR-1.96SE> 1、(PRR ≥ 2,A≥3,χ2≥4)和IC-2SD > 0。
本研究将ADR数据库中与FQNs相关的ADR报告作为一个整体和背景,如果某一药物-神经系统ADR组合生成了一个风险信号,就可以说明该药物与其他FQNs相比和神经系统ADR的关联强度更高,更应引起临床足够的重视。
1.3 数据处理分析
采用Microsoft Excel 2013和SPSS22.0软件进行数据整理与统计分析,计量资料描述采用x± s表示,计数资料描述采用频数(构成比)表示。两组计量资料比较采用独立样本t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 基本情况
FQNs相关ADR报告分别来自135所网点医院,共计11988例;涉及ADR表现257种,累及18大类器官/系统。涉及神经系统ADR报告共计1322例(11.03%);其中一般报告1274例(96.37%),严重报告48例(3.63%);男性580例(43.87%),女性736例(55.68%),性别不详6例(0.45%);年龄最小为新生儿,最大111岁,平均年龄(47.82±20.57)岁,详见表2。
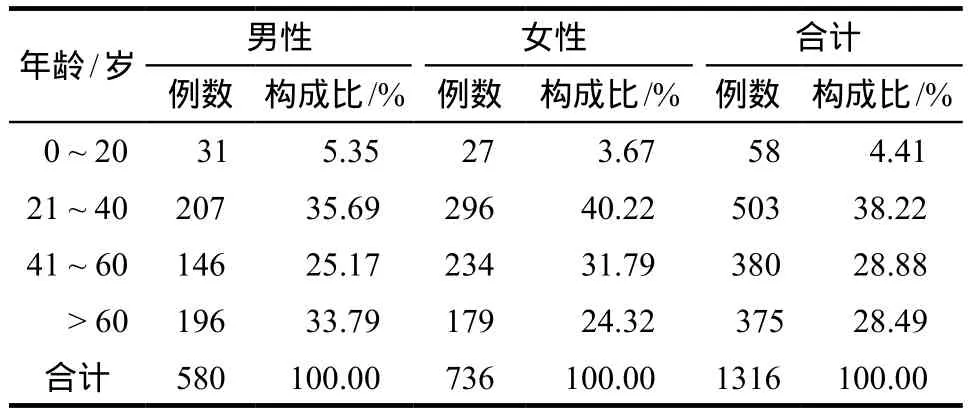
表2 患者的年龄及性别分布Tab 2 Age and gender distribution of the patients
男女患者在各个年龄段的构成比差异具有统计学意义(χ2= 18.947,P< 0.001)。进一步两两比较结果显示,男女患者在41 ~ 60岁与大于60岁这两个年龄段的构成比差异具有统计学意义(χ2= 14.602,P<0.001);在21 ~ 40岁与大于60岁这两个年龄段的构成比差异具有统计学意义(χ2= 10.686,P= 0.001);在0 ~ 20岁与41 ~ 60岁这两个年龄段的构成比差异具有统计学意义(χ2= 4.719,P= 0.03)。
2.2 风险信号检测结果
因为1份报告可能涉及多种ADR,故需要对ADR报告按照发生的ADR进行拆分。11988例ADR报告共拆分为18851对药物-ADR组合,其中神经系统ADR的相关组合为1573例(8.34%)。属于CNS、PNS的ADR分别为1347例(7.14%)、226例(1.20%),前者主要临床表现为头晕、头痛、震颤、癫痫、意识障碍等,后者则主要表现为感觉减退、感觉异常、肌肉不自主收缩、舌麻痹等。涉及FQNs品种14个,其中出现频次最高的前3种药物分别为左氧氟沙星(732例)、莫西沙星(354例)、加替沙星(213例),占所有神经系统ADR相关组合的82.58%,详见表3。
采用4种数据挖掘方法对神经系统ADR及CNS和PNS的ADR风险信号进行检测,在不限制A值大小的情况下,PRR法和ROR法检出的风险信号相同且最多,MHRA法检出的风险信号最少,PRR法、ROR法、MHRA法和BCPNN法分别检出风险信号7个、7个、3个、6个。发生例数在3例以上的药物-神经系统ADR组合的风险信号检测结果见表4,CNS和PNS的ADR风险信号检测结果见表5和表6。在神经系统ADR风险信号的检测方面,莫西沙星和氟罗沙星各生成了3个阳性信号,芦氟沙星生成了4个阳性信号;在CNS的ADR风险信号的检测方面,莫西沙星和芦氟沙星分别生成了3个和4个阳性信号;在PNS的ADR风险信号的检测方面,莫西沙星和氟罗沙星分别生成了2个和4个阳性信号。

表3 引发ADR频次最高的5种药物及主要临床表现Tab 3 Top 5 drugs of inducing ADR and major clinical manifestations

表4 神经系统ADR风险信号的检测结果Tab 4 Detection results of neurological disorders risk signal
3 讨论
3.1 患者性别与年龄因素
有研究表明,临床上女性比男性神经系统ADR的发生率高,45岁以下的患者发生率高于45岁以上的患者[9]。本研究结果与其一致,FQNs相关神经系统ADR的女性多于男性,男女比例为1 : 1.27,男女患者的年龄构成均以21 ~ 40岁的患者比例最高,分别为35.69%和40.22%,提示45岁以下的女性为FQNs相关神经系统ADR的多发人群。另外大于60岁的男女患者也占有较高的比例,分别为33.79%和24.32%,分析可能是随着老年患者肝肾功能减退引起的药物蓄积,以及可能的多种药物长期联合使用所致,因此老年患者应用FQNs期间的用药监护亦应重视。
3.2 神经系统ADR关联性品种及表现
本研究涉及的14种FQNs中,莫西沙星、氟罗沙星和芦氟沙星均生成了阳性信号,提示这3种药物和其他FQNs相比,与神经系统ADR的发生有更强的关联性。而引发神经系统ADR最多的左氧氟沙星并未生成阳性信号,说明其与神经系统ADR的关联性弱于上述FQNs。
基于美欧数据的研究中,氟罗沙星发生CNS相关ADR的概率最高,达9.0%,莫西沙星次之为5.4%[10]。而本研究中将神经系统ADR按照CNS和PNS分别检测所得的结果并不完全一致。如表5所示,12种药物中仅莫西沙星和芦氟沙星分别生成了3个和4个阳性信号,提示这两种药物与CNS的ADR的关联性高于其他FQNs。而表6中的9种药物中,莫西沙星和氟罗沙星分别生成了2个和4个PNS的ADR阳性信号,说明与其他FQNs相比,莫西沙星和氟罗沙星与PNS的ADR的关联性更高。因此氟罗沙星的神经系统ADR表现是否存在人种差异尚需进一步研究。
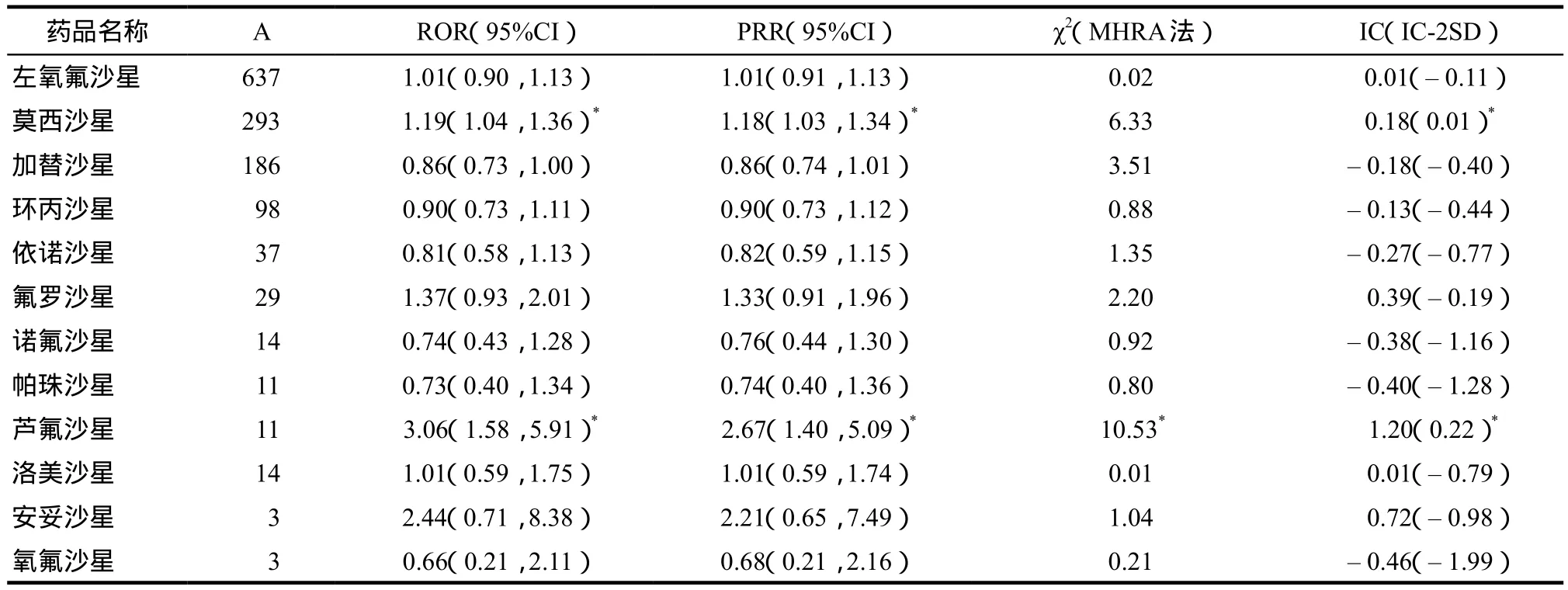
表5 CNS的ADR风险信号的检测结果Tab 5 Detection results of CNS ADR risk signal

表6 PNS的ADR风险信号的检测结果Tab 6 Detection results of PNS ADR risk signal
值得注意的是,4种方法中都检测到了芦氟沙星神经系统ADR信号,但分组研究中仅见其CNS相关ADR报告,显示芦氟沙星与CNS的ADR有很强的相关性,此外也可能与芦氟沙星使用相对较少有关。
3.3 ADR自发报告的风险信号研究
自发报告形式收集的ADR,较易出现漏报、跟风报告现象,且由于缺少用药人群数据,并不能得到ADR的实际发生率;但军队ADR数据库基于多年的全程电子化报告,数据质量相对较高[11],在此基础上利用数据挖掘技术对大量ADR监测数据开展风险信号检测,能够有效规避人工挖掘的高耗低效,快速检测到药物与某种ADR的风险关联性,对进一步开展真实世界的用药风险评价也具备更高的参考价值。本研究中,FQNs中的莫西沙星、氟罗沙星和芦氟沙星与神经系统ADR的发生有较高的关联性,提示临床医务人员在使用该类药物时,应当密切注意其神经系统ADR发生的症状和特征,及时停药并进行相应治疗。
此外,由于神经系统ADR临床表现具有多样性,且数据来源为自发报告形式,患者临床信息不够详细,难以准确判断较多病例中伴发的皮肤及其附件损害或胃肠道损害,是否PNS相关表现的ADR而可能会影响到分组和评级。
[1] CFDA.药品不良反应信息通报(第35期)关注喹诺酮类药品的不良反应[EB/OL].(2011-01-20)[2017-08-22].http://www.sfda.gov.cn/WS01/CL0078/57994.html.
[2] CFDA.药品不良反应信息通报(第58期)关注氟喹诺酮类药品的严重不良反应[EB/OL].(2013-11-21)[2017-08-22].http://www.sfda.gov.cn/WS01/CL0078/94324.html.
[3] CFDA.总局关于修订全身用氟喹诺酮类药品说明书的公告(2017年第79号)[EB/OL].(2017-07-05)[2017-08-22].http://www.sfda.gov.cn/WS01/CL1706/174528.html.
[4] 张婧媛,白羽霞,韩晟,等.数据挖掘方法检测药品不良反应信号的应用研究[J].药物不良反应杂志,2016,18(6):412-416.
[5] Evans SJ, Waller PC, Davis S. Use of proportional reporting ratios (PRRs) for signal generation from spontaneous adverse drug reaction reports[J]. Pharmacoepidemiol Drug Saf, 2001,10(6): 483-486.
[6] Wechwithan S, Suwankesawong W, Sornsrivichai V, et al. Signal detection for Thai traditional medicine: examination of national pharmacovigilance data using reporting odds ratio and reported population attributable risk[J]. Regul Toxicol Pharmacol, 2014,70(1): 407-412.
[7] Li C, Xia J, Deng J, et al. A comparison of measures of disproportionality for signal detection on adverse drug reaction spontaneous reporting database of Guangdong province in China[J]. Pharmacoepidemiol Drug Saf, 2008, 17(6): 593-600.
[8] Bate A, Lindquist M, Edwards IR, et al. A Bayesian neural network method for adverse drug reaction signal generation[J].Eur J Clin Pharmacol, 1998, 54(4): 315-321.
[9] 毛浩玉,游雪甫.喹诺酮类抗菌药不良反应及其机制研究现状[J].国外医药抗生素分册,2004,25(1):23-26.
[10] Ball P, Mandell L, Niki Y, et al. Comparative tolerability of the newer fl uoroquinolone antibacterials[J]. Drug Saf, 1999, 21(5): 407-421.
[11] 郭代红,陈超,马亮,等.2009 – 2013年军队医院67826例药品不良反应报告分析[J].中国药物应用与监测, 2014,11(5):300-304.
Analysis of fluoroquinolones related neurological adverse reactions based on data mining methods
YANG Hong-yi1, JIA Wang-ping2, GUO Dai-hong2, FAN Qi1, ZHAO Su-yu2(1. School of Pharmacy, Chongqing Medical University, Chongqing 400016, China; 2. Department of Pharmaceutical Care, PLA General Hospital, Beijing 100853, China)
Objective:Risk signals of fluoroquinolones-induced neurological adverse drug reactions were detected and analyzed to provide references for clinical medication.Methods:The ADR reports related to fl uoroquinolones were collected and analyzed from PLA ADR monitoring center. The risk signals of fl uoroquinolones-induced neurological adverse reactions, including central nervous system (CNS) adverse effects and peripheral nervous system (PNS) adverse effects, were assessed by 4 kinds of data mining methods including the proportional reporting ratio (PRR), the reporting odds ratio (ROR), combination χ2test-PRR measure of the Medicines and Healthcare Products Regulatory Agency (MHRA) and Bayesian Confidence Propagation Neural Network (BCPNN).Results:A total of 11988 reports from July 2008 to June 2017 were analyzed, among which 1322 reports were fluoroquinolones-induced neurological ADRs and 14 kinds of fl uoroquinolones were involved. The top five fluoroquinolones inducing neurological ADRs were levofloxacin, moxifloxacin, gatifloxacin, ciprofloxacin and enoxacin. Moxifloxacin, fleroxacin and rufloxacin generated significant ADR positive signals.Conclusion:Moxifloxacin, fleroxacin and rufloxacin were the most suspected drugs of the neurological ADRs among fluoroquinolones. The awareness of pharmacovigilance should be strengthened in clinic and some measures should be taken to guard patients against ADR.
R969.3
A
1672 – 8157(2017)05 – 0285 – 05
2014年全军后勤科研重点项目(BWS14R039)
郭代红,女,主任药师,硕士生导师,研究方向:临床药学与药物警戒。E-mail:guodh301@163.com;范琦,女,教授,硕士生导师,研究方向:药物分析。E-mail:fanqi787@cqmu.edu.cn
杨鸿溢,男,硕士研究生,研究方向:临床药学。
E-mail:yanghongyi94@163.com
2017-08-01
2017-09-12)
