不同碳源对粘性红酵母WP3生长及类胡萝卜素产量的影响
2017-10-24曹海宁邓小美
王 蓉,曹海宁,邓小美
(湖南环境生物职业技术学院医药技术学院,湖南 衡阳 421000)
不同碳源对粘性红酵母WP3生长及类胡萝卜素产量的影响
王 蓉,曹海宁,邓小美
(湖南环境生物职业技术学院医药技术学院,湖南 衡阳 421000)
研究了不同碳源及含量对粘性红酵母(Rhodotorula mucilaginosa)WP3生长及类胡萝卜素积累的影响。结果表明,在所研究的碳源中,葡萄糖有利于生长,而果糖有利于类胡萝卜素积累。在碳源含量为40 g/L,果糖和葡萄糖比例为7∶1,果糖含量为35 g/L,葡萄糖含量为5 g/L时,粘性红酵母WP3的生物量为7.94,类胡萝卜素产量达到556.84 μg/L,对粘性红酵母生长及类胡萝卜素合成有利。
碳源;粘性红酵母;生物量;类胡萝卜素;产量
类胡萝卜素是自然界分布广泛的天然色素,存在于微生物中,也存在于一些植物和动物资源中,已发现的类胡萝卜素种类多于600多种[1]。动物不能合成类胡萝卜素,类胡萝卜素主要的生物功能是抗癌和作为维生素前体[2]。一些微生物,包括细菌、藻类、霉菌和酵母都能够合成类胡萝卜素[3]。酵母比藻类、霉菌更适合生产类胡萝卜素,因为它们的单细胞特性和高生长速率[4]。酵母合成类胡萝卜素被大量环境和发酵参数影响,特别是培养基成分起了重要作用[5]。
一些酵母积累类胡萝卜素,如β-胡萝卜素、红酵母烯和红酵母红素,使它们呈黄、橙、红色,因此称为红酵母。红酵母属于子囊菌纲半子囊菌亚纲酵母目隐球酵母科红酵母亚科[6]。能生产类胡萝卜素的酵母菌主要有粘性红酵母(Rhodotorula mucilaginosa),粘红酵母(Rhodotorula glutinis)和红法夫酵母(Phaffia rhodozyma)[7]。产类胡萝卜素的酵母被认为无所不在,因为广泛分布在陆地、淡水和海洋环境中,能够利用各种底物。它们能够同化各种碳源(如葡萄糖、木糖、纤维二糖、蔗糖、甘油、山梨醇等)。国内许多学者也相继研究了红酵母,但主要研究红酵母的一些破壁方法、类胡萝卜素高产菌株的选育,而在红酵母发酵条件如培养基成分方面研究甚少。
本研究从不同碳源入手,应用单因素试验研究不同碳源和浓度对粘性红酵母(Rhodotorula mucilaginosa)WP3生物量和类胡萝卜素合成的影响,还对混合碳源的比例影响进行了探究。在可控条件下得到粘性红酵母(Rhodotorula mucilaginosa)WP3类胡萝卜素发酵的最佳碳源,提高类胡萝卜素产量。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
粘性红酵母(Rhodotorula mucilaginosa)WP3:广西科技大学化学工程与技术学院实验室保存[8]。
1.1.2 试剂
葡萄糖、果糖、蔗糖、麦芽糖、甘油(均为分析纯):国药集团化学试剂公司;类胡萝卜素标准品(纯度>99%):上海赛弗生物科技有限公司;所用其他试剂均为国产分析纯。
1.1.3 培养基
斜面培养基:酵母粉10g/L,蛋白胨20g/L,葡萄糖20g/L,琼脂20 g/L,pH自然。
MS3培养基:葡萄糖30g/L,酵母粉1.5g/L,NH4NO35g/L,KH2PO41 g/L,MgSO4·7H2O 0.4 g/L,NaCl 0.4 g/L,补足自来水[9]。
MS3-A培养基:酵母粉1.5 g/L,NH4NO35 g/L,KH2PO41 g/L,MgSO4·7H2O 0.4 g/L,NaCl 0.4 g/L,补足自来水。
1.2 仪器与设备
JJ200电子天平:常熟市双杰测试仪器厂;DMB5Motic数码显微镜:麦克奥迪实业集团有限公司;LRH-250-Ⅱ生化培养箱:广西省医疗器械厂;HWY-2112全温度恒温调速摇床柜:上海智城分析仪器制造有限公司;AB104-N电子分析天平:梅特勒-托利多仪器(上海)有限公司;UV-1100紫外可见分光光度计:上海美普达仪器有限公司;XB-K-25血球计数板:广西南宁融仪实验仪器有限公司。
1.3 方法
1.3.1 菌种的保藏
配制斜面培养基,加热然后分装灭菌,摆出斜面,将菌种粘性红酵母(Rhodotorula mucilaginosa)WP3接入斜面,28℃培养2 d,然后置于4℃冰箱保存,一个月活化一次[10]。
1.3.2 种子的培养
取一环生命力旺盛的斜面种子接于装有50 mLMS3培养基的150 mL锥形瓶中,30 ℃、150 r/min[11]培养3 d,取此培养液5 mL接于装有50 mL MS3培养基的150 mL锥形瓶中,30℃、150 r/min再次培养3 d,取发酵液离心得细胞沉淀,细胞重悬于无菌水中,用血球计数板计数,使接种量达到107个/mL。
1.3.3 摇瓶培养
按接种量107个/mL将种子液接入装有300mL发酵培养液的500 mL锥形瓶中,30℃、150 r/min培养7 d。每次做3组平行实验[12]。
1.3.4 生物量的测定
取细胞分散均匀的发酵液,离心去上清液,加等体积的水,重悬,用UV-1100紫外可见分光光度计测细胞悬浮液的吸光度值A600nm[13]。
1.3.5 比生长速率的计算
比生长速率指的是在单位时间内单位质量的菌体所增加的菌体量,它是表征微生物生长速率的一个参数,也是发酵动力学中的一个重要参数,其计算公式如下[14]:

式中:μ为连续培养时间内的比生长速率,h-1;N1及N0分别为培养时间为t1和t0时红酵母细胞的密度,即为生物量A600nm。
1.3.6 类胡萝卜素的提取
取20 mL培养7 d的发酵液6 000×g离心5 min,得湿菌体,弃上清,水洗沉淀,加4 mL 5 mol/L盐酸振荡1 h,沸水浴4 min,离心去除盐酸,加水重悬,离心弃上清液,沉淀加丙酮混匀,离心收集上清液,重复此步骤直到上清液无色,将几次所提的丙酮上清液混合为提取液,将其转移到装有石油醚(沸程为60~90℃)的分液漏斗中,通过缓慢添加超纯水(防止乳化)除去丙酮,再弃水相,这个过程重复4次,直到丙酮相不再含色素得到的提取液为测定液[15]。
1.3.7 类胡萝卜素产量的测定
石油醚提取液在最大吸收波长450 nm处测定吸光度值[16],总的类胡萝卜素含量计算公式如下[15]:

式中:V为定容后总类胡萝卜素提取液体积,mL;A为波长450 nm处的吸光度值;消光系数A1%1cm表示在最大吸收峰450 nm处的光通过1 cm光径、盛有1%类胡萝卜素标准品溶液的比色杯,测得的光密度,为3次所测的平均值;P为提取所用发酵培养液体积,mL。
2 结果与分析
2.1 不同初始pH值对细胞生长和类胡萝卜素合成的影响
配制MS3培养基,装液量为300 mL/500 mL,调节初始pH值分别为4.0、5.0、5.5、6.0、6.5、7.0、7.5、8.0,接种WP3至培养基中至细胞浓度为107个/mL,30 ℃、150 r/min培养7 d[4],最后取样测类胡萝卜素含量和细胞生物量,结果见图1。

图1 初始pH值对粘性红酵母WP3生物量和类胡萝卜素积累的影响Fig.1 Effect of initial pH on the biomass ofR.mucilaginosaWP3 and the accumulation of carotenoids
由图1可知,粘性红酵母WP3能在初始pH值4.0~8.0的范围内生长并合成类胡萝卜素,培养基的pH值不仅影响类胡萝卜素的合成,还影响细胞生长速率[17]。随着初始pH值在4.0~7.5范围内的增长,生物量逐渐增长,在pH值为7.5时,生物量达到最大,pH值>7.5之后,生物量开始下降,而最大的类胡萝卜素含量也在pH值7.5处获得,pH值小于或大于7.5,类胡萝卜素含量明显下降。因此pH值7.5为最优pH值。本实验结果和AKSUZ等[17]研究的最优pH值7.0相近。
2.2 培养过程中pH值的变化
配制MS3培养基,装液量为300 mL/500 mL,调节初始pH值为7.5,接种WP3至培养基中至细胞浓度为107个/mL,30℃、150 r/min培养7 d,每隔24 h测一次pH值,观察其变化情况,结果见图2。

图2 培养过程中pH值的变化Fig.2 Change of pH value in the process of cultivation
由图2可知,可将红酵母的发酵分为两个阶段,第一阶段是从0~4 d,红酵母主要利用培养基中的葡萄糖,通过糖酵解和柠檬酸循环途径进行初级代谢,代谢分泌出有机酸等酸性物质,使培养基pH值下降,因而前4天pH值呈下降趋势,4 d后培养基中葡萄糖含量不足,于是红酵母进入过渡期,一方面利用葡萄糖,一方面利用第一阶段分泌出的有机酸,有机酸被利用,于是pH值回升,进入发酵的第二阶段,随后进入稳定期,培养基pH值也比较稳定,表现为第6天、第7天pH值变化不大,因而可根据pH值的变化监测发酵程度。
2.3 培养过程中生物量和类胡萝卜素含量的变化
配制MS3培养基,装液量为300 mL/500 mL,调节初始pH值为7.5,接种WP3至培养基中至细胞浓度为107个/mL,30℃、150r/min培养7d,每隔24h测一次类胡萝卜素含量和细胞生物量,观察其变化情况,结果见图3。
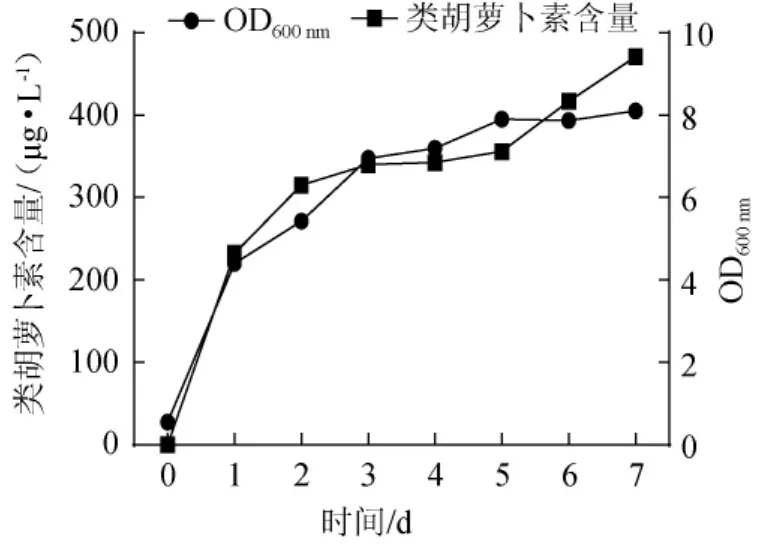
图3 培养过程中粘性红酵母WP3生物量和类胡萝卜素积累的变化Fig.3 Changes of the biomass ofR.mucilaginosaWP3 and accumulation of carotenoids in the process of cultivation
由图3可知,红酵母发酵在第5天后进入稳定期,在最后培养的2d内OD600nm几乎不增加(仅增加0.21)。类胡萝卜素是次级代谢产物,基本在细胞生长的稳定期形成,因而类胡萝卜素在培养时间内一直增加,稳定期时类胡萝卜素积累加快,7d发酵结束时,类胡萝卜素含量最大,为471.0007μg/L。由此变化与pH值变化联系起来可监测发酵阶段。
2.4 不同碳源对细胞生长和类胡萝卜素合成的影响
配制MS3-A培养基,分别加入不同碳源(葡萄糖、果糖、蔗糖、麦芽糖、甘油)各30 g/L,调节pH值为7.5,装液量为300 mL/500 mL,接种菌株WP3至培养基中至细胞浓度为107个/mL,30 ℃、150 r/min培养7 d,每间隔24 h取样测生物量,发酵结束后取样测类胡萝卜素含量,结果分别见图4和图5。

图4 不同碳源对粘性红酵母WP3生物量的影响Fig.4 Effects of different carbon sources on the biomass of R.mucilaginosaWP3
由图4可知,在0~3 d,随着时间的增长,细胞生物量不断增大,随后生物量逐渐趋于稳定,细胞生长进入稳定期。加入不同碳源,细胞生物量变化不一致,以麦芽糖和甘油为碳源时细胞生长最差,7 d后生物量最低,分别为6.06和5.92,平均比生长速率只达到0.015 5 h-1和0.015 2 h-1,在实验浓度30g/L时,甘油不利于红酵母的生长,这与JOHNSON A等[18]的研究红酵母对甘油的利用能力较弱结果一致,而利用其他碳源,菌株WP3都有一个好的长势,同时观察到在以葡萄糖为碳源的情况下细胞生长最好,7 d后生物量为8.11,平均比生长速率达到0.017 2 h-1,而蔗糖和果糖7 d后的生物量分别为7.90和7.78,平均比生长速率为0.0167h-1和0.016 3 h-1,虽然蔗糖的最大比生长速率达到0.099 0 h-1,大于葡萄糖,但总体上生长还是比葡萄糖差,因此最利于菌株WP3生长的碳源是葡萄糖。

图5 不同碳源对类胡萝卜素积累的影响Fig.5 Effects of different carbon sources on the accumulation of carotenoids
由图5可知,在以果糖为碳源的情况下获得了最大类胡萝卜素含量,为496.399 0 μg/L,以蔗糖为碳源产量紧随其后,为484.986 0 μg/L,而以葡萄糖为碳源时细胞生长最好,因此最佳碳源为果糖,而葡萄糖最利于细胞生长。这个结果和LATHA B V等[19]实验中得出粘红酵母DFR-PDY在以果糖为碳源时获得了最大类胡萝卜素产量,在以麦芽糖为碳源时类胡萝卜素产量很低的结论一致。
2.5 碳源条件两对细胞生长和类胡萝卜素合成的影响
配制MS3-A培养基,分别加入果糖10g/L、20g/L、30g/L、40g/L、50g/L,调节pH值为7.5,装液量为300mL/500mL,接种WP3至培养基中至细胞浓度为107个/mL,30℃、150r/min培养7 d,最后取样测总类胡萝卜素含量和生物量,结果见图6。

图6 果糖含量对粘性红酵母WP3生物量和类胡萝卜素积累的影响Fig.6 Effect of fructose concentration on the biomass of R.mucilaginosaWP3 and the accumulation of carotenoids
由图6可知,果糖含量在10~40 g/L时,类胡萝卜素含量随初始果糖含量增加而增加;果糖含量达到40 g/L时,类胡萝卜素含量和生物量达到最大值,分别为520.6723 μg/L和7.86;果糖含量>40 g/L时,类胡萝卜素产量随果糖含量增加而减少,可能是过高的果糖含量不利于其发酵。因此最佳果糖含量为40 g/L。
2.6 混合碳源对细胞生长和类胡萝卜素合成的影响
以上述实验为基础,葡萄糖为碳源时最利于粘性红酵母WP3的生长,而果糖为碳源时最利于菌株WP3的类胡萝卜素的合成,从菌株WP3对碳源的利用情况来看,要提高类胡萝卜素产量需从两方面下手,一方面促进细胞生长,另一方面提高类胡萝卜素含量,因此用果糖,葡萄糖来进行混合发酵。
配制MS3-A培养基,加入果糖∶葡萄糖分别为0∶1、1∶7、1∶3、1∶1、3∶1、7∶1、1∶0混合碳源40 g/L,调节pH值为7.5,装液量为300 mL/500 mL,接种菌株WP3至培养基中至细胞浓度为107个/mL,30 ℃、150 r/min培养7 d,最后取样测类胡萝卜素含量和生物量,结果见图7。
由图7可知,当果糖与葡萄糖的比例为7∶1时,即类胡萝卜素含量达到最大,为556.8413μg/L,高于葡萄糖和果糖单独作为碳源时的类胡萝卜素产量(分别为476.144 7 μg/L、520.672 3 μg/L)。结果表明,使用果糖∶葡萄糖为7∶1的混合碳源更好,果糖最利于类胡萝卜素合成,葡萄糖最利于粘性红酵母WP3的生长,使用此比例混合碳源产量更高,说明果糖和葡萄糖之间可能存在交互作用。

图7 不同比例果糖和葡萄糖混合对粘性红酵母WP3生物量和类胡萝卜素积累的影响Fig.7 Effects of fructose and glucose ratio on the biomass of R.mucilaginosaWP3 and the accumulation of carotenoids
3 结论
本研究从培养基成分中的不同碳源入手,研究了不同碳源对粘性红酵母WP3生物量和类胡萝卜素合成的影响,结果表明,不同碳源对粘性红酵母WP3细胞生长和类胡萝卜素合成有显著影响,确定类胡萝卜素合成最佳碳源为果糖,最利于细胞生长的碳源为葡萄糖,最佳碳源含量为40 g/L,果糖和葡萄糖最佳混合比例为7∶1,即果糖含量为35 g/L,葡萄糖含量为5 g/L时,粘性红酵母WP3的生物量为7.94,类胡萝卜素产量达到最高,为556.841 3 μg/L。
[1]YEHIA H M,AL-OLAYAN E M,ELKHADRAGY M F,et al.Improvement of carotenoid pigments produced byRhodotorula glutinis[M].Epigenetics in Human Disease.Elsevier Inc.2013:28-47.
[2]BANZATTO D,FREITA L A D,MUTTON M J R.Carotenoid production byRhodotorula rubracultivated in sugarcane juice,molasses,and syrup[J].Food Sci Technol,2013,33(Supl.1):14-18.
[3]FRENGOVA G I,BESHKOVA D M.Carotenoids fromRhodotorula andPhaffia:yeasts of biotechnological importance[J].J Ind Microbiol Biotechnoly,2009,36(2):163-180.
[4]VOAIDES C,DIMA R.Effect of carbon source on carotenoid production byRhodotorulasp.[J].Archiva Zootechnica,2011,17(5):7570-7576.
[5]FERRAO M,GARG S.Studies on effect of media components on growth and α-caroteneproduction byRhodotorula graminisRC04[J].J Cell Tissue Res,2011,11(1):2551-2556.
[6]张 闯,张玉苍,何连芳.不同微生物生产类胡萝卜素的研究现状[J].食品研究与开发,2011,32(2):179-183.
[7]FRENGOVA G I,BESHKOVA D M.Carotenoids fromRhodotorulaand PhaYa:yeastsofbiotechnologicalimportance[J].J Ind Microbiol Biotechnol,2009,36:163-180.
[8]王 蓉,伍时华,赵东玲,等.一株能产类胡萝卜素的粘性红酵母的分离与鉴定[J].中国调味品,2015,40(4):16-20.
[9]MIHALCEA A,UNGUREANU C,FERDES M,et al.The influence of operating conditionson the growth of the yeastRhodotorula rubraICCF 209 and on torularhodin formation[J].Rev De Chim,2011,62(6):659-665.
[10]朱明军,浦跃武,吴海珍,等.不同碳源及其浓度对红发夫酵母培养的影响[J].华南理工大学学报:自然科学版,2002,30(4):77-80.
[11]仓一华,陆 玲,王 伟,等.一株高产类胡萝卜素酵母Rhodotorrula.sp 色素组分及摇瓶发酵研究[J].食品科学,2002,23(5):34-37.
[12]石 群,张庆芳,杨丽娜,等.肌酐水解酶菌株S-09发酵条件优化及酶的分离纯化[J].中国酿造,2017,36(4):20-25.
[13]CATALINA V,DIMA R.The effect of nitrogen source on carotenoids production byRhodotorulasp[J].Roman Biotechnol Lett,2012,17(5):7570-7576.
[14]梁 英,孙明辉,刘春强,等.营养盐输入方式对3种微藻生长及种间竞争的影响[J].中国海洋大学学报:自然科学版,2014,44(12):21-27.
[15]DE CARVALHO L M J,GOMES P B,GODOY R,et al.Total carotenoid content,α-carotene and β-carotene,of landrace pumpkins(Cucurbita moschataDuch):Apreliminarystudy[J].Food Res Int,2012,47(2):337-340.
[16]魏 华,魏 春,汪 钊.Sporidiobolus pararoseusWZ012产类胡萝卜素发酵条件的优化[J].食品科技,2012,37(8):22-26.
[17]AKSU Z,EREN A T.Carotenoids production by the yeastRhodotorula mucilaginosa:Use of agricultural wastes as a carbon source[J].Process Biochem,2005,40(9):2985-2991.
[18]JOHNSON E A,HWAN A G.Astaxanthin from microbial sources[J].CRC Crit Rev Biotechnol,1991,4(11):297-326.
[19]LATHA B V,JEEVARATNAM K,MURALI H S,et al.Influence of growth factors on carotenoid pigmentation ofRhodotorula glutinisDFRPDY from natural source[J].Indian J Biotechnol,2005,4(4):353-357.
Effects of different carbon sources onRhodotorula mucilaginosaWP3 growth and carotenoids production
WANG Rong,CAO Haining,DENG Xiaomei
(School of Medicine Technology,Hunan Polytechnic Institute of Environmental Biology,Hengyang 421000,China)
The effects of different carbon sources and contents on the growth ofRhodotorula mucilaginosaWP3 and the accumulation of carotenoids were researched.The results showed that in the carbon sources studied,glucose was the most beneficial to cell growth,while fructose was the most beneficial to the accumulation of carotenoids.In the conditions of carbon sources 40 g/L,fructose and glucose ratio 7∶1(fructose 35 g/L and glucose 5 g/L),the biomass ofR.mucilaginosaWP3 was 7.94 and carotenoids yield was up to 556.84 μg/L,which indicated that the conditions were beneficial to the growth ofR.mucilaginosaand the accumulation of carotenoids.
carbon source;Rhodotorula mucilaginosa;biomass;carotenoids;production
TS219
0254-5071(2017)09-0132-05
10.11882/j.issn.0254-5071.2017.09.029
2017-06-07
王 蓉(1989-),女,助教,硕士,研究方向为化学工程与技术。
