茎瘤芥(榨菜叶)中硫苷酶基因的酶活性研究
2017-10-23张燕,李瑶
张 燕,李 瑶
(长江师范学院生命科学与技术学院,重庆 涪陵 408100)
茎瘤芥(榨菜叶)中硫苷酶基因的酶活性研究
张 燕,李 瑶
(长江师范学院生命科学与技术学院,重庆 涪陵 408100)
【目的】异硫代氰酸盐(Isothiocyanates,ITCs)具有抗癌和植物杀虫剂的作用,为解决天然硫苷酶提取复杂、费用昂贵等问题,【方法】本研究采用RT-PCR法扩增硫苷酶的关键基因MYR1,通过构建硫苷酶表达载体,并在毕赤酵母中进行体外诱导表达,以获得外源硫苷酶。将从榨菜叶中提取的总RNA,通过SalI酶切,插入pPIC9K-S表达载体构建重组子。在YPD培养基中菌体悬浮培养至OD600为1左右,更换BMMY培养基进行诱导表达72 h。【结果】提取菌液进行SDS-PAGE电泳检测分析,发现表达蛋白的分子量为90 KDa左右,经诱导表达,Ni柱纯化后,得到纯度为85 %的硫苷酶融合蛋白,产率约850 U/L。硫苷酶融合蛋白以sinigrin为底物,运用HPLC测得蛋白的比活力约等于0.003 U/μl。【结论】采用在毕赤酵母中进行体外诱导表达,以获得外源硫苷酶,对硫苷酶活性最佳条件进行筛选和确认,为扩增和签定硫苷酶活性等技术提供重要参考。
MYR1;硫苷酶;质粒构建;表达
【研究意义】硫苷酶即硫代葡萄糖苷酶主要存在于十字花科植物中,水解硫苷产生异硫代氰酸盐、葡萄糖、硫代氰酸盐等物质,具有有较好的抗癌功效[1-2]。【前人研究进展】近年来国内外学者主要以萝卜、油菜、拟南芥、芥菜、西兰花等为材料,对硫苷酶的性质、功能、基因克隆等方面做了相关的研究[3[4]。【本研究切入点】由于硫苷酶以同工酶的形式存在,这些同工酶由于糖基化的程度不同导致其物理性质、化学性质不同[4],要获得大量异硫代氰酸酯等抗癌物,需要更多外源性硫苷酶[5]。硫苷酶在植物体内含量比较少,获取较多的硫苷酶很难实现[6]。重庆涪陵盛产榨菜,利用此优势,对榨菜硫苷酶基因的研究,加大对榨菜叶的充分利用和生产中的优质榨菜产品的创新过程中提供一定依据。【拟解决的关键问题】 硫苷酶至少有3种类型的编码基因家族:MA(Myr1,TGG1)、MB(Myr2,TGG2)、MC(Myr3,TGG3)[7-8],本研究旨在通过利用RT-PCR法扩增榨菜叶中的硫苷酶基因MYR1,并构建表达载体进行异源表达,进而产出大量外源酶降解硫苷,为进一步的抗癌研究奠定基础。
1 材料与方法
1.1 材料
榨菜[Brassicajuncea(L.) Czern.et Coss.var.tumida Tsen et Lee],储藏期3年,由重庆市涪陵绿原农业科技发展公司提供。大肠杆菌DH10B,工程菌SMD1168,表达载体pPIC9K为NEB公司产品。无RNase H2O、灭菌石蜡油、1×TAE缓冲液、1×TBE缓冲液、平衡缓冲液、洗脱缓冲液、6×loading buffer、GoldviewTM核酸染料、RNase 抑制剂、dNTP Mix、AMV反转录酶、10×PCR Buffer、MgCl2、DNA聚合酶、琼脂糖。以上试剂购自上海生物工程有限公司。限制性核酸内切酶EcoR I,NotI为NEB公司产品。 Oligo dt Primer、上、下游引物(由上海生工生物工程有限公司合成),AMV第一链cDNA合成试剂盒、胶回收试剂盒等为上海生工生物工程有限公司产品,小提中量试剂盒为北京天根公司产品,冷冻离心机、电泳仪、凝胶成像系统、PCR仪、冰箱、超低温冰箱、恒温空气摇床、层析柱和纯化设备。
1.2 叶片总RNA的提取和cDNA合成
取0.5 g新鲜榨菜叶在液氮中快速研磨至粉末,放入盛有0.5 mL Trizol的RNase-free离心管中(置于冰上),剧烈振荡混匀;室温静置10 min,4 ℃,7200 r/min,离心25 min,吸取上清液;加入1 mL CHCl3和1 mL 5 mol/L NaCl溶液,剧烈振荡后静置3 min;4 ℃,7200 r/min,离心25 min,这时样品会分成3层,取上清;加入2.5 mL 异丙醇,静置10 min,4 ℃,7200 r/min离心20 min;去上清,加5 mL乙醇,离心5 min,弃上清;待乙醇挥发完全后加0.25 mL DEPC水溶解沉淀, -80 ℃保存。
取4 μl RNA在1 %琼脂糖凝胶进行电泳检测。体系(12 μl): 2 μl总RNA,1 μl Oligo dt Primer(0.5 μg/μl),RNase free ddH2O。4000 r/min 离心2 min,65 ℃ 水浴5 min,静置30 s并离心2 min,在上述体系中再次加入以下组分:4 μl 5×Reaction bμffer,1 μl RNase Inhibitor(20 Μ/μl),2 μl DNTP Mix(10 mmol/l),2 μl AMV Reverse Transcriptase(10 Μ/μl),混匀后离心2 min,在PCR仪上进行反转录反应,42 ℃反应60 min,85 ℃反应5 min后置于-20 ℃冰箱中保存。
1.3 PCR反应
选取油菜、芥菜等植物硫苷酶基因的核苷酸序列同源性较高的区域,以cDNA为模板进行PCR反应。体系(50 μl): 5 μl 10×PCR Buffer,5 μl dNTP,2 μl上引物1,2 μl上引物2,2 μl 下引物,4 μl MgCl2,1 μlTaqDNA聚合酶。上引物1:5’-gatCCGGTTCTGGCGAATTCGACGACGACGACAAGGATGAA GAAATCAC -3’,上引物2:5’ CGACGACGACAAGGATGAAGAAATCACATGTGAAGA AAATAACC-3’,下引物:5’-GGCGAATTAATTCGCGGCCGCTTATTAAGCATCTGCGAAACGCTTCTT TTG-3’,加入模板cDNA 2 μl,加水至终体积为50 μl,并将混合液混匀,离心2 min,热循环条件如下:94 ℃ 5min,94 ℃ 1min,50 ℃ 30 s,72 ℃ 2 min,72 ℃ 10 min,35cycle,PCR产物用琼脂糖凝胶电泳检测,并回收纯化。然后以此为模板进一步扩增获得硫苷酶基因的全长序列。
1.4 载体的构建,鉴定与表达
用EcoR I和NotI对质粒进行双酶切,反应混合液在37 ℃条件下酶切过夜,并电泳检测,回收和纯化载体pPIC9K-S,将硫苷酶基因与已酶切表达载体进行杂交,杂交体系与反应条件如下:5 μl杂交混合液,6 μl MYR1,8 μl pPIC9K-S,1 μl ddH2O,25 ℃反应30 min后,将10 μl连接产物转化至DH10B感受态细胞当中,37 ℃培养18 h。利用PCR鉴定和Western Blotting手段筛选出阳性克隆菌并送DNA 测序鉴定。鉴定正确后提取质粒pPIC9K-S-myr1,并用SalI单酶切线性化处理后,电转化至感受态细胞SMD1168,立即加入1 mL冰冷的1 M山梨醇,将稀释后的细胞移入试管中,混匀,细胞30 ℃培养1 h,在MD板涂布培养。30 ℃培养3~6 d,利用遗传霉素筛选出抗性转化子,挑取单克隆至3 mL YPD培养基培养,28 ℃ 振摇培养(300 r/min)到OD600值为2~6。接种至含250 mL BMGY的摇瓶中,28~30 ℃剧烈振荡,至对数生长期测OD600值为2~6,收集细胞,离心去除上清,用 BMMY重悬细胞进行诱导表达。在每个摇瓶中加入400 mL的上述培养物,加盖4层灭菌纱布,放入摇床培养。第2天加甲醇至1 %,之后每诱导24 h加甲醇至1 %。72 h收集上清。
1.5 融合蛋白的纯化和活性鉴定
用2倍柱体积的平衡缓冲液以15 mL/min的流速平衡Ni2+柱,将发酵液以10 mL/min的流速上样。用平衡缓冲液洗涤5~10个柱体积直至流出基线水平,用洗脱缓冲液进行洗脱,收集硫苷酶融合蛋白流出峰,电泳检测。同时按表1的反应体系分别加入相应的试剂于45 ℃水浴反应10 min,随后立即将反应液于100 ℃沸水浴中灭活10 min,冷却后进行HPLC分析测定。
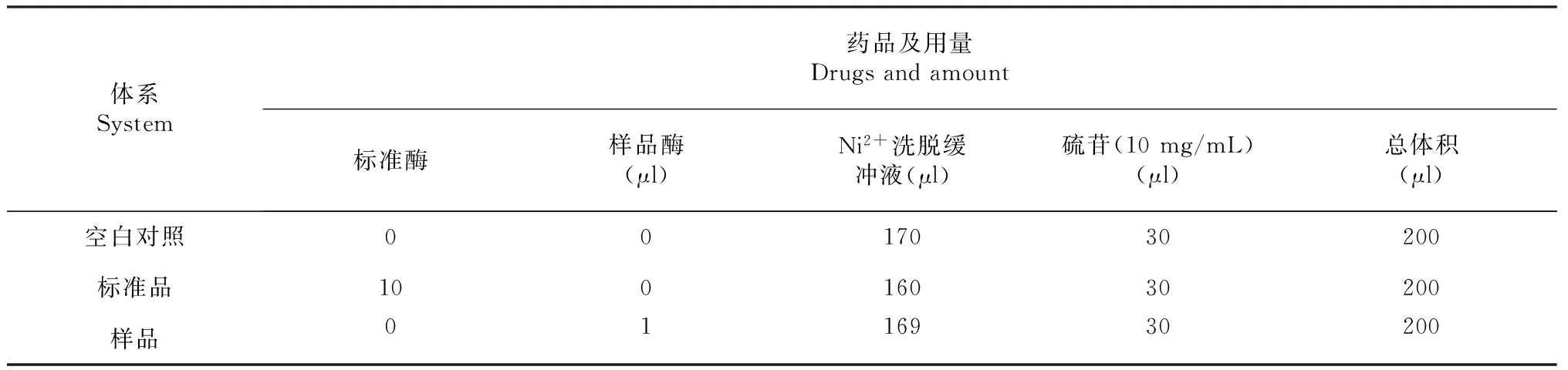
表1 反应试剂Table 1 Reaction reagent
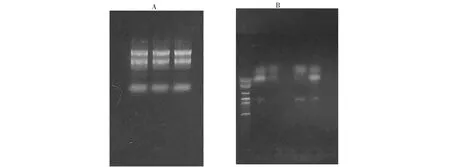
图1 榨菜叶总RNA电泳和PCR 扩增Fig.1 RNA electrophoresis and PCR amplification product
2 结果与分析
2.1 榨菜叶总RNA的电泳和硫苷酶基因的扩增结果
由图1-A可知,RNA的28S条带与18S条带相比亮度约为2∶1,证明RNA提取成功;由图1.B可以看出,已经扩增出的目的条带颜色淡,还出现少量引物二聚体,可能是由于退火温度高,循环次数少,造成引物与引物之间进行配对扩增。以此为模板扩增全长序列并送到上海生工公司测序,获得的硫苷酶基因全长为1587 bp。
2.2 DNA和氨基酸序列比对
将获得的芥蓝黑芥子酶基因全长cDNA序列及其编码的氨基酸序列在NCBI网站上BLAST,结果表明该序列与芥蓝、欧洲油菜、菜心、大白菜、萝卜的硫苷酶基因的同源性比较分别是98 %、97 %、96 %、96 %、95 %的相似性。在氨基酸水平上,与芥菜(Brassica juncea,AAG54074.1)、欧洲油菜(BrassicanapusABQ42337.1)、菜心(Brassicarapavar.Parachinensis,AAX68547.1)、大白菜(Brassicarapasubsp.Pekinensis,AAV80206.1)分别有88 %、98 %、98 %、98 %的相似性(图2)。

图2 硫苷酶基因序列推导出的氨基酸序列Fig.2 Deductive amino acid sequence of myrosinase gene

图3 氨基酸比对结果Fig.3 Amino acid ratio on the results
2.3 融合蛋白表达结果检测
图3表明,经过72 h培养后,可溶性蛋白成功诱导并表达,大小约为 90 KD。同时,通过Western blotting 技术手段也验证出相同的结果(图4),6个阳性菌株(1R,1N,2R,2N,3R,3N)表明目的基因成功转入载体中,且蛋白的大小也与硫苷酶分子量的预期值相符,并为后续蛋白纯化试验作了充足的准备。
2.4 融合蛋白的纯化活性测定
经过Ni柱纯化得到一系列的蛋白经SDS-PAGE凝胶电泳可以看出,硫苷酶融合蛋白成功获得(图5),经过纯化的融合蛋白在凝胶上有1条90 KDa的条带,由图6可得,在45 ℃条件下,纯化过后的目的蛋白硫苷酶粗蛋白对硫苷发挥了一定的水解能力,表现出硫苷酶的生物活性,而将样品与标准样品所对比发现,样品的硫苷峰面积同加入0.5 U酶标准品的硫苷峰面积较为接近,因此样品中的硫苷酶比活力约为0.03 U/μl。与前人所做的效果比较,发现本次实验所得蛋白的活性比较低,可能的原因如下:第一,所得的粗蛋白的空间构象发生了改变,有一部分的蛋白没有形成可溶性蛋白,而是形成了包涵体。第二,可能是重组子的表达条件没有设定好,本次实验条件是在OD600=1的条件下进行诱导,并且诱导时间偏长。第三,就是硫苷酶本身就不是很稳定,因此在实验中会损失一部分,造成实验结果有所差异。

M: Marker;S: Secretion图4 硫苷酶的表达Fig.4 Expression of myrosinase

M:Marker,P:Positive control,R:Reducing,N:Non-reducing图5硫苷酶表达的免疫印迹试验Fig.5 Western blot of myrosinase
3 讨 论
硫苷酶是十字花科植物中重要的酶,能够降解硫苷生成各种物质,比如葡萄糖、异硫代氰酸盐。同时这些物质在植物中在防御害虫的方面起到的作用是毋容置疑的,然而最为引人注目的就是异硫代氰酸盐的抗癌作用[9-10]。同时,近年来硫苷酶基因的异源表达研究越来越受到关注,主要原因是硫苷酶在植物体内的含量非常少,所以在植物中直接提纯硫苷酶工艺手段上具有一定的难度。天然硫苷酶具有糖基化修饰作用,原核表达产物缺乏硫苷酶活性,因此糖基化修饰对于硫苷酶酶活性有很大影响[11]。
毕赤酵母是近年来发展起来的新型表达体系,是目前最为成功的外源蛋白表达系统之一,在表达产物的加工、外分秘、翻译、修饰以及糖基化等方面具有有很大的优势和前景,并表现出较好的生物学活性[12]。 毕赤酵母具有醇氧化酶AOX1基因启动子,它能在以甲醇为唯一碳源的培养基中快速生长,蛋白表达量占总蛋白的90 %,这点对于蛋白的纯化提供了良好的基础。不同蛋白虽然在毕赤酵母中的表达水平差异较大,但都比在其他细胞中的表达水平高。到目前为止,研究者们提取了大多数的十字花科蔬菜(比如,芥菜、甘蓝、油菜)中的硫苷酶基因并对其研究已经深入[13]。而对榨菜叶片中硫苷酶的基因研究相对较少,这也是本次实验创新之处。本实验将MYR1基因克隆到毕赤酵母表达载体中进行表达,分蛋白子量为90 KDa,通过纯化后以Sinigrin为底物测定重组蛋白的生物学活性,在45 ℃条件下,重组子所表达的蛋白能够水解硫苷,表现出了硫苷酶的生物活性,比活力约为0.003 U/μl。而张盛敏等人通过克隆拟南芥硫苷酶基因并在大肠杆菌中表达获得了重组蛋白,其分子量为78 KDa[14],而本实验获得的重组蛋白分子量略大于该重组蛋白。可能是两者的硫苷酶基因具有类似的翻译后加工。另外与肖海燕等的实验结果相比[15],获得的重组蛋白大小相似、比活力接近。

M: Marker;S: Sample before loading (with 20 mM imidazole);FT: Flowthrough;E: Elution by 20 mM Tris,300 mM NaCl,300 mM imidazole,pH 8.0;R: Reducing conditions;N: Non-reducing conditions图6 融合蛋白的纯化结果Fig.6 Purification of myrosinase
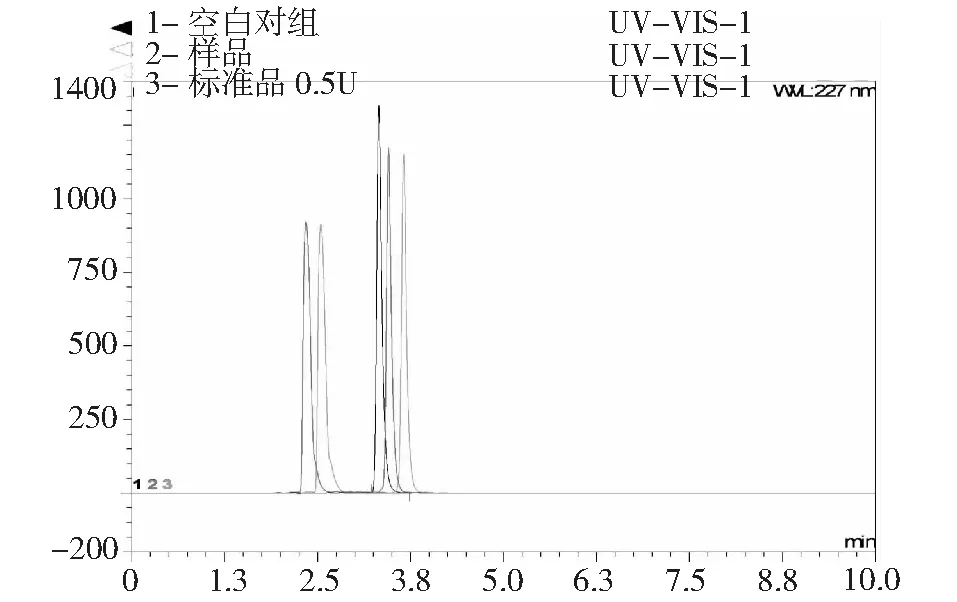
图7 样品酶的活性测定Fig.7 The activity determination of the sample
4 结 论
目前,国内研究者通常从甘蓝、油菜、芥菜中提取硫苷酶基因并克隆到大肠杆菌中进行表达,本实验首次从榨菜叶中提取硫苷酶基因并克隆到毕赤酵母SMD1168菌株中进行诱导表达,获得了酶活性。虽然获得的酶比活力还不是很高,但发现其对菌株的生长没有影响,为以后进一步提高工程菌硫苷酶的产量和活性提供了资料,为大量获得异硫代氰酸盐及其在抗癌方面的应用提供了理论基础。
[1]袁高峰,陈思学,汪俏梅.芥子油苷及其代谢产物的生物学效应研究与应用[J].核农学报,2009,23(4):664-668
[2]Hartel F V,Brandt A.Characterization of abrassicanapusmyrosinase expressed and secreted byPichiapastoris[J].Protein Expression and Purification,2002,24:221-226.
[3]梁锦峰.萝卜硫素抗肿瘤活性研究及其关键酶myrosinase基因的克隆表达[A].浙江工商大学,2009: 24-26.
[4]张学杰,樊守金,孙稚颖,等.中国十字花科植物系统分类近期研究进展[J].武汉植物学研究,2003(3):267-272.
[5]刘月萍,王向阳.硫苷酶研究进展[J].生物技术通报,2006,17(5):837-839.
[6]谢丽雪.芥蓝黑芥子酶基因的克隆与原核表达[D].2007:17-18.
[7]庞道标,吴宇佳.植物芥子酶研究进展[J].生命科学研究,2007,11(3):189-194.
[8]李定琴,常凯军,麻琼丽,等.番木瓜芥子酶基因的表达调控和酶活性研究[J].中国农学通报,2009,25(15):252-257.
[9]Bones A M,Slupphaung G.Purification,characterfion and partial amino acid sequencing of B-thioghcosidase fromBrassicanapusL[J].Jounal of Plant Physiology,1989,134: 722-729.
[10]梁锦峰.萝卜硫素抗肿瘤活性研究及其关键酶myrosinase基因的克隆表达[A].浙江工商大学,2009: 24-26.
[11]汪俏梅,Steffen A.异硫代氰酸盐的抗癌机理及其相关性研究[J].细胞生物学杂志,2005,24(3):171-175.
[12]陈亚洲,阎秀峰.芥子油苷在植物-生物环境关系中的作用[J].生态学报,2007,27(6):2584-2593.
[13]梁锦锋,沈莲清,王向阳,等.西兰花硫代葡萄糖苷酶基因BOMyr2在毕赤酵母中的表达[J].中国食品学报,2010,10(1):67-71.
[14]张盛敏,孙雪飘,张家明.拟南芥硫代葡萄糖苷酶基因TGG1的克隆、表达和酶学特性[J].中国农学通报,2010,26(21):55-58.
[15]肖海燕,王向阳,宋达峰,等.油菜黑芥子酶基因重组表达质粒的构建以及在大肠杆菌中的表达[J].农业生物技术学报,2008,16(4):644-645.
StudyofEnzymaticActivityofMyrosinaseGenefromBrassicajuncea(MustardLeaves)
ZHANG Yan,LI Yao
(College of Life Science and Technology,Yangtze Normal University,Chongqing Fuling 408100,China)
【Objective】Isothiocyanates (ITCs) have potential as anti-cancer drugs and plant insecticides.The present paper aims to improve the expensive and challenging extraction of naturally occurring myrosinase.【Method】MYR1 encoding myrosinase in tumorous stem mustard was amplified using RT-PCR,cloned into the pPIC9K-S expression vector,and recombinantly expressed inPichiapastoris.Mycelia were cultured in YPD medium and expression was induced by replacing with BMMY medium for 72 hours.【Result】SDS-PAGE revealed a protein of 90 kDa,and myrosinase was isolated using immobilized metal affinity chromatography to a purity of 85 % and an overall yield of 850 U/l.With sinigrin as substrate,the specific activity of the myrosinase fusion protein was 0.003 U/μl as measured by HPLC.【Conclusion】Cloned into the pPIC9K-S expression vector,and recombinantly expressed inPichiapastoris,using isothiocyanates from tumorous stem mustard as standards,enzymatic conditions were investigated to identify the optimum.This study can be provide important references for amplifying and signing enzyme activity of thioglycoside.
MYR1;Myrosinase;Plasmid build;Expression
1001-4829(2017)4-0744-06
10.16213/j.cnki.scjas.2017.4.006
2015-12-01
重庆市教委项目“茎瘤芥(榨菜)中硫苷生成异硫氰酸酯酶解条件优化及抗肿瘤的体外试验研究” (KJ1601223)
张 燕(1977-),女,四川巴中人,讲师,硕士,主要从事细胞与分子生物学研究,E-mail:28789155@qq.com。
S637.3
A
(责任编辑 李 洁)
