缩胆囊素神经肽分子印迹膜的制备及荧光免疫分析应用
2017-10-16彭丽芳
彭丽芳, 李 桦
(武汉大学化学与分子科学学院,湖北武汉 430072)
缩胆囊素(Cholecystokinin,CCK)是一类分布广泛且具有多种生理功能的多型性神经肽,通常以四肽CCK4、五肽CCK5和八肽CCK8形式存在于脑脊液中[1]。CCK神经肽对记忆、学习和睡眠等生理功能具有调控作用,与抑郁等精神类疾病也紧密相关[2 - 3]。目前报道的脑脊液及血液中CCK神经肽的定量分析主要基于放射性免疫法[4 - 5],该方法灵敏度高,但需使用昂贵的抗体,且有交叉反应的缺点。因此,研究建立高效、经济、特异性强的CCK神经肽定量分析方法,对于阐明其含量与脑疾病之间的关系具有重要的理论价值和临床意义。
常规生物传感器以酶、抗体等生物分子为识别元件,由于蛋白质类抗体价格昂贵且热稳定性差,限制了这类生物传感器的广泛应用[6 - 7]。分子印迹技术是以目标分子为模板合成具有特异性识别能力的分子印迹聚合物(Molecularly Imprinted Polymer,MIP),MIP不仅具有抗体的特异性识别能力,而且具有耐高温、抗酸碱及有机溶剂、制备成本低和可重复利用的优点。MIP技术已经逐步应用于传感[8 - 9]、免疫分析[10 - 11]和色谱分离[12]等领域。与小分子MIP相比,蛋白质MIP的合成制备更具挑战性,主要是因为蛋白质分子量大且聚合过程中构象多变。抗原决定簇法是以多肽或蛋白质中一个特异性的裸露短肽为模板分子,制备所得的MIP可用来特异性识别整个多肽或蛋白质,该技术已用于合成多种蛋白质MIP[13 - 14]。
本课题组曾用抗原决定簇法合成制备CCK-MIP整体柱,将其用于固相微萃取-液质联用(LC-MS)测定人脑脊液中CCK神经肽[15]。本研究用抗原决定簇法,在硅烷化的玻片表面制备能特异性识别CCK神经肽的MIP膜。结合MIP的高选择性与荧光法的高灵敏度,研究建立了基于此MIP膜的固相竞争-荧光免疫分析方法,并对人脑脊液中CCK神经肽进行定量分析。
1 实验部分
1.1 仪器、试剂及材料
1100型液相色谱仪(美国,Agilent公司);5700型红外(IR)光谱分析仪(美国,Nicolet公司);Zeiss扫描电子显微镜(SEM)(德国,Sigma公司);DSY5000X型荧光倒置显微镜(重庆澳浦光电技术有限公司),配置MC21型CCD探测器(广州明美光电技术有限公司)。
CCK4、CCK5、CCK8、四肽YPLG、甲啡肽(Met-enk)、亮啡肽(Leu-enk)以及FITC标记的CCK5(FITC-CCK5),均购于上海吉尔生化有限公司(纯度>98%);乙二醇二甲基丙烯酸酯(EDMA)、丙烯酰胺(AM)、4-乙烯基吡啶(4-VP)、3-甲基丙烯酰氧基丙基三甲氧基硅烷(γ-MAPS),均购于Aladdin公司(纯度>96%);偶氮二异丁腈(AIBN)、甲基丙烯酸(MAA)、丙烯酸(AA),均购于国药集团化学试剂有限公司(分析纯)。
1.2 实验步骤
1.2.1玻片的预处理玻片用双官能团试剂γ-MAPS预处理使其表面硅烷化。依次在0.1 mol/L的NaOH溶液和HCl中煮沸1 h后置于γ-MAPS-甲醇(1∶9,V/V)溶液中浸泡12 h,甲醇冲洗,N2吹干即可。
1.2.2缩胆囊素-分子印迹膜(CCK-MIP)的制备在400 μL甲醇中依次加入3 mg模板分子CCK4,3 μL 功能单体MAA,40 μL交联剂EDMA,0.025 g引发剂AIBN,超声溶解,充入N25 min。将预聚合液转移至硅烷化的玻片表面,盖上普通载玻片,置于培养皿中并用保鲜膜密封,温度60 ℃热引发聚合8 h。聚合后的MIP膜置于乙腈-水(3∶7,V/V)溶液振荡洗脱(洗脱液含0.1%TFA),直至洗脱液用HPLC-UV法检测不到模板分子的信号为止。非印迹聚合物(NIP)的制备除不加模板分子外,其他均相同。
1.2.3CCK-MIP膜吸附平衡实验通过吸附平衡实验评价MIP膜的吸附容量及选择性。分别用5 mL浓度为5、10、15、35、50、100、175、350 μmol/L的CCK4 标准溶液与MIP膜温育3 h,以HPLC法测定吸附平衡后溶液中CCK4的浓度,并按公式计算吸附容量(Qe):Qe=V(c0-ce)/m。式中c0和ce(μmol/L)分别代表吸附前后CCK4的浓度,V为CCK4 溶液体积(L),m为MIP膜质量(g)。
MIP膜的特异性以印迹因子(IF)来考察,IF定义为:IF=QMIP/QNIP。其中QMIP和QNIP分别代表印迹膜和非印迹膜的吸附容量。
MIP膜的选择性考察:多肽混合溶液(CCK4、CCK5、CCK8、YPLG、Met-enk和Leu-enk,浓度均为5.5 μmol/L)与MIP膜温育3 h,以HPLC法测定吸附平衡后溶液中各多肽浓度,计算IF。
1.2.4人脑脊液的样品处理人脑脊液样品取自于武汉同济医院的病人,并于-80 ℃储存。使用前将氯仿与脑脊液(4∶1,V/V)混匀,4 ℃下于4 000g离心10 min以除去蛋白质,取上清液备用。
1.2.5MIP膜-竞争性荧光免疫分析方法测定CCK神经肽含量配置一系列标准CCK5与FITC-CCK5的混合溶液,其中FITC-CCK5浓度固定为210 pmol/L,CCK5浓度分别为0、20、60、120、200、400 pmol/L。将混合溶液与MIP膜温育进行竞争性荧光免疫反应,3 h后取出MIP膜,用pH=8.0的0.1 mol/L磷酸盐缓冲溶液冲洗2 min;用荧光倒置显微镜-CCD图像分析系统随机对MIP膜上10个区域进行拍照,得到10张荧光图(FM),每张荧光图随机选取15个相同面积的圆,以图像分析软件 image-pro-plus 分析这些圆(共150个)的荧光强度,获取平均值(FI)。以归一化荧光强度(B/B0%)为纵坐标,绘制B/B0% 随CCK5浓度变化的曲线,得到拟合方程。其中B为竞争性免疫反应中不同浓度的标准CCK5溶液所对应的FM的FI值,B0为CCK5标准品浓度为0时所对应的荧光图的FI值。将待分析样品进行MIP膜荧光免疫反应,将得到荧光图的FI值代入拟合的线性回归方程式,计算人脑脊液样品中CCK神经肽的含量。竞争免疫分析方法的检出限(LOD)为标准品CCK5浓度为0时,对应的FI值减去其标准偏差(n=3)的三倍所得值代入线性回归方程求得的CCK浓度[16]。
2 结果与讨论
2.1 MIP膜的制备机理及固相竞争-荧光免疫分析方法的设计
CCK系列神经肽具有相同C端(Trp-Met-Asp-Phe-NH2),用抗原决定簇法以CCK4为模板所制备的MIP对CCK神经肽均能特异性识别。图1为CCK-MIP膜的制备及固相竞争-荧光免疫分析方法设计示意图,以抗原决定簇法在硅烷化的玻片表面原位合成MIP膜,洗脱移除模板CCK4后,MIP膜形成能特异性吸附CCK神经肽的识别位点。以此MIP膜为固相吸附基质,游离的CCK与荧光标记的CCK5(FITC-CCK5)竞争性吸附到MIP膜的识别位点,建立固相竞争-荧光免疫分析方法,利用荧光倒置显微镜-CCD图像分析系统对吸附到MIP膜上CCK神经肽进行定量分析。
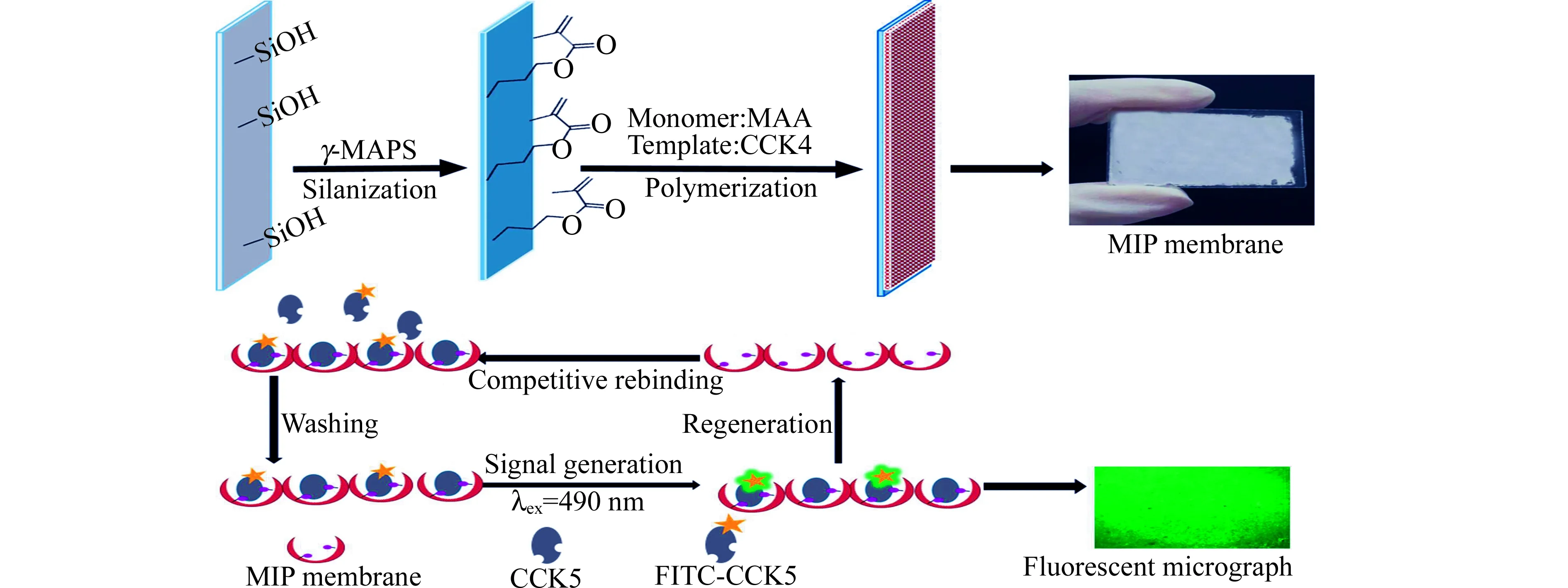
图1 CCK-MIP膜的制备及固相竞争-荧光免疫分析应用Fig.1 Schematic illustration of CCK-MIP membrane preparation and its application for competitive immunoassay
2.2 MIP膜聚合条件的选择优化
为制备出对CCK神经肽具有特异性识别能力且形貌良好的MIP膜,本实验对单体的种类及用量、交联剂用量等聚合条件进行了系统的选择及优化。研究表明,该体系最佳功能单体为MAA,模板与单体最佳比例为1∶4。聚合过程中,通过交联剂与硅烷化试剂的作用,MIP膜键合到玻片表面,因此交联剂的用量是本实验考察的重点。研究表明当单体与交联剂比例为1∶6时,所制备的MIP膜特异性吸附能力强、形貌规整且耐冲洗。
2.3 MIP膜的表征
图2 为MIP的扫描电镜(SEM)图及MIP、NIP和MAA的红外(IR)光谱图。由图2A可见所制备的MIP膜为结构致密、孔径均匀的交联状聚合物,这为传质提供了良好的场所。从图2B可以看出,MIP和NIP 特征吸收峰的位置和强度相似,1 729.08 cm-1处为交联剂EDMA中C=O伸缩振动吸收峰;与MAA相比,MIP和NIP在1 633 cm-1处的C=C键伸缩振动和3 100~3 000 cm-1处 C-H 伸缩振动明显减弱,由此表明,MAA参与了聚合过程。综上分析说明,本实验已经成功制备了MIP膜。

图2 (A)MIP膜扫描电镜(SEM)图;(B) NIP、MIP 和MAA的红外(IR)光谱图Fig.2 (A) SEM image of MIP membrane;(B)IR spectra of NIP,MIP and MAA

图3 MIP/NIP膜对CCK4的吸附等温线Fig.3 Adsorption isotherm of CCK4 on MIP/NIP membrane
2.4 MIP膜吸附容量及选择性考察
按实验步骤1.2.3进行吸附平衡实验,图3是MIP/NIP膜对CCK4的吸附等温线,MIP膜对CCK4的吸附容量为31.7 μmol/g,而NIP膜仅2.61 μmol/g,印迹因子达到12,说明MIP膜对CCK4具有高的特异性识别能力。
表1是MIP/NIP膜对6种小肽的吸附容量和印迹因子。表1表明:MIP膜对CCK4、CCK5和CCK8的印迹因子分别为5.6、4.5 和4.3,而对另三种非CCK类的小肽的印迹因子均接近1,说明该MIP膜能选择性识别CCK神经肽。
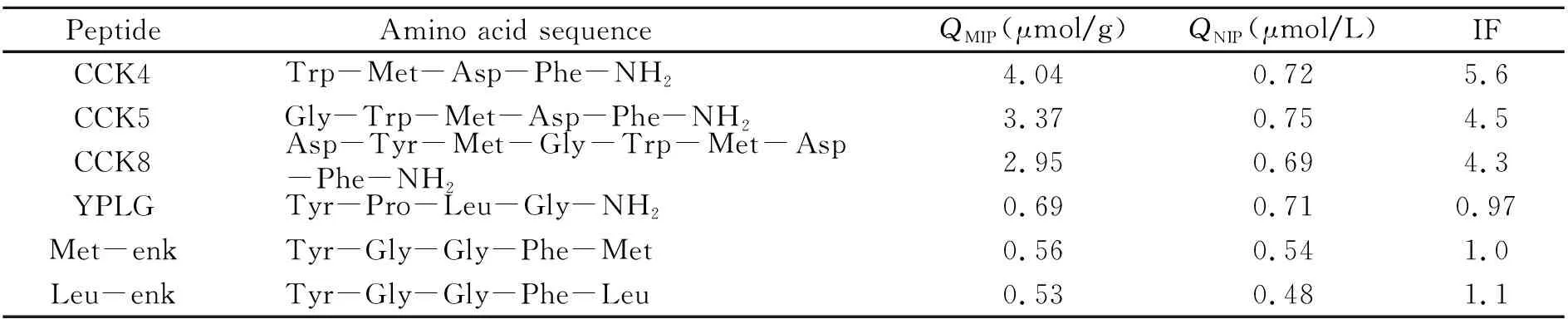
表1 MIP/NIP膜的吸附容量(Q)和印迹因子(IF)
2.5 基于MIP膜的竞争-荧光免疫分析法测定人脑脊液中CCK神经肽
按实验步骤1.2.5进行MIP膜的竞争-荧光免疫实验,图4A为竞争吸附后MIP膜荧光图及平均荧光强度图,图4B为由图4A数据绘制的竞争结合校准曲线(1)及半对数曲线(2)。图4B(1)中B/B0%与CCK5浓度在0~200 pmol/L范围内存在明显线性关系,绘制该范围内半对数曲线如图4B(2)所示,表2为该竞争性免疫分析方法的线性回归方程式,线性范围,相关系数和CCK5检出限。我们所建立的固相竞争-荧光免疫分析方法对CCK神经肽检出限达到8.91 pmol/L,与文献所报道的RIA方法检出限相近[5]。

图4 (A)竞争吸附后MIP膜荧光图及其平均荧光强度(FI:所分析的150个圆的荧光强度平均值);(B) MIP膜竞争结合校准曲线及半对数曲线Fig.4 (A)Quantitative representation of the fluorescence intensities for the fluorescent micrograph(FI:The mean fluorescence intensity of 150 wafers);(B)Competitive binding calibration curve(1) and semi-logarithmic linegraph(2) for the MIP membrane

AnalyteLinear range(pmol/L)Regression equationR2LOD(pmol/L)CCK50-200lgY=1.9898-0.0023X0.99198.91
Y:B/B0(%);X:CCK5 concentration(pmol/L).
按实验步骤1.2.5对预处理后的人脑脊液样品进行MIP膜竞争荧光免疫实验,表3为所测的CCK神经肽含量,结果表明:人脑脊液样品中CCK神经肽的含量与文献报道接近[17]。
2.6 MIP膜竞争性免疫分析方法评价
为考察该分析方法的重现性,对加标脑脊液进行3次平行分析。表4是MIP膜竞争性免疫分析方法日间加标回收率及精密度,从表中可以看出CCK5的平均加标回收率在96.4%~113%之间,加标回收率的RSD为2.2%~4.6%。将此MIP膜反复用于竞争吸附-解吸15次左右,吸附性能略微降低,说明该方法的重现性好且该印迹膜具有优异的稳定性,适用于脑脊液样品中CCK神经肽的高灵敏和高选择性分析。

表3 脑脊液样品中CCK神经肽含量
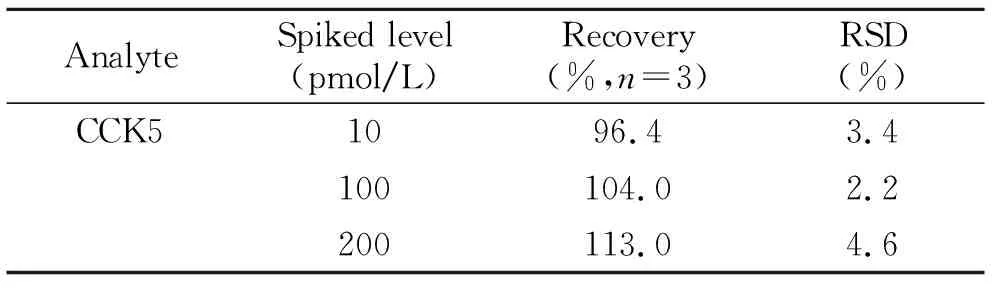
表4 竞争性免疫分析方法日间加标回收率及精密度(n=3)
3 结论
本研究用抗原决定簇法,在硅烷化的玻片表面合成制备了对CCK神经肽具有特异性识别能力的MIP膜。结合MIP的高选择性与荧光的高灵敏度,以此MIP膜为固相吸附基质,我们研究建立了基于此MIP膜固相竞争-荧光免疫分析方法,该方法可对人脑脊液中CCK神经肽进行定量分析。实验结果表明所制备的分子印迹膜具有特异性强和可重复利用的优点,在缩胆囊素神经肽分析中具有良好的应用价值。
