双齿围沙蚕对芘的生物可利用性研究
2017-10-13蔡富才赵欢李艳楠张文龙杨大佐周一兵
蔡富才,赵欢,李艳楠,张文龙,杨大佐,周一兵
大连海洋大学 辽宁省海洋生物资源恢复与生境修复重点实验室,大连 116023
双齿围沙蚕对芘的生物可利用性研究
蔡富才,赵欢,李艳楠,张文龙,杨大佐,周一兵*
大连海洋大学 辽宁省海洋生物资源恢复与生境修复重点实验室,大连 116023
为近海岸沉积质中PAHs的生态风险评价及其污染生境的修复提供理论依据,以双齿围沙蚕为研究对象,以芘为暴露污染物,开展双齿围沙蚕对芘的生物可利用性研究,分别考察了芘对双齿围沙蚕抗氧化酶活性的影响以及芘在双齿围沙蚕体内的生物富集特征。结果表明,双齿围沙蚕SOD、CAT和GSH-PX活性均随诱导时间的增加而升高,且SOD活性随芘浓度的增加出现显著性抑制,CAT和GSH-PX活性则随芘浓度的增加出现显著性升高。芘在双齿围沙蚕体内的生物富集特征如下:双齿围沙蚕体内芘的蓄积量随暴露浓度的增加而增加,各处理组双齿围沙蚕体内芘的蓄积量随时间的变化均呈类凸形的二次曲线关系,在第10天达到蓄积的最大值,最大蓄积量依次为(6.18±0.62) mg·kg-1、(12.37±1.23) mg·kg-1和(24.76±1.51) mg·kg-1。生物富集系数BCF随芘浓度的增加而减小,分别为0.0692、0.0684和0.0674。上述研究结果表明,在一定浓度范围内,双齿围沙蚕抗氧化酶活性对芘的暴露具有很好的指示作用;此外,在短期内,双齿围沙蚕对芘具有明显的富集效应。
芘;双齿围沙蚕;生物可利用性;抗氧化酶;生物富集
Received14 January 2017accepted13 March 2017
Abstract: In this article, the bioavailablility of pyrene in Perinereis aibuhitensis was studied. The antioxidant enzyme activities and the characteristics of bioconcentration of pyrene in P. aibuhitensis were detected. The results showed that the activities of SOD, CAT and GSH-PX in P. aibuhitensis were significantly up-regulated with prolonged exposure to pyrene. The activity of SOD was significantly decreased with increased concentration of pyrene, in contrast, the activities of CAT and GSH-PX were increased. The characteristics of bioconcentration of pyrene in P. aibuhitensis were as follows: the accumulation amount of pyrene in P. aibuhitensis showed a quadratic curve pattern with exposure time, which was increased with increased concentration of pyrene. At the 10thday of exposure to pyrene, the accumulation amount in each treatment group reached the maximum with (6.18±0.62) mg·kg-1, (12.37±1.23) mg·kg-1and (24.76±1.51) mg·kg-1, respectively. The BCFs in each treatment group was 0.0692, 0.0684 and 0.0674, respectively, which showed negative relationship with pollutant concentration. These results indicated that the activity of antioxidant enzymes in P. aibuhitensis may act as a good indicator for pyrene exposure in a certain concentration range, and furthermore, P. aibuhitensis has the ability to bioaccumulate pyrene. This article will support the further study on ecological risk evaluation and environmental remediation in the coastal sediment polluted by PAHs.
Keywords: pyrene;Perinereis aibuhitensis; bioavailablility; antioxidant enzyme; bioconcentration
多环芳烃(polycyclic aromatic hydrocarbons, PAHs)是一类由2个或2个以上芳烃(苯)环以线状、角状或簇状排列构成的碳氢化合物,具有很强的致癌、致畸和致基因突变作用[1-2]。该类物质随着苯环数量的增多,其辛醇-水分配系数增加,水溶性降低而脂溶性增强[3],极易吸附于有机颗粒物上,进而蓄积在有机体和沉积质中[4],并可通过食物链的放大作用危害人类健康。近海岸沉积质中的PAHs主要来源于近岸溢油、石化污染以及陆源排放[5-6]。目前已有多种PAHs被美国环境保护署列入优先控制有机污染物,其中包括芘(pyrene, PY)。芘在环境中普遍存在[7],常作为PAHs的代表物用于各项毒理学和生态风险评价的研究[8-9]。
多毛类是一类广泛栖居于污染物较为汇集的海陆交错带沉积质中具有典型沉积食性的底栖无脊椎动物[10]。多毛类动物的不易长距离迁移的特点,使其极易通过直接接触和主动摄食接触到沉积质中的污染物,近年来常被用作海洋沉积质污染评价的物种[11]。研究表明一些种类的多毛类动物对重金属和石油烃等污染物具有较强的耐受和富集作用[12-13],可通过一系列分解和转化作用将有毒有害的污染物排出体外,维持机体对污染物较高的生物可利用性[14],因此,这些种类的多毛类动物也被用作近海岸污染沉积质生境修复的物种。
生物可利用性的实质在于研究化学物质与生物体的一种潜在的相互关系,由间接的毒性数据或生物体浓度数据来评价,对生物修复、污染物的生态毒性和生态风险评价具有重要影响[15-16]。目前,近海岸沉积质中PAHs的生物可利用性研究已有相关报道,主要集中在少数多毛类物种上,有关PAHs在我国海陆交错带分布广泛的多毛类动物—双齿围沙蚕(Perinereis aibuhitensis)体内的生物可利用性研究尚未多见。
本研究以P. aibuhitensis为研究对象,以芘作为暴露污染物,开展P. aibuhitensis对芘的生物可利用性研究,分别考察了芘对P. aibuhitensis体内主要抗氧化酶活性的影响以及芘在P. aibuhitensis体内的生物富集特征,旨在为近海岸沉积质中PAHs的生态风险评价及其污染生境的修复提供理论依据。
1 材料与方法(Materials and methods)
1.1 实验材料
实验用P. aibuhitensis采自辽宁大连海域,个体质量为(2.5±0.5) g,将采集的个体放入塑料箱后迅速带回实验室进行暂养。暂养期间,每24 h更换一次海水,水温为(13±0.5) ℃,盐度为31~32,pH为8.25±0.10。供试土壤采自辽宁金州沿海滩涂,干燥后用40目分样筛筛去碎石,其相关理化性质测定结果如表1。
实验用分析纯芘购于Sigma公司(纯度为99%),分析纯丙酮购于上海国药集团化学试剂有限公司,分析纯无水硫酸钠购自广州化学试剂公司,分析纯正己烷、二氯甲烷和硫酸溶液以及层析纯中性氧化铝(200~300目)和弗罗里硅土(60~100目)均购自天津科密欧化学试剂有限公司,考马斯亮兰试剂盒、超氧化物歧化酶(superoxide dismutase, SOD)试剂盒、过氧化氢酶(catalase, CAT)试剂盒和谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-PX)试剂盒均购于南京建成生物工程研究所。
1.2 实验方法
1.2.1 芘的毒性实验
[17]、[18]中的方法,设置3个不同浓度芘溶液暴露组,分别为5 μg·L-1、25 μg·L-1和50 μg·L-1,另设一空白对照组和体积分数为0.01%的丙酮溶剂对照组,每组设置3个重复。挑取健康P. aibuhitensis个体,放入2 L预先加入500 mL不同浓度芘溶液的塑料杯中,每个杯中放入6尾P. aibuhitensis,每24 h更换一次新的溶液,整个实验过程不投喂饲料,实验期间,水温维持在(13±0.5) ℃。于实验开始后第4、7和14天分别从各处理组中随机取3尾P. aibuhitensis,取其体壁肌肉组织立即放入超低温冰箱(-80 ℃)中保存,用于后续进行P. aibuhitensis酶活的测定。

表1 供试土壤背景值Table 1 Background value of the tested soil
1.2.2 生物富集模型构建与管理
在实验室条件下构建垂直潜流人工湿地微宇宙生态系统,其由上箱和下箱组成,上箱为规格0.45 m×0.31 m×0.20 m的塑料箱,于塑料箱体顶部一侧安装入水管一支,并于每个塑料箱底部分别钻9个直径为0.5 cm的圆孔。每个塑料箱底部铺垫80~100目筛绢以防止土壤流失,放入5 kg实验土壤。下箱规格为0.60 m×0.40 m×0.15 m,如图1所示。
实验采取“静态法”[19]将土壤经芘一次性暴露染毒,连续检测土壤中和P. aibuhitensis体内芘的浓度。参考文献[20]中的方法,分别设置3个不同浓度芘土壤暴露组,分别为100 mg·kg-1、200 mg·kg-1和400 mg·kg-1,每组设置3个重复。以正己烷作为芘的溶剂,将称好质量的芘放入适量体积的正己烷中溶解。将配制好的芘溶液喷洒入土壤中,混合均匀,放置7 d,使其与土壤达到充分平衡。实验微宇宙每箱放置P. aibuhitensis 25尾(按180尾/m2计),模拟潮汐规律,每日早8时和晚5时用海水浇灌,并收集塑料箱底部渗出海水,重新置入实验箱内。分别于实验第2天至第22天,每2天取一次样,整体取样,每次分别从各处理组取3条完整P. aibuhitensis,海水清洗后,于-80 ℃冰箱保存,用于后续进行P. aibuhitensis体内芘的蓄积量的测定。
1.2.3 酶活测定方法
SOD、CAT和GSH-PX活性均采用南京建成生物工程研究所试剂盒方法测定。蛋白质含量采用南京建成生物工程研究所试剂盒方法——考马斯亮蓝法测定。

图1 微宇宙生态系统截面示意图Fig. 1 Schematic diagram of microcosm ecosystem
1.2.4 双齿围沙蚕体内芘的提取
参考文献[21]中样品的前处理方法,取肌肉组织匀浆。称取已制成均匀肉糜的样品2 g,加入2 g无水硫酸钠研磨均匀后,将样品置于10 mL具塞离心管中,以正己烷-二氯甲烷(体积比为2∶1)作为溶剂进行超声提取,提取液经60%硫酸溶液和中性氧化铝-弗罗里硅土混合层析柱净化。用正己烷定容至1 mL,转移至棕色进样瓶中,待测。
1.2.5 双齿围沙蚕体内芘浓度的测定
利用气相色谱-质谱联用仪(gas chromatography-mass spectrometer, GC-MS)进行定性和定量分析,采用外标法,首先对不同浓度芘的标准溶液进行SIM扫描,绘制芘的标准曲线,根据标准曲线来计算芘的浓度。GC-MS配置与参数见表2,升温程序为:柱初始温50 ℃,保持1 min,再以20 ℃·min-1升至100 ℃,然后以10 ℃·min-1升至210 ℃,保持1 min,最后以5 ℃·min-1升至290 ℃,保持5 min。

表2 GC-MS配置与参数Table 2 Configuration and parameters of GC-MS
1.3 数据处理与分析
1.3.1 差异显著性分析
所有实验数据利用Microsoft Excel 2007和SPSS 19.0进行处理,采用单因素方差(ANOVA)及其Duncan多重比较进行差异显著性分析,显著性水平P<0.05或P<0.01表示差异显著;结果以平均值±标准差(Mean ± SD)形式表示。
1.3.2 双齿围沙蚕体内芘生物富集动力学参数的计算
应用生物富集过程动力学模型[22]计算动力学参数得到P. aibuhitensis对芘的生物富集系数,即根据测得的P. aibuhitensis体内芘的蓄积量,通过公式(1)和(2)对不同暴露浓度下P. aibuhitensis芘的蓄积量随时间变化进行Origin非线性拟合,得到K1和K2的值,再通过公式(3)和(4)计算生物富集系数(biological concentration factor, BCF)和富集平衡状态下,P. aibuhitensis体内污染物的最大蓄积量(CAmax)。
蓄积阶段:CA=C0+CW·K1/K2·(1-e-k2t)
(1)
排放阶段(t>t*):CA=CW·K1/K2·(e-k2t(t-t*)-e-k2t)
(2)
生物富集系数:BCF=K1/K2
(3)
平衡状态下的最大蓄积量:CAmax=BCF×CW
(4)
式中:K1—生物吸收速率常数,K2—生物排出速率常数,CW—底质污染物浓度(mg·kg-1),CA—t时刻生物体内污染物浓度(mg·kg-1),C0—初始时刻生物体内污染物浓度(mg·kg-1),t—实验进行的时间。
2 结果(Results)
2.1 芘胁迫对双齿围沙蚕抗氧化酶活性的影响
2.1.1 芘胁迫对双齿围沙蚕SOD活性的影响
从图2至图4可以看出,溶剂对照组与空白对照组的3种抗氧化酶活性均无明显差异(P>0.05),表明丙酮作为助溶剂对P. aibuhitensis没有明显的毒性效应。从图2可以看出,各浓度梯度芘胁迫下,P. aibuhitensis SOD活性均随时间的增加而逐渐升高。在5 μg·L-1芘中暴露4、7和14 d时,SOD活性分别为溶剂对照组的1.38、1.7和2.08倍;在25 μg·L-1芘中暴露4、7和14 d时,SOD活性分别为溶剂对照组的1.21、1.46和1.66倍;50 μg·L-1芘中暴露4、7和14 d时,SOD活性分别为溶剂对照组的1.12、1.25和1.32倍。对同一时间不同处理组进行单因素方差分析,发现在第4、7和14天时,各浓度梯度芘胁迫下,P. aibuhitensis SOD活性较溶剂对照组均出现显著升高(P<0.01);经Duncan多重比较后,发现在第4、7和14天时,5 μg·L-1芘胁迫下SOD活性均显著高于25 μg·L-1芘胁迫下SOD活性(P<0.01),25 μg·L-1芘胁迫下SOD活性均显著高于50 μg·L-1芘胁迫下SOD活性(P<0.01),SOD活性随芘浓度的升高出现显著下降。
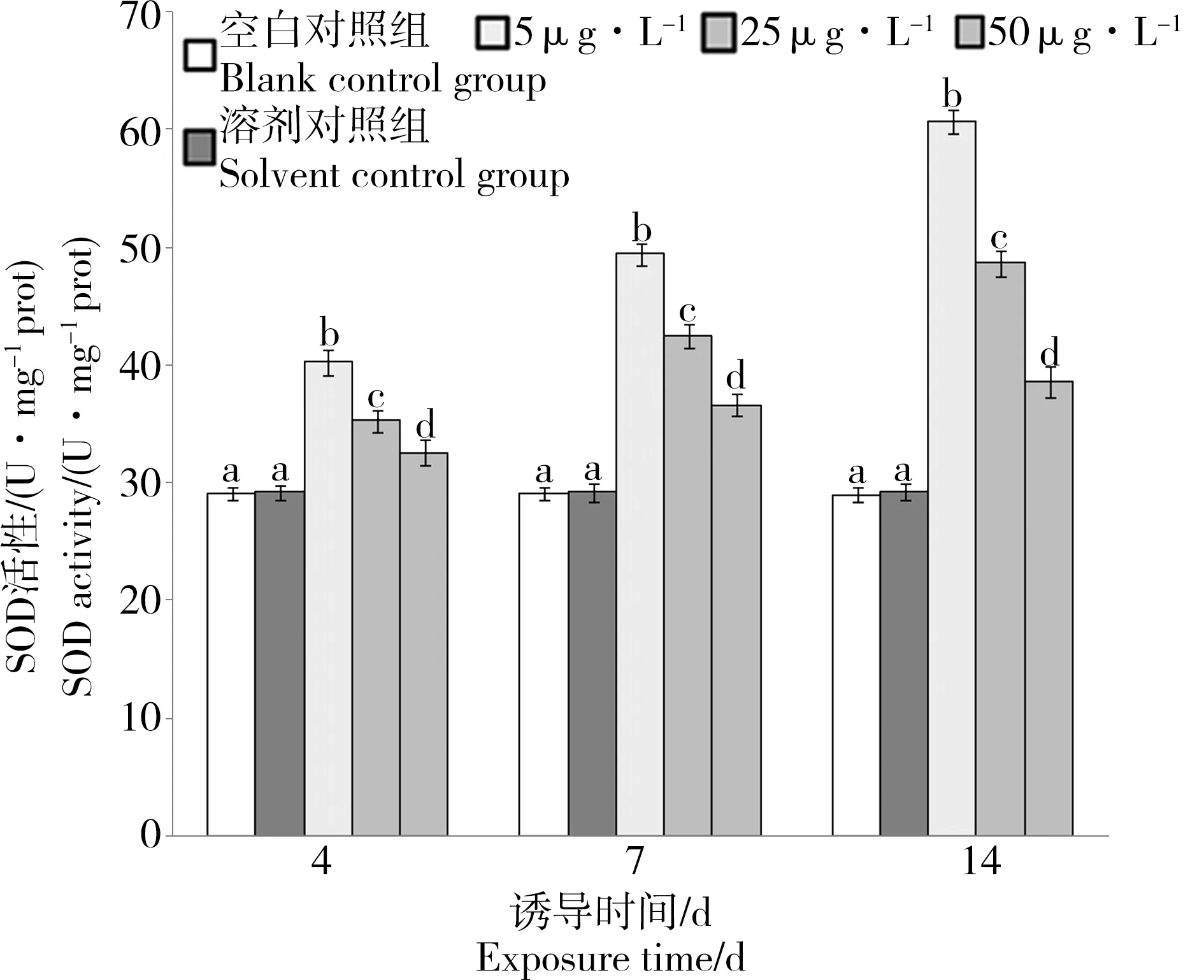
图2 芘胁迫对双齿围沙蚕SOD活性的影响Fig. 2 The effect of pyrene on activities of SOD in P. aibuhitensis
2.1.2 芘胁迫对双齿围沙蚕CAT活性的影响
从图3可以看出,各浓度梯度芘胁迫下,P. aibuhitensis CAT活性均随时间的增加而逐渐升高。在5 μg·L-1芘中暴露4、7和14 d时,CAT活性分别为溶剂对照组的1.15、1.2和1.35倍;在25 μg·L-1芘中暴露4、7和14 d时,CAT活性分别为溶剂对照组的1.31、1.47和1.62倍;50 μg·L-1芘中暴露4、7和14 d时,CAT活性分别为溶剂对照组的1.64、1.74和1.9倍。对同一时间不同处理组进行单因素方差分析,发现在第4、7和14天时,各浓度梯度芘胁迫下,P. aibuhitensis CAT活性较溶剂对照组均出现显著升高(P<0.01);经Duncan多重比较后,发现在第4、7和14天时,25 μg·L-1芘胁迫下CAT活性均显著高于5 μg·L-1芘胁迫下CAT活性(P<0.01),50 μg·L-1芘胁迫下CAT活性均显著高于25 μg·L-1芘胁迫下CAT活性(P<0.01),CAT活性随芘浓度的升高出现显著升高,这一变化趋势与SOD相反。

图3 芘胁迫对双齿围沙蚕CAT活性的影响Fig. 3 The effect of pyrene on activities of CAT in P. aibuhitensis
2.1.3 芘胁迫对双齿围沙蚕GSH-PX活性的影响
从图4可以看出,各浓度梯度芘胁迫下,P. aibuhitensis GSH-PX活性变化趋势与SOD和CAT相类似,均随时间的增加而逐渐升高。在5 μg·L-1芘中暴露4、7和14 d时,GSH-PX活性分别为溶剂对照组的2.33、3.55和3.86倍;在25 μg·L-1芘中暴露4、7和14 d时,GSH-PX活性分别为溶剂对照组的2.58、3.86和4.18倍;50 μg·L-1芘中暴露4、7和14 d时,GSH-PX活性分别为溶剂对照组的3.27、4.37和4.68倍。对同一时间不同处理组进行单因素方差分析,发现在第4、7和14天时,各浓度梯度芘胁迫下,P. aibuhitensis GSH-PX活性较溶剂对照组均出现显著升高(P<0.01);经Duncan多重比较后,发现在第4、7和14天时,25 μg·L-1芘胁迫下GSH-PX活性均显著高于5 μg·L-1芘胁迫下GSH-PX活性(P<0.01),50 μg·L-1芘胁迫下GSH-PX活性均显著高于25 μg·L-1芘胁迫下GSH-PX活性(P<0.01),GSH-PX活性随芘浓度的升高出现显著升高,这一变化趋势与CAT相类似,与SOD相反。
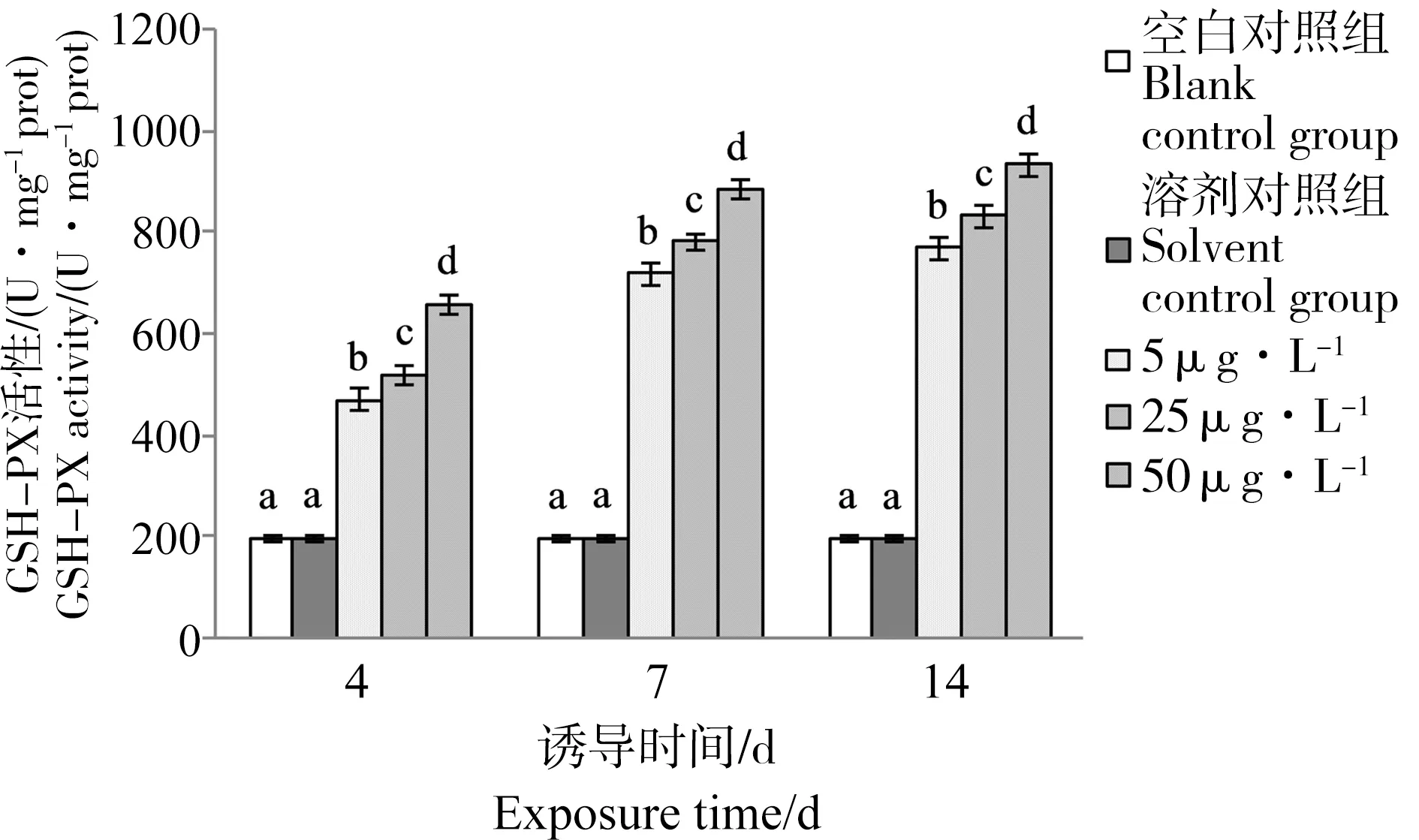
图4 芘胁迫对双齿围沙蚕GSH-PX活性的影响Fig. 4 The effect of pyrene on activities of GSH-PX in P. aibuhitensis
2.2 芘在双齿围沙蚕体内的生物富集特征
2.2.1 双齿围沙蚕体内芘的蓄积变化规律
在不同暴露浓度下,P. aibuhitensis体内芘的蓄积量随时间的变化趋势如图5。由图5可见,总体来看,P. aibuhitensis体内芘的蓄积量随暴露浓度的增加而增加,各处理组P. aibuhitensis体内芘的蓄积量随时间的变化趋势均呈类凸形的二次曲线关系且各处理组均在第10天达到蓄积的最大值。暴露浓度为100、200和400 mg·kg-1时最大蓄积量依次为(6.18±0.62) mg·kg-1、(12.37±1.23) mg·kg-1和(24.76±1.51) mg·kg-1,分别相当于各处理组P. aibuhitensis体内初始浓度的6.06、10.06和18.21倍,较初始浓度有显著差异(P<0.01)。在0~10 d,各处理组P. aibuhitensis体内芘的日均累积量随暴露浓度增加依次为(0.62±0.06) mg·kg-1、(1.24 ±0.12) mg·kg-1和(2.48±0.15) mg·kg-1。第10天之后,各处理组P. aibuhitensis体内芘的蓄积量均呈下降趋势。在第10~22天,P. aibuhitensis体内芘的日均下降量随暴露浓度增加依次为(0.52±0.05) mg·kg-1、(1.03±0.10) mg·kg-1和(2.06±0.13) mg·kg-1。暴露实验至第22天时,各处理组P. aibuhitensis体内芘的蓄积量已接近初始浓度,随暴露浓度依次为(1.06±0.21) mg·kg-1、(2.13±0.31) mg·kg-1和(4.28±0.82) mg·kg-1。

图5 各处理组双齿围沙蚕体内芘的蓄积量随时间的变化Fig. 5 The accumulation amount of pyrene in P. aibuhitensis in different treatment groups at different exposure times
2.2.2 双齿围沙蚕对芘的生物富集动力学参数
根据图5所得数据,应用生物富集过程动力学模型对不同暴露浓度下P. aibuhitensis体内芘的蓄积量随时间的变化进行非线性拟合,结果如图6所示,各处理组P. aibuhitensis的K1变动于0.00966~0.01343,K2变动于0.13967~0.19921,通过公式(3)计算得出,P. aibuhitensis的BCF随土壤中芘浓度的增加而减小,分别为0.0692、0.0684和0.0674。通过公式(4)计算得出,在平衡状态下,P. aibuhitensis的CAmax随土壤中芘浓度的增加而增加,分别为6.92 mg·kg-1、13.68 mg·kg-1和26.96 mg·kg-1。
3 讨论(Discussion)
3.1 芘胁迫对双齿围沙蚕抗氧化酶活性的影响
污染物进入到生物体内会经过一系列的生物转化,在此过程中会产生一定量的活性氧自由基,机体若不及时清除会产生氧化损伤。机体在氧化损伤过程中,SOD、CAT和GSH-PX是3种起主要作用的酶,SOD是生物体内唯一一种以自由基为底物的抗氧化酶,可将超氧阴离子歧化为H2O2和O2,以避免细胞受到氧自由基的损害[23-24];CAT是生物体内抗氧化体系中又一关键非特异性抗氧化酶,能清除SOD催化活性氧自由基所产生的H2O2,使其转化为无毒的H2O和O2,从而使机体免受氧自由基的攻击[25];GSH-PX也是生物体内一种普遍存在的抗氧化酶,可以降低内外有毒物质对机体产生的毒性作用,又可分解H2O2以及清除细胞内的脂质和机体过氧反应的产物,以达到保护细胞机构和功能完整的作用[26]。本实验结果显示在不同浓度芘的暴露下,P. aibuhitensis的这3种抗氧化酶活性均随着芘暴露时间的增加呈明显的上升趋势,表明随着暴露时间的增加,机体内产生大量的活性氧自由基,SOD活性的升高可以消除氧自由基。CAT活性变化趋势与GSH-PX相类似,这2种酶活性的升高可以去除代谢过程中产生的H2O2,从而减少生物体受到氧化损伤的风险。这一变化趋势与其他研究结果相类似[27-30]。

图6 各处理组双齿围沙蚕对芘的生物富集曲线注:A, B, C中芘初始浓度分别为100、200和400 mg·kg-1。Fig. 6 The bioconcentration curves of pyrene in P. aibuhitensis at different treatment groupsNote: The initial concentration of pyrene were 100, 200 and 400 mg·kg-1respectively in A, B and C.
本实验结果中SOD与CAT和GSH-PX活性随暴露浓度的变化趋势并不一致,在25 μg·L-1芘诱导下,P. aibuhitensis SOD活性的上升趋势明显低于5 μg·L-1浓度组;在50 μg·L-1芘诱导下,P. aibuhitensis SOD活性的上升趋势明显低于25 μg·L-1浓度组,P. aibuhitensis SOD活性随暴露浓度的增加而降低,而CAT和GSH-PX活性则随暴露浓度的增加而升高。不少研究表明SOD与CAT和GSH-PX随暴露浓度的变化趋势存在相似性,也有研究发现SOD与CAT和GSH-PX随暴露浓度的变化趋势相反。本实验中产生这一现象的原因可能与CYP家族参与PAHs的代谢有关。Livingstone等[31]在研究沙丁鱼(Limanda limanda)的抗氧化酶活性时发现SOD和CAT的变化趋势并不一致,推断原因是由于H2O2的来源除来自SOD催化外,还可来自氨基酸和细胞色素P450氧化酶(cytochrome p450, CYP450)的激活。赵欢等[18]在研究苯并芘对P. aibuhitensis的抗氧化酶活性时也发现SOD与CAT和GSH-PX随暴露浓度的变化趋势并不一致,在进行苯并芘对P. aibuhitensis抗氧化酶活性影响研究的同时,也进行了苯并芘对P. aibuhitensis CYP450基因表达的影响分析,发现苯并芘会显著诱导该基因的表达。故推断本实验中,SOD与CAT和GSH-PX的变化趋势相反是由于P. aibuhitensis体内H2O2的来源有一部分是通过CYP450激活产生的。综合上述研究结果,在一定浓度范围内,P. aibuhitensis体内SOD、CAT和GSH-PX活性与芘之间存在明显的“时间-效应”和“剂量-效应”关系。
3.2 芘在双齿围沙蚕体内的生物富集特征
本实验考察了芘在P. aibuhitensis体内的生物富集特征,结果发现在0~10 d,P. aibuhitensis体内芘的蓄积量随暴露时间和暴露浓度的增加均呈升高趋势且均在第10天时达到蓄积的最大值,较体内初始浓度存在显著性差异(P<0.05),这表明P. aibuhitensis暴露于芘后,在初始阶段的生物富集效应较为显著。陶宇[32]在研究P. aibuhitensis对菲的生物富集时也曾发现类似现象,P. aibuhitensis在暴露于菲浓度为400 mg·kg-1的土壤中时,其体内菲的蓄积量随暴露时间的增加而增加,在第9天时达到蓄积的最大值,较体内初始浓度存在显著性差异(P<0.05)。
在10~22 d,各处理组P. aibuhitensis体内芘的蓄积量随时间的增加均呈降低趋势。在第18天时,各处理组P. aibuhitensis体内芘的蓄积量开始趋于初始浓度水平,至22 d时,各处理组P. aibuhitensis体内芘的蓄积量虽仍高于初始浓度,但已与初始浓度无显著性差异(P>0.05)。显然在第10天后,P. aibuhitensis对芘的代谢大于蓄积。已有研究表明海洋多毛类动物在去除体内蓄积的PAHs时,其重要方式就是通过生物转化的多个代谢途径使疏水性PAHs转化为亲水性化合物,从而排除体外,这一反应分为2个阶段,第一阶段主要由CYP450作用下使PAHs发生羟基化反应;第二阶段由二磷酸尿核苷葡萄糖醛氨酰转移酶和磺基转移酶参与,与羟基化的PAHs反应生成水溶性代谢产物[14]。由此推断实验最初的0~10 d内,P. aibuhitensis对芘的蓄积速率大于代谢速率,表现为蓄积作用;在10~22 d内,P. aibuhitensis对芘的代谢速率大于蓄积速率,表现为排泄作用。
Meador等[33]在总结大量已报道文献的基础上认为BCF决定了生物体对污染物的富集能力,在污染物低暴露水平时,BCF值较高;在高暴露水平时,BCF值较低。本研究得到的结果与该规律一致,即随着土壤中芘浓度的增加,BCF逐渐下降,P. aibuhitensis对芘的富集能力逐渐降低。此外,本实验所得BCF值与紫贻贝(Mytilus edulis)和菲律宾蛤仔(Ruditapes philippinarum)等海洋无脊椎生物对石油烃的生物富集所得BCF值具有较大差异[34-35]。推断可能是由于PAHs、石油烃等持久性有机污染物在生物组织中的富集受到诸多因素的影响,如食物可获性、生物体的生理状态以及生物组织的脂肪含量等,因此不同种类间所得BCF值可能存在较大差异[34-35]。
参考文献(References):
[1] Tsai W T, Mi H H, Chang Y M, et al. Polycyclic aromatic hydrocarbons (PAHs) in bio-crudes from induction-heating pyrolysis of biomass wastes [J]. Bioresource Technology, 2007, 98(5): 1133-1137
[2] Durant J L, Busby Jr W F, Lafleur A L, et al. Human cell mutagenicity of oxygenated, nitrated and unsubstituted polycyclic aromatic hydrocarbons associated with urban aerosols [J]. Mutation Research/Fundamental & Molecular Mechanisms of Mutagenesis, 1996, 371(3-4): 123-157
[3] Chen Y Y, Zhu L Z, Zhou R B. Characterization and distribution of polycyclic aromatic hydrocarbon in surface water and sediment from Qiantang River, China [J]. Journal of Hazardous Materials, 2007, 141(1): 148-155
[4] 梁慧姣, 刘小龙, 白莉, 等. 多环芳烃在水生环境食物链中的研究进展[J]. 安徽农业科学, 2014, 29: 10261-10265
Liang H J, Liu X L, Bai L, et al. Research progress of polycyclic aromatic hydrocarbons (PAHs) in food chain of aquatic environment [J]. Journal of Anhui Agricultural Sciences, 2014, 29: 10261-10265 (in Chinese)
[5] Haritash A K, Kaushik C P. Biodegradation aspects of polycyclic aromatic hydrocarbons (PAHs): A review [J]. Journal of Hazardous Materials, 2009, 169(1-3): 1-15
[6] Zhang J, Lin X G, Zeng J, et al. In-situ phytoremediation of PAHs contaminateds soils in a mixed cropping system [J]. Chinese Journal of Environmental Engineering, 2012, 6(1): 341-346
[7] Keith L, Telliard W. ES&T special report: Priority pollutants: I-a perspective view [J]. Environmental Science & Technology, 1979, 13(4): 416-423
[8] 宋玉芳, 周启星, 许华夏, 等. 菲、芘、1,2,4-三氯苯对蚯蚓的急性毒性效应[J]. 生态与农村环境学报, 2003, 19(1): 36-39
Song Y F, Zhou Q X, Xu H X, et al. Effect of acute toxicity of phenanthrene, pyrene and 1,2,4-trichlorobenzene on earthworms in soils [J]. Rural Eco-Environment, 2003, 19(1): 36-39 (in Chinese)
[9] 吴尔苗, 王军良, 赵士良, 等. 菲和芘单一及复合污染对蚯蚓抗氧化酶活性和丙二醛含量的影响[J]. 环境科学学报, 2011, 31(5): 1077-1085
Wu E M, Wang J L, Zhao S L, et al. Effect of single and combined pollution of Phe, Pyr on SOD, CAT activities and MDA content of Eisenia foeada in soils [J]. Acta Scientiae Circumstantiae, 2011, 31(5): 1077-1085 (in Chinese)
[10] Lopez G R, Levinton J S. Ecology of deposit-feeding animals in marine sediments [J]. The Quarterly Review of Biology, 1987, 62(3): 235-260
[11] Matozzo V, Gagné F, Marin M G, et al. Vitellogenin as a biomarker of exposure to estrogenic compounds in aquatic invertebrates: A review [J]. Environment International, 2008, 34(4): 531-545
[12] Amiard J C, Geffard A, Amiard-Triquet C, et al. Relationship between the lability of sediment-bound metals (Cd, Cu, Zn) and their bioaccumulation in benthic invertebrates [J]. Estuarine Coastal & Shelf Science, 2007, 72(3): 511-521
[13] Tian Y L, Liu H J, Wang Q X, et al. Acute and chronic toxic effects of Pb2+on polychaete Perinereis aibuhitensis: Morphological changes and responses of the antioxidant system [J]. Journal of Environmental Sciences, 2014, 26(8): 1681-1688
[14] Jørgensen A, Giessing A M, Rasmussen L J, et al. Biotransformation of polycyclic aromatic hydrocarbons in marine polychaetes [J]. Marine Environmental Research, 2008, 65(2): 171-186
[15] 崔艳芳, 滕彦国, 刘晶, 等. 生物可利用性及其在重金属污染生态风险评价中的作用[J]. 环境保护科学, 2008, 34(1): 44-46
Cui Y F, Teng Y G, Liu J, et al. Bioavailability and its significance for ecological risk assessment of heavy metal pollution [J]. Environmental Protection Science, 2008, 34(1): 44-46 (in Chinese)
[16] Juhasz A L, Megharaj M, Naidu R. Bioavailability: The major challenge (constraint) to bioremediation of organically contaminated soils [M]// Wise D L. eds. Bioremediation of Contaminated Soils. New York: Marcel Dekker Inc, 2000: 217-242
[17] 宋莹莹, 袁秀堂, 张升利, 等. 苯并(a)芘、镉单一及复合污染对双齿围沙蚕3刚节疣足幼体发育的影响[J]. 海洋环境科学, 2011, 30(3): 333-336
Song Y Y, Yuan X T, Zhang S L, et al. Single and joint toxic effects of benzo(a) pyrene and cadmium on development of three-setiger juvenile of polychaete Pernereis aibuhitensis Grube [J]. Marine Environmental Science, 2011, 30(3): 333-336 (in Chinese)
[18] 赵欢, 赵新达, 岳宗豪, 等. 苯并(a)芘对双齿围沙蚕抗氧化酶活性和细胞色素P450基因表达的影响[J]. 大连海洋大学学报, 2014(4): 342-346
Zhao H, Zhao X D, Yue Z H, et al. Effects of B(a) P exposure on antioxidant enzyme activity and CYP450 gene expression in sandworm Perinereis aibuhitensis [J]. Journal of Dalian Fisheries University, 2014(4): 342-346 (in Chinese)
[19] Fornari R E, Alessi P, Kikic I. ChemInform Abstract: High pressure fluid phase equilibria: Experimental methods and systems investigated (1978-1987) [J]. ChemInform, 1990, 57(47): 1-33
[20] 陶宇, 蔡富才, 赵欢, 等. 沙蚕对翅碱蓬-降油细菌系统降解菲效果的影响[J]. 应用与环境生物学报, 2016, 22(5): 891-896
Tao Y, Cai F C, Zhao H, et al. Effect of Perinereis aibuhitensis on the degradation of phenanthrene in Suaeda heteroptera and oil-degradation bacteria system [J]. Journal of Applied & Environmental Biology, 2016, 22(5): 891-896 (in Chinese)
[21] 孙闰霞, 柯常亮, 林钦, 等. 超声提取/气相色谱-质谱法测定海洋生物中的多环芳烃[J]. 分析测试学报, 2013, 32(1): 57-63
Sun R X, Ke C L, Lin Q, et al. Determination of polycyclic aromatic hydrocarbons (PAHs) in marine organisms by ultrasonic extraction and gas chromatography-mass spectrometry [J]. Journal of Instrumental Analysis, 2013, 32(1): 57-63 (in Chinese)
[22] Phillips D J H. The common mussel Mytilus edulis as an indicator of pollution by zinc, cadmium, lead and copper. I. Effects of environmental variables on uptake of metals [J]. Marine Biology, 1976, 38(1): 59-69
[23] Pastor A, Medina J, Del R J, et al. Determination of lead in treated crayfish Procambarus clarkii: Accumulation in different tissues [J]. Bulletin of Environmental Contamination and Toxicology, 1988, 41(3): 412-418
[24] Papadimitriou E, Loumbourdis N S. Exposure of the frog Rana ridibunda to copper: Impact on two biomarkers, lipid peroxidation, and glutathione [J]. Bulletin of Environmental Contamination and Toxicology, 2002, 69(6): 885-891
[25] Sarkar S, Yadav P, Trivedi R, et al. Cadmium-induced lipid peroxidation and the status of the antioxidant system in rat tissues [J]. Journal of Trace Elements in Medicine and Biology, 1995, 9(3): 144-149
[26] 闫博, 王兰, 李涌泉, 等. 镉对长江华溪蟹肝胰腺抗氧化酶活力的影响[J]. 动物学报, 2007, 53(6): 1121-1128
Yan B, Wang L, Li Y Q, et al. Effects of cadmium on hepatopancreatic antioxidant enzyme activity in a freshwater crab Sinopotamon yangtsekiense [J]. Current Zoology, 2007, 53(6): 1121-1128 (in Chinese)
[27] Solé M, Porte C, Albaigés J. Mixed-function oxygenase system components and antioxidant enzymes in different marine bivalves: Its relation with contaminant body burdens [J]. Aquatic Toxicology, 1994, 30(3): 271-283
[29] 任加云, 潘鲁青, 苗晶晶. 苯并(a)芘和苯并(k)荧蒽混合物对栉孔扇贝毒理学指标的影响[J]. 环境科学学报, 2006, 26(7): 1180-1186
Ren J Y, Pan L Q, Miao J J. Effects of benzo (a)pyrene and benzo (k)fluoranthene mixture on the toxicology parameter of scallop Chlamys farreri [J]. Acta Scientiae Circumstantiae, 2006, 26(7): 1180-1186 (in Chinese)
[30] 丁正峰, 薛晖, 王晓丰, 等. 乐斯本对克氏原螯虾肝胰脏抗氧化系统的影响[J]. 大连海洋大学学报, 2013, 28(1): 72-76
Ding Z F, Xue H, Wang X F, et al. Effects of Lorsban on antioxidant system in hepatopancreas of red swamp crayfish Procambarus clarkii [J]. Journal of Dalian Fisheries University, 2013, 28(1): 72-76 (in Chinese)
[31] Livingstone D, Archibald S, Chipman J, et al. Antioxidant enzymes in liver of dab Limanda limanda from the North Sea [J]. Marine Ecology Progress, 1992, 91(1-3): 97-104
[32] 陶宇. 沙蚕对翅碱蓬-降油细菌组合降解三种多环芳烃效果的影响[D]. 大连: 大连海洋大学, 2016: 15-17
Tao Y. Effect of Perinereis aibuhitensis on the degradation of three kinds of PAHs in Suaeda heteroptera and oil-degradation bacteria models [D]. Dalian: Dalian Ocean University, 2016: 15-17 (in Chinese)
[33] Meador J P, Ernest D W, Kagley A N. A comparison of the non-essential elements cadmium, mercury, and lead found in fish and sediment from Alaska and California [J]. Science of The Total Environment, 2005, 339(1-3): 189-205
[34] 薛秋红, 孙耀. 紫贻贝对石油烃的生物富集动力学参数的测定[J]. 渔业科学进展, 2001, 22(1): 32-36
Xue Q H, Sun Y. Determination of kinetic parameters for bioconcentration of petroleum hydrocar bons by Mytilus edulis [J]. Marine Fisherics Research, 2001, 22(1): 32-36 (in Chinese)
[35] 姜朝军, 乔庆林, 蔡友琼, 等. 菲律宾蛤仔对石油烃的污染动力学和阈值研究[J]. 海洋渔业, 2006, 28(4): 314-320
Jiang C J, Qiao Q L, Cai Y Q, et al. Kinetic features and threshold value of petroleum hydrocarbons for Ruditapes philippinarum [J]. Marine Fisheries, 2006, 28(4): 314-320 (in Chinese)
◆
BioavailablilityofPyreneinthePerinereisaibuhitensis
Cai Fucai, Zhao Huan, Li Yannan, Zhang Wenlong, Yang Dazuo, Zhou Yibing*
Key Laboratory of Marine Bio-resources Restoration and Habitat Reparation in Liaoning Province, Dalian Ocean University, Dalian 116023, China
10.7524/AJE.1673-5897.20170114006
2017-01-14录用日期2017-03-13
1673-5897(2017)3-620-09
X171.5
A
国家自然科学基金资助项目(41306138);海洋公益性行业专项(201305002,201305043);辽宁省教育厅一般项目(L201608)
蔡富才(1991-),男,硕士,研究方向为海洋生态毒理学及海洋污染生境修复,E-mail: caifucai520@126.com;
*通讯作者(Corresponding author), E-mail: ybzhou@dlou.edu.cn
蔡富才, 赵欢, 李艳楠, 等. 双齿围沙蚕对芘的生物可利用性研究[J]. 生态毒理学报,2017, 12(3): 620-628
Cai F C, Zhao H, Li Y N, et al. Bioavailablility of pyrene in the Perinereis aibuhitensis [J]. Asian Journal of Ecotoxicology, 2017, 12(3): 620-628 (in Chinese)
