双酚A对斑马鱼幼鱼神经递质和神经行为的影响
2017-10-13杨丽华史奇朋周炳升
杨丽华,史奇朋, 2,周炳升, *
1. 中国科学院水生生物研究所 淡水生态与生物技术国家重点实验室,武汉 430072. 中国科学院大学,北京 100049
双酚A对斑马鱼幼鱼神经递质和神经行为的影响
杨丽华1,史奇朋1, 2,周炳升1, *
1. 中国科学院水生生物研究所 淡水生态与生物技术国家重点实验室,武汉 430072. 中国科学院大学,北京 100049
环境浓度水平下双酚A(BPA)暴露对生物体的毒性效应受到广泛关注。以早期发育阶段斑马鱼为模型,评价了环境浓度下BPA暴露对斑马鱼幼鱼运动行为的影响,并探讨了可能的作用机制。将斑马鱼胚胎暴露于不同浓度BPA(0、1、3、10和30 μg·L-1)后,斑马鱼幼鱼的整体平均运动速率显著降低。低浓度组幼鱼在持续光照条件下的运动行为显著降低,同时5-羟色胺受体(htr1a)的转录水平增加十分显著,表明BPA可能通过5-羟色胺受体对斑马鱼的运动行为产生影响。而高浓度组幼鱼在第2个黑暗刺激周期的活动过度受到抑制,同时多巴胺受体(d1r)的转录水平显著降低,表明BPA可能通过多巴胺受体影响斑马鱼对外界刺激的响应。HPLC分析结果表明,5-羟色胺和多巴胺神经递质含量在所有浓度组均显著升高。进一步分析与早期神经发育(wnt1, shha)、单胺类递质神经元分化(lmx1a, nr4a2和syn2a)以及递质合成(tph1b, th)相关的基因和蛋白水平,发现神经递质含量的升高可能是由于BPA促进了斑马鱼胚胎早期神经发育和单胺类递质神经元的分化。综上,环境浓度下BPA暴露即可对斑马鱼的运行行为产生影响,提示BPA污染很可能对生态环境及人体健康产生潜在的危害。
双酚A;斑马鱼;神经行为;神经递质
Received22 January 2017accepted8 March 2017
Abstract: Toxic effects of bisphenol A (BPA) on organisms after exposure to environmentally relevant concentrations have received great concerns. In this study, embryos of zebrafish were exposed to series of concentrations (0, 1, 3, 10 and 30 μg·L-1) of BPA, and changes in behavior and the underlying mechanisms were studied. Our results indicated that embryonic exposure to BPA caused a significant decrease in average swimming speed of larval zebrafish. Specifically, larval activity was significantly decreased in a continuous light period in groups of lower concentrations and in the next dark stimulating period in groups of higher concentrations after exposure to BPA. Transcriptional changes of htr1a and d1r indicated these receptors might be responsible for the effects observed above. HPLC analysis showed exposure to BPA increased the contents of dopamine and 5-HT at all treatments examined. Further results of expression of genes and proteins related to neurodevelopment of monoamine neurons (wnt1, shha, lmx1a, nr4a2, syn2a) and rate limiting enzymes for synthesis of dopamine and 5-HT (th, tph1b) provided evidences for our hypothesis that BPA could accelerate neurogenesis and neural differentiation thus resulting in increased number of monoamine neurons. Generally, exposure to environmental relevant levels of BPA could affect neurodevelopment and result in behavioral changes in zebrafish larvae, indicating potential risks for wild animals and human due to BPA pollution.
Keywords: bisphenol A; zebrafish; neurobehavior; neurotransmitter
双酚A(Bisphenol A, BPA)由刚性平面芳环和可塑的非线性脂肪侧链组成,具有无色透明、轻巧耐用、防冲击性强等优点,因此作为一种重要的工业原料被广泛应用到日常生活的各个方面,比如电子设备、体育器材、医疗器械、餐具、以及食品包装等[1]。这些产品的大量使用造成了BPA在环境介质中的广泛分布。在自然水体中,BPA的含量通常为ng·L-1级别。我国珠江三角洲水体中的BPA浓度范围为4~377 ng·L-1[2]。生活污水及工业废水中的BPA含量非常高。如在美国污水处理厂及曾检测到BPA含量为3.642 μg·L-1[3],加拿大某工厂排出的废水中BPA含量高达230~149 ng·L-1或200 ng·L-1[4]。BPA在沉积物中的含量通常为ng·g-1级别,如北京温榆河底沉积物检测到BPA为0.6~59.6 ng·g-1[5]。此外,在各种生物及人类体内都检测到了BPA的存在[2]。近来的研究表明,BPA在非常低的剂量下(远低于FDA推荐的安全剂量)即可对哺乳动物产生影响[6-7],因此环境浓度水平下BPA暴露对生物体的毒性效应研究对于BPA的生态风险评价和管理至关重要。
BPA已被证实具有内分泌干扰效应,它可以通过干扰甲状腺激素、雌激素和雄激素受体等对生物体产生有害效应[8-11]。内源性激素对于生物体内神经发育特别是胚胎发育早期阶段具有十分关键的作用,并且BPA可以通过血脑屏障[12],因此双酚A很可能对生物体早期神经发育及相关功能产生影响。啮齿动物研究表明,BPA可以诱导神经行为的改变,并且这种改变很有可能和动物体内神经递质有关。如Ishido等[13]研究表明BPA可以通过多个环节增加中脑多巴胺活性,导致运动行为异常、注意力降低等不良后果。但生物体的神经行为调控机制十分复杂,其与神经递质的关系也尚不明确。因此,本研究的主要目的为以早期阶段斑马鱼为模型,以运动行为为终点评价低剂量下BPA的神经毒性效应,并从分子水平上揭示BPA对斑马鱼早期神经发育和神经递质的影响,探讨BPA导致神经毒性的可能作用机制。
1 材料与方法(Materials and methods)
1.1 材料与试剂
BPA(纯度> 97%, CAS 85-05-7)购自美国Acros Organics(Thermo Fisher Scientific, New Jersey, US),助溶剂二甲基亚砜(DMSO)(色谱纯)购自美国Sigma Chemical公司(St. Louis, MO, USA)。Trizol试剂购自Invitrogen公司(Invitrogen, Carlsbad, CA, USA)。荧光定量试剂盒购于日本的Toyobo(Osaka, Japan)公司。其他常规试剂为分析纯。
1.2 斑马鱼饲养及胚胎暴露
野生型AB系斑马鱼在(28±0.5) ℃的活性炭过滤的密闭循环水系统中培养,光周期(14 h光照∶10 h黑暗),每天喂丰年虫2次。收集鱼卵的前一天晚上将雄鱼和雌鱼以2∶1的比例置于同一缸中,次日灯光刺激产卵收集。用活性炭过滤自来水清洗鱼卵,剔除异物。在解剖镜下取发育正常的囊胚期斑马鱼胚胎(2 hour post fertilization, hpf),随机分配于含有500 mL暴露工作液的玻璃培养皿中(200颗/皿),BPA暴露浓度依次为0, 1, 3, 10和30 μg·L-1,其中DMSO浓度均为0.005%(V/V),并且设置0.005% DMSO(V/V)为对照组。每个浓度设置5个平行并且每天更换暴露液,并记录孵化数量和死亡数量,及时清除死亡个体。暴露至120 hpf后,每个浓度组随机选取幼鱼进行运动行为分析,其余幼鱼用清洗3~5次后,迅速液氮冷冻后保存于-80 ℃。
1.3 常规发育指标
根据记录数据计算120 hpf的孵化率、存活率和畸形率,计算方法如下:
孵化率=成功孵化数量/胚胎总数
存活率=存活的幼鱼数量/成功孵化数量
畸形率=成功孵化后的畸形数量/存活数量
1.4 幼鱼运动行为分析
每个浓度组随机选取30条健康幼鱼(6条/平行)进行运动行为分析。斑马鱼幼鱼的运动行为量化分析采用ZebraLab行为分析系统(ViewPoint Life Sciences, Montreal, Canada)。斑马鱼幼鱼(120 hpf)置于24孔板中,每孔放置一条鱼,保持温度为28 ℃。实验前适应10 min然后开始监测运动行为。首先在20 min的持续光照下记录幼鱼的运动轨迹,而后使用20 min的光暗周期刺激记录幼鱼运动轨迹(5 min光-5 min暗-5 min光-5 min暗)。每30秒采集一次行为学数据(运动的频率、距离和总时间)。记录的数值用在线Open Office.Org 2.4软件分析数据(http://www.openoffice.org)。
1.5 神经递质含量测定
神经递质含量通过高效液相色谱-电化学联用仪(HPLC-ECD, ESA, Chelmsford, MA, USA)测定。50条幼鱼为一个平行样(每个浓度组2个平行样),在500 μL 0.1 mol·L-1的高氯酸中进行超声破碎,4 ℃、10 000 × g离心10 min,取上清液经0.22 μm的聚乙烯膜过滤,而后进行上机检测(每个平行样做3个重复)。检测条件如下:色谱柱为C18(250 mm×3 mm, 5 μm),流动相为甲醇∶乙腈∶磷酸盐缓冲液(60 nmol·L-1NaH2PO4,50 mmol·L-1乙二胺四乙酸和2 mmol·L-1正十八烷基磺酸钠盐,pH=3.8) = 4∶7∶89,流速为0.8 mL·min-1。
1.6 蛋白质表达水平分析
每个浓度组随机选取400条幼鱼(100条/皿,合并为2个平行样)进行western blot分析。蛋白质提取使用南京凯基公司的全蛋白提取试剂盒,按照说明书操作进行,蛋白质含量检测使用碧云天生物技术的BCA蛋白检测试剂盒。蛋白质样品(每个平行样做2个重复,每个重复取50 μL样品)以6%聚丙烯酰胺凝胶电泳 (SDS-PAGE)分离,电转至PVDF膜(Sigma-Aldrich, St. Louis, MO, USA)。然后将PVDF膜于37 ℃封闭1 h,加入一抗(MBP, AnaSpec, Fremont, CA, USA, 1:800;SYN2a, Synaptic Systems, Göttingen, Germany, 1:1000;或glyceraldehyde 3-phosphate dehydrogenase, 1:1000)于4 ℃过夜。将膜取出,加入辣根过氧化物酶标记二抗(羊抗兔,Proteintech, Wuhan, China, 1:5000),室温孵育2 h。目标带的分子量和净光密度值使用Western blot图象处理系统(FluorChem Q; Alpha Innotech, San Leandro, CA, USA)进行分析。
1.7 基因转录水平分析
总RNA提取使用Trizol法(Invitrogen, Carlsbad, CA, USA)。NanoDrop-2000 spectrophotometer (Nanodrop Technologies Inc., Wil-mington DE, USA)测定总RNA的浓度及质量。cDNA的合成采用PrimeScript®reagent Kit (TaKaRa Bio, Shiga, Japan)试剂盒按照其说明书进行。在定量检测之前使用在线工具http://www.leonxie.com/ referencegene.php评估了较为常用的5个内参基因(rpl8, 18s,β-actin, gapdh, ef1α)在BPA暴露下的转录稳定性,最后选取rpl8作为内参基因。荧光定量PCR采用日本Toyobo公司(Osaka, Japan)的SYBR Green试剂盒,于ABI 7300 (Applied Biosystems, Foster City, CA)进行检测。扩增程序为:95 ℃×10 min变性,95 ℃×30 s,60 ℃×15 s,72 ℃×45 s,35个循环。反应结束后绘制溶解曲线用于检验是否有非特异性产物。对照组和每个暴露浓度组中均设置3个平行样(30条/平行样),每个样品2个重复。实验中所用的基因引物序列采用在线引物设计软件Primer 3 program (http://frodo.wi.miT.edu/)设计,引物序列见表1。目的基因转录水平的相对变化使用2-△△CT法进行计算处理。
1.8 数据处理与分析
所有的数据分析均使用SPSS 13.0 (SPSS, Chicago, IL, USA)软件。实验数据的正态性用Kolmogorov-Smirnov test检测,方差齐性检验采用Levene's test方法;如有需要用对数转换使之符合方差齐性。实验组与对照组间差异显著性分析用one-way ANOVA方法,显著性水平为P<0.05,结果表示以算术平均值 ± 标准误差(mean ± SEM)。作图使用Origin 8.0软件完成。
2 结果(Results)
2.1 常规发育指标
统计结果显示暴露于BPA没有显著影响斑马鱼胚胎/幼鱼的孵化率、存活率、畸形率等指标(表2)。所有浓度组斑马鱼胚胎孵化率均大于85%,存活率大于95%。
2.2 幼鱼运动行为
BPA暴露斑马鱼5 d后,行为分析显示:在整个实验周期内,暴露于3、10和30 μg·L-1BPA的幼鱼平均运动速率显著下降(P < 0.05)(图1A)。在连续光照下,在3 μg·L-1BPA暴露组,运动速率显著下降(P < 0.05)。在光暗交替刺激下,第1个5 min黑暗刺激下,幼鱼运行行为无显著变化;第1个5 min光照内,暴露于3、10和30 μg·L-1的幼鱼速率均显著下降(P < 0.05);在第2个5 min黑暗阶段暴露于10和30 μg·L-1的幼鱼速率均显著下降(P < 0.05);第2个5 min光照下,所有BPA暴露组的幼鱼运动速率均显著下降(P < 0.05)(图1.B)。

图1 BPA暴露对斑马鱼幼鱼运动行为的影响注:A,整个试验周期内平均运动速率;B,光暗周期内平均运动速率。*P < 0.05,** P < 0.01。Fig. 1 Effect of BPA on locomotor behavior of larval zebrafish (Danio rerio)Note: A, average swimming speed during the test; B, average swimming speed during light-dark stimulating photo period. *P < 0.05, ** P < 0.01.

表1 定量PCR所用引物信息Table 1 Primers for q-RT-PCR utilized in this study

表2 BPA暴露对斑马鱼胚胎发育的影响Table 2 The effects of BPA exposure on zebrafish embryos
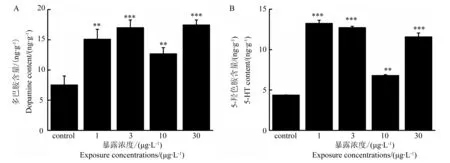
图2 BPA暴露对斑马鱼幼鱼体内多巴胺及5-HT含量的影响注:*P < 0.05。Fig. 2 Effect of BPA on contents of dopamine and 5-HT in larval zebrafish (Danio rerio) Note: *P < 0.05.
2.3 神经递质含量的变化
HPLC-ECD分析结果显示,经BPA暴露后斑马鱼幼鱼体内多巴胺及5-羟色胺的含量在所有处理组均显著升高(P < 0.01)(图2)。
2.4 基因转录水平的变化
荧光定量PCR结果显示(图3),nr4a2、syn2a和htr1a的转录水平在所有BPA暴露组幼鱼体内均显著增加(P < 0.05);tph1b和th的转录水平在3、10和30 μg·L-1BPA暴露组幼鱼体内显著增加,而shha的转录水平在上述浓度组显著降低(P < 0.05);wnt1在10和30 μg·L-1BPA暴露组显著增加(P < 0.05);lmx1a的转录水平在1 μg·L-1浓度组显著降低(P < 0.05),而在10和30 μg·L-1浓度组显著升高(P < 0.05);d1r在3 μg·L-1浓度组显著升高而在30 μg·L-1浓度组显著降低(P < 0.05)。
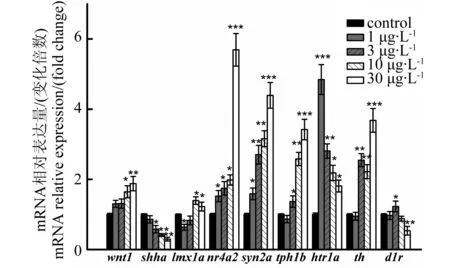
图3 BPA暴露对斑马鱼幼鱼基因转录水平的影响注:* P<0.05,** P<0.01,*** P<0.001。 Fig. 3 Effect of BPA on transcription of genes in larval zebrafish (Danio rerio) Note: * P<0.05, ** P<0.01, *** P<0.001.
2.5 蛋白表达水平的变化
western blot分析结果表明(图4),LMX1A蛋白表达水平在3 μg·L-1BPA暴露组幼鱼体内显著降低(P < 0.05),而在30 μg·L-1暴露组幼鱼体内显著增加(P < 0.05);SYN2α蛋白的表达水平在1和3 μg·L-1BPA暴露组幼鱼体内显著降低(P < 0.05),而在10和30 μg·L-1浓度组变化不显著。
3 讨论(Discussion)
本研究以早期发育阶段斑马鱼为模型,评价了环境浓度下BPA暴露对斑马鱼幼鱼运动行为的影响,并探讨了可能的作用机制。结果表明,胚胎期暴露于3 μg·L-1BPA即可影响孵化后幼鱼在持续光照和光暗刺激条件下的运行行为,这种影响可能与神经递质含量及功能的变化有关。同时我们的结果还表明,斑马鱼幼鱼体内的神经递质在低浓度和高浓度BPA暴露下的响应机制不同。
斑马鱼幼鱼的运动行为在第1个持续光照周期内,仅在较低浓度(3 μg·L-1)出现了显著降低;而在第2个黑暗刺激周期内,高浓度组幼鱼的活动过度受到抑制。同时,在整个试验周期内,斑马鱼幼鱼的平均运动速率显著降低。Gioiosa等[14]也观察到类似的结果,他们将发育期小鼠暴露于甲氧滴滴涕和BPA,结果发现小鼠成年后的运动能力降低。Farabollini等[15]的研究表明,围产期BPA暴露可以减轻雄性后代的焦虑样行为,降低雌性和雄性子代的探究能力。但是还有一些研究表明,BPA暴露可以导致实验动物活动过度。如Ishido等[16]发现脑池内注射BPA 4周后可以增加自发性运动,Mizuo等[17]的研究表明胚胎期和哺乳期BPA暴露也可以导致运动活力增加。BPA暴露还可以改变对外界刺激的响应,如胚胎期和哺乳期BPA暴露也可以导致幼鼠对吗啡反应的改变[17],成年大鼠暴露于BPA后,其在疼痛或恐惧刺激条件下的运动行为加剧[18]。上述结果表明,胚胎阶段暴露于BPA可以降低孵化后幼鱼在持续光照条件下的自发性行为以及光暗交替刺激条件下的应激性运动行为。
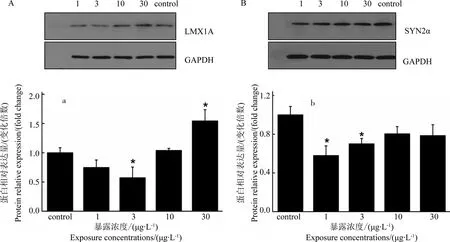
图4 BPA对斑马鱼幼鱼神经发育相关蛋白表达水平的影响注:A,LMX1A的western blot分析结果;a,LMX1A蛋白的相对表达量;B,SYN2α的western blot分析结果; b,SYN2α蛋白的相对表达量。* P<0.05。Fig. 4 Effect of BPA on protein related to neurodevelopment in larval zebrafish (Danio rerio)Note: A, western blot analysis of LMX1A; a, relative expression of LMX1A; B, western blot analysis of SYN2α; b, relative expression of SYN2α. * P<0.05.
虽然生物体神经行为的调控机制尚不清楚,但是神经递质多巴胺和5-羟色胺及其受体在其中的关键作用已经得到证实。Hidaka等[19]的研究表明,多巴胺受体拮抗剂可以使实验动物在刺激条件下表现出的运动过度消失,而5-羟色胺受体可能参与自发性活动的调节。本研究中,htr1a的转录水平在低浓度组增加十分显著,这可能与观察到的第1个持续光照条件下运行行为降低有关。而在高浓度组,多巴胺受体(d1r)的转录水平受到显著抑制,这可能与第2个黑暗刺激阶段斑马鱼幼鱼的运动行为变化有关。因此我们推测,在不同浓度BPA暴露条件下,斑马鱼幼鱼体内神经递质系统的响应机制存在差异。
然而当我们进一步检测这2种神经递质的含量时发现,各BPA暴露组斑马鱼幼鱼体内神经递质的含量均出现非常显著的升高。类似地,Nakamura等[20]研究发现胚胎期及哺乳期暴露于BPA可导致小鼠体内多巴胺含量显著升高;Matsuda等[21]也发现暴露于的BPA雄性小鼠海马体及杏仁核部位的多巴胺含量升高。我们的基因定量结果表明,与5-羟色胺合成相关的基因tph1b和与多巴胺合成相关的基因th也都显著升高,这可能是导致这2种神经递质含量水平显著升高的直接原因。
Nakamura等[22]的研究表明,BPA可能通过促进胚胎期小鼠神经元分化和迁移影响其新脑皮层的发育,我们猜测这可能是导致本研究中神经递质含量升高的主要原因,因此进一步检测了与神经系统早期发育相关的关键基因和蛋白的表达水平。Wnt1在中脑和后脑的神经特化过程中具有关键作用,它可以通过抑制b-catenin的降解调控shh基因表达,从而抑制神经发生[23]。我们的研究结果中,wnt1的基因转录水平显著增加,而shha基因的转录水平显著受到抑制,表明早期神经发育受到促进,与Nakamura等[22]的研究结果一致。Wnt1还可以通过lmx1a调控nr4a2,进而影响单胺类神经递质神经元前体细胞的分化、成熟以及存活[24]。SYN2a是突触形成的标志物,在突触发生以及神经递质释放过程中均起到关键作用[25]。本研究中nr4a2和syn2a基因的转录水平也出现显著性的升高,表明BPA可以通过促进早期神经发育而加速单胺类递质神经元的分化。值得注意的是,与单胺类递质神经元发育相关的lmx1a基因的转录水平仅在高浓度下显著增加,而在低浓度组显著降低。我们进一步检测了LMX1A蛋白质含量,结果与基因表达水平相一致。同时SYN2a蛋白质含量仅在低浓度组显著降低,在高浓度组没有显著变化。我们推测,在低浓度BPA暴露组幼鱼体内触发了某种保护机制,可以在某种程度上修复BPA引起的神经系统的影响,这也可以解释在低浓度组幼鱼行为变化不明显的现象。

图5 BPA暴露导致斑马鱼运动行为变化的作用机制示意图Fig. 5 A diagram presenting possible mechanism of BPA-induced behavioral changes of larval zebrafish (Danio rerio)
综上,本研究中BPA暴露可以促进斑马鱼胚胎早期神经发育及单胺类递质神经元的分化,导致神经递质含量的显著性升高;在低浓度和高浓度BPA暴露条件下,可能分别通过5-羟色胺受体和多巴胺受体影响幼鱼的运动行为,其作用机制总结如图5。环境浓度下BPA暴露即可对斑马鱼的运行行为产生影响,提示BPA污染很可能对生态环境及人体健康产生潜在的危害。神经递质对运动行为的调控机制以及在外源性污染物诱导神经毒性过程中的作用还需要进一步的深入研究。
[1] Staples C A, Dorn P B, Klecka G M, et al. A review of the environmental fate, effects, and exposures of bisphenol A [J]. Chemosphere, 1998, 36(10): 2149-2173
[2] Yang J, Li H, Ran Y, et al. Distribution and bioconcentration of endocrine disrupting chemicals in surface water and fish bile of the Pearl River Delta, South China [J]. Chemosphere, 2014, 107: 439-446
[3] Drewes J E, Hemming J, Ladenburger S J, et al. An assessment of endocrine disrupting activity changes during wastewater treatment through the use of bioassays and chemical measurements [J]. Water Environment Research, 2005, 77(1): 12-23
[4] Lee H B, Peart T E. Determination of bisphenol A in sewage effluent and sludge by solid-phase and supercritical fluid extraction and gas chromatography/mass spectrometry [J]. Journal of AOAC International, 2000, 83(2): 290-297
[5] Lei B L, Luo J P, Zha J M, et al. Distribution of nonylphenols and bisphenol-A in the sediments of Wenyuhe River [J]. Environmental Chemistry, 2008, 27: 314-317
[6] vom Saal F S. Bisphenol A eliminates brain and behavior sex dimorphisms in mice: How low can you go? [J]. Endocrinology, 2006, 147(8): 3679-3680
[7] Leranth C, Hajszan T, Szigeti-Buck K, et al. Bisphenol A prevents the synaptogenic response to estradiol in hippocampus and prefrontal cortex of ovariectomized nonhuman primates [J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(37): 14187-14191
[8] Kuiper G G, Lemmen J G, Carlsson B, et al. Interaction of estrogenic chemicals and phytoestrogens with estrogen receptor beta [J]. Endocrinology, 1998, 139(10): 4252-4263
[9] Sohoni P, Tyler C R, Hurd K, et al. Reproductive effects of long-term exposure to bisphenol A in the fathead minnow (Pimephales promelas) [J]. Environmental Science & Technology, 2001, 35(14): 2917-2925
[10] Lee H J, Chattopadhyay S, Gong E Y, et al. Antiandrogenic effects of bisphenol A and nonylphenol on the function of androgen receptor [J]. Toxicological Sciences, 2003, 75(1): 40-46
[11] Zoeller R T, Bansal R, Parris C. Bisphenol A, an environmental contaminant that acts as a thyroid hormone receptor antagonist in vitro, increases serum thyroxine, and alters RC3/neurogranin expression in the developing rat brain [J]. Endocrinology, 2005, 146(2): 607-612
[12] Sun Y, Nakashima M N, Takahashi M, et al. Determination of bisphenol A in rat brain by microdialysis and column switching high-performance liquid chromatography with fluorescence detection [J]. Biomedical Chromatography, 2002, 16(5): 319-326
[13] Ishido M, Masuo Y, Terasaki M, et al. Rat hyperactivity by bisphenol A, but not by its derivatives, 3-hydroxybisphenol A or bisphenol A 3,4-quinone [J]. Toxicology Letters, 2011, 206(3): 300-305
[14] Gioiosa L, Fissore E, Ghirardelli G, et al. Developmental exposure to low-dose estrogenic endocrine disruptors alters sex differences in exploration and emotional responses in mice [J]. Hormones & Behavior, 2007, 52(3): 307-316
[15] Farabollini F, Porrini S, Dessì-Fulgherit F. Perinatal exposure to the estrogenic pollutant bisphenol A affects behavior in male and female rats [J]. Pharmacology Biochemistry & Behavior, 1999, 64(4): 687-694
[16] Ishido M, Masuo Y, Kunimoto M, et al. Bisphenol A causes hyperactivity in the rat concomitantly with impairment of tyrosine hydroxylase immunoreactivity [J]. Journal of Neuroscience Research, 2004, 76(3): 423-433
[17] Mizuo K, Narita M, Miyagawa K, et al. Prenatal and neonatal exposure to bisphenol-A affects the morphine-induced rewarding effect and hyperlocomotion in mice [J]. Neuroscience Letters, 2004, 356(2): 95-98
[18] Aloisi A M, Della S D, Rendo C, et al. Exposure to the estrogenic pollutant bisphenol A affects pain behavior induced by subcutaneous formalin injection in male and female rats [J]. Brain Research, 2002, 937(1-2): 1-7
[19] Hidaka N, Suemaru K, Araki H. Serotonin-dopamine antagonism ameliorates impairments of spontaneous alternation and locomotor hyperactivity induced by repeated electroconvulsive seizures in rats [J]. Epilepsy Research, 2010, 90(3): 221-227
[20] Nakamura K, Itoh K, Yoshimoto K, et al. Prenatal and lactational exposure to low-doses of bisphenol A alters brain monoamine concentration in adult mice [J]. Neuroscience Letters, 2010, 484(1): 66-70
[21] Matsuda S, Matsuzawa D, Ishii D, et al. Effects of perinatal exposure to low dose of bisphenol A on anxiety like behavior and dopamine metabolites in brain [J]. Progress in Neuro-psychopharmacology & Biological Psychiatry, 2012, 39(2): 273-279
[22] Nakamura K, Itoh K, Yaoi T, et al. Murine neocortical histogenesis is perturbed by prenatal exposure to low doses of bisphenol A [J]. Journal of Neuroscience Research, 2006, 84(6): 1197-1205
[23] Prakash N, Brodski C, Naserke T, et al. A Wnt1-regulated genetic network controls the identity and fate of midbrain-dopaminergic progenitors in vivo [J]. Development, 2006, 133(1): 89-98
[24] Chung S, Leung A, Han B S, et al. Wnt1-lmx1a forms a novel autoregulatory loop and controls midbrain dopaminergic differentiation synergistically with the SHH-FoxA2 pathway [J]. Cell Stem Cell, 2009, 5(6): 646-658
[25] Kao H T, Porton B, Czernik A J, et al. A third member of the synapsin gene family [J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(8): 4667-4672
◆
TheEffectsofBPAonNeurobehaviorandNeurotransmittersofLarvalZebrafish(Daniorerio)
Yang Lihua1, Shi Qipeng1, 2, Zhou Bingsheng1, *
1. State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China2. University of Chinese Academy of Sciences, Beijing 100049, China
10.7524/AJE.1673-5897.20170122001
2017-1-22录用日期2017-3-8
1673-5897(2017)3-162-08
X171.5
A
周炳升(1965-),男,博士研究生导师,责任研究员,主要研究方向为环境毒理学,特别是有机污染物对水生生物作用的毒性效应、风险评价、健康危害及生态毒理学效应。
中国科学院战略性先导科技专项(XDB140401);中国科学院水生生物研究所特色研究所服务项目(Y55Z05)
杨丽华(1984-),女,博士,副研究员,研究方向为环境毒理学,E-mail: lhyang@ihb.ac.cn
*通讯作者(Corresponding author), E-mail: bszhou@ihb.ac.cn
杨丽华, 史奇朋, 周炳升. 双酚A对斑马鱼幼鱼神经递质和神经行为的影响[J]. 生态毒理学报,2017, 12(3): 162-169
Yang L H, Shi Q P, Zhou B S. The effects of BPA on neurobehavior and neurotransmitters of larval zebrafish (Danio rerio) [J]. Asian Journal of Ecotoxicology, 2017, 12(3): 162-169 (in Chinese)
