全氟辛酸(PFOA)对菲律宾蛤仔体内酶活性的影响
2017-10-13刘芝余翟毓秀姚琳江艳华李风铃王联珠尚德荣杨元昊郭萌萌谭志军
刘芝余,翟毓秀,姚琳,江艳华,李风铃,*,王联珠,尚德荣,杨元昊,郭萌萌,谭志军
1. 中国水产科学研究院黄海水产研究所,农业部水产品质量安全检测与评价重点实验室,青岛 2660712. 南京农业大学无锡渔业学院,无锡2141823. 陕西省水产研究所,中国水产科学研究院黄河水产研究所,西安 710086
全氟辛酸(PFOA)对菲律宾蛤仔体内酶活性的影响
刘芝余1,2,翟毓秀1,姚琳1,江艳华1,李风铃1,*,王联珠1,尚德荣1,杨元昊3,郭萌萌1,谭志军1
1. 中国水产科学研究院黄海水产研究所,农业部水产品质量安全检测与评价重点实验室,青岛 2660712. 南京农业大学无锡渔业学院,无锡2141823. 陕西省水产研究所,中国水产科学研究院黄河水产研究所,西安 710086
采用半静态毒性实验方法,将菲律宾蛤仔(Ruditapes philippinarum)分别暴露于0.2、2、20 μg·L-1的全氟辛酸(perfluorooctanoic acid, PFOA)中,在处理后第1、3、6、10、15、21天分别取样,测定整体组织中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、谷胱甘肽-S-转移酶(GST)、7-乙氧基异吩噁唑酮脱乙基酶(EROD)活性和过氧化脂质(LPO)含量。酶活性分析结果显示:PFOA对菲律宾蛤仔组织SOD、CAT和POD活性均呈现先促进后抑制的作用;低浓度组SOD活性在暴露第1天达到最高,显著高于对照组(P < 0.01);中高浓度组SOD活性在暴露第6天达到最低;暴露1~15 d,低浓度组CAT活性均显著高于对照组(P < 0.05);高浓度组CAT活性在暴露第6天得到显著诱导,其余时间基本处于抑制状态;中浓度组POD活性在暴露第3天即达到最高,高浓度组POD活性基本一直处于抑制状态;随着PFOA暴露时间的延长,菲律宾蛤仔组织LPO含量呈现了先降低后升高的趋势;各浓度组中EROD的活力都显著被诱导(P < 0.01),与处理浓度呈正相关;中高浓度组的GST活性在胁迫期间变化比较显著,呈现诱导-抑制的变化规律。研究表明,PFOA暴露能够引起菲律宾蛤仔组织抗氧化酶和生物转化酶的变化,可以与其他敏感性指标一起作为指示早期海洋PFOA污染的生物标志物。
PFOA;菲律宾蛤仔;毒性效应;抗氧化酶系;生物转化酶
Received13 January 2017accepted13 March 2017
Abstract: A semi-static toxicity experiment under laboratory conditions was carried out to study the effects of different concentrations (low, 0.2 μg·L-1; medium, 2 μg·L-1; and high, 20 μg·L-1) perfluorooctanoic acid (PFOA) on Ruditapes philippinarum. After exposure for 1, 3, 6, 10, 15, 21 days, activities of superoxide dismutase (SOD), catalase (CAT), peroxidase (POD), glutathione-S-transferase (GST), 7-ethoxy-resorufin-o-deethylase (EROD) and lipid peroxide (LPO) content were measured. Under the effects of PFOA, the SOD, CAT, and POD activities decreased after an initial increase. After 1 day exposure to low concentration PFOA, the SOD activity reached the maximum, being significantly higher than the control (P < 0.01). The SOD activity in the medium and high concentration group reached the lowest at 6th day. After exposure to low concentration PFOA for 1-15 days, the CAT activity was significantly higher than the control. However, the CAT activity was basically inhibited when exposed to high concentration PFOA, except for being the highest on the 6th day. The POD activity in the medium concentration group reached the highest on the 3th day, and was basically inhibited in the high concentration group. As the extension of PFOA exposure time, the LPO content increased after an initial decrease. The EROD activity was significantly induced, and was positively correlated with the concentration of PFOA. The GST activity significantly changed when exposed to medium and high concentrations PFOA during the stress period, and changed by the rule of induction-inhibition. The results showed that PFOA exposure could trigger the changes of antioxidant enzymes and biotransformation enzymes in Ruditapes philippinarum, which could be considered as potential biomarkers to warning PFOA pollution in marine.
Keywords: PFOA; Ruditapes philippinarum; toxic effects; antioxidant enzymes; biotransformation enzymes
全氟辛酸(perfluorooctanoic acid, PFOA)是人工合成的化学品,具有独特的疏水疏油性,被广泛应用于航空科技、运输、电子行业,以及厨具等民生用品中[1-2]。目前,PFOA的生产和使用已经超过50年,环境中存在大量的PFOA残留。调查发现,PFOA在大气[3]、水体[4-5]、沉积物[6]、野生动物[7]和人体[8-10]中甚至偏远地区均可检测到。毒理学研究显示,PFOA对鱼类、禽类、大鼠等动物具有胚胎发育、生殖、肾脏等多种毒性[11],另外可引起动物基因的异常表达、细胞膜结构损伤或破坏、酶活性降低等多种不良生物学效应,并易使机体感染疾病致使死亡率增加[12]。PFOA污染已引起越来越多科学家的关注,探索其致毒机理,评价其对生态环境及人体健康的影响[13]。
研究表明,污染物的毒性作用最先体现在机体的细胞、生物化学和分子水平上的变化[14]。当PFOA进入机体内,引起体内系统的代谢转化,产生系列活性氧,如·O2-、·OH、H2O2等,造成机体氧化损伤[15]。脂质过氧化物(lipid peroxidation, LPO)是机体膜脂质过氧化反应的主要产物之一,其含量的高低可以直接反应生物体内脂质过氧化的程度,也可间接反映生物体内活性氧的累积程度和细胞的损伤程度[16]。生物体需要开启防御系统来对抗自由基可能产生的细胞损伤,抗氧化酶系统及机体生物转运反应的启动,就可以认为是生物体抵抗环境污染和抵御毒性损伤的反应[17]。超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)和过氧化物酶(peroxidase, POD)是生物体抗氧化酶体系的重要组成部分,在活性氧自由基的清除中发挥重要作用。SOD能歧化氧自由基变成H2O2,CAT和POD催化分解H2O2为H2O和O2。相关研究指出,PFOA可以引起生物体内SOD和CAT等抗氧化酶活性显著变化,产生及一系列抗氧化反应,从而导致氧化损伤[18-20]。当活性氧平衡遭到破坏时,机体通过相Ⅰ、相Ⅱ的生物转运反应来缓解氧化压力,参与相Ⅰ、相Ⅱ反应的主要酶系为7-乙氧基异吩噁唑酮脱乙基酶(7-ethoxy-resorufin-o-deethylase, EROD)和谷胱甘肽S转移酶(glutathione S-transferase, GST),可以将它们作为生物标志物来指示特定污染物的污染状况[21-22]。
菲律宾蛤仔(Ruditapes philippinarum)是我国沿海地区重要的滩涂贝类,分布极广,对污染物具有高蓄积性、高敏感性等特点,被广泛应用于污染物检测和环境预警研究中[23-25]。本实验通过海水直接暴露方式,观察不同时间点菲律宾蛤仔的抗氧化酶系统和生物转化酶活性的变化,分析探讨PFOA胁迫过程中菲律宾蛤仔SOD、CAT、POD、EROD、GST和LPO含量等一系列生理生化指标,为PFOA在海洋中污染监测和环境毒理学研究提供理论依据。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
仪器:可见分光光度计(V1800,尤尼柯(上海)仪器有限公司),酶标仪(iMark 168-1130,美国Bio-Rad公司),台式高速冷冻离心机(Neofuge 15R,上海力康生物医疗科技控股有限公司),电热恒温水浴锅(HWS-26,上海圣科仪器设备有限公司),匀浆机(T18,德国IKA集团)。
试剂:全氟辛酸(C8HF15O2),纯度为AR级(Sigma公司,美国)。SOD、CAT、GST、LPO、EROD、POD酶活力测试盒和蛋白质试剂盒均购自南京建成生物工程研究所。其他试剂均为分析纯,购自中国国药有限公司。
1.2 实验材料
成体蛤仔壳长(3.5±0.14) cm,壳宽(2.0±0.22) cm,采集于山东省青岛市水产品批发市场,实验开始前于实验室驯养1周。实验中所用到的海水均采集于远离工业和生活区的近海海域,属于Ⅰ类海水。
1.3 实验方法1.3.1 曝毒实验
根据预实验结果设计PFOA对菲律宾蛤仔的暴露浓度,设置3个浓度组:0.2、2、20 μg·L-1,每个浓度设置3个平行组,曝毒水体为3 L。每个实验组随机投放40只菲律宾蛤仔。饲养期间温度保持在20~25 ℃,盐度25‰~30‰,pH 7.7~8.5。连续充氧,24 h更换1次实验海水,每日正常投放绿藻粉,投放量占菲律宾蛤仔体重的0.6‰。
1.3.2 样品的制备及测定
实验分别于第1、3、6、10、15、21天取样,每组取8个菲律宾蛤仔整只研磨,称取这8个个体的5 g组织样,加入预冷的贝类生理盐水[26](0.02 mol·L-1HEPES缓冲液,0.4 mol·L-1NaCl,0.1 mol·L-1MgSO4,0.01 mol·L-1KCl,0.01 mol·L-1CaCl2,pH 7.4),匀浆机匀浆,4 ℃下2 500 r·min-1离心10 min后立即取上清液,冻存于-80 ℃,留待蛋白质含量和SOD、CAT、POD等一些酶活力测定。匀浆比例为组织质量(g)∶贝类生理盐水体积(mL)=1∶9。酶的活性测定均按照试剂盒说明书进行,蛋白质含量采用考马斯亮蓝比色法测定。
1.4 数据处理
实验数据用统计学方法进行处理,进行统计分析,结果用平均值±标准偏差(X ± SD)表示。采用SPSS 22.0软件中的单因素方差分析法(One-Way ANOVA)进行差异分析,用Turkey法比较组间数据的差异。各浓度组与空白对照组差异显著(P < 0.05)表示为a,差异显著(P < 0.01)表示为b,未标注则表示与空白对照组无显著性差异(P > 0.05)。
抑制率和诱导率的计算公式为:抑制率(%) = (1 - 浓度组酶活性/对照组酶活性)×100%,诱导率(%) =(浓度组酶活性/对照组酶活性)×100%。
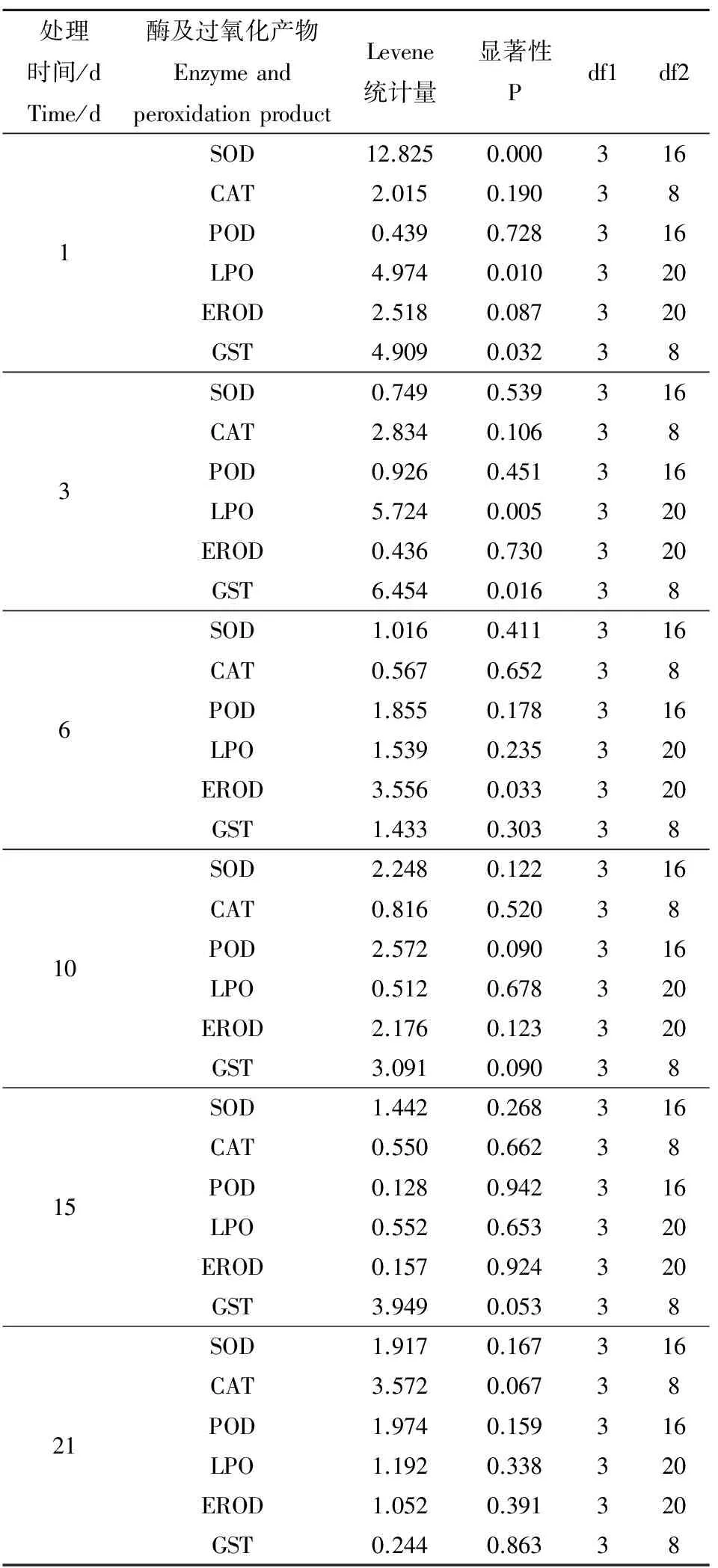
表1 方差齐性检验Table 1 Homogeneity test of variances
注:SOD, CAT, POD, LPO, EROD, GST表示超氧化物歧化酶、过氧化氢酶、过氧化物酶、脂质过氧化物、7-乙氧基异吩噁唑酮脱乙基酶、谷胱甘肽S转移酶。
Note: SOD, CAT, POD, LPO, EROD, GST stand for superoxide dismutase, catalase, peroxidase, lipid peroxidation, 7-ethoxy-resorufin-o-deethylase, glutathione S-transferase.
2 结果(Results)
2.1 方差齐性分析
表1为实验数据方差齐性分析结果。P > 0.05说明方差相等,P < 0.05说明为非等方差。方差齐性检验结果表明,数据方差大部分为等方差,方差齐性较好。
2.2 PFOA对菲律宾蛤仔组织SOD的影响
PFOA胁迫下菲律宾蛤仔SOD变化见图1。在胁迫第1天,0.2和2 μg·L-1浓度组SOD酶活即被诱导,且与对照组相比,具有显著差异(P < 0.01),诱导率分别为128%和115.22%;随着胁迫时间的延长,在第6天时,各个处理组的SOD活性迅速下降,被显著抑制(P < 0.01),抑制率分别为24.38%、37.94%和33.69%;第10天,除20 μg·L-1浓度组被显著诱导外(P < 0.01),其余浓度组依然处于抑制状态;第15天,与对照组相比,除0.2 μg·L-1浓度组SOD酶活性被显著抑制外,其余浓度组均显著提高;而0.2 μg·L-1浓度组则在第21天被再次诱导,诱导率为113.6%,其余浓度组却被显著抑制。
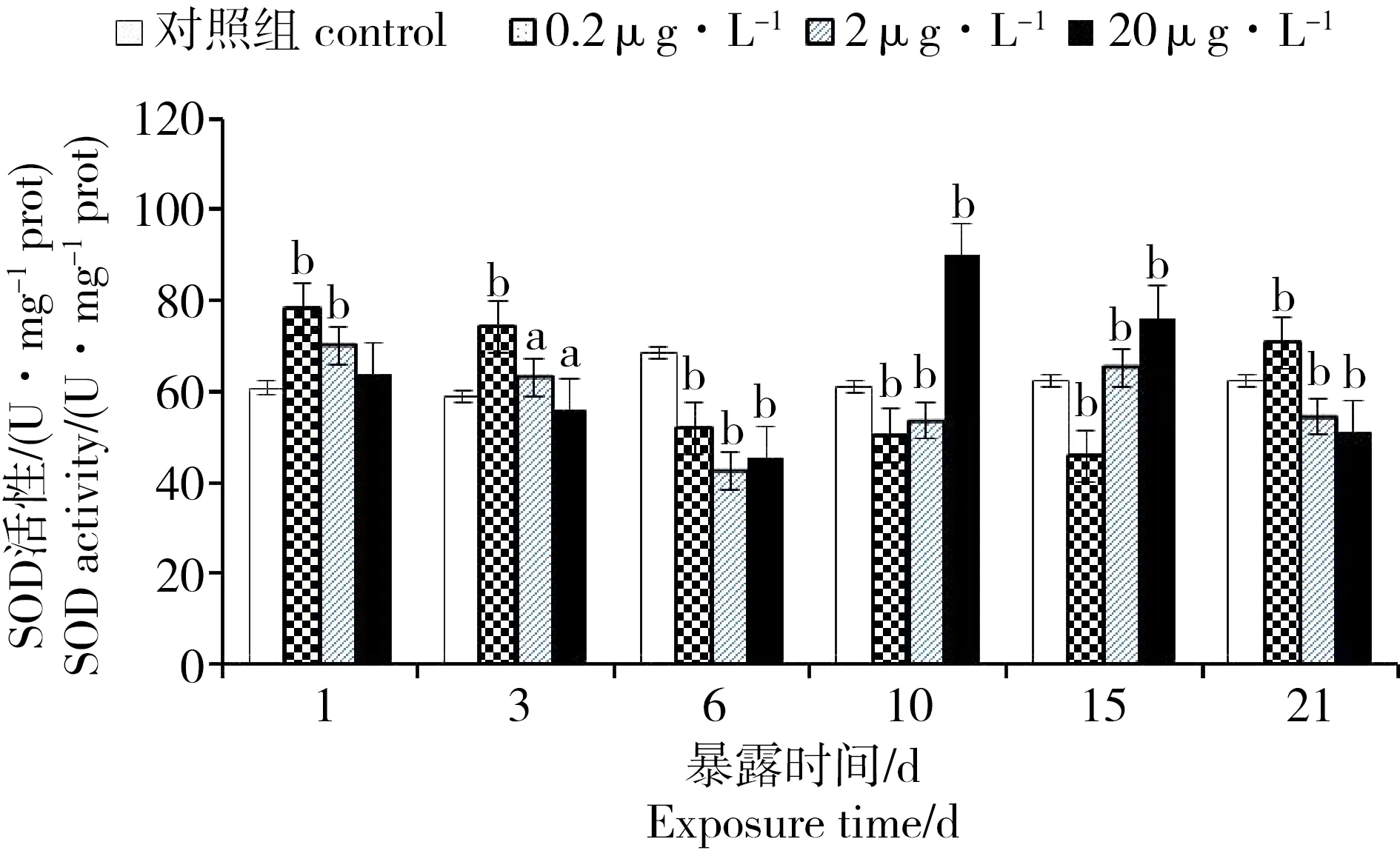
图1 全氟辛酸(PFOA)对菲律宾蛤仔SOD活性的影响注:a 显著差异(P < 0. 05),b 显著差异(P < 0. 01),下同。Fig. 1 Effects of perfluorooctanoic acid (PFOA) on the SOD activity of R. philippinarumNote: a. significant difference (P < 0. 05); b. significant difference (P < 0. 01). The same case in the following figures.
2.3 PFOA对菲律宾蛤仔组织CAT的影响
PFOA胁迫下菲律宾蛤仔CAT变化见图2。对照组菲律宾蛤仔抗氧化酶活性在所检测时间范围内未出现显著变化(P > 0.05)。CAT活性在PFOA作用下的响应特征较为敏感,在0.2和2 μg·L-1PFOA作用下,菲律宾蛤仔CAT活性在胁迫初期始终处于诱导状态(P < 0.01),且随着胁迫天数的增加,诱导得越明显。0.2 μg·L-1浓度组的CAT活性在第15天达到顶峰后,CAT活力开始显著降低,至21 d时活力明显低于对照组;2 μg·L-1浓度组的CAT活性至第6天达到活力最高峰后逐渐降低,在第21天时活力又显著高于对照组。20 μg·L-1浓度组的CAT活性在胁迫期间基本处于抑制状态,仅在第6天活性得到诱导,与胁迫时间之间并无明显对应关系。
2.4 PFOA对菲律宾蛤仔组织POD的影响
PFOA胁迫下菲律宾蛤仔组织POD变化见图3。0.2和2 μg·L-1浓度组在胁迫初期一直处于显著诱导状态(P < 0.01),但0.2 μg·L-1浓度组在第6天时活性开始下降,但仍处于诱导状态,至第15天后活性又开始上升;而2 μg·L-1浓度组在第6天时活性得到显著抑制(P < 0.01),在第15天活性得到再次诱导后,21 d时重新变为抑制状态;20 μg·L-1浓度组与其他2组相比,POD活力抑制得更为显著,基本一直处于抑制状态。
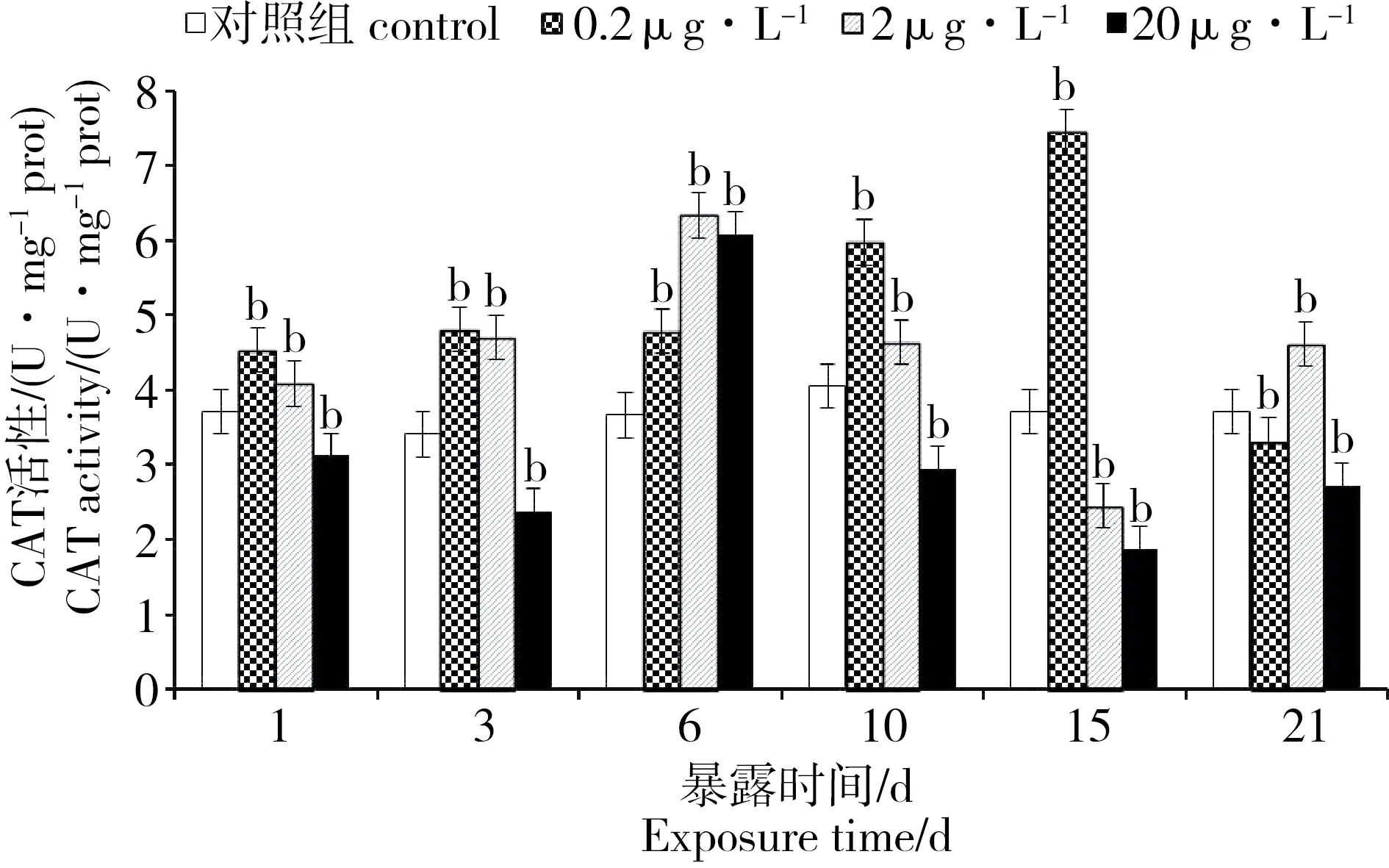
图2 PFOA对菲律宾蛤仔CAT活性的影响Fig. 2 Effects of PFOA on the CAT activity of R. philippinarum
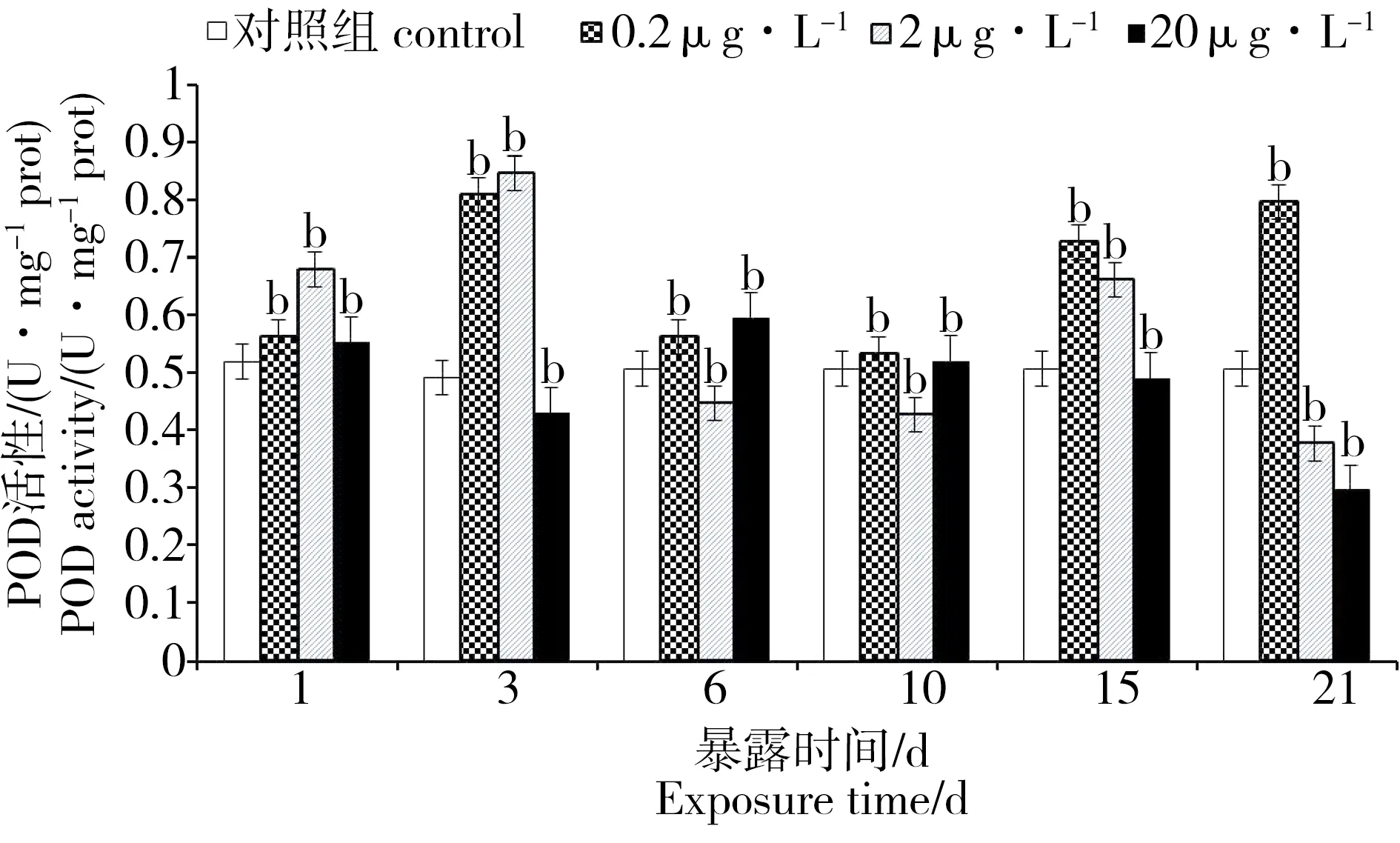
图3 PFOA对菲律宾蛤仔POD活性的影响Fig. 3 Effects of PFOA on the POD activity of R. philippinarum
2.5 PFOA对菲律宾蛤仔组织LPO的影响
PFOA胁迫下菲律宾蛤仔组织LPO含量变化见图4。与对照组相比,各个浓度组的LPO含量在前15 d一直处于降低状态,在第10天时最低;0.2 μg·L-1浓度组的LPO含量在第15天时开始上升,但仍明显低于对照组,直至第21天时LPO含量明显升高;而2和20 μg·L-1浓度组的LPO含量在第15天显著增加,与对照组相比差异显著(P < 0.01);第21天时,20 μg·L-1浓度组的LPO含量与对照组无显著差异。
2.6 PFOA对菲律宾蛤仔组织EROD的影响
PFOA胁迫下菲律宾蛤仔组织EROD变化见图5。在整个PFOA暴露阶段,不同浓度组EROD活性均显著高于对照组。EROD活力在整个实验期间与浓度组的暴露浓度成正比,浓度越高,EROD的活力越高。2、20 μg·L-1浓度组的EROD活力分别从第10天开始缓慢降低,但与对照组相比仍然处于诱导状态。
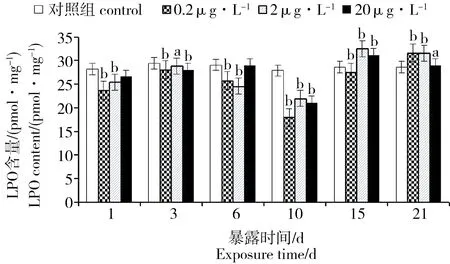
图4 PFOA对菲律宾蛤仔LPO含量的影响Fig. 4 Effects of PFOA on the LPO content of R. philippinarum
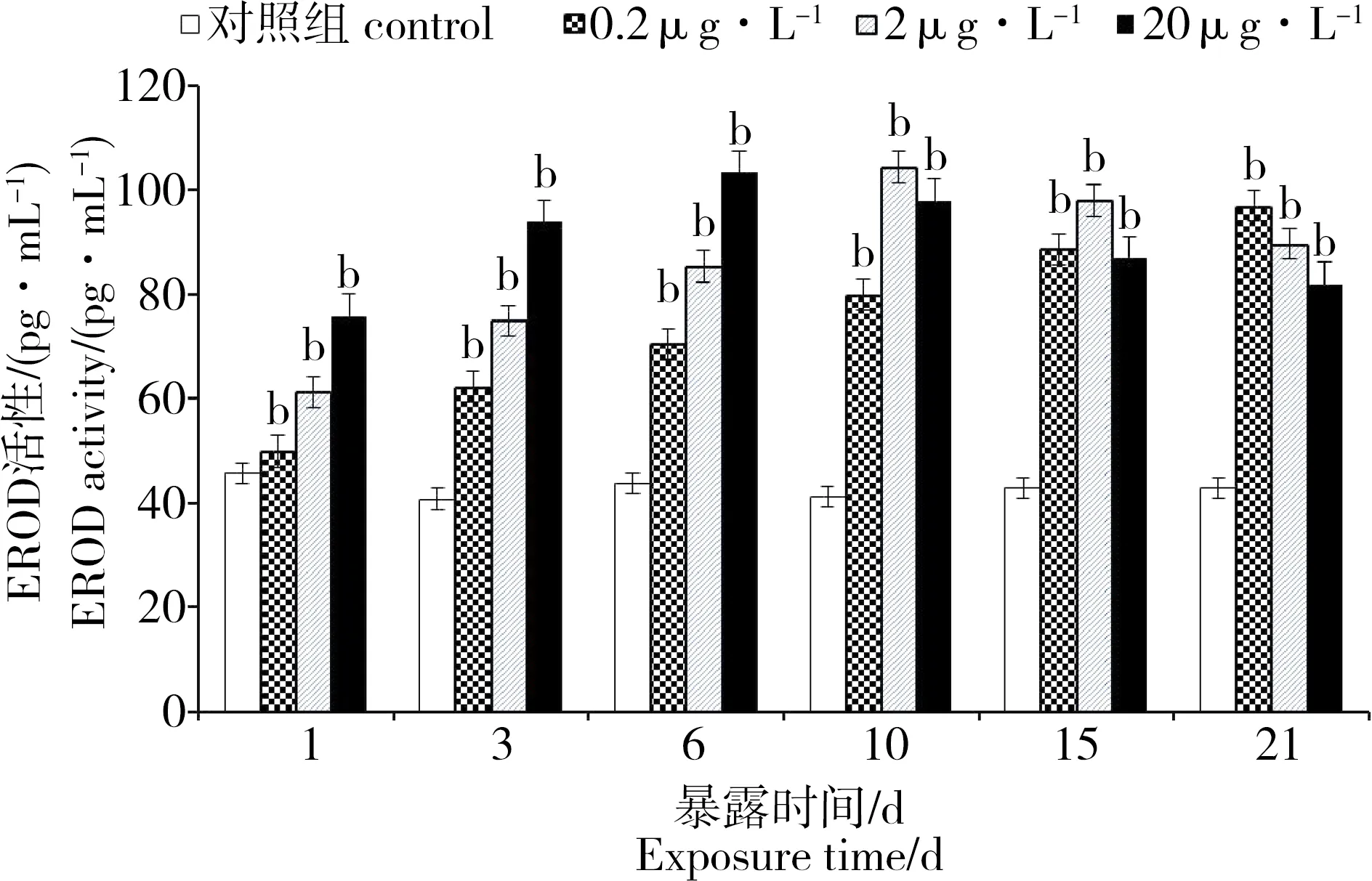
图5 PFOA对菲律宾蛤仔EROD活性的影响Fig. 5 Effects of PFOA on the EROD activity in the tissues of R. philippinarum
2.7 PFOA对菲律宾蛤仔组织GST的影响
PFOA胁迫下菲律宾蛤仔组织GST变化见图6。与对照组相比,0.2 μg·L-1浓度组在胁迫前期GST的活性变化不大,直至第15天时活性才被显著诱导,后又开始下降被抑制;2和20 μg·L-1浓度组的GST活性在胁迫初期被显著诱导(P < 0.01),随着胁迫时间的延长,在第6天时活性开始下降,至第15天时跌至谷底。
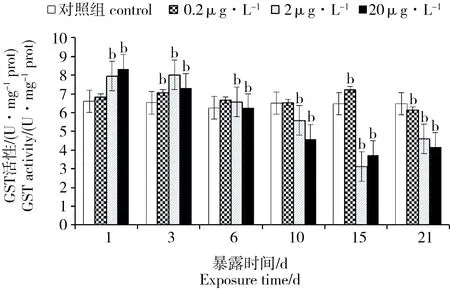
图6 PFOA对菲律宾蛤仔GST酶活性的影响Fig. 6 Effects of PFOA on the GST activity of R. philippinarum
3 讨论(Discussion)
3.1 PFOA胁迫下菲律宾蛤仔体内抗氧化酶活性及LPO含量的变化
生物体通过不断产生和清除自由基来保持动态平衡,其中SOD、CAT和POD是典型的清除氧自由基的抗氧化酶,LPO是脂质自由基的产物之一,它们已被广泛用于指示生物遭受污损的程度。本次研究发现,菲律宾蛤仔在PFOA胁迫后,各指标与对照组相比均有受诱导或抑制的显著变化。SOD通过催化·O2-产生歧化反应生成H2O2,是唯一一种以自由基为底物的抗氧化酶,它的活性决定了清除·O2-的能力。有研究表明,生物体的SOD活性往往会在受到轻度污染或者短时间胁迫时升高;而受到重度污染或者长时间胁迫时又会降低,致使活性氧自由基大量积累在生物体内,使其受到氧化损伤[27],Stebbing[28]把这种现象定义为生物的“毒物兴奋效应”。本研究结果发现,在0.2 μg·L-1PFOA浓度组胁迫下,SOD活性首先被显著诱导,随着胁迫时间的延长,所有浓度组的SOD活性显著被抑制。王贺威等[29]研究了PFOS胁迫对翡翠贻贝抗氧化酶的影响,结果显示,PFOS能够在短时间内诱导抗氧化酶的活性,但随着胁迫时间的推移,抗氧化酶的活性表现出明显的被抑制趋势;于庆云等[30]研究了镉和铅对菲律宾蛤仔脂质过氧化及抗氧化酶活性的影响,也证实了以上观点。同时有研究表明,SOD活性在胁迫初期的提高可能是一种对外界环境的应激反应,是为了平衡活性氧的水平从而更好地适应环境[31]。不过,20 μg·L-1PFOA浓度组在胁迫初期时被显著抑制,到第10天时活性显著升高,这表明了活性氧物质对机体造成的损伤尚未对细胞造成严重伤害,而胁迫15 d之后SOD活性再次下降,表明未被及时清除的活性氧物种对抗氧化酶系统已经造成了破坏,这与杨涛等[15]在研究苯并(b)荧蒽对翡翠贻贝内脏团抗氧化酶活性及脂质过氧化物含量胁迫时所得的结果相似。
POD也是一种抗氧化酶,广泛分布于生物体内的过氧物酶体中,是一类含铁的金属酶类,通过降解污染物在代谢等过程中形成的过氧化物(如酚、胺等)来减轻其毒性,防止膜脂过氧化或脱酯反应被活性氧自由基启动,保护生物体细胞生物膜[36]。由于POD和CAT具有相同的辅基铁卟啉及相似的催化机制,因此也可使H2O2分解,与CAT、SOD共同组成了生物体内的活性氧防御系统,可以清除超氧自由基、H2O2和过氧化物,以及阻止或减少·OH的形成[37]。已有研究表明,POD活性维持在一定的水平,可以将机体内产生的过多自由基去除,维持机体的自由基处于一个平衡的状态,防止自由基对机体产生伤害,维持一个正常的生理活动[38-40]。在本研究中,POD与CAT在胁迫前期活力变化几近相同,这可能因为POD和CAT具有相似的作用机理;但在胁迫6 d后POD与CAT的活性变化出现差异,2 μg·L-1PFOA浓度组的POD活性一直处于抑制状态,在第15天又得到显著抑制,而CAT的活性却由诱导变为抑制状态。究其原因可能是它们催化H2O2的方式不同,POD通过催化H2O2分解其他底物来消耗H2O2,而CAT是直接催化分解H2O2[41],因此可以看出经过长时间的PFOA胁迫后,中、高浓度组的POD活性远低于低浓度组。孙云之等[19]研究了PFOS对无齿蚌鳃的保护酶系的影响,发现实验组的SOD、CAT活性明显高于对照组,且随着暴露时间的延长逐渐升高,而POD的活性变化则比较复杂,这也可以证明POD虽然与CAT具有相似的作用机理,但是作用方式未必相同。
一旦生物体内不断产生和蓄积的自由基超过了机体可以清除的范围,则会产生氧化压力[42-44],因此过多的自由基攻击生物膜生成LPO,它可以通过改变生物膜的结构,减少细胞膜的流动性,细胞膜由此产生脂质过氧化损伤。因此,不仅机体脂质过氧化程度可用LPO的含量判定,同时自由基的产生、生物活性及其抗氧化能力的强弱也可间接由LPO反映[45]。本研究中,在短时间或低浓度PFOA胁迫下,SOD、CAT和POD活性均表现为升高,LPO含量显著减少,说明在该条件下,·O2-能有效被SOD歧化,同时H2O2被CAT和POD有效分解,这3种酶协同作用,不仅消除了活性氧物种,同时使脂质过氧化作用明显降低[19]。随着时间的推移,抗氧化酶活性伴随着生物受到高浓度或长时间污染物的胁迫时,通常会降低,20 μg·L-1浓度组的SOD活性在第6天达到最低点,CAT活性在胁迫期间基本处于抑制状态,POD的活力也在逐渐递减,在第21天降到最低。这说明PFOA的积累导致了一些组织的氧化损伤,未被及时清除的活性氧物种对抗氧化酶系统造成了破坏,造成细胞内膜系统的破裂,活性氧含量大量积聚,此时各浓度组LPO含量均达到峰值,生物体处在较严重的中毒状态。杨涛等[15]研究了苯并(b)荧蒽对翡翠贻贝内脏团抗氧化酶活性及脂质过氧化物含量的变化,结果显示,高浓度组的苯并(b)荧蒽实验组LPO含量在暴露15 d后显著升高,与本研究结果基本一致,即由于抗氧化酶的活性被PFOA抑制,因此引起生物体脂质过氧化,造成了机体组织和细胞的氧化损伤[44]。
3.2 PFOA胁迫下菲律宾蛤仔体内生物转化酶活性的变化
EROD是存在于细胞膜上依赖细胞色素P450的重要生物转化酶,它的活性与污染物的毒性效应呈显著正相关,可以作为监测一些有机污染物的指标,以探讨污染物对机体的损害程度[46]。有研究表明,在一些有机污染物的影响下,双壳贝类、对虾和鱼类通过大幅度的提高其自身组织的EROD活性进行代谢解毒[34-35,38-39]。本实验结果可以看出,与对照组相比,其他各浓度组的EROD活力都被明显激活,并且激活程度和PFOA的浓度呈正比关系,与先前的研究相似。这表明菲律宾蛤仔在PFOA的胁迫下受到较为显著的影响,应激反应比较明显,同时也说明机体通过提升EROD的活性来应对污染物带来的影响。而中高浓度组的EROD活力在胁迫后期略有下降,这可能是由于PFOA的积累导致生物体产生耐受效应,使EROD的活性提升有限。
GST是II相代谢酶家族的一员,当污染物进入生物体内,经过I相代谢形成中间产物,同时大量的活性氧物质由此产生[17],而GST可催化GSH与这些活性氧物质结合,使之变成亲水性的物质排出机体外,从而达到解毒的效果,因此在污染物的影响下也会呈现激活的现象[47-49]。但是也有研究发现,GST的活性会随着污染物浓度的升高或者种类的不同呈现被抑制的情况[50-51],其解毒功能也会下降。本实验中,2和20 μg·L-1PFOA浓度组GST活性出现明显激活现象,说明在PFOA胁迫下,机体短期可以提升GST的活性来进行防御性解毒,以代谢相Ⅰ过程中产生的一级代谢物,而随着胁迫时间的延长,GST的活性逐渐被抑制。这可能是由于生物体无法及时代谢在组织内不断积累的代谢物,从而导致GST酶受到伤害,机体则处于致毒损伤状态,有研究认为这也与污染物的代谢受到其他抗氧化系统的酶活性变化的影响有一定关系[52-53]。
本实验中菲律宾蛤仔组织抗氧化酶和生物转化酶的活性发生变化,说明菲律宾蛤仔对PFOA不同胁迫阶段产生响应。随着PFOA浓度的升高,菲律宾蛤仔组织的SOD、CAT、POD活性均呈现先促后抑的特点,LPO含量在胁迫期间先减少再增加,而EROD和GST活性则逐渐升高或降低,PFOA对菲律宾蛤仔已显示出较明显的毒性效应,表明其对PFOA具有高敏感性,在浓度为0.2 μg·L-1时机体即可受到显著的损伤。然而酶活性的变化受到多种因素制约,是一个动态的过程,这些因素可以是污染物种类和浓度,也可以是实验生物、环境条件等;LPO含量也可能随着时间升高[29]。因此,在考虑利用生理生化指标监测环境中的PFOA时需要考虑多方面的条件和因素,不能仅依据某一种酶的活性,而是应该将几种酶甚至其他的生物标志物结合起来分析,筛选出最合理最具指示性的生物和指标[54]。本研究结果显示,SOD、CAT、POD、EROD、GST活性和LPO含量非常敏感,虽然它们的变化规律并不一致,但均可在一定程度上反映出PFOA带来的氧化胁迫的影响,因此可以将抗氧化酶系统(SOD、CAT、POD)与生物转化酶(EROD、GST)、LPO含量结合起来一起指示早期海洋PFOA污染。
[1] Prevedouros K, Cousins I T, Buck R C, et al. Sources, fate and transport of perfluorocarboxylates [J]. Environmental Science & Technology, 2006, 40(1): 32-44
[2] Paul A G, Jones K C, Sweetman A J. A first global production, emission, and environmental inventory for perfluorooctane sulfonate [J]. Environmental Science & Technology, 2009, 43(2): 386-392
[3] Shoeib M, Harner T,Webster G M, et al. Indoor sources of poly- and perfluorinated compounds (PFCS) in Vancouver, Canada: Implications for human exposure [J]. Environmental Science & Technology, 2011, 45(19): 7999-8005
[4] Boulanger B, Vargo J, Schnoor J L, et al. Detection of perfluorooctane surfactants in great lakes water [J]. Environmental Science & Technology, 2004, 38(15): 4064-4070
[5] Post G B, Louis J B, Lippincott R L, et al. Occurrence of perfluorinated compounds in raw water from New Jersey public drinking water systems [J]. Environmental Science & Technology, 2013, 47(23): 13266-13275
[6] Lam N H, Cho C R, Lee J S, et al. Perfluorinated alkyl substances in water, sediment, plankton and fish from Korean rivers and lakes: A nationwide survey [J]. Science of the Total Environment, 2014, 491-492: 154-162
[7] Route W T, Russell R E, Lindstrom A B, et al. Spatial and temporal patterns in concentrations of perfluorinated compounds in bald eagle nestlings in the upper Midwestern United States [J]. Environmental Science & Technology, 2014, 48(12): 6653-6560
[8] Zhou Z, Shi Y, Vestergren R, et al. Highly elevated serum concentrations of perfluoroalkyl substances in fishery employees from Tangxun Lake, China [J]. Environmental Science & Technology, 2014, 48(7): 3864-3874
[9] Zhang Y, Beesoon S, Zhu L, et al. Biomonitoring of perfluoroalkyl acids in human urine and estimates of biological half-life [J]. Environmental Science & Technology, 2013, 47(18): 10619-10627
[10] Olsen G W, Burris J M, Ehresman D J, et al. Half-life of serum elimination of perfluorooctanesulfonate, perfluorohexanesulfonate, and perfluorooctanoate in retired fluorochemical production workers [J]. Environmental Health Perspectives, 2007, 115(9): 1298-1305
[11] 胡存丽, 仲来福. 全氟辛烷磺酸和全氟辛酸毒理学研究进展[J]. 中国工业医学杂志, 2006, 19(6): 354-358
Hu C L, Zhong L F. Progress of toxicological study on PFOS and PFOA [J]. Chinese Journal of Industrial Medicine, 2006, 19(6): 354-358 (in Chinese)
[12] 周启星, 胡献刚. PFOS/PFOA环境污染行为与毒性效应及机理研究进展[J]. 环境科学, 2007, 28(10): 2153-2162
Zhou Q X, Hu X G. Researching progresses in environmental pollution behavior, toxic effects and mechanisms of PFOS/PFOA [J]. Environmental Science, 2007, 28(10): 2153-2162 (in Chinese)
[13] 金一和, 汤先伟, 曹秀娟, 等. 全球性全氟辛烷磺酰基化合物环境污染及其生物效应[J]. 自然杂志, 2002, 24(6): 344-348
Jin Y H, Tang X W, Cao X J, et al. Global environmental pollution and biological effects of perfluorooctane sulfonate [J]. Chinese Journal of Nature, 2002, 24(6): 344-348 (in Chinese)
[14] 肖国强, 张炯明, 邵艳卿, 等. 苯并芘B[a]P对泥蚶组织EROD、GST酶活力和MDA含量的影响[J]. 海洋科学, 2013, 37(8): 28-34
Xiao G Q, Zhang J M, Shao Y Q, et al. Effect of benzo[a]pyrene on two enzymes activity and lipid peroxidation MAD in Tegillarca granosa [J]. Marine Sciences, 2013, 37(8): 28-34 (in Chinese)
[15] 杨涛, 陈海刚, 蔡文贵, 等. 翡翠贻贝内脏团抗氧化酶活性及脂质过氧化物含量对苯并(b)荧蒽胁迫的生物响应研究[J]. 生态毒理学报, 2011, 6(5): 539-545
Yang T, Chen H G, Cai W G, et al. Response of antioxidant enzymes activities and lipid peroxidation levels in visceral mass of green-lipped mussel (Perna viridis) to benzo[b]fluoranthene stress [J]. Asian Journal of Ecotoxicology, 2011, 6(5): 539-545 (in Chinese)
[16] 郭勤单, 王有基, 吕为群. 温度和盐度对褐牙鲆幼鱼渗透生理及抗氧化水平的影响[J]. 水生生物学报, 2014, 38(1): 58-67
Guo Q D, Wang Y G, Lv W Q. Combined effects of temperature and salinity on the physiological osmotic induction and antioxidant responses in the juvenile Japanse flounder (Paralichthys olivaceus) [J]. Acta Hydrobiologica Sinica, 2014, 38(1): 58-67 (in Chinese)
[17] Winston G W, Giulio R T D. Prooxidant and antioxidant mechanisms in aquatic organisms [J]. Aquatic Toxicology, 1991, 19(2): 137-161
[18] 于红瑶, 刘利, 刘薇, 等. PFOS致大鼠肝脏氧化损伤及对脂褐质含量影响[J]. 中国公共卫生, 2009, 25(5): 578-579
Yu H Y, Liu L, Liu W, et al. Oxidative damage of perfluorooctane sulfonate on lipofuscin levels in rat livers [J]. Chinese Journal of Public Health, 2009, 25(5): 578-579 (in Chinese)
[19] 孙云之, 刘缠民. 全氟辛烷磺酰基化合物对无齿蚌鳃保护酶系的影响[J]. 安徽农业科学, 2010, 38(21): 11150-11151
SunY Z, Liu C M. Effect of perfloorooctane sulfonate on the protective enzyme activities in the gill of Anodonta woodiana [J]. Journal of Anhui Agricultural Sciences, 2010, 38(21): 11150-11151 (in Chinese)
[20] 方雪梅, 王建设, 戴家银. 全氟类有机污染物的污染状况及其生态毒理研究进展[J]. 地球科学进展, 2010, 25(5): 543-551
Fang X M, Wang J S, Dai J Y. The progress in environmental distributions and toxicological effects of perfluoroalkyl acids [J]. Advance in Earth Science, 2010, 25(5): 543-551 (in Chinese)
[21] Beyer J, Sandvik M, Hylland K, et al. Contaminant accumulation and biomarker responses in flounder (Platichthys flesus L.) and Atlantic cod (Gadus morhua L.) exposed by caging to polluted sediments in Sørfjorden, Norway [J]. Aquatic Toxicology, 1996, 36(1-2): 75-98
[22] Kopecka-Pilarczyk J, Correia A D. Biochemical response in gilthead seabream (Sparus aurata) to in vivo exposure to a mix of selected PAHs [J]. Journal of Experimental Marine Biology & Ecology, 2009, 72(4): 1296-1302
[23] 王淑红, 王新红, 陈荣, 等. 荧蒽、菲、芘对菲律宾蛤仔(Ruditapes philippinarum)超氧化物歧化酶的影响[J]. 厦门大学学报: 自然科学版, 2000, 39(4): 504-508
Wang S H, Wang X H, Chen R, et al. The Effects of fluoranthene, phenaphthene and pyrene on superoxide dismutase (SOD) of Ruditapes philippinarum [J]. Journal of Xiamen University: Natural Science, 2000, 39(4): 504-508 (in Chinese)
[24] 胡莹莹, 李爱, 叶赛, 等. 氯霉素对菲律宾蛤仔的急性和亚急性毒性作用[J]. 中国环境科学, 2006, 26(z1): 125-128
Hu Y Y, Li A, Ye S, et al. The acute and subacute toxicity action of chloramphenicol on Ruditapes philippinarum [J]. China Environmental Science, 2006, 26(z1): 125-128 (in Chinese)
[25] 王琳, 潘鲁青, 许超群, 等. Cd2+-B[α]P复合污染对菲律宾蛤仔急性毒性和解毒代谢酶活力的影响[J]. 水生生物学报, 2011, 35(1): 37-44
Wang L, Pan L Q, Xu C Q, et al. Combination effects of cadmium and benzo[α]pyrene on acute toxicity and metabolic enzymes activities of Ruditapes philippinarum [J]. Acta Hydrobiologica Sinica, 2011, 35(1): 37-44 (in Chinese)
[26] Hannam M L, Bamber S D, Moody J A, et al. Immune function in the Arctic Scallop, Chlamys islandica, following dispersed oil exposure [J]. Aquatic Toxicology, 2009, 92(3): 187-194
[27] 唐学玺, 张培玉. 蒽对黑鮶超氧化物歧化酶活性的影响[J]. 水产学报, 2000, 24(3): 217-220
Tang X X, Zhang P Y. Effects of anthracene on activity of superoxide dismutase in Sebastodes fuscescens [J]. Journal of Fisheries of China, 2000, 24(3): 217-220 (in Chinese)
[28] Stebbing A R. Hormesis--The stimulation of growth by low levels of inhibitors [J]. Science of the Total Environment, 1982, 22(3): 213-234
[29] 王贺威, 马胜伟, 张喆, 等. 全氟辛烷磺酸盐(PFOS)胁迫对翡翠贻贝抗氧化酶的影响[J]. 生态毒理学报, 2012, 7(5): 508-516
Wang H W, Ma S W, Zhang Z, et al. Effects of perfluorooctanesulfonate (PFOS) exposure on antioxidant enzymes of Perna viridis [J]. Asian Journal of Ecotoxicology, 2012, 7(5): 508-516 (in Chinese)
[30] 于庆云, 王悠, 徐彦, 等. 镉和铅对菲律宾蛤仔脂质过氧化及抗氧化酶活性的影响[J]. 生态毒理学报, 2013, 8(4): 504-512
Yu Q Y, Wang Y, Xu Y, et al. Effects of cadmium and lead on the lipid peroxidation and levels of antioxidant enzymes in Ruditapes philippinarum [J]. Asian Journal of Ecotoxicology, 2013, 8(4): 504-512 (in Chinese)
[31] 秦洁芳, 陈海刚, 蔡文贵, 等. 邻苯二甲酸二乙基己酯(DEHP)胁迫下红鳍笛鲷不同组织生化指标的变化[J]. 农业环境科学学报, 2011, 30(3): 409-415
Qin J F, Chen H G, Cai W G, et al. The change of biochemical indexes in different tissue of crimson snapper (Lutjanus erythropterus) exposed to di-(2-ethylhexyl) phthalate (DEHP) [J]. Journal of Agro-Environment Science, 2011, 30(3): 409-415 (in Chinese)
[32] Porte C, Solé M, Albaigés J, et al. Responses of mixed-function oxygenase and antioxidant enzyme system of Mytilus sp. to organic pollution [J]. Comparative Biochemistry & Physiology Part C: Comparative Pharmacology & Toxicology, 1991, 100(1-2): 183-186
[33] Richardson B J, Mak E, De Luca-Abbott S B, et al. Antioxidant responses to polycyclic aromatic hydrocarbons and organochlorine pesticides in green-lipped mussels (Perna viridis): Do mussels "integrate" biomarker responses? [J]. Marine Pollution Bulletin, 2008, 57(6-12): 503-514
[34] Habig W H, Pabst M J, Jakoby W B. Glutathione S-transferases. The first enzymatic step in mercapturic acid formation [J]. Journal of Biological Chemistry, 1974, 249(22): 7130-7139
[35] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72(1-2): 248-254
[36] 贾守菊, 应雪萍, 陈艳乐, 等. 中华绒蟹不同发育阶段腹肢粘液腺同工酶的比较[J]. 海洋湖沼通报, 2004(4): 52-60
Jia S J, Ying X P, Chen Y L, et al. A study on isozymes changes during veriant development periods of Eriocheir sinensis [J]. Transaction of Oceanology & Limnology, 2004(4): 52-60 (in Chinese)
[37] 张喆, 马胜伟, 王贺威. 十溴联苯醚(BDE-209)对菲律宾蛤仔外套膜抗氧化酶活性的影响[J]. 生态学杂志, 2013, 32(1): 122-128
Zhang Z, Ma S W, Wang H W. Effects of decabromodiphenyl ether (BDE-209) on the antioxidant enzyme activities of Lutjanus argentimaculatus mantle membrane [J]. Chinese Journal of Ecology, 2013, 32(1): 122-128 (in Chinese)
[38] Lewis D F, Ioannides C, Parke D V. Cytochromes P450 and species differences in xenobiotic metabolism and activation of carcinogen [J]. Environmental Health Perspectives, 1998, 106(10): 633-641
[39] Shirani M, Mirvaghefi A, Farahmand H, et al. Biomarker responses in mudskipper (Periophthalmus waltoni) from the coastal areas of the Persian Gulf with oil pollution [J]. Environmental Toxicology and Pharmacology, 2012, 34(3): 705-713
[40] 孙虎山, 李光友. 栉孔扇贝血淋巴中超氧化物歧化酶和过氧化氢酶活性及其性质的研究[J]. 海洋与湖沼, 2000, 31(3): 259-265
Sun H S, Li G Y. Activities and properties of superoxide dismutase and catalase in the haemolymph of Chlamys farreri [J]. Oceanologia et Limnologia Sinica, 2000, 31(3): 259-265 (in Chinese)
[41] 王贺威, 马胜伟, 张喆, 等. 全氟辛烷磺酸对真鲷鳃抗氧化酶和组织损伤的影响[J]. 生态与农村环境学报, 2013, 29(1): 98-105
Wang H W, Ma S W, Zhang Z, et al. Effects of perfluorooctane sulfonate (PFOS) on antioxidant enzyme in the gill of Pagrosomus major and damage to its tissues [J]. Journal of Ecology and Rural Environment, 2013, 29(1): 98-105 (in Chinese)
[42] 洪美玲, 陈立侨, 顾顺樟, 等. 不同温度胁迫方式对中华绒蟹免疫化学指标的影响[J]. 应用与环境生物学报, 2007, 13(6): 818-822
Hong M L, Chen L Q, Gu S Z, et al. Effect of temperature change on immunochemical indexes of Eriocheir sinensis [J]. Chinese Journal of Applied & Environmental Biology, 2007, 13(6): 818-822 (in Chinese)
[44] Shin H S, Yoo J H, Min T S, et al. The effects of quercetin on physiological characteristics and oxidative stress resistance in olive flounder, Paralichthys olivaceus [J]. Asian-Australasian Journal of Animal Sciences, 2010, 23(5): 588-597
[45] Viarengo A, Canesi L, Martinez P G, et al. Pro-oxidant processes and antioxidant defence systems in the tissues of the Antarctic scallop (Adamussium colbecki ) compared with the Mediterranean scallop (Pecten jacobaeus) [J]. Comparative Biochemistry & Physiology Part B: Biochemistry & Molecular Biology, 1995, 111(1): 119-126
[46] 任加云, 苗晶晶, 李学平, 等. 石油烃暴露对栉孔扇贝(Chlamys farreri)组织生物转化酶及DNA损伤的影响[J]. 海洋湖沼通报, 2016(3): 46-54
Ren J Y, Miao J J, Li X P, et al. Effects of petroleum hydrocarbon exposure on biotransformation enzymes activities and DNA damage of scallop Chlamys farreri [J]. Transaction of Oceanology & Limnology, 2016(3): 46-54 (in Chinese)
[47] 丁秀蓉, 李正炎, 王波, 等. 壬基酚对牙鲆肝脏EROD和GST酶活性的影响[J]. 中国海洋大学学报: 自然科学版, 2007(s1): 101-104
Ding X R, Li Z Y, Wang B, et al. Effects of nonylphenol on EROD and GST activity in the liver of Paralichthys olivaceus [J]. Periodical of Ocean University of China, 2007(s1): 101-104 (in Chinese)
[48] 王静, 潘鲁青, 苗晶晶. 多环芳烃化合物对栉孔扇贝组织芳烃羟化酶活力的影响[J]. 海洋科学, 2007, 31(12): 19-23
Wang J, Pan L Q, Miao J J. Effects of polycyclic aromatic hydrocarbons on aryl hydrocarbon hydroxylase activities of marine scallop Chlamys farreri [J]. Marine Sciences, 2007, 31(12): 19-23 (in Chinese)
[49] 费来华, 邵雁群, 李赟. 栉孔扇贝不同组织SOD、CAT和MPO活力的比较分析[J]. 海洋湖沼通报, 2008(3): 128-132
Fei L H, Shao Y Q, Li Y. Comparitive analysis of the activity of SOD, CAT and MPO in different tissues of the scallop Chlamys farreri [J]. Transactions of Oceanology & Limnology, 2008(3): 128-132 (in Chinese)
[50] 苗晶晶, 潘鲁青, 王静. 苯并[a]芘对栉孔扇贝(Chlamys farreri)组织显微和超微结构的影响[J]. 环境科学学报, 2007, 27(9): 1497-1503
Miao J J, Pan L Q, Wang J. Effects of B[a]P on micro and ultrastructure of gill and digestive gland of Chlamys farreri [J]. Acta Scientiae Circumstantiae, 2007, 27(9): 1497-1503 (in Chinese)
[51] Fitzpatrick P J, Sheehan D, Livingstone D R. Studies on isoenzymes of glutathione S-transferase in the digestive gland of Mytilus galloprovincialis with exposure to pollution [J]. Marine Environmental Research, 1995, 39(1-4): 241-244
[52] Wang C, Zhao Y, Zheng R, et al. Effects of tributyltin, benzo[a]pyrene, and their mixture on antioxidant defense systems in Sebastiscus marmoratus [J]. Ecotoxicology and Environmental Safety, 2006, 65(3): 381-387
[53] 穆景利, 王新红, 林建清, 等. 苯并[a]芘对黑鲷肝脏GST活性的影响及其与肝脏代谢酶和胆汁代谢产物之间的变化关系[J]. 生态毒理学报, 2009, 4(4): 516-523
Mu J L, Wang X H, Lin J Q, et al. Effects of benzoapyrene exposure on hepatic GST activity in black porgy (Sparus macrocephalus) and variation relationships with hepatic metabolic enzymes and biliary metabolites [J]. Asian Journal of Ecotoxicology, 2009, 4(4): 516-523 (in Chinese)
[54] 王重刚, 郑微云, 余群, 等. 苯并(a)芘和芘的混合物暴露对梭鱼肝脏抗氧化酶活性的影响[J]. 环境科学学报, 2002, 22(4): 529-533
Wang C G, Zheng W Y, Yu Q, et al. Effects of mixture of benzo(a)pyrene and pyrene exposure on hepatic antioxidant enzymes activities in Mugil soiuy [J]. Acta Scientiae Circumstantiae, 2002, 22(4): 529-533 (in Chinese)
◆
TheEffectsofPerfluorooctanoicAcid(PFOA)onEnzymeActivitiesinRuditapesphilippinarum
Liu Zhiyu1,2, Zhai Yuxiu1, Yao Lin1, Jiang Yanhua1, Li Fengling1,*,Wang Lianzhu1, Shang Derong1, Yang Yuanhao3, Guo Mengmeng1, Tan Zhijun1
1. Key Laboratory of Testing and Evaluation for Aquatic Product Safety and Quality, Ministry of Agriculture, Yellow Sea Fishery Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China2. Wuxi Fisheries College, Nanjing Agricultural University, Wuxi 214182, China3. Shanxi Fisheries Institute, Yellow River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Xi’an 710086, China
10.7524/AJE.1673-5897.20170113001
2017-01-13录用日期2017-03-13
1673-5897(2017)3-695-10
X171.5
A
李风铃(1980—),女,海洋生物学博士,助理研究员,主要研究方向为海洋生物毒理学。
山东省自然科学基金项目(ZR2014DQ025);国家科技基础性工作专项(2014FY230100);陕西省水利科技计划项目(2015SLKJ-22)
刘芝余(1991-),女,硕士研究生,研究方向为海洋生物毒理学,E-mail: 15195986641@163.com
*通讯作者(Corresponding author), E-mail: lifl@ysfri.ac.cn
刘芝余, 翟毓秀, 姚琳, 等. 全氟辛酸(PFOA)对菲律宾蛤仔体内酶活性的影响[J]. 生态毒理学报,2017, 12(3): 695-704
Liu Z Y, Zhai Y X, Yao L, et al. The effects of perfluorooctanoic acid (PFOA) on enzyme activities in Ruditapes philippinarum [J]. Asian Journal of Ecotoxicology, 2017, 12(3): 695-704 (in Chinese)
