过表达转录因子21对肺癌细胞裸鼠成瘤的影响
2017-10-13李志英闫廷赞
李志英 周 军 闫廷赞 周 倜 叶 姗
(常州市第一人民医院呼吸内科,江苏 常州 213000)
过表达转录因子21对肺癌细胞裸鼠成瘤的影响
李志英 周 军 闫廷赞 周 倜 叶 姗
(常州市第一人民医院呼吸内科,江苏 常州 213000)
目的探讨转录因子(TCF)21对肺癌细胞裸鼠成瘤的影响。方法选取人肺癌细胞SPC-A1,细胞转染TCF21过表达载体(过表达组)和空载体(空载体组),设置对照组,对照组中只加入转染试剂,培养48 h,Western印迹检测细胞中TCF21的表达水平。将过表达TCF21的肺癌细胞接种到裸鼠皮下,分别在5、10、15、20 d测量肿瘤的长径和短径,计算肿瘤体积并绘制肿瘤生长曲线。在20 d时,取出肿瘤,称量肿瘤重量,并计算瘤重抑瘤率,同时Western印迹检测肿瘤组织中B细胞淋巴瘤/白血病-2(Bcl-2)、活化的含半胱氨酸的天冬氨酸蛋白水解酶(Cleaved Caspase)-3、TCF21表达水平。结果过表达组肺癌细胞中TCF21水平明显高于对照组(P<0.01)。过表达组肿瘤生长与对照组相比明显受到抑制(P<0.01)。空载体组和过表达组的抑瘤率分别为(7.52±0.07)% 和(72.24±0.61)%,且过表达组肿瘤重量明显低于对照组(P<0.01)。过表达组肿瘤组织中Cleaved Caspase-3、TCF21表达水平明显高于对照组,而Bcl-2水平明显低于对照组(均P<0.01)。结论TCF21能够抑制肺癌细胞的裸鼠成瘤能力。
肺癌;裸鼠成瘤;转录因子21;肿瘤生长曲线
肺癌发病早期没有明显的症状,有超过60%的患者在就诊时已处于晚期,另外肺癌具有易转移、生长速度快、预后差等特点〔1〕。转录因子(TCF)21是一种抑癌基因,在乳腺癌、结直肠癌、黑色素瘤、卵巢癌等组织中均发现TCF21表达下调甚至缺失〔2〕。TCF21能够抑制结直肠癌细胞的生长并对结直肠癌裸鼠成瘤能力具有抑制作用〔3〕。本研究探讨TCF21对肺癌细胞裸鼠成瘤能力的作用。
1 材料与方法
1.1材料 细胞:人肺癌细胞SPC-A1购于中国科学院细胞库。3~5周龄,体重18~22 g的雄性Balb/c裸鼠21只由江苏医科大学动物实验中心提供。主要仪器及试剂:胎牛血清购自美国Gibco;RPMI1640培养基、胰蛋白酶、硝酸纤维素膜均购自美国Sigma;Lipofectamine 2000转染试剂购自上海翊圣生物科技有限公司;CO2培养箱购自上海精密仪器仪表有限公司;B细胞淋巴瘤/白血病-2(Bcl-2)单克隆抗体、活化的含半胱氨酸的天冬氨酸蛋白水解酶(Cleaved Caspase)-3单克隆抗体、TCF21单克隆抗体、β 肌动蛋白(β-actin)单克隆抗体均购自无锡安迪生物工程有限公司。
1.2细胞培养 取保存于液氮罐中的人肺癌细胞SPC-A1,放到37℃中融化1 min,观察细胞完全融合后,转移至离心管中,1 000 r/min离心10 min,弃上清液,用含有10% 胎牛血清的RPMI1640细胞培养液悬浮细胞,接种到细胞培养瓶中,放在37℃,5% CO2培养箱中培养48 h。观察细胞密度达到85%时,倒掉细胞培养液,加入0.25%的胰蛋白酶,放在37℃消化2 min,加入细胞培养液,离心后,加入适量的细胞培养液悬浮细胞,接种到细胞培养瓶中继续培养。
1.3细胞转染 取培养至对数生长期的SPC-A1细胞,以每孔4×105个细胞接种到6孔细胞培养板中,观察细胞融合度达到80%时,转染开始。转染前将细胞培养液更换为不含胎牛血清的不完全培养液。取244 μl的不含胎牛血清的不完全培养液与6 μl的 Lipofectamine 2000混合后放在室温下静置5 min记为A液;将246 μl的不含胎牛血清的不完全培养液与4 μl的pIRES2-ZsGreen-TCF21质粒载体(过表达组)、空载体质粒载体(空载体组)混合后记为B液。取A液与B液在室温下混合静置20 min,加入到6孔细胞培养板中,放在37℃,5% CO2培养箱中培养5 h,更换为含有胎牛血清的完全培养液继续培养24 h,用G418法筛选能够稳定表达质粒基因的细胞株进行后续实验。同时设置对照组,对照组中只加入转染试剂。
1.4Western印迹检测细胞中TCF21水平 取转染后的SPC-A1细胞,用细胞刮刀收集细胞,加入细胞裂解液,放在冰上裂解反应15 min后,4℃,15 000 r/min离心30 min。吸取上清液,用二喹啉甲酸(BCA)蛋白定量检测试剂盒对蛋白样品定量后,与加样缓冲液按照4∶1的比例混合均匀,放在100℃的沸水中煮沸5 min,每孔加入40 μl至蛋白凝胶(5%浓缩胶,10%分离胶)上样孔中,蛋白没有进入分离胶之前用60 V电压电泳,进入分离胶后用100 V电压电泳。将蛋白凝胶在4℃,250 mA恒流下转印90 min至硝酸纤维素膜上,放在5%脱脂奶粉中在37℃封闭60 min。依次放在一抗(600倍稀释,4℃过夜)、二抗(37℃,90 min)结合后,加入化学增强发光法(ECL)显色液,以β-actin为内参,用Quantity one分析目的蛋白相对表达量。
1.5裸鼠成瘤 21只雄性Balb/c裸鼠随机分为三组,每组7只,取培养至对数生长期的对照组、空载体组、过表达组的细胞,配制成4×105个/ml浓度的细胞悬浮液,每组每只裸鼠取200 μl的细胞悬浮液接种到裸鼠的前肢背部的皮下。观察肿瘤出现后,分别在5、10、15、20 d用游标卡尺测量长径和短径,计算裸鼠的肿瘤体积。肿瘤的体积=长径×短径2×0.5。在第20天时,处死各组裸鼠,分离肿瘤,称量移植瘤的重量,并计算每组的瘤重抑瘤率。瘤重抑瘤率=100%×(1-转染组肿瘤重量/对照组肿瘤重量)。
1.6Western印迹检测组织中Bcl-2、Cleaved Caspase-3、TCF21表达水平 取各组肿瘤组织,提取组织蛋白,按照1.5中Western印迹检测组织中Bcl-2、Cleaved Caspase-3、TCF21表达水平。
1.7统计学方法 应用SPSS22.0软件行t检验、单因素方差。
2 结 果
2.1转染后细胞中TCF21表达水平检测结果 细胞转染后,培养48 h,过表达组细胞中TCF21表达水平(1.22±0.6)明显高于对照组(0.56±0.05)(P<0.01)。空载体组(0.57±0.04)与对照组相比没有明显差异(P>0.05)。见图1。

图1 Western印迹检测转染后细胞中TCF21表达水平
2.2肿瘤生长曲线及抑瘤率 如图2所示,第5天开始,对照组和空载体组肿瘤的生长明显高于过表达组(P<0.01)。空载体组和过表达组的抑瘤率分别为(7.52±0.07)% 和(72.24±0.61)%;过表达组肿瘤的重量〔(165.43±14.54)mg〕明显低于对照组〔(596.36±15.67)mg〕(P<0.01),空载体组〔(551.61±16.98)mg〕与对照组无统计学差异(P>0.05)。
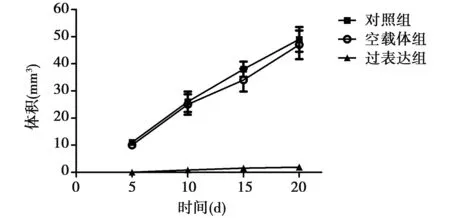
图2 肿瘤生长曲线
2.3组织中Bcl-2、Cleaved Caspase-3、TCF21表达水平检测结果 过表达组中Cleaved Caspase-3、TCF21水平均明显高于对照组,Bcl-2水平明显低于对照组(均P<0.01)。空载体组和对照组中Bcl-2、Cleaved Caspase-3、TCF21表达水平无统计学差异(P>0.05)。见表1,图3。
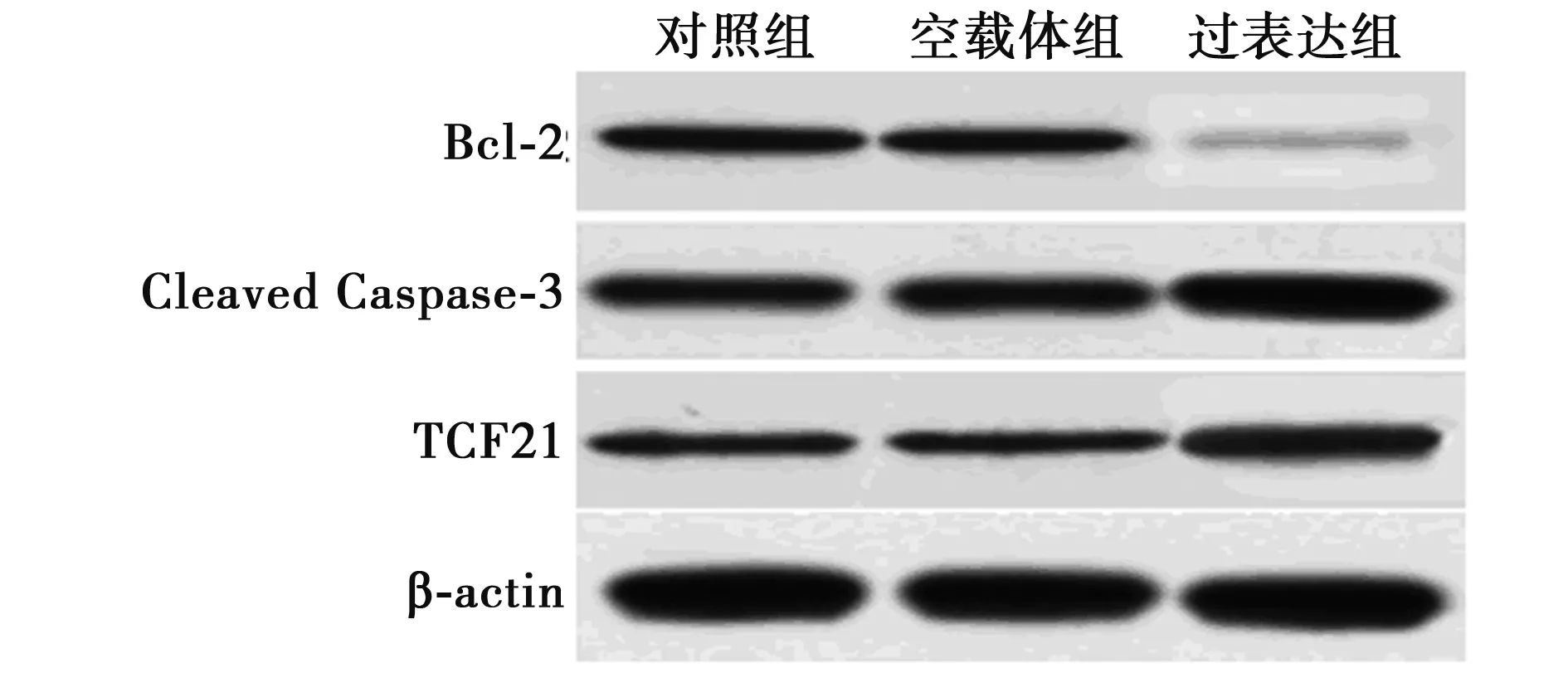
图3 Western印迹检测肿瘤组织中Bcl-2、Cleaved Caspase-3、TCF21表达水平
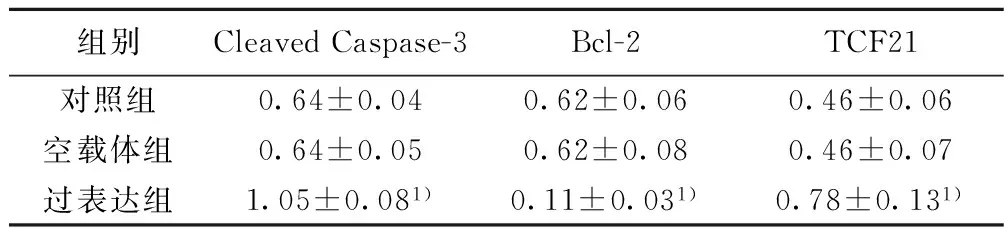
组别CleavedCaspase-3Bcl-2TCF21对照组0.64±0.040.62±0.060.46±0.06空载体组0.64±0.050.62±0.080.46±0.07过表达组1.05±0.081)0.11±0.031)0.78±0.131)
与对照组比较:1)P<0.01
3 讨 论
肺癌的发病率在男性恶性肿瘤中位居首位,在女性恶性肿瘤中位居第3位〔4〕。目前治疗肺癌的主要方法为手术治疗、放化疗辅助治疗,但由于肺癌具有易转移等特点,5年内的生存率只有20%左右〔5〕。
TCF21基因定位于6号染色体的6q32-24,TCF21是碱性螺旋-环-螺旋家族的成员之一,其在肺组织、肠道组织、肾组织、性腺等组织中均有表达〔6〕。研究表明,TCF21与肿瘤的发生有关,在乳腺癌、淋巴瘤、结直肠癌、卵巢癌等组织中均发现TCF21基因表达异常下调或缺失〔7〕。激活TCF21基因的表达后,肿瘤的生长受到抑制,在头颈部癌症、肾癌等癌症中均得以证实〔8〕。有研究表明,促进肺癌细胞中TCF21表达后,肺癌细胞的生长受到抑制,凋亡增多〔9〕。本研究结果说明,TCF21能够在体内抑制肿瘤的生长,能够抑制肺癌细胞裸鼠成瘤。
Bcl-2是目前公认的与肿瘤细胞生长和凋亡有关的蛋白,能够抑制肿瘤细胞的凋亡,是一种抑凋亡蛋白〔10〕。Caspase-3是Caspase蛋白家族成员之一,在Caspase级联反应中发挥凋亡执行作用,Caspase-3活化后能够促进凋亡的发生〔11〕。本研究结果提示,TCF21抑制肺癌细胞裸鼠成瘤可能与促进肺癌细胞凋亡有关。
1Brahmer J,Reckamp KL,Baas P,etal.Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer〔J〕.N Engl J Med,2015;373(2):123-35.
2Yang Z,Li DM,Xie Q,etal.Protein expression and promoter methylation of the candidate biomarker TCF21 in gastric cancer〔J〕.J Cancer Res Clin Oncol,2015;141(2):211-20.
3Dai Y,Duan H,Duan C,etal.Down-regulation of TCF21 by hypermethylation induces cell proliferation,migration and invasion in colorectal cancer〔J〕.Biochem Biophys Res Commun,2016;469(3):430-6.
4杨大运,邢亚威,张月花,等.老年非小细胞肺癌中 Raf 激酶抑制蛋白与 p-AKT 的表达及意义〔J〕.中国老年学杂志,2016;36(3):644-5.
5Jänne PA,Yang JC,Kim DW,etal.AZD9291 in EGFR inhibitor-resistant non-small-cell lung cancer〔J〕.N Engl J Med,2015;372(18):1689-99.
6Kim JB,Pjanic M,Sazanova O,etal.TCF21 Regulates coronary artery disease causing aryl-hydrocarbon receptor gene expression and its downstream pathway activation by environmental ligands〔J〕.Circulation,2015;132(3):A17671.
7Arab K,Park YJ,Lindroth AM,etal.Long noncoding RNA TARID directs demethylation and activation of the tumor suppressor TCF21 via GADD45A〔J〕.Mol Cell,2014;55(4):604-14.
8Wang J,Gao X,Wang M,etal.Clinicopathological significance and biological role of TCF21 mRNA in breast cancer〔J〕.Tumor Biol,2015;36(11):8679-83.
9Yoo S,Leung SY,Zhu J.Abstract B22:Integrative analysis of DNA methylation and gene expression data reveals complex regulation of gastric cancer〔J〕.Cancer Res,2016;76(2 Supplement):B22.
10武 晓,刘凤娟,王鹏飞,等.巴豆生物碱对肺腺癌细胞凋亡的影响及机制研究〔J〕.中国医药导报,2016;13(1):17-20.
11Dar AA,Pradhan TN,Kulkarni DP,etal.Extracellular 2′ 5′-oligoadenylate synthetase 2 mediates T-cell receptor CD3-ζ chain down-regulation via caspase-3 activation in oral cancer〔J〕.Immunology,2016;147(2):251-64.
〔2017-03-11修回〕
(编辑 袁左鸣/滕欣航)
R739.41
A
1005-9202(2017)19-4760-03;
10.3969/j.issn.1005-9202.2017.19.030
江苏省前瞻性研究专项基金项目(No.BE2013629)
周 军(1969-),男,硕士,主任医师,主要从事肺癌的临床诊疗研究。
李志英(1979-),女,硕士,主治医师,主要从事肺癌的基础与临床研究。
