低氧预处理对脐带间充质干细胞表型、增殖及神经营养因子分泌功能的影响
2017-10-10姚舜靳安民张辉闵少雄黄帅周治来
姚舜,靳安民,张辉,闵少雄,黄帅,周治来
(南方医科大学珠江医院,广州510282)
低氧预处理对脐带间充质干细胞表型、增殖及神经营养因子分泌功能的影响
姚舜,靳安民,张辉,闵少雄,黄帅,周治来
(南方医科大学珠江医院,广州510282)
目的探讨低氧预处理对脐带间充质干细胞表型、增殖、神经营养因子分泌功能的影响。方法收集分娩过程中丢弃的脐带组织,分离培养脐带间充质干细胞,将原代培养的间充质干细胞进行传代。取传至第3代的脐带间充质干细胞,随机分为低氧组和常氧组,分别置于氧浓度为5%、21%的恒温培养箱中培养6天。取对数生长期的两组细胞,采用流式细胞术检测CD44、CD45、CD90、HLA-DR表达,细胞免疫荧光法检测CD34及层粘连蛋白、波形蛋白表达,实时荧光定量PCR法检测脑源性神经营养因子(BDNF)、血管内皮生长因子(VEGF)、肝细胞生长因子(HGF)、睫状节神经细胞营养因子(CNTF)mRNA表达。两组培养1~6天进行细胞计数,并采用CCK-8法检测细胞增殖活性。结果两组均高表达CD44、CD90、层粘连蛋白、波形蛋白,低表达CD45、HLA-DR、CD34,证实两组细胞均具备间充质干细胞表型特性;两组上述细胞表型相关指标表达比较P均>0.05。两组培养1~6天细胞计数及细胞增殖活性均先升高后降低;低氧组培养1~6天细胞计数均高于常氧组,培养2~6天细胞增殖活性均高于常氧组(P均<0.05)。低氧组BDNF、VEGF、HGF、CNTF mRNA相对表达量均高于常氧组(P均<0.05)。结论低氧预处理对脐带间充质干细胞的表型特征无明显影响,但可提高其增殖能力及神经营养因子分泌功能。
间充质干细胞;脐带;低氧;细胞增殖;细胞表型;神经营养因子
Abstract:ObjectiveTo investigate the influences of hypoxic preconditioning on cell phenotype, proliferation, and secretion of neurotrophic factors of human umbilical cord mesenchymal stem cells (UCMSCs).MethodsThe discarded umbilical cord tissues during delivery process were collected for UCMSCs culture, and the primary cultured mesenchymal stem cells were passaged. Cells at passage 3 were randomly divided into the normoxia group and hypoxia group, which were growing in 21% and 5% O2, respectively. Cells in logarithmic growth phase were used. The expression of CD44, CD45, CD90, and HLA-DR was detected by flow cytometry; the expression of CD34, laminin, and vimentin was determined by immunocytochemistry; the mRNA expression of brain-derived neurotrophic factor (BDNF), vascular endothelial growth factor (VEGF), hepatocyte growth factor (HGF), and ciliary neurotrophic factor (CNTF) was determined by real-timer fluorescent quantitative PCR. After the cells were cultured for 1 to 6 days, we did the cell counting, and determined the cell proliferation by CCK-8.ResultsCD44, CD90, laminin, and vimentin were highly expressed, and CD45, HLA-DR, and CD34 were low expressed in both of the two groups, which showed that cells in the two groups had the characteristics of mesenchymal stem cells. There was no significant difference in expression of phenotype-related indexes between the two groups (allP>0.05). The CCK-8 results indicated that the cell counting and proliferation rate first increased and then decreased in 1-6 days′ culture in the two groups. When the cells were cultured for 1-6 days, the cell counting in the hypoxia group was higher than that in the normoxia group; when the cells were cultured for 2-6 days, the proliferation activity of the hypoxia group was higher than that of the normoxia group (allP<0.05). The mRNA expression of HGF, BDNF, VEGF, and CNTF in the hypoxia group was higher than that of the normoxia group (allP<0.05).ConclusionHypoxic preconditioning has little effect on the phenotypic features of UCMSCs, but can significantly enhance the proliferation rate and the secretion of neurotrophic factors.
Keywords: mesenchymal stem cells; umbilical cord; hypoxia; cell proliferation; cell phenotype; neurotrophic factors
间充质干细胞最早是从人骨髓中提取,但之后研究发现人体许多组织均能分离、培养间充质干细胞,包括脂肪、脐带、牙髓、韧带、皮肤、肌肉等[1]。不同组织来源的间充质干细胞在细胞形态、表型、免疫源性等方面大体相同,但增殖速度及分泌功能等则差别较大。脐带组织为分娩过程中丢弃的组织,取材方便;脐带间充质干细胞增殖速度较快[2,3],但存活率较低,分泌能力、炎症调节能力有限。体外分离培养间充质干细胞的氧浓度一般为20%,而宿主体内氧浓度为1.5%~8%,细胞移植到宿主体内后氧浓度急剧下降,细胞适应能力差,可能是导致细胞移植效率低的一个重要原因。部分研究在体外对细胞进行低氧预处理,试图提高其对低氧环境的耐受能力[4,5]。但是,目前关于低氧预处理对脐带间充质干细胞生物学行为影响的研究较少。为此,我们于2015年7月~2016年7月进行了如下研究。
1 材料与方法
1.1 材料 DMEM/F12完全培养液购于美国Gibco公司,CO2恒温培养箱购于美国Thermo公司,培养瓶购于美国Corning公司。
1.2 脐带间充质干细胞分离与培养 收集产妇分娩过程中丢弃的脐带组织,以含1%青霉素-链霉素的PBS冲洗3次。用眼科剪去除血管组织,并将脐带组织剪成碎片,接种于DMEM/F12完全培养液(含10%FBS、100 IU/L青霉素、100 mg/L链霉素)的25 cm2培养瓶中,置于37 ℃、5% CO2恒温培养箱中进行培养。培养72 h后换液,去除悬浮细胞,细胞逐渐长出,即为原代脐带间充质干细胞。待原代细胞融合至80%时进行细胞传代,消化离心后用培养基重悬细胞,轻柔吹打形成单细胞悬液,按1∶4进行传代,并接种于新的25 cm2培养瓶中。本研究通过医院伦理委员会审核,产妇及其家属均签署知情同意书。
1.3 细胞分组处理 取传至第3代的脐带间充质干细胞,制备细胞悬液,调整密度为1×105个/mL。将细胞随机分为低氧组和常氧组,37 ℃条件下分别置于氧浓度为5%、21%的恒温培养箱中培养6天。
1.4 细胞表型相关指标检测 ①CD44、CD45、CD90、HLA-DR表达:采用流式细胞术。取对数生长期的两组细胞,消化后调整细胞密度为1×106个/mL,用含0.1%叠氮钠和0.5% BSA的PBS冲洗2遍,PBS重悬细胞。加入一抗,4 ℃条件下孵育30 min,PBS冲洗2遍。加入异硫氰酸荧光素或藻红蛋白标记的小鼠抗人IgG二抗,4 ℃条件下孵育30 min,PBS冲洗2遍。用不含BSA的PBS重悬细胞,上流式细胞仪检测CD44、CD45、CD90、HLA-DR表达。②CD34及层粘连蛋白、波形蛋白表达:采用细胞免疫荧光法。取对数生长期的两组细胞,吸除培养液,4%多聚甲醛室温固定30 min,PBS冲洗5 min×3次,0.3% Triton X-100室温破膜5 min,山羊血清封闭液37 ℃封闭1 h。分别加入血清稀释液稀释的一抗兔抗CD34、兔抗层粘连蛋白、鼠抗波形蛋白(稀释比例分别为1∶100、1∶200、1∶200),湿盒内4 ℃孵育过夜,吸除一抗,PBS冲洗5 min×3次;滴加二抗Alexa Fluor 594标记羊抗兔IgG(1∶200)和Alexa Fluor 488标记羊抗鼠IgG(1∶200),室温孵育1 h;去除二抗后,PBS冲洗5 min×3次。DAPI复染细胞核,封片。同时设阴性对照,以抗体稀释液代替一抗。荧光显微镜下随机选取5~20个高倍视野,计数DAPI染色细胞数,随后改变观察波长,计数相同视野下CD34、层粘连蛋白、波形蛋白阳性染色的细胞数量,计算阳性表达率。
1.5 细胞增殖活性检测 ①细胞计数:取两组培养1~6天的细胞,消化后重悬于2 mL DMEM/F12培养基中,将计数板放在低倍镜下(10×10)观察并进行计数。每组取4皿,每皿重复计数3次,取平均值。②细胞增殖活性:采用CCK-8法。取两组培养1~6天的细胞,制成单细胞悬液,以2×103个/孔接种于96孔板,共200 μL。每孔加入10 μL CCK-8溶剂,采用酶联免疫检测仪于450 nm波长下读取吸光度(OD)值。每组3个复孔,取平均值。
1.6 神经修复相关因子mRNA表达检测 采用实时荧光定量PCR法。取对数生长期的两组细胞,弃去培养液,预冷PBS洗涤单层细胞。采用TRIzol试剂提取总RNA,检测总RNA浓度和纯度合格后,逆转录合成cDNA。脑源性神经营养因子(BDNF)、血管内皮生长因子(VEGF)、肝细胞生长因子(HGF)、睫状节神经细胞营养因子(CNTF)及内参基因β-actin引物序列见表1,PCR反应过程参照前期研究[6]。PCR反应体系:Q-PCR Mix 10 μL,ddH2O 4 μL,上下游引物各2 μL,cDNA(1∶5) 2 μL。PCR反应条件:95 ℃预变性5 min、95 ℃变性45 s、56 ℃退火45 s、72 ℃延伸20 s,共40个循环。采用2-ΔΔCt法计算目的基因相对表达量。

表1 各基因引物序列及扩增长度
2 结果
2.1 两组细胞表型相关指标表达比较 两组均高表达CD44、CD90、层粘连蛋白及波形蛋白,低表达CD45、HLA-DR、CD34,证实两组细胞均具备间充质干细胞表型特征;两组CD44、CD45、CD90、HLA-DR、CD34、层粘连蛋白、波形蛋白等细胞表型相关指标表达比较P均>0.05。见表2。
2.2 两组细胞增殖能力比较 两组培养1~6天细胞计数及细胞增殖活性均先升高后降低; 低氧组培养1~6天细胞计数均高于常氧组,培养2~6天细胞增殖活性均高于常氧组(P均<0.05)。见表3、4。

表2 两组细胞表型相关指标表达

表3 两组培养1~6天细胞计数比较
注:与常氧组同时间点比较,*P<0.05。

表4 两组培养1~6天细胞增殖活性比较
注:与常氧组同时间点比较,*P<0.05。
2.3 两组神经修复相关因子mRNA表达比较 低氧组BDNF、VEGF、HGF、CNTF mRNA相对表达量均高于常氧组(P均<0.05)。见表5。
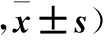
表5 两组细胞神经修复相关因子mRNA表达比较(相对表达量
注:与常氧组比较,*P<0.05。
3 讨论
间充质干细胞移植治疗在神经损伤的修复中发挥越来越重要的作用,脐带间充质干细胞移植后可调节宿主炎症反应及凋亡等,有助于促进神经生长[7]。但任何细胞移植发挥治疗作用均需以一定的细胞数量为基础,目前脐带间充质干细胞移植领域的一个瓶颈就是移植后细胞存活率较低,尤其是神经损伤患者。由于血管损伤、组织撕裂、血栓形成等导致局部缺血、炎症、坏死,组织含氧量进一步下降,细胞生长环境恶劣,间充质干细胞移植后往往大量死亡,难以发挥其修复作用[8]。
生理状态下,女性生殖系统组织氧浓度为1.5%~8%,胎儿体内循环氧浓度不超过5%[9]。正常情况下体外培养脐带间充质干细胞的氧浓度是21%,将其移植到低于1%的损伤局部势必会导致部分细胞无法适应骤然下降的氧浓度而大量死亡。为了解决细胞移植后存活率低的问题,有学者提出在移植前对细胞进行低氧预处理,以适应移植后宿主体内的低氧状态[10,11]。目前有研究证实,低氧预处理能减少细胞内活性氧自由基的生成,低氧预处理的间充质干细胞对心肌梗死的修复效果更强[12]。在脊髓损伤的修复实验中,低氧预处理脐带间充质干细胞的移植存活率高于常氧细胞,且能进一步下调损伤局部ED-1、caspase-3阳性细胞数量,表明低氧预处理的脐带间充质干细胞对损伤组织炎症的调控能力更强[13]。有研究证实,低氧刺激会降低树突状细胞的迁移能力,氧分压越低,其迁移能力越低[14]。但间充质干细胞的生物学行为与树突状细胞差别较大,低氧是否影响脐带间充质干细胞的迁移仍需进一步研究。本研究选用低氧浓度为5%,该浓度与体内生理氧浓度,尤其是女性生殖系统组织氧浓度更接近。结果显示,两组均高表达干细胞相关标志物CD90、CD44及间充质干细胞的标志性蛋白波形蛋白、层粘连蛋白,低表达血管内皮细胞相关标志物CD34、CD45及HLA-DR,证实两组细胞均为间充质干细胞;两组上述表型相关指标表达比较差异均无统计学意义,表明低氧预处理对脐带间充质干细胞的表型特征无明显影响。
刘林奇等[15]研究显示,低氧刺激可提高脂肪间充质干细胞的增殖速度。本研究结果显示,两组培养1~6天细胞计数及细胞增殖活性均先升高后降低,低氧组培养1~6天细胞计数均高于常氧组,培养2~6天细胞增殖活性均高于常氧组;说明低氧预处理可提高脐带间充质干细胞的增殖能力,对于在短期内收集足够移植所需数量的细胞具有重要意义。脐带间充质干细胞在神经修复中具有重要作用,与其神经因子分泌功能密切相关,其中BDNF、VEGF、HGF、CNTF均为重要的神经营养因子。本研究结果显示,低氧组BDNF、VEGF、HGF、CNTF mRNA相对表达量均高于常氧组,说明低氧预处理可提高脐带间充质干细胞的神经因子分泌功能,对于其修复神经损伤具有重要作用。
综上所述,低氧预处理对脐带间充质干细胞的表型特征无明显影响,但可提高其增殖能力及神经营养因子分泌功能。本研究为提高干细胞移植效率提供了新的实验和理论基础。脐带间充质干细胞移植修复神经损伤除了对移植细胞的存活率、分泌功能有要求外,还涉及宿主体内细胞的增殖、分化等方面。低氧预处理脐带间充质干细胞的氧浓度及其对宿主细胞炎症、凋亡、增殖的影响仍需进一步研究。
[1] Parekkadan B, Milwid JM. Mesenchymal stem cells as therapeutics[J]. Annu Rev Biomed Eng, 2010(12):87-117.
[2] Koh S, Kim N, Yin HH, et al. Human umbilical tissue-derived cells promote synapse formation and neurite outgrowth via thrombospondin family proteins[J]. J Neurosci, 2015,35(47):15649-15665.
[3] Gong W, Han Z, Zhao H, et al. Banking human umbilical cord-derived mesenchymal stromal cells for clinical use[J]. Cell Transplant, 2012,21(1):207-216.
[4] Kakudo N, Morimoto N, Ogawa T, et al. Hypoxia enhances proliferation of human adipose-derived stem cells via HIF-1α activation[J]. PLoS One, 2015,10(10):e139890.
[5] Wang X, Liu C, Li S, et al. Hypoxia precondition promotes adipose-derived mesenchymal stem cells based repair of diabetic erectile dysfunction via augmenting angiogenesis and neuroprotection[J]. PLoS One, 2015,10(3):e118951.
[6] Zhou Z, Chen Y, Zhang H, et al. Comparison of mesenchymal stromal cells from human bone marrow and adipose tissue for the treatment of spinal cord injury[J]. Cytotherapy, 2013,15(4):434-448.
[7] Hsuan YC, Lin CH, Chang CP, et al. Mesenchymal stem cell-based treatments for stroke, neural trauma, and heat stroke[J]. Brain Behav, 2016,6(10):e526.
[8] Huxtable AG, Smith SM, Peterson TJ, et al. Intermittent hypoxia-induced spinal inflammation impairs respiratory motor plasticity by a spinal p38 map kinase-dependent mechanism[J]. J Neurosci, 2015,35(17):6871-6880.
[9] Andrade PZ, de Soure AM, Dos SF, et al. Ex vivo expansion of cord blood haematopoietic stem/progenitor cells under physiological oxygen tensions: clear-cut effects on cell proliferation, differentiation and metabolism[J]. J Tissue Eng Regen Med, 2015,9(10):1172-1181.
[10] Liu J, Hao H, Xia L, et al. Hypoxia pretreatment of bone marrow mesenchymal stem cells facilitates angiogenesis by improving the function of endothelial cells in diabetic rats with lower ischemia[J]. PLoS One, 2015,10(5):e126715.
[11] Ejtehadifar M, Shamsasenjan K, Movassaghpour A, et al. The effect of hypoxia on mesenchymal stem cell biology[J]. Adv Pharm Bull, 2015,5(2):141-149.
[12] Liu XB, Wang JA, Ji XY, et al. Preconditioning of bone marrow mesenchymal stem cells by prolyl hydroxylase inhibition enhances cell survival and angiogenesis in vitro and after transplantation into the ischemic heart of rats[J]. Stem Cell Res Ther, 2014,5(5):111.
[13] Zhilai Z, Biling M, Sujun Q, et al. Preconditioning in lowered oxygen enhances the therapeutic potential of human umbilical mesenchymal stem cells in a rat model of spinal cord injury[J]. Brain Res, 2016(1642):426-435.
[14] 胡柯,王光伟,杨宇,等.间歇性低氧致树突状细胞迁徙能力改变及其通路机制探讨[J].重庆医学,2016,45(30):4200-4202,4206.
[15] 刘林奇,鲁峰,王量,等.低氧预处理对人脂肪来源干细胞增殖和分化潜能影响的研究[J].中国美容整形外科杂志,2015,26(4):231-234.
Effects of hypoxic preconditioning on cell phenotype, proliferation, and secretion of neurotrophic factors of umbilical cord mesenchymal stem cells
YAOShun,JINAnmin,ZHANGHui,MINShaoxiong,HUANGShuai,ZHOUZhilai
(ZhujiangHospitalofSouthernMedicalUniversity,Guangzhou510282,China)
国家自然科学基金青年科学基金资助项目(81400996);广东省自然科学基金博士启动项目(2014A030310100)。
姚舜(1990-),男,住院医师,研究方向为脊柱脊髓损伤的基础与临床。E-mail: yaoshun810@163.com
周治来(1983-),男,主治医师,研究方向为脊柱脊髓损伤的基础与临床。E-mail: 273344078@qq.com
10.3969/j.issn.1002-266X.2017.32.007
R329.2
A
1002-266X(2017)32-0025-04
2017-02-15)
