脑源性神经营养因子对人滋养层细胞增殖和侵袭的影响及其机制
2017-10-10肖艳平付久园王哲葛永梅裴美丽
肖艳平,付久园,王哲,葛永梅,裴美丽
(1承德医学院附属医院,河北承德067000;2献县人民医院;3宽城县医院)
脑源性神经营养因子对人滋养层细胞增殖和侵袭的影响及其机制
肖艳平1,付久园1,王哲2,葛永梅1,裴美丽3
(1承德医学院附属医院,河北承德067000;2献县人民医院;3宽城县医院)
目的探讨脑源性神经营养因子(BDNF)对人滋养层细胞HTR-8/SVneo增殖和侵袭的影响,并探讨其可能的作用机制。方法将HTR-8/Svneo细胞分成A、B、C组,A组加入1 mL/L DMSO,B组加入5×10-8g/mL的BDNF,C组加入0.1 μmol/L的BDNF络氨酸激酶受体TrkB特异性抑制剂K252a,24 h后转板继续培养。采用CCK8法观察3组细胞继续培养0、24、48及72 h时的细胞增殖能力(以OD450表示),采用Transwell实验观察3组细胞继续培养24 h时的侵袭能力(以穿膜细胞数表示),采用Western blotting法检测3组细胞继续培养24 h时磷酸化TrkB(p-TrkB)和PI3K/Akt/mTOR信号通路相关蛋白磷酸化蛋白激酶B(p-Akt)、磷酸化雷帕霉素靶蛋白(p-mTOR)。结果继续培养48、72 h时B组细胞OD450均高于A组(P均<0.05),C组细胞OD450均低于A组(P均<0.05)。A、B、C组穿膜细胞数分别为(42±4)、(87±6)、(29±3)个。B组细胞穿膜细胞数多于A组(P<0.05),C组细胞穿膜细胞数少于A组(P均<0.05)。与A组相比,B组细胞p-TrkB、p-Akt、p-mTOR蛋白表达量均升高(P均<0.05),C细胞p-TrkB、p-Akt、p-mTOR表达量均降低(P均<0.05)。结论BDNF可以增强人滋养层细胞HTR-8/Svneo增殖和侵袭能力,其机制可能与其活化PI3K/Akt/mTOR信号通路有关。
脑源性神经营养因子;人滋养层细胞;细胞增殖;细胞侵袭
妊娠期间胎盘的成功形成和维持依靠对滋养层细胞增殖和侵袭能力的严格调控[1]。滋养层细胞能够将胎儿和母体组织分隔开并充当两者物质交换的通道,为胎盘提供物理支撑的同时可保护胎儿免受母体免疫排斥反应的伤害[2,3]。胎盘滋养层细胞的功能异常会引起多种妊娠疾病的发生,严重威胁母婴的健康。研究表明,脑源性神经营养因子(BDNF)与其受体酪氨酸激酶受体B(TrkB)在神经系统等多个领域发挥重要作用[4,5],但目前有关其对滋养层细胞增殖和侵袭能力影响的研究少见。本研究以人源妊娠滋养细胞系HTR-8/SVneo为研究对象,探讨BDNF对HTR-8/SVneo细胞增殖和侵袭的影响,并探讨相关作用机制。
1 材料与方法
1.1 主要试剂及仪器 RPMI-1640培养液购自HYCLONE公司,血清购自Gibco公司,胎牛血清(FBS)、青霉素、链霉素、二甲基亚砜(DMSO)、0.25%胰酶消化液、CCK-8试剂、RIPA裂解液购自北京索莱宝公司,BDNF购自ProSpec公司,TrkB的特异性抑制剂K252a购自MCE公司,兔抗人磷酸化TrkB(p-TrkB)、磷酸化蛋白激酶B(p-Akt)和磷酸化雷帕霉素靶蛋白(p-mTOR)一抗及HRP标记的二抗均购自Proteintech公司,Matrigel胶购自美国BD公司,Transwell小室购自美国Millipore公司。细胞培养耗材购自美国Eppendorf公司。HTR-8/SVneo细胞为本科室保存。
1.2 细胞分组及BDNF应用 HTR-8/SVneo细胞使用RPMI-1640培养液于37 ℃、5%CO2环境下常规培养(血清浓度为10%,青霉素100 U/mL,链霉素0.1 g/L),待细胞进入对数生长期时,制备单细胞悬液,种植到6孔板,将细胞分成A、B、C组,A组加入1 mL/L DMSO,B组加入5×10-8g/mL的BDNF,C组加入0.1 μmol/L的BDNF络氨酸激酶受体TrkB特异性抑制剂K252a,继续培养24 h后进行后续实验。
1.3 三组细胞增殖能力观察 采用CCK-8法。3组细胞处理24 h后,制备细胞悬液并计数,取100 μL细胞悬液,以每孔1 000个细胞的标准种到96孔板中进行常规培养,分别在第0、24、48、72 h检测一次细胞活力。每次检测前每孔加10 μL CCK8试剂,37 ℃培养箱中孵育1.5 h,使用酶标仪用450 nm激发光检测光密度值(OD450),实验重复3次。
1.4 三组细胞侵袭能力观察 采用Transwell法。将Matrigel胶100 μL加至24孔板的Transwell上室,37 ℃放置4 h。吸掉小室中的液体,上下室分别加入100、600 μL无血清培养液,37 ℃放置30 min后吸去培养基。将处理24 h后的3组细胞制备细胞悬液各100 μL加至上室,使细胞数为1×104个,下室加入600 μL的含10% FBS的RPMI-1640培养液。进行常规培养24 h后,擦掉上室中的细胞和基质胶,清洗上下室,4%多聚甲醛固定15 min,0.1%结晶紫染色5 min,切下基底膜观察,拍照,计数穿膜细胞数。
1.5 三组细胞p-TrkB、p-Akt、p-mTOR检测 采用Western blotting法。收集3组细胞,加RIPA裂解液(加蛋白酶抑制剂)裂解提取蛋白,BCA法测定浓度后,95 ℃加热5 min。垂直电泳槽内每孔内加入约20 μg蛋白,10% SDS聚丙烯酰胺凝胶电泳分离蛋白样品,转膜至PVDF膜,5%脱脂奶粉室温封闭1 h,兔抗人p-TrkB、p-Akt和p-mTOR一抗4 ℃孵育过夜,HRP标记的二抗室温孵育1 h,洗膜后加ECL显色。以β-tubulin为内参照。采用Image J v1.48中文版软件分析图像,以目的蛋白条带灰度/β-tubulin条带灰度比值表示目的蛋白相对表达量。
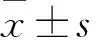
2 结果
2.1 三组细胞OD450比较 继续培养0、24、48、72 h三组细胞OD450见表1。继续培养48、72 h时B组细胞OD450均高于A组(P均<0.05),C组细胞OD450均低于A组(P均<0.05)。
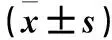
表1 不同时点三组细胞OD450值比较
注:与A组比较,aP<0.05。
2.2 三组穿膜细胞数比较 A、B、C组穿膜细胞数分别为(42±4)、(87±6)、(29±3)个。B组细胞穿膜细胞数多于A组(P<0.05),C组细胞穿膜细胞数少于A组(P均<0.05)。
2.3 三组细胞p-TrkB、p-Akt、p-mTOR比较 三组细胞p-TrkB、p-Akt、p-mTOR表达量见表2。与A组相比,B组细胞p-TrkB、p-Akt、p-mTOR蛋白表达量均升高(P均<0.05),C细胞p-TrkB、p-Akt、p-mTOR表达量均降低(P均<0.05)。
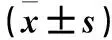
表2 组细胞p-TrkB、p-Akt、p-mTOR比较
注:与A组比较,aP<0.05。
3 讨论
BDNF是一种脑源性生长因子,主要由神经元和星形胶质细胞分泌,在脑组织中广泛分布,在维持早期胚胎神经元的生长、分化和脊椎动物的神经系统分发育中发挥重要作用。TrkB是BDNF的特异性受体,由一条单跨膜肽链组成。当TrkB与BDNF结合后,TrkB自身发生磷酸化,活化的TrkB能够继续向下传导信号,激活丝裂原活化蛋白激酶(MAPK)、磷脂酰肌醇-3-激酶(PI3K)、磷酸脂酶C-γ(PLC-γ)信号通路,进而影响细胞的各项功能[6,7]。目前,BDNF/TrkB信号通路的研究主要集中在神经系统[8]。近年来在其他组织的细胞中也广泛发现了BDNF的表达,BDNF/TrkB信号通路也越来越多地被引入到其他领域的研究[9-10],但目前尚少见BDNF对滋养层细胞影响的研究。
稳定的HTR-8/SVneo细胞系模型的建立可为妊娠早期滋养层细胞分化的细胞生物学研究提供一个可靠有效的模型。HTR-8/SVneo细胞的生理功能与早孕绒毛层细胞基本一致,故被广泛应用。本研究以HTR-8/SVneo细胞系为实验对象,结果显示,与A组相比,外源性BDNF对滋养层细胞HTR-8/SVneo细胞的增殖和侵袭能力有显著的促进作用,而用特异性TrkB抑制剂K252a切断BDNF/TrkB信号通路后,HTR-8/SVneo细胞的增殖和侵袭能力皆被抑制,提示BDNF/TrkB信号通路参与影响了滋养层细胞HTR-8/SVneo的增殖和侵袭能力。本研究结果显示,BDNF处理后细胞TrkB的磷酸化水平增加,而抑制剂K252a处理后,TrkB的磷酸化水平受到抑制,表明人为的刺激可以成功控制BDNF/TrkB信号通路的活化。PI3K/Akt/mTOR信号通路是影响细胞增殖、侵袭和凋亡等生理活动的关键信号通路之一。本研究通过进一步对PI3K/Akt/mTOR信号通路相关蛋白的表达进行了检测,结果表明经BDNF处理上调p-TrkB的水平后,p-Akt和p-mTOR的表达水平也相应上调。故推测在滋养层细胞HTR-8/SVneo中,BDNF可能是通过影响PI3K/Akt/mTOR信号通路的活化来实现对滋养层细胞HTR-8/SVneo功能的影响。
综上所述,外源添加BDNF可通过影响PI3K/Akt/mTOR信号通路的活化增加滋养层细胞HTR-8/SVneo的增殖和侵袭能力,这将有助于后续对滋养层细胞相关疾病发病机制的研究。
[1] Redman CW,Sargent IL. Latest advances in understanding preeclampsia[J]. Science,2005,308(5728):1592-1594.
[2] Albekairi NA,Alenazy S,Ali S,et al. Transport of digoxin-loaded polymeric nanoparticles across BeWo cells, an in vitro model of human placental trophoblast[J]. Ther Deliv,2015,6(12):1325-1334.
[3] Anupa G,Bhat MA,Srivastava AK,et al. Cationic antimicrobial peptide, magainin down-regulates secretion of pro-inflammatory cytokines by early placental cytotrophoblasts[J]. Reprod Biol Endocrinol,2015,13(1):121.
[4] Pandya CD,Kutiyanawalla A,Pillai A. BDNF-TrkB signaling and neuroprotection in schizophrenia[J]. Asian J Psychiatr,2013,6(1):22.
[5] Feng N,Huke S,Zhu G,et al. Constitutive BDNF/TrkB signaling is required for normal cardiac contraction and relaxation[J]. Proc Nati Acad Sci USA,2015,112(6):1880.
[6] Luo L,Liu X L,Li J,et al. Macranthol promotes hippocampal neuronal proliferation in mice via BDNF-TrkB-PI3K/Akt signaling pathway[J]. Eur J Pharmacol,2015,76(2):357-363.
[7] Min SK,Lee WS,Jeong J,et al. Induction of metastatic potential by TrkB via activation of IL6/JAK2/STAT3 and PI3K/AKT signaling in breast cancer[J]. Oncotarget,2015,6(37):40158-40171.
[8] Liu WX,Wang J,Xie ZM,et al. Regulation of glutamate transporter 1 via BDNF-TrkB signaling plays a role in the anti-apoptotic and antidepressant effects of ketamine in chronic unpredictable stress model of depression[J]. Psychopharmacology,2016,233(3):405-415.
[9] Colle R,Deflesselle E,Martin S,et al. BDNF/TRKB/P75NTR polymorphisms and their consequences on antidepressant efficacy in depressed patients[J]. Pharmacogenomics,2015,16(9):997-1013.
[10] Thomaz A,Jaeger M,Buendia M,et al. BDNF/TrkB signaling as a potential novel target in pediatric brain tumors: anticancer activity of selective TrkB inhibition in medulloblastoma cells [J]. J Mol Neurosci,2016,59(3):326-333.
10.3969/j.issn.1002-266X.2017.35.010
R329.25;R714.12
A
1002-266X(2017)35-0033-03
2017-03-22)
