急性白血病患儿骨髓单个核细胞CREB、Bcl-2的表达及其与病灶髓外浸润和预后的关系
2017-10-10郑转珍李国霞张耀方徐丽娟朱镭
郑转珍,李国霞,张耀方,徐丽娟,朱镭
(1山西医科大学第二临床医学院,太原030001;2 山西省妇幼保健院)
急性白血病患儿骨髓单个核细胞CREB、Bcl-2的表达及其与病灶髓外浸润和预后的关系
郑转珍1,李国霞1,张耀方1,徐丽娟1,朱镭2
(1山西医科大学第二临床医学院,太原030001;2山西省妇幼保健院)
目的观察急性白血病(AL)患儿 骨髓单个核细胞中CAMP反应元件型结合因子(CREB)、B淋巴细胞瘤-2(Bcl-2) mRNA和蛋白的表达变化,并探讨其与AL患儿髓外浸润、预后的关系。方法选择2015年2月~2017年3月收治的96例AL患儿,其中急性淋巴细胞白血病(ALL)61例为ALL组,急性髓细胞白血病(AML)35例为对照组,另取骨髓穿刺排除白血病的其他血液病患儿35例为对照组。均行骨髓穿刺抽取骨髓组织分离单个核细胞,用实时荧光定量PCR法测算其中CREB、Bcl-2 mRNA相对表达量,用Western blotting法测算其中CREB、Bcl-2 蛋白相对表达量,并进行组间比较。将ALL、AML组患儿按是否存在髓外浸润分为髓外浸润亚组和无髓外浸润亚组,按化疗后是否缓解分为缓解亚组和未缓解亚组,比较各亚组CREB、Bcl-2 mRNA和蛋白相对表达量。结果ALL、AML组骨髓单个核细胞中CREB、Bcl-2 mRNA和蛋白相对表达量均高于对照组(P均<0.05)。ALL组和AML组骨髓单个核细胞CREB、Bcl-2 mRNA和蛋白相对表达量相比,P均>0.05。ALL、AML组中有髓外浸润亚组患儿骨髓单个核细胞中CREB、Bcl-2 mRNA和蛋白相对表达量均高于各自的无髓外浸润亚组(P均<0.05)。ALL、AML组中缓解亚组患儿骨髓单个核细胞中CREB、Bcl-2 mRNA和蛋白相对表达量均高于各自的未缓解亚组(P均<0.05)。结论AL患儿骨髓单个核细胞中CREB、Bcl-2 mRNA和蛋白高表达,且表达量与髓外浸润和患儿预后有关。
急性白血病;急性淋巴细胞白血病;急性髓细胞白血病;骨髓;单个核细胞;CAMP反应元件结合蛋白;B淋巴细胞瘤-2
急性白血病(AL)作为多发于儿童时期的一类常见的血液性恶性肿瘤,对患儿的生命安全具有较大的威胁。该病发病机制不明确,复发率高,髓外浸润多见,影响长期生存,治疗难度较大。寻找AL的相关基因并用其辅助AL诊治具有重要的临床意义[1]。CAMP反应元件结合蛋白(CREB)属于核转录调节因子,有利于细胞的存活与增殖,还可对细胞凋亡产生抑制,参与正常机体的造血功能及慢性白血病的发生发展[2],但其与AL的关系尚不明确。B淋巴细胞瘤-2(Bcl-2)属于凋亡抑制基因,其同恶性肿瘤的形成紧密相关[3,4],但Bcl-2与AL关系的相关研究相对较少。本研究观察了AL患儿骨髓单个核细胞CREB、Bcl-2 mRNA和蛋白的表达变化,并探讨其与AL患儿髓外浸润、预后的关系。现报告如下。
1 资料与方法
1.1 临床资料 选择2015年2月~2017年3月收治的96例AL患儿。入选标准:①患儿均经骨髓穿刺病例活检确诊;②年龄<14岁;③初诊的患儿。排除标准:①其他类型的恶性血液性疾病;②继发于其他恶性肿瘤者;③有严重的心、肝、肾等脏器的功能性不全者。其中急性淋巴细胞白血病(ALL)61例,为ALL组。ALL组男32例、女29例,年龄3~12(6.24±1.07)岁。B细胞型20例,T细胞型41例。有髓外浸润46例,无髓外浸润15例。均采用标准VDLP方案(长春新碱+柔红霉素+泼尼松+左旋门冬酰胺酶)治疗1个月,缓解(完全缓解+部分缓解)48例,未缓解13例。急性髓细胞白血病(AML)35例为AML组。男22例、女13例,年龄4~13(6.27±1.12)岁。M1型7例,M2型19例,M4型6例,M5型3例。有髓外浸润27例,无髓外浸润8例。均采用DAE方案(柔红霉素+阿糖胞苷+VP16)治疗1个月,缓解24例,未缓解11例。另选同期收治的骨髓穿刺排除白血病的35例血液病患儿为对照组。男25例、女10例,年龄3~12(6.25±1.09)岁。其中感染性疾病15例,缺铁型贫血14例,血小板减少型紫癜6例。各组患儿性别、年龄等一般资料相比P均>0.05。本研究的内容和方法已经我院医学伦理委员会批准,患儿监护人均签署知情同意书。
1.2 各组患儿骨髓单个核细胞CREB、Bcl-2 mRNA检测 取各组患儿骨髓穿刺所得骨髓组织,用天津浩洋公司生产的Ficoll液分离单个核细胞,采用实时荧光定量PCR法测算其中CREB、Bcl-2 mRNA相对表达量。先用购于美国MBI公司的RNA提取试剂盒对细胞的RNA进行提取,操作过程应严格遵照说明书的步骤施行。然后行实时荧光定量PCR,试剂盒购自美国MBI公司,操作按试剂盒说明书进行。CREB引物序列:正向5′-GACTTTCTCCGGAACTCA-3′,反向5′-CGGTACCATTGCTAGCCAG-3′,扩增片段长度312 bp。Bcl-2引物序列:正向5′-CGCTTTGCCACGGTGGTGGAG-3′,反向5′-GTACATCACTGACAATGC-3′,扩增片段长度415 bp。内参照β-actin引物序列:正向5′-TTAGCTGTGCTCGCGCTACTCTCTCTC-3′,反向5′-GTCGGATTGATGAAACCCAGACACA-3′,扩增片段长度168 bp。PCR反应条件为94 ℃ 5 min,64 ℃1 min,后退火(其中CREB为55 ℃,Bcl-2为60 ℃,β-actin为50 ℃)约1 min,72 ℃ 2 min,72 ℃ 5 min,共40个循环。将10μL的PCR产物放于20 g/L的琼脂糖凝胶中电泳,凝胶成像系统分析,用2-ΔΔCt表示CREB、Bcl-2 mRNA相对表达量。
1.3 各组患儿骨髓单个核细胞CREB、Bcl-2 蛋白检测 采用Western blotting法。取按1.2方法分离的骨髓单个核细胞,加入细胞裂解液裂解,心收集蛋白,用Western blotting法检测CREB、Bcl-2 蛋白相对表达量。操作按试剂盒说明书进行。CREB、Bcl-2 蛋白相对表达量以CREB、Bcl-2 蛋白条带与内参照GADPH条带灰度值的比值表示。
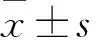
2 结果
2.1 各组骨髓单个核细胞CREB、Bcl-2mRNA及蛋白相对表达量比较 各组骨髓单个核细胞CREB、Bcl-2mRNA及蛋白相对表达量见表1。ALL、AML组骨髓单个核细胞中CREB、Bcl-2 mRNA和蛋白相对表达量均高于对照组(P均<0.05)。ALL组和AML组骨髓单个核细胞CREB、Bcl-2 mRNA和蛋白相对表达量相比,P均>0.05。
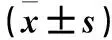
表1 各组患儿骨髓单个核细胞CREB、Bcl-2的mRNA和蛋白相对表达量比较
注:与对照组相比,*P<0.05。
2.2 有、无髓外浸润亚组患儿骨髓单个核细胞中CREB、Bcl-2 mRNA和蛋白相对表达量比较 ALL、AML组中有、无髓外浸润亚组患儿骨髓单个核细胞中CREB、Bcl-2 mRNA和蛋白相对表达量见表2。ALL、AML组中有髓外浸润亚组患儿骨髓单个核细胞中CREB、Bcl-2 mRNA和蛋白相对表达量均高于各自的无髓外浸润亚组(P均<0.05)。
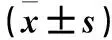
表2 有、无髓外浸润亚组患儿骨髓单个核细胞CREB、Bcl-2的mRNA和蛋白相对表达量比较
注:与无髓外浸润组相比,*P<0.05。
2.3 缓解、未缓解亚组患儿骨髓单个核细胞中CREB、Bcl-2 mRNA和蛋白相对表达量比较 ALL、AML组中缓解、未缓解亚组患儿骨髓单个核细胞中CREB、Bcl-2 mRNA和蛋白相对表达量见表3。ALL、AML组中缓解亚组患儿骨髓单个核细胞中CREB、Bcl-2 mRNA和蛋白相对表达量均高于各自的未缓解亚组(P均<0.05)。
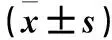
表3 缓解、未缓解亚组患儿骨髓单个核细胞CREB、Bcl-2的mRNA和蛋白相对表达量比较
注:与未缓解组相比,*P<0.05。
3 讨论
骨髓细胞基因转录主要受转录因子的调控[5]。CREB属于CREB/ATF-1这一重要转录因子家族的成员。在多类癌症中均已发现CREB处于高表达状态。Bcl-2蛋白由Bcl-2原癌基因编码,其高表达可以促进癌细胞存活。有报道指出[6~8],AL的发病机制主要是增殖失控、分化障碍和细胞凋亡抑制。造血细胞的非正常恶性增殖及凋亡受抑也与患者预后有关[9~11]。为进一步明确CREB、Bcl-2与AL的关系,我们观察了AL患儿骨髓单个核细胞CREB、Bcl-2 mRNA和蛋白的表达变化,并探讨其与AL患儿髓外浸润、预后的关系。结果显示ALL、AML组患儿骨髓单个核细胞中CREB、Bcl-2 mRNA和蛋白相对表达量高于对照组,ALL、AML组间比较差异无统计学意义。这与文川等[12~14]的报道结果类似,提示无论是ALL还是AML,患儿骨髓单个核细胞中CREB、Bcl-2 mRNA和蛋白的表达均上升。分析原因,主要可能与CREB和Bcl-2在癌细胞中的作用机制及白血病的发病机制有关。CREB的高表达则可能是通过某种信号通路对Bcl-2在白血病的有关发病进程中的表达进行上调而实现的。换言之,CREB及Bcl-2的高表达均可能是ALL及AML的部分发病共同机制,因此二者在ALL组和AML组中的表达水平均明显上升。本研究还发现,ALL、AML患儿髓外浸润亚组骨髓单个核细胞中CREB、Bcl-2 mRNA和蛋白相对表达量均高于各自的无髓外浸润亚组。这提示了CREB及Bcl-2在有髓外浸润的白血病患儿中更易表现出高表达状态。原因可能是因为髓外浸润易使病情进展,终使二者均呈现出高表达。此外,ALL、AML组缓解亚组骨髓单个核细胞中CREB、Bcl-2 mRNA和蛋白相对表达量均高于未缓解亚组。这提示了经过相应的治疗后,症状缓解的白血病患儿骨髓细胞中CREB和Bcl-2的表达明显下调。原因可能是因为化疗药物的作用杀死了部分癌细胞,阻断了白血病有关细胞的异常增殖过程,最终干扰了CREB和Bcl-2在细胞中的表达,并使二者均下调[15]。
[1] 乔静巧,何苗,张姝婷,等.新型小分子药物在治疗慢性淋巴细胞白血病中的研究进展[J].中国实验血液学杂志,2017,25(1):244-248.
[2] 吴勇,薛孟华,刘伟,等.非小细胞肺癌CREB表达的临床意义[J].中华胸心血管外科杂志,2010,26(6):403-404.
[3] 余丹,程辉,易雪,等.黄芪对老年急性髓系白血病患者Bcl-2家族凋亡因子的相关影响[J].哈尔滨医药,2016,36(5):501-503.
[4] 李梅,茅国新,沈浮,等.CREB3基因启动子区域的突变与肝癌的关系[J].实用肿瘤杂志, 2005,20(1):29-32.
[5] 李增军,邱录贵.慢性淋巴细胞白血病治疗研究进展[J].白血病·淋巴瘤,2017,26(1):5-7.
[6] 石瑞雪,吕坤聚.肺癌组织CXCR2和CREB的表达及意义[J].齐鲁医学杂志,2014,29(5):411-413.
[7] 赵冬梅,潘兴泉.B细胞淋巴瘤因子-2(Bcl-2)抑制剂 --Venetoclax[J].临床药物治疗杂志,2017,15(2):85-88.
[8] 张伟英,张晓东,叶丽虹,等.乙肝病毒X蛋白通过CREB上调HBx结合蛋白促进肝癌细胞迁移[J].中国生物化学与分子生物学报,2015,31(5):473-480.
[9] 张晓杰,费洪新,刘得水,等.B细胞淋巴瘤/白血病因子-2家族相关信号通路与重度抑郁症关系的研究进展[J].中国老年学杂志,2017,37(2):485-488.
[10] Dai Y, Rahmani M, Pei XY, et al. Farnesyltransferase inhibitors interact synergistically with the Chk1 inhibitor UCN-01 to induce apoptosis in human leukemia cells through interruption of both Akt and MEK/ERK pathways and activation of SEK1/JNK[J]. Blood, 2005,105(4):1706-1716.
[11] 彭静,马筱玲,孙晓曦,等.LukS-PV通过C5aR诱导急性髓系白血病细胞THP-1凋亡的研究[J].安徽医科大学学报,2017,52(2):164-168.
[12] 文川,马夫天,万伍卿,等.cAMP反应元件结合蛋白/Bcl-2在小儿急性白血病骨髓细胞中的表达及意义[J].中国当代儿科杂志,2010,12(3):177-180.
[13] Sakamoto KM, Grant S, Saleiro D, et al. Targeting novel signaling pathways for resistant acute myeloid leukemia[J]. Mol Genet Metab, 2015,114(3):397-402.
[14] 肖佩芳,柴忆欢,何军,等.cAMP反应元件结合蛋白在儿童急性髓细胞白血病中的表达及其意义探讨[J].中国小儿血液与肿瘤杂志,2007,12(3):97-101.
[15] 饶佳,卢玮,王芸芸,等.bcl-2基因过表达致急性髓系白血病对柔红霉素耐药机制的初步探讨[J].安徽医科大学学报,2017,52(3):369-372.
10.3969/j.issn.1002-266X.2017.35.023
733.72
B
1002-266X(2017)35-0069-03
2017-06-28)
山西省科技攻关项目(20120313020-6)。
