类风湿性关节炎合并血小板增多患者血清IL-11、sIL-11R水平变化
2017-10-10李琳苏娟柴克霞杨洁秦雅婧鄂维建李玉玲
李琳,苏娟,柴克霞,杨洁,秦雅婧,鄂维建,李玉玲
(1青海大学研究生院,西宁810000;2淄博第一医院;3青海大学附属医院)
类风湿性关节炎合并血小板增多患者血清IL-11、sIL-11R水平变化
李琳1,2,苏娟3,柴克霞3,杨洁3,秦雅婧3,鄂维建3,李玉玲3
(1青海大学研究生院,西宁810000;2淄博第一医院;3青海大学附属医院)
目的观察类风湿性关节炎(RA)合并血小板增多患者血清白细胞介素11(IL-11)、游离白细胞介素11受体(sIL-11R)水平的变化。方法将60例RA患者根据血小板计数(PLT)是否>300×109/ L,分为血小板升高组24例和血小板正常组36例,另选健康体检者30例为对照组,采用ELISA法检测三组患者血清IL-11、sIL-11R。分析RA患者血清IL-11、sIL-11R与PLT、平均血小板体积(MPV)、血小板分布宽度(PDW)、降钙素原(PCT)、RA患者病情评分(DAS28评分)、血沉(ESR)、C反应蛋白(CRP)、类风湿因子(RF)、抗环氨酸肽抗体(ACCP)的相关性。结果血小板增多组血清IL-11、sIL-11R水平均高于血小板正常组和正常组(P均<0.05)。RA组患者血清IL-11水平与sIL-11R、PLT、PCT、DAS28、ESR、CRP呈正相关(P均<0.05),与MPV、PDW、RF、ACCP无相关性(P均>0.05);RA组血清sIL-11R水平与PLT、PCT、DAS28、ESR、CRP、RF、ACCP均呈正相关(P均<0.05)。结论RA合并血小板增多患者血清IL-11、sIL-11R水平明显升高。
白细胞介素11;游离白细胞介素11受体;类风湿关节炎;血小板增多症
类风湿关节炎(RA)患者疾病活动期多合并反应性血小板增多。血小板在RA患者的关节滑液及血浆中发生聚集、增强活化,血小板活化导致大量炎性介质释放,与RA患者滑膜炎和血管翳密切相关[1,2]。所以关于RA合并反应性血小板增多的调控因素是一直研究的热点。IL-11是IL-6家族细胞因子的新进成员,在促进血小板的增殖分化、调节免疫应答、调节骨代谢、诱导急性期反应蛋白合成等方面[3~6]具有重要作用,与多种组织的炎症状态相关。目前有研究表明 IL-11较高表达于 RA患者的滑膜组织、关节液及血清中,而IL-11是否与RA合并反应性血小板增多有关,国内尚未有相关报道。本研究观察了RA合并血小板增多患者血清IL-11及游离白细胞介素11受体(sIL-11R)水平变化,探讨其在 RA合并血小板增多发生的可能机制中的作用。现报告如下。
1 资料与方法
1.1 临床资料 选择2014年11月~2015年9月青海大学附属医院风湿科住院的RA患者60例,均符合2010 EULAR/ACR修订并颁布的RA分类标准[7],按照PLT是否>300×109/L分为血小板增多组24例和血小板正常组36例。血小板增多组男9例,女15例,年龄(48.79±7.87)岁。血小板正常组男14例,女22例,年龄(52.19±13.91)岁。所有患者均排除糖尿病、高血压、高血脂、心脑血管疾病、感染、肝肾疾病、血栓性疾病、血小板疾病等其他疾病。另选30例年龄、性别与RA患者匹配的健康体检人员为对照组。
1.2 血清IL-11、sIL-11R的检测方法 受试者清晨空腹抽取肘静脉血2 mL,2 h内室温下3 000 r/min离心15 min,分离血清并于-80℃冰箱中保存待检。血清IL-11、sIL-11R 检测采用ELISA法,操作按试剂盒(购自武汉优尔生商贸有限公司)说明书进行。
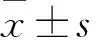
2 结果
2.1 各组血清IL-11、sIL-11R比较 三组受检者血清IL-11、sIL-11R 见表1。血小板增多组血清IL-11、sIL-11R水平明显高于血小板正常组及健康对照组(P均<0.05)。
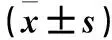
表1 三组血清IL-11、sIL-11R水平比较
注:与血小板正常组比较,▲P<0.05;与对照组比较,*P<0.05。
2.2 RA患者血清IL-11、sIL-11R与PLT、PCT、DAS28、ESR、CRP、RF、ACCP的相关性 Pearson相关分析结果显示RA患者血清IL-11水平与sIL-11R、PLT、PCT、DAS28、ESR、CRP均呈正相关(r=0.480,0.642,0.408,0.447,0.352,0.355,P均<0.05),与MPV、PDW、RF、ACCP无相关性(P均>0.05)。血清sIL-11R水平与PLT、PCT、DAS28、ESR、CRP、Rf、ACCP均呈正相关(r=0.426、0.307、0.457、0.421、0.413、0.442、0.370,P均<0.05)。
以IL-11为因变量,PLT、PCT、CRP、ESR、sIL-11R为自变量,进行多元逐步回归分析,结果显示影响血清IL-11最显著的因素是PLT(Beta=0.932,P<0.05)、PCT(Beta=-0.443,P<0.05);以sIL-11R作为因变量,IL-11、PLT、RF、CRP、ESR、RF、ACCP为自变量,进行多元逐步回归分析,结果影响血清sIL-11R最显著的因素是IL-11(Beta=0.349,P<0.05)。
3 讨论
本研究结果显示RA合并血小板增多患者血清IL-11水平显著升高,进一步分析发现RA组患者血清IL-11与PLT、PCT呈正相关,表明在RA中IL-11可能促进了血小板的增多。RA患者血清中IL-11水平增高,可能通过单独作用或与血小板生成素(TPO)、干细胞因子(SCF)、IL-3等细胞因子协同作用的方式,参与促进血小板增多:在骨髓细胞的分化中IL-11可与SCF、IL-3协同作用,刺激造血干细胞和原始多能祖细胞的增殖,并促进其向巨核系分化[8];IL-11可以作用于巨核系生长的各阶段,促进幼稚巨核细胞的成熟,还可诱导成熟巨核细胞释放血小板,增加血小板的生成[9]。因此,RA中IL-11水平升高可能为RA合并反应性血小板增多发生的机制之一。本研究未发现RA组血清IL-11与MPV、PDW存在相关性,提示RA中血清IL-11主要促进血小板数目的增多,可能并未直接参与血小板的活化。有关RA中血小板变化的机制复杂仍需要进行深入研究。
本研究结果显示,RA患者血清IL-11水平与DAS28、CRP、ESR等反映RA活动的指标均呈正相关。RA活动期患者滑膜组织的巨噬细胞释放TNF-α、IL-1、IL-6等炎性因子增多,加重滑膜组织的炎症改变,诱导更多的IL-11生成。同时,产生的IL-11能诱导非RANKL依赖的循环单核细胞分化成破骨细胞[10],进而产生更多的炎症因子、基质金属蛋白酶类,参与RA疾病活动。
IL-11通过与IL-11R特异性结合介导信号转导,发挥生物学功能。IL-11R有膜型IL-11R和体液中sIL-11R两种形式。sIL-11R与膜型IL-11R具有类似活性结构,也能与IL-11发生特异性结合。因此,我们假设sIL-11R与膜型IL-11R竞争性拮抗阻断IL-11的作用,在RA患者合并反应性血小板增多时sIL-11R降低,促进了IL-11与膜型IL-11R结合,进而促进血小板生成增多。但本研究结果意外的发现,RA血小板增多组血清sIL-11R水平高于血小板正常组,RA患者血清sIL-11R与PLT、PCT呈正相关,表明sIL-11R可能在RA中同样促进了血小板增多。既往关于sIL-11R对IL-11促血小板生成的调控作用的研究报道非常少。最近有研究发现IL-11与sIL-11R特异性结合形成IL-11/sIL-11R复合物,后者可能被膜型gp130捕捉,介导下游STAT信号转导,还可对某些不含膜型受体的细胞发挥作用[11~13],因此sIL-11R对IL-11的生物效应可能发挥激动作用。结合本研究结果,RA中血清sIL-11R水平与IL-11水平呈正相关,血清IL-11水平是影响血清sIL-11R的显著因素。我们推测在RA活动时IL-11水平显著升高,激活膜型IL-11R水解、释放sIL-11R水平增高,这些可溶性受体可与IL-11形成免疫复合物,激动IL-11的促进巨核细胞及血小板的生成作用,可能是RA患者血小板增多的另一机制。本研究未能检测膜型IL-11R,有关膜型IL-11R在RA中的变化及对于IL-11的调控作用,有待进一步研究。
本研究结果显示RA患者血清sIL-11R水平与DAS28、ESR、CRP均呈正相关,说明在持续RA疾病状态下,sIL-11R仍然有活化。ADAM10是sIL-11R形成过程中重要的金属蛋白酶解离素[13],随着RA疾病活动,滑膜成纤维细胞在炎症介质的刺激下表达ADAM10增多[14],促进膜型IL-11R的水解及脱落,使血清sIL-11R增高。RA疾病活动机制复杂,sIL-11R可能仅为影响因素之一,相关机制仍需深入研究。
本研究结果显示,RA患者血清sIL-11水平与RF、ACCP呈正相关,提示sIL-11R可能与RA患者自身抗体的产生有关。有学者[15]研究了ACCP阳性或阴性状态的RA患者血浆sIL-6R与DAS28的相关性,认为自身抗体的表达或缺失是决定sIL-6R与疾病活动度相关性的必要因素。sIL-11R与sIL-6R在结构、功能上最为相近,因此我们推测本研究中RF、ACCP等自身抗体是决定sIL-11R与疾病活动度呈正相关的重要因素,可能是sIL-11R水平与自身抗体相关的原因。RA中自身抗体的产生机制复杂,sIL-11与自身抗体的作用仍需做进一步研究。
总之,本研究发现RA合并血小板增多患者血清IL-11、sIL-11R水平升高,血清IL-11、sIL-11R在RA合并血小板增多中发挥促进作用。RA炎症反应中细胞因子网络作用机制复杂,IL-11/sIL-11R可能在RA免疫调节中发挥作用,加强IL-11/sIL-11R在RA发生发展中的研究,有望进一步阐明RA的免疫机制,为探索RA治疗的新靶点提供方向。
[1] Boilard E, Nigrovic P A, Larabee K, et al. Platelets amplify inflammation in arthritis via collagen-dependent microparticle production[J]. Science, 2010,327(5965):580-583.
[2] 杨秀丽,黄传兵,贾建云,等.血小板微粒的释放与类风湿关节炎的相关性研究现状[J].风湿病与关节炎,2015,4(6):61-64.
[3] Dams-Kozlowska H, Kwiatkowska-Borowczyk E, Gryska K, et al. Designer cytokine hyper interleukin 11 (H11) is a megakaryopoietic factor [J]. International journal of medical sciences, 2013,10(9):1157-1165.
[4] Putoczki T, Ernst M. More than a sidekick: the IL-6 family cytokine IL-11 links inflammation to cancer[J]. J Leuk Biol, 2010,88(6):1109-1117.
[5] McCoy EM, Hong H, Pruitt HC, et al. IL-11 produced by breast cancer cells augments osteoclastogenesis by sustaining the pool of osteoclast progenitor cells [J]. BMC Cancer, 2013,13(1):16.
[6] Kheifetz Y, Elishmereni M, Agur Z. Complex pattern of interleukin-11-induced inflammation revealed by mathematically modeling the dynamics of C-reactive protein[J]. J Pharmacok pharmacod, 2014,41(5):479-491.
[7] Cader M Z, Filer A, Hazlehurst J, et al. Performance of the 2010 ACR/EULAR criteria for rheumatoid arthritis: comparison with 1987 ACR criteria in a very early synovitis cohort[J]. An Rheum Dis, 2011,70(6):949-955.
[8] 陈淑萍,陈慧菁,叶韵斌,等.TPO,PDGF,IL-11在脐血巨核细胞生长和分化中的作用[J].福建医科大学学报,2006,40(4):330-333.
[9] Weich NS , Fitzgerald M , Wang A , et al . Recom binant human interleukin- 11 synergiz es w it h st eel factor and int erleukin-3 to promote directly the early stages of murine megakaryocy te development in vitro[ J] . Blood, 2000,95(2):503- 509.
[10] Sabokbar A, Mahoney D J, Hemingway F, et al. Non-canonical (RANKL-Independent) pathways of osteoclast differentiation and their role in musculoskeletal diseases[J]. Clin Rev Allerg Immunol, 2016,51(1):16-26.
[11] 段聚宝,王嘉玺.白细胞介素及其受体研究概况[J]. 国外医学: 分子生物学分册,1999,21(1):35-39.
[12] Dams-Kozlowska H, Gryska K, Kwiatkowska-Borowczyk E, et al. A designer hyper interleukin 11 (H11) is a biologically active cytokine[J]. BMC Biotechnol, 2012,12(1):8.
[13] Lokau J, Nitz R, Agthe M, et al. Proteolytic cleavage governs interleukin-11 trans-signaling[J]. Cell Rep, 2016,14(7):1761-1773.
[14] Isozaki T, Rabquer BJ, Ruth JH, et al. ADAM-10 is overexpressed in rheumatoid arthritis synovial tissue and mediates angiogenesis[J]. Arth Rheumatol, 2013,65(1):98-108.
[15] Rodriguez-Rodriguez L, Lamas JR, Varade J, et al. Plasma soluble IL-6 receptor concentration in rheumatoid arthritis: associations with the rs8192284 IL6R polymorphism and with disease activity[J]. Rheumatol Inter 2011,31(3):409-413.
10.3969/j.issn.1002-266X.2017.35.031
R593.22
B
1002-266X(2017)35-0093-03
2017-03-21)
中西部高校综合实力提升工程建设项目(4056051001);青海省科技创新能力促进计划项目(2015-HZ-810)
苏娟(E-mail:sujuanqh@163.com)
