硼替佐米治疗非霍奇金淋巴瘤研究进展
2017-10-10夏炳森林玉珊冯绪梅
宋 蕾,夏炳森,林玉珊,冯绪梅
(潍坊医学院临床医学院,山东 潍坊 261042)
·综述·
硼替佐米治疗非霍奇金淋巴瘤研究进展
宋 蕾,夏炳森,林玉珊,冯绪梅
(潍坊医学院临床医学院,山东 潍坊 261042)
非霍奇金淋巴瘤(NHL)是一组有不同组织学特点和起病部位的淋巴瘤,早期易发生远期扩散。通常NHL对传统的化疗方案敏感,但一部分NHL短期内易复发,复发后预后不佳。硼替佐米是第一个临床应用于治疗恶性肿瘤的蛋白酶体抑制剂,治疗多发性骨髓瘤(MM)疗效肯定。研究表明,该药同样能在NHL中发挥抗肿瘤作用。近年来,国外有多家医学机构报道硼替佐米治疗NHL,且取得一定疗效,本文就硼替佐米对NHL可能作用机制、临床应用及不良反应作一综述。
淋巴瘤,非霍奇金;抗肿瘤联合化疗方案;硼替佐米
侵袭性非霍奇金淋巴瘤(NHL)通过常规化疗后部分可治愈,部分缓解后复发,预后不良[1]。而惰性亚型NHL通过目前疗法治愈的可能性小[2]。都提示NHL迫切需要新的治疗方法。在过去十年里,蛋白酶抑制剂(PIs)硼替佐米( Bortezomib,万珂,Velcade)广泛应用于多发性骨髓瘤(MM)和套细胞淋巴瘤(MCL)的治疗,使患者受益良多。最近临床学者对硼替佐米在多种亚型NHL包括复发和难治弥漫大B细胞淋巴瘤(DLBCL)、华氏巨球蛋白血症(WM)、边缘区淋巴瘤(MZL)、滤泡性淋巴瘤(FL)及外周T细胞淋巴瘤(PTCL)的治疗应用中进行了探讨,发现硼替佐米治疗NHL可取得显著疗效。本文就硼替佐米在NHL治疗中的可能机制、临床应用和未来前景作一综述。
1 硼替佐米作用机制
1.1 泛素-蛋白酶体系统(UPS)及硼替佐米结构特点 蛋白酶体是一种多蛋白复合物,作为UPS的一部分,负责降解泛素介导的蛋白质。真核细胞利用此系统选择性破坏折叠错误或缺损的多肽,来保证细胞内合成蛋白的质量[3]。将泛素标记的不符合要求的蛋白降解,对正常细胞的循环、功能十分重要,它保护细胞免受热休克及氧化应激的损害,避免蛋白酶体通路遭受抑制而致使细胞周期阻滞和细胞凋亡。硼替佐米是一种小分子的水溶性双肽基硼酸盐类似物,是26 S蛋白酶体的可逆性抑制剂。26 S蛋白酶体由1个20 S的核心部分和2个19 S的调节部分构成,硼替佐米能直接与20 S核心部分的活性位点苏氨酸结合,干扰其糜蛋白酶/胰蛋白酶活性从而影响蛋白质降解[4]。
1.2 作用于淋巴瘤的可能机制
1.2.1 抑制核转录因子κB(NF-κB)信号通路 NF-κB是一类关键性因子,它与免疫细胞的活化,T、B淋巴细胞的发育,应激性反应,细胞凋亡等多种细胞活动有关。NF-κB在胞浆中与抑制性核因子κB(IκB)相结合,当磷酸化或泛素化的IκB降解后,NF-κB转移到核内激活它的靶基因,促进细胞的生长。而硼替佐米能明显减少IκB的降解,IκB与NF-κB结合后能有效抑制NF-κB的活性,抑制与细胞增殖相关的基因的表达,最终导致肿瘤细胞凋亡。已有研究显示PIs通过抑制NF-κB通路,选择性诱导人类瘤细胞周期停滞,从而导致细胞死亡[5]。
1.2.2 调节细胞内凋亡信号通路 细胞内凋亡信号主要包括caspase相关的凋亡信号,caspase能够切断细胞与周围细胞的联络、阻断DNA复制和修复、破坏DNA和核结构、诱导细胞吞噬和整合为凋亡小体,最终导致细胞的凋亡。c-Jun氨基末端激酶(JNK)是丝裂原活化蛋白激酶(MARK)通路家族的重要成员之一,是蛋白酶抑制细胞凋亡的信号分子,介导细胞信号的转导。研究显示硼替佐米可以激活JNK信号通路并导致肿瘤细胞凋亡[6]。
1.2.3 调控凋亡相关蛋白 硼替佐米通过抑制蛋白酶体使细胞周期调控因子积累而阻断细胞周期;并通过调节抑凋亡蛋白和促凋亡蛋白而直接诱导细胞凋亡。Bcl-2蛋白家族主要通过控制线粒体释放阻止细胞凋亡。研究发现PIs可能通过抑制Bcl-2的表达,从而解除BCL-2对细胞色素C的释放阻滞,最终启动凋亡信号通路诱导细胞凋亡。另外,PIs通过抑制p53转录活性以及p53的泛素化,导致蛋白酶体降解[7]。
1.2.4 调节细胞周期相关蛋白 大量研究表明硼替佐米通过上调周期蛋白依赖性激酶抑制因子(CKIs)的表达,选择性抑制肿瘤组织周期蛋白依赖性激酶(CDKs)的活性,从而抑制肿瘤细胞周期蛋白的表达,阻止肿瘤细胞的异常增殖[8]。除此之外,PIs可以抑制细胞外信号调节激酶信号,在PTCL中,硼替佐米通过下调microRNA187、去磷酸化细胞信号外调节激酶(ERK)、蛋白激酶B(AKT)的表达来抑制细胞增殖[9]。
1.2.5 其他 ①活性氧的产生及热休克的影响。已有研究证明硼替佐米通过利用活性氧的产生及热休克反应来诱导MCL瘤细胞的凋亡[10]。②未折叠蛋白(URP)反应的中断,内质网(ER)的应激。蛋白酶体活性的调节可能导致URP反应的中断,增加ER应激,最终导致细胞凋亡,并导致疾病[11]。③干扰肿瘤微环境的相互作用。④应激反应。PIs可以抑制肿瘤细胞对多种应激因素的反应,包括如乳酸酸中毒、染色体不稳定、DNA损伤,可以利用这种机制对NHL细胞造成致命损伤[12]。⑤抗血管生成因素的影响,硼替佐米通过NF-kB途径介导,显示出促进化学耐药性、介导细胞增殖、肿瘤转移和血管发生的作用[13]。
2 硼替佐米的临床应用
2.1 MCL MCL是少见的B细胞恶性肿瘤,占NHL的3%~10%,而硼替佐米是第一个通过美国食品和药物管理局(FDA)批准应用于MCL治疗的靶向药物[14]。目前,硼替佐米常联合化疗药用于MCL的治疗。Chang等[15]进行了两项试验,均应用硼替佐米、利妥昔单抗、环磷酰胺、长春新碱、阿霉素、地塞米松(VcR-CVAD)诱导,利妥昔单抗巩固与维持治疗。第一项试验纳入30例初治患者,硼替佐米每周2次给药,随访42个月后,患者获得了较高的客观缓解率(ORR)及完全缓解/未确定完全缓解率(CR/CRu),3年无进展生存期(PFS)及3年总生存期(OS)均获益。第二项试验纳入75例患者,硼替佐米仅在第1周给药2次,获得反应者行利妥昔单抗维持或自体干细胞移植(ASCT)治疗,中位随访4.5年后,较第一项试验获得更高的ORR,3年PFS及OS增高,且耐受性好,不良反应较少[16],得出结论VcR-CVAD治疗MCL效果显著,且为VcR-CVAD方案中硼替佐米的应用量提供了重要的参考价值。Furtado等[17]将46例复发难治的MCL患者随机分为两组,一组应用环磷酰胺、多柔比星、长春新碱、泼尼松龙(CHOP)方案,另一组应用硼替佐米、环磷酰胺、多柔比星、长春新碱、泼尼松龙(V-CHOP)方案治疗,结果显示V-CHOP方案组获得了更高的ORR及CR,且PFS及OS中位时间较CHOP组明显延长。不良反应方面,V-CHOP组中有更多的患者发生周围神经病变(BIPN),但大部分病变较轻,两组严重BIPN发生率差异无统计学意义。说明硼替佐米联合化疗方案治疗MCL效果显著且较为安全。Robk等[18]进行的LYM-3002试验,纳入488例初治MCL患者,将患者随机分配到R-CHOP方案组或VR-CAP方案组中,随访40个月后,结果显示VR-CAP组PFS明显延长,ORR、CR、OS较R-CHOP组更高。由此可见,硼替佐米治疗初治MCL较传统化疗方案效果更优,可作为一线治疗。除此之外,新的化疗联合方案不断尝试,Morrison等[19]纳入53例复发难治MCL患者,应用硼替佐米联合来那度胺(VR)方案进行治疗,结果显示这种新方案的ORR不佳,可能是由于药物毒性或剂量不足造成,有待以后的研究改进。相关研究结果见表1。

表1 硼替佐米治疗MCL的相关研究
2.2 FL FL属于NHL,是临床常见的惰性淋巴瘤。多数患者发现时已为晚期,普通治疗已经无法治愈,仅有少数早期患者经过放疗能够治愈,目前临床上较多通过硼替佐米进行治疗[20]。Evens等[21]进行了一项Ⅱ期临床试验,纳入33例初治FL患者,应用硼替佐米联合利妥昔单抗(BR)方案治疗,获得较高的ORR,PFS及OS获益。另有研究在BR方案基础上增加其他化疗药物。如Cohen等[22]进行的Ⅱ期临床试验中,纳入20例初治FL患者,行硼替佐米联合RCHOP方案,获得了较前方案更高的ORR及CR,并且PFS明显延长,而OS差异无统计学意义。BIPN发生率较前增高,但大部分病变较轻。说明硼替佐米联合RCHOP方案治疗FL较单纯应用BR方案更积极有效且较为安全,但样本小,仍需后续试验的验证支持。在复发难治FL方面,Cohen等[22]纳入48例患者,行硼替佐米联合利妥昔单抗、环磷酰胺、长春新碱、泼尼松(RCVP)方案治疗,获得较高的ORR,但CR低,PFS获益,疗效佳,为临床复治FL治疗提供重要参考价值,但OS尚未报道,需进一步研究。相关研究见表2。

表2 硼替佐米FL相关研究
2.3 WM WM是一种惰性B细胞淋巴瘤,系分泌大量单克隆IgM的浆细胞样淋巴细胞恶性增生性疾病,常累及B细胞发生的部位包括骨髓、淋巴结和脾脏。Ghobrial等[24]研究纳入37例复发难治WM患者,应用BR方案,中位肿瘤进展时间(TTP)延长,中位PFS获益。由于随访时间短,OS尚未报道。认为BR方案治疗复发难治WM患者可取得显著疗效,不良反应主要为较小的中枢毒性及胃肠道反应等。在一项多中心Ⅱ期临床试验中,Gavriatopoulou等[25]评估了硼替佐米、利妥昔单抗联合地塞米松(BDR)方案的疗效,纳入59例初治患者,其中大部分患者为晚期且有不良预后因素。获得了较高的ORR,中位随访6年后,中位PFS获益,中位缓解持续时间(DOR)明显延长,且无患者出现继发性骨髓增生不良。因此得出结论,BDR是非常稳固,疗效持续时间持久和长期毒性较低的化疗方案。相关研究见表3。
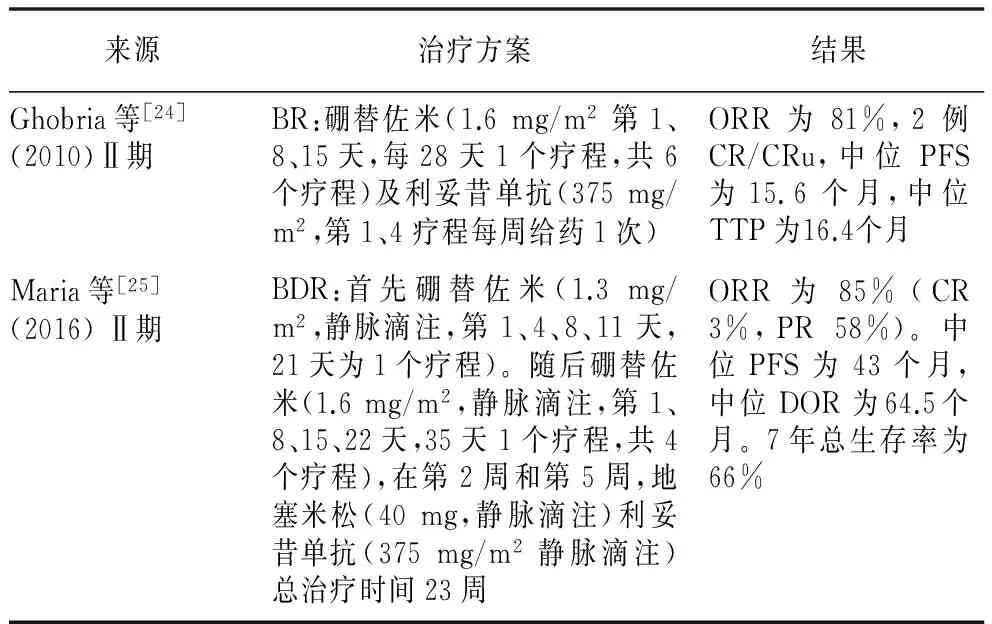
表3 硼替佐米治疗华氏巨球蛋白血症相关研究
2.4 DLBCL 在亚洲DLBCL占NHL的45%~55%,是淋巴瘤分类中最大的一个亚群。DLBCL分为生发中心(GCB)和非生发中心(non-GCB)两种亚型,其中,non-GCB型预后较GCB型差。在一项硼替佐米联合R-CHOP治疗DLBCL研究中,纳入40例DLBCL患者,硼替佐米采取递增剂量(0.7、1.0或1.3 mg/m2,第1,4天,每21天为1个疗程),ORR达100%,其中CR/CRu达86%。由意向治疗分析后,ORR为88%,75%达CR/CRu。2年无进展生存率和总生存率分别为64%和70%。认为硼替佐米联合R-CHOP治疗DLBCL是有效的[26]。最新的一项开放随机试验研究中,纳入164例non-GCB患者,对比R-CHOP方案与VR-CAP方案(由硼替佐米代替长春新碱)治疗DLBCL的疗效。结果显示VR-CAP组和R-CHOP组具有类似的毒性特征,所有等级不良事件(AE)(99% vs 100%)和3级以上AE(88% vs 89%)发生率相似。主要结局CR(64.5% vs 66.2%)及ORR(93.4% vs 98.6%)相似。说明VR-CAP方案可获得与RCHOP方案相似的治疗效果,硼替佐米联合化疗可用于传统化疗方案的替代治疗,但由于随访时间短,PFS和OS并没有报告[27],相关的治疗试验仍需进一步总结。
2.5 MZL 由于MZL的异质性和总体低发病率使大多数药物研究没有涉及到这种疾病,其中黏膜相关淋巴组织(MALT)淋巴瘤是患病最多的类型[28]。两个Ⅱ期临床试验研究了硼替佐米在MALT中的疗效[31-32]。在第一项研究中,16例患者(14例初治)接受剂量为1.5 mg/m2,第1、4、8、11天,每21天1个疗程,ORR为80%,但毒性反应很大。中位随访23个月后,4例患者复发[29]。另一项研究中,纳入32例复发难治患者,接受硼替佐米1.3 mg/m2,第1、4、8、11天,每21天1个疗程,共6个疗程,29例患者可评估,ORR达48%(CR达31%),中位随访24个月后,中位DOR尚未达到[30]。表明硼替佐米单药治疗在MALT的治疗中可取得一定疗效。
2.6 T细胞淋巴瘤 PTCL是具有不同异质性的侵袭性淋巴瘤,且预后不良,包括外周T细胞淋巴瘤非特指型(PTCL-NOS)、血管免疫母T细胞淋巴瘤(AITL)、间变大细胞淋巴瘤(AICL)等,而结外NK/T细胞淋巴瘤通常不包含在内[31]。在一项Ⅱ期临床试验中,硼替佐米联合CHOP用于46例不同组织亚型的PTCL患者。结果显示硼替佐米联合化疗方案治疗T细胞淋巴瘤ORR为76%,CR为65%,3年总生存率为47%,无进展生存率达35%。硼替佐米治疗T细胞淋巴瘤有一定疗效,但其中PTCL-NOS、AITL和AICL占获得反应的大多数,而那些结外NK/T细胞淋巴瘤,鼻型细胞淋巴瘤反应不佳[32],由于相关试验开展较少,硼替佐米治疗T细胞淋巴瘤仍需进一步探讨。
3 不良反应
BIPN是硼替佐米临床应用中最常见的不良反应,常表现为疼痛;硼替佐米治疗MM过程中,约有37%~44%的患者发生BIPN。治疗终止后通常可逆。硼替佐米的累计剂量是其最重要的毒性因素。试验发现,在BR方案中,硼替佐米每周1次用药方案的BIPN发病率比每周2次用药会要明显降低[33]。硼替佐米皮下给药也可减少BIPN的发生,一项国际性、开放性期随机对照临床试验纳入222例既往无硼替佐米治疗史的复发MM患者,分别接受硼替佐米皮下注射和静脉注射治疗,结果显示,接受硼替佐米皮下给药治疗与静脉注射治疗患者的ORR相当,但两组在BIPN发生率差异有统计学意义,皮下给药和经静脉给药治疗两组BIPN≥3级的发生率分别为6%和16%。硼替佐米皮下给药治疗的疗效与经静脉给药疗效相当,BIPN的发生率更低,更安全。基于此,2012年美国食品药品监督管理局批准皮下途径给药[34]。硼替佐米其他不良反应主要包括胃肠道毒性如腹泻、便秘,乏力,中性粒细胞减少及血小板减少[35]。
4 结论
虽然目前治疗NHL方面,美国仅批准硼替佐米应用于MCL的治疗,但对于多种亚型NHL,包括FL、WM、MZL、DLBCL及PTCL,硼替佐米均表现出明显的治疗作用。硼替佐米治疗non-GCB型DLBCL已经引起学者的关注。在WM治疗中,BDR方案已成为标准方案。硼替佐米联合利妥昔单抗治疗惰性淋巴瘤十分有效,尤其是FL。合理的药物组合是优化硼替佐米治疗NHL潜能的关键,硼替佐米将会在治疗NHL方面发挥更大的作用。
[1] Fenske TS,Shah NM,Kim KM,et al.A phase 2 study of weekly temsirolimus and bortezomib for relapsed or refractory B-cell non-Hodgkin lymphoma:a Wisconsin Oncology Network study[J].Cancer,2015,121(19):3465-3471.
[2] 宋腾,王华庆.惰性淋巴瘤非化疗药物的治疗现状及进展[J].中国临床肿瘤,2016,43(5):216-219.
[3] Kleiger G,Mayor T.Perilous journey:a tour of the ubiquitin-proteasome system[J].Trends Cell Biol,2014,24(6):352-359.
[4] Citrin R,Foster JB,Teachey DT.The role of proteasome inhibition in the treatment of malignant and non-malignant hematologic disorders[J].Expert Rev Hematol,2016,9(9):873-889.
[5] Arkwright R,Pham TM,Zonder JA,et al.The preclinical discovery and development of bortezomib for the treatment of mantle cell lymphoma[J].Expert Opin Drug Discov,2017,12(2):225-235.
[6] 高力,张曦.硼替佐米在恶性血液病治疗中的应用进展[J].中国药房,2013,24(38):3555-3557.
[7] McCormack PL.Bortezomib:a review in mantle cell lymphoma in previously untreated patientsunsuitable for stem-cell transplantation[J].Bio Drugs,2015,29(3):207-214.
[8] Cheah CY,Seymour JF,Wang ML.Mantle cell lymphoma[J].J Clin Oncol,2016,34(11):1256-1269.
[9] Yan ZX,Wu LL,Xue K,et al.MicroRNA187 overexpression is related to tumor progression and determines sensitivity to bortezomib in peripheral T-cell lymphoma[J].Leukemia,2014,28(4):880-887.
[10] Hambley B,Caimi PF,William BM.Bortezomib for the treatment of mantle cell lymphoma:an update[J].Ther Adv Hematol,2016,7(4):196-208.
[11] Otoda T,Takamura T,Misu H,et al.Proteasome dysfunction mediates obesity-induced endoplasmic reticulum stressand insulin resistance in the liver[J].Diabetes,2013,62(3):811-824.
[12] Mahadevan D,Fisher RI.Novel therapeutics for aggressive non-Hodgkin's lymphoma[J].J Clin Oncol,2011,29(14):1876-1884.
[13] Koprivnikar JL,Cheson BD.Bortezomib:a proteasome inhibitor with an evolving role in select subtypes of B-cell non-Hodgkin's lymphoma[J].Future Oncol,2012,8(4):359-371.
[14] 聂蔓,李志铭,魏小娟.基于硼替佐米的治疗方案在老年套细胞淋巴瘤中应用[J].循证医学,2016,16(2):84-85,92.
[15] Chang JE,Peterson C,Choi S,et al.VcR-CVAD induction chemotherapy followed by maintenance rituximab in mantlecell lymphoma:a Wisconsin Oncology Network study[J].Br J Haematol,2011,155(2):190-197.
[16] Chang JE,Li H,Smith MR,et al.Phase 2 study of VcR-CVAD with maintenance rituximab for untreated mantle celllymphoma:an Eastern Cooperative Oncology Group study (E1405)[J].Blood,2014,123(11):1665-1673.
[17] Furtado M,Johnson R,Kruger A,et al.Addition of bortezomib to standard dose chop chemotherapy improves responseand survival in relapsed mantle cell lymphoma[J].Br J Haematol,2015,168(1):55-62.
[18] Robak T,Huang H,Jin J,et al.Bortezomib-based therapy for newly diagnosed mantle-cell lymphoma[J].N Engl J Med,2015,372(10):944-953.
[19] Morrison VA,Jung SH,Johnson J,et al.Therapy with bortezomib plus lenalidomide for relapsed/refractory mantle celllymphoma:final results of a phase II trial (CALGB 50501)[J].Leuk Lymphoma,2015,56(4):958-964.
[20] 李颖璐.硼替佐米治疗滤泡性淋巴瘤疗效及不良反应的分析[J].中国实验血液学杂志,2015,23(1):119-122.
[21] Evens AM,Smith MR,Lossos IS,et al.Frontline bortezomib and rituximab for the treatment of newly diagnosed hightumour burden indolent non-Hodgkin lymphoma:a multicentre phase II study[J].Br J Haematol,2014,166(4):514-520.
[22] Cohen JB,Switchenko JM,Koff JL,et al.A phase II study of bortezomib added to rituximab,cyclophosphamide,doxorubicin,vincristine,and prednisone in patients with previously untreated indolent non-Hodgkin's lymphoma[J].Br J Haematol,2015,171(4):539-546.[23] Craig M,Hanna WT,Cabanillas F,et al.Phase II study of bortezomib in combination with rituximab,cyclophosphamide andprednisone with or without doxorubicin followed by rituximab maintenance inpatients with relapsed or refractory follicular lymphoma[J].Br J Haematol,2014,166(6):920-928.
[24] Ghobrial IM,Hong F,Padmanabhan S,et al.Phase II trial of weekly bortezomib in combination with rituximab in relapsed orrelapsed and refractory Waldenstrom macroglobulinemia[J].J Clin Oncol,2010,28(8):1422-1428.
[25] Gavriatopoulou M,García-Sanz R,Kastritis E,et al.BDR in newly diagnosed patients with WM:final analysis of a phase 2 study after aminimum follow-up of 6 years[J].Blood,2017,129(4):456-459.
[26] Ruan J,Martin P,Furman RR,et al.Bortezomib plus CHOP-rituximab for previously untreated diffuse large B-celllymphoma and mantle cell lymphoma[J].J Clin Oncol,2011,29(6):690-697.
[27] Offner F,Samoilova O,Osmanov E,et al.Frontline rituximab,cyclophosphamide,doxorubicin,and prednisone withbortezomib (VR-CAP) or vincristine (R-CHOP) for non-GCB DLBCL[J].Blood,2015,24(6):74-81.
[28] Zinzani PL,Broccoli A.Possible novel agents in marginal zone lymphoma[J].Best Pract Res Clin Haematol,2017,30(1-2):149-157.
[29] Troch M,Jonak C,Müllauer L,et al.A phase Ⅱ study of bortezomib in patients with MALT lymphoma[J].Haematologica,2009,94(5):738-742.
[30] Conconi A,Martinelli G,Lopez-Guillermo A,et al.Clinical activity of bortezomib in relapsed/refractory MALT lymphomas:results of aphase II study of the International Extranodal Lymphoma Study Group (IELSG)[J].Ann Oncol,2011,22(3):689-695.
[31] Armitage JO.The aggressive peripheral T-cell lymphomas:2017[J].Am J Hematol,2017,92(7):706-715.
[32] Kim SJ,Yoon DH,Kang HJ,et al.Bortezomib in combination with CHOP as first-line treatment for patients with stageIII/IV peripheral T-cell lymphomas:a multicentre,single-arm,phase 2 trial[J].Eur J Cancer,2012,48(17):3223-3231.
[33] 顾姗姗,孙琪,杨威,等.皮下注射硼替佐米治疗多发性骨髓瘤研究进展[J].现代肿瘤医学,2016,24(3):505-508.
[34] 秦慧,汪延生,丁士华,等.皮下注射硼替佐米治疗多发性骨髓瘤的疗效及安全性分析[J].四川大学学报:医学版,2014,45(3):529-532.
[35] 刘斯佳,杜新,蔡云,等.硼替佐米为主治疗多发性骨髓瘤的疗效与安全性临床观察[J].临床血液学杂志,2016,29(7):563-567.
R733.4
A
1004-583X(2017)10-0912-05
2017-03-23 编辑:王秋红
夏炳森,Email:2270458081@qq.com
10.3969/j.issn.1004-583X.2017.10.022
