枣幼胚体细胞胚的发生及植株再生
2017-09-25任海燕杜学梅李登科王永康薛晓芳赵爱玲隋串玲弓桂花山西省农业科学院果树研究所果树种质创制与利用山西省重点实验室山西太谷030815
任海燕,杜学梅,李登科,王永康,薛晓芳,赵爱玲,隋串玲,弓桂花(山西省农业科学院 果树研究所,果树种质创制与利用山西省重点实验室,山西太谷 030815)
枣幼胚体细胞胚的发生及植株再生
任海燕,杜学梅,李登科,王永康,薛晓芳,赵爱玲,隋串玲,弓桂花
(山西省农业科学院 果树研究所,果树种质创制与利用山西省重点实验室,山西太谷 030815)
以小梨枣胚龄30~40 d的幼胚为外植体,研究不同质量浓度6-苄基腺嘌呤(6-BA)、噻苯隆(TDZ)、吲哚丁酸(IBA)、萘乙酸(NAA)、脱落酸(ABA)及其组合对幼胚胚乳看护培养效果、体细胞胚发生、成熟及萌发的影响。结果表明,适宜小梨枣幼胚(30~40 d)胚乳看护培养的培养基为MS+IBA0.2 mg·L-1+BA0.5 mg·L-1+ NAA 0.1 mg·L-1,成胚率达62.07%;诱导胚性愈伤组织较适宜的培养基为MS+TDZ 0.6 mg·L-1+IBA1.5 mg·L-1+NAA 0.1 mg·L-1,诱导率为53.32%;在MS+6-BA 0.3 mg·L-1+NAA 0.02 mg·L-1组合下有利于体细胞胚的发生,发生率可达71.43%;ABA可促进体胚的正常发育,质量浓度为0.5 mg·L-1时,体细胞胚结构完整,体胚成熟率为21.83%;将成熟的体胚转接到含有IBA 0.03 mg·L-1+GA30.03 mg·L-1的培养基中,体细胞胚萌发形成完整植株。
枣; 幼胚; 体细胞胚的发生; 植株再生
植物体细胞胚胎发生现象普遍存在,是离体培养形态发生的有效途径[1]。长期以来,植物体胚发生技术已成为快速繁殖和制作人工种子的重要手段。另外,体细胞再生植株的最初来源是单个胚性细胞,能够克服遗传嵌合及后代分离问题,对于进行基因工程或细胞工程育种有着重要意义。以枣胚为外植体经体细胞胚发生获得植株的研究国内外有一些报道[2],陈维伦等[3]对酸枣胚进行无性胚状体发生并获得植株;李登科等[4]对‘六月鲜’枣幼胚进行离体培养,成功获得了胚状体及再生苗;郝建平等[5]对‘晋矮1号’等枣合子胚和体细胞胚发育过程进行观察与比较。张存智[6]以胚龄50~60 d‘陇东马牙枣’为试材成功诱导出胚状体及再生苗植株。据已有报道,幼胚较适宜作为体胚发生的外植体,但目前关于枣幼胚体胚发生条件和幼胚的发育形成过程缺乏系统性研究。本试验以‘小梨枣’胚龄30~40 d幼胚为外植体,研究不同激素组合对胚性细胞诱导、体胚形成和发育过程的影响,试图阐明其体胚发生所需的激素配比条件和幼胚的发生发育规律,为拯救早期败育幼胚、创建新种质资源及体胚途径的遗传转化奠定基础。
1 材料与方法
1.1 试验材料
供试材料‘小梨枣’为可育率较高的枣品种,采自山西省农业科学院果树研究所国家枣资源圃,试验于2013-2015年进行,‘小梨枣’盛花期为6月上旬,在盛花期选取黄蕾期开放的枣花挂牌标记为定花,由定花所结得果为定果,根据定花和定果确定胚龄。以王群瑛[7]枣胚发育过程的观察为依据,并结合石蜡切片观察,确定胚龄30~40 d胚胎发育阶段为球形胚后期。采集30~40 d 的幼果。
幼果于洁净水中泡洗后流水冲洗1~1.5 h,在超净工作台上置于无菌三角瓶或烧杯中,用体积分数为75%酒精浸泡20~30 s,无菌水洗1~2次,再用质量分数为0.1%HgCl2振荡2.5~3 min,无菌水洗4~5次,然后用手术刀将枣果剖开,取出胚珠,剥去外表皮后以合点端插入培养基的竖放方式接种在培养基中。培养温度为24 ℃±2 ℃,光照时间14 h·d-1,光照度3 000 lx。
1.2 试验方法
1.2.1 胚乳看护条件的优化 将去除表皮的胚珠接种在MS培养基中,不同质量浓度的激素配比采用L9(34)正交设计(表1),添加0.5 g·L-1水解乳蛋白(Hydrolyzed milk protein,LH), 质量分数为7%蔗糖,5.5 g·L-1琼脂,pH 5.8。研究不同激素组合对合子胚培养效果的影响。30 d后调查成胚率,以形成可见胚或沿胚性生长的百分率为成胚率。
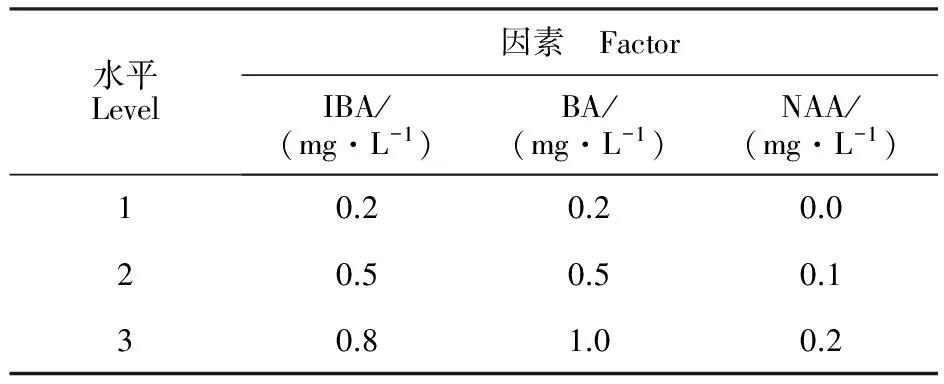
表1 正交设计因素水平Table 1 Factors and levels of hormone composition in orthogonal design for immature embryo culture of jujube varieties
1.2.2 幼胚愈伤组织的诱导 将经胚乳看护培养形成的幼胚从胚珠中取出,接种在愈伤组织诱导的MS培养基上,添加不同质量浓度的TDZ、IBA、NAA激素组合(表2), 质量分数4%蔗糖,5.5 g·L-1琼脂,pH 5.8。研究不同激素组合诱导愈伤组织的效果。黑暗条件培养6~7 d后转到正常培养条件进行培养,40 d后观察愈伤组织生长情况,统计其诱导率。以产生愈伤组织胚数占接种幼胚个数的百分数为诱导率(%)。
1.2.3 体细胞胚的发生 将诱导出的胚性愈伤组织转入诱导体细胞胚发生的培养基上进行培养,MS培养基中添加不同质量浓度的6-BA、IBA、NAA激素组合,质量分数为3%蔗糖, 0.5 g·L-1LH, 5.5 g·L-1琼脂,pH 5.8。培养20 d 后观察胚性愈伤组织的生长情况并统计体细胞发生率(%),即体细胞胚数量占接种的胚性愈伤组织数的百分率。
1.2.4 体细胞胚的成熟与萌发 将形成的体细胞胚置于MS培养基中,添加质量浓度为0.0~1.0 mg·L-1ABA, 0.5 g·L-1LH,质量分数为3%蔗糖, 5.5 g·L-1琼脂。培养20 d后观察体细胞胚成熟的形成过程并统计体细胞胚成熟率,即成熟体细胞胚数占接种体细胞胚总数的百分率。
将成熟的体细胞胚胎接种在含质量浓度0.3 mg·L-1GA3+0.3 mg·L-1IBA的MS培养基上进行培养,观察体细胞胚萌发过程。
1.2.5 统计分析 所有数据采用SAS 9.0软件进行统计分析和差异比较,用Excel 2003处理数据。
2 结果与分析
2.1 胚乳看护培养条件的优化
由表2可知,在处理2的激素条件下,幼胚成胚率为62.07%,极显著高于其他处理。在IBA0.5 mg·L-1+BA1.0 mg·L-1+NAA0.1 mg·L-1(处理6)条件下,成胚率仅次于处理2,为56.27%,但有少数胚珠愈伤化。在IBA0.8 mg·L-1+BA0.5 mg·L-1+NAA0.2 mg·L-1(处理8)条件下,胚珠内幼胚生长缓慢或枯萎,幼胚成胚率最低为34.37%。当添加IBA0.8 mg·L-1+BA1.0 mg·L-1(处理9)时,成胚率为46.36%,其中少数胚珠基部膨大,幼胚畸形发育呈细长条状。表明,较适宜‘小梨枣’幼胚生长的激素配比为IBA0.2 mg·L-1+BA0.5 mg·L-1+NAA 0.1 mg·L-1,成胚率达62.07%。
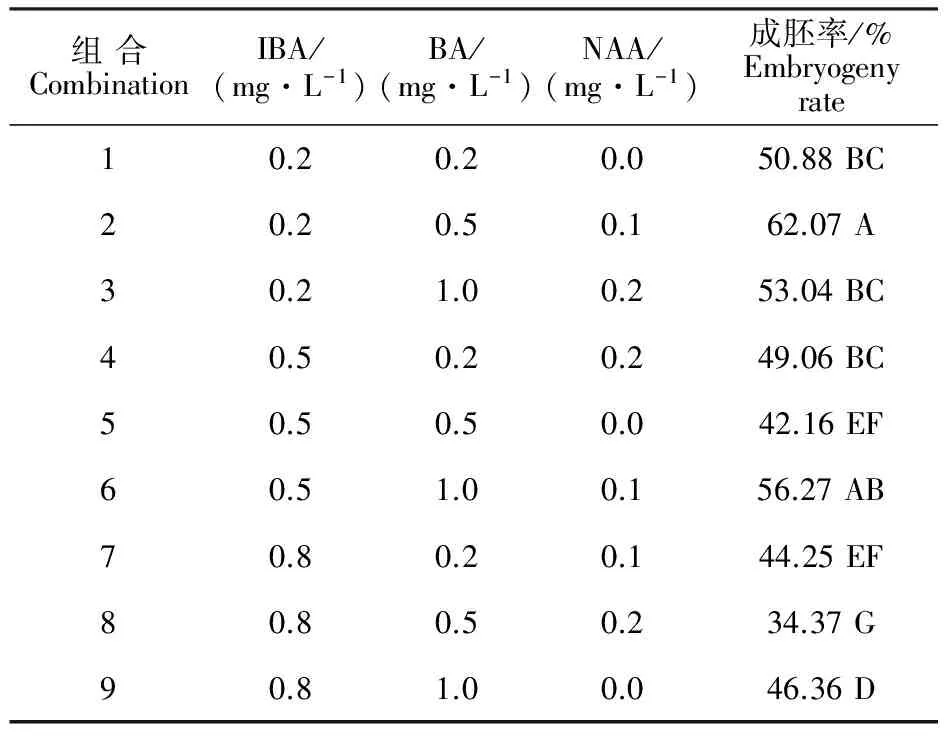
表2 不同激素配比对‘小梨枣’幼胚成胚率的影响Table 2 Effects of different hormone combinations on embryo rate of Chinese jujube
注:Duncan’s新复极差检验,不同字母表示差异极显著(P<0.01)。下同。
Note:Data was analyzed by Duncan’s multiple new range test,the different letter indicate significant difference at 0.01 level.The same below.
2.2 激素组合对胚性愈伤组织诱导的影响
经胚乳看护培养后,将幼胚完整剥离,接种在诱导愈伤组织培养基上。培养40 d后,愈伤组织逐渐产生并生长。观察发现,添加0.4 mg·L-1TDZ的处理中,愈伤组织增殖变大,质地较紧密,瘤状,呈黄绿色,利于器官发生途径分化不定芽,但未形成胚性愈伤组织。其余处理均不同程度地诱导产生胚性愈伤组织。由表3可以看出,TDZ0.6 mg·L-1+IBA1.5 mg·L-1+NAA0.1 mg·L-1的激素组合,利于诱导形成淡黄色、颗粒状、易分离的胚性愈伤组织(图1-A),诱导率为53.32%。
2.3 激素组合对幼胚体细胞胚发生的影响
将胚性愈伤组织转接至含有不同质量浓度的6-BA、IBA、NAA的培养基上诱导体细胞胚发生。经过20 d培养,愈伤组织上陆续形成肉眼可见的不同发育时期的体细胞胚(图1-B)。附加不同激素组合对‘小梨枣’幼胚体细胞的发生有重要的影响(表4),体胚发生率因激素配比的不同而存在明显差异,其中生长情况也表现明显差异(图1- F~I)。结果表明,在6-BA0.3 mg·L-1与NAA 0.02 mg·L-1组合处理下,体胚发生率可达71.43%,并且在诱导体细胞胚发生的同时,胚性愈伤组织也在不断地增殖。
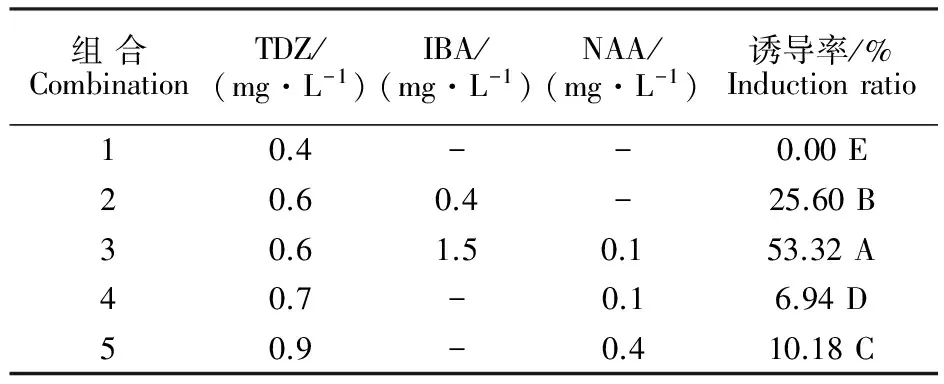
表3 不同激素组合对‘小梨枣’幼胚胚性愈伤组织诱导的影响Table 3 Effects of different hormone combinations on embryogenic callus induction in Chinese jujube

A.胚性愈伤组织诱导 Embryonic callus;B.体细胞胚的发生 Somatic embryogenesis;C.体细胞胚的成熟 Somatic embryo maturation;D,E.体细胞胚的萌发 Somatic embryo germination;F.有体细胞胚产生,部分畸形发育 Somatic embryos with partial abnormal tissue;G.形成白色石细胞,不利于后期萌发 The formation of white stone cells which are harmful to germination;H.胚性愈伤组织发育缓慢,无体细胞胚产生 Embryogenic callus development without somatic embryos; I.有体细胞胚发生,其中少数畸形发育 Some embryo produced and a few of them were abnormal
图1‘小梨枣’幼胚体细胞胚的发生
Fig.1ThesomaticembryogenesisofZiziphusjujuba‘Xiaolizao’
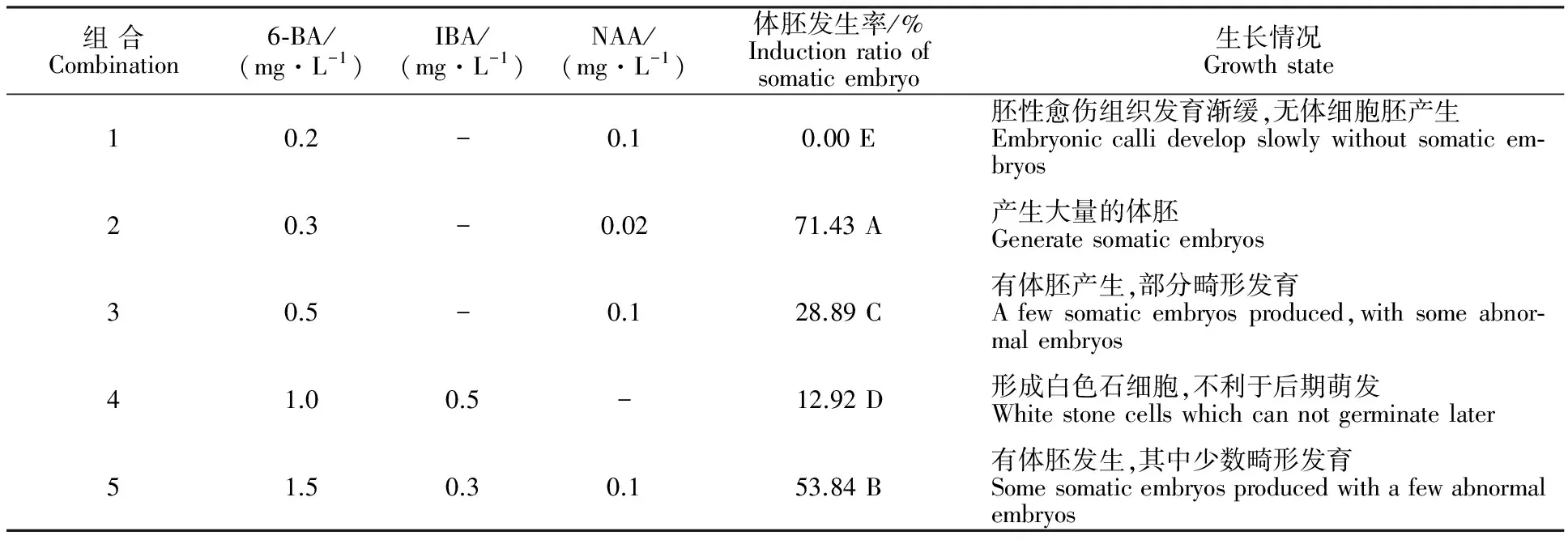
表4 不同激素组合对‘小梨枣’幼胚体细胞发生的影响Table 4 Effects of different hormone combinations on somatic embryogenesis in Chinese jujube
2.4 体细胞胚的成熟与萌发
对增殖培养好的胚性愈伤组织,置于含有不同质量浓度的ABA的成熟分化培养基中。在分化与成熟培养的过程中,体胚外观表现为白色,发育程度不一,有呈球形或呈长圆柱形,易于分离。20 d后形成白色棒状结构,逐渐转发育形成胚芽、胚轴与胚根的完整胚状体结构(图1-C),即为成熟体细胞胚。由表5可以看出,在ABA质量浓度不同的成熟培养基上,胚性愈伤组织转化为成熟体细胞胚的能力不同。随着质量浓度的升高,体胚的诱导率呈先升高后降低的趋势,当质量浓度为0.5 mg·L-1时,体细胞胚结构完整,质量较好,体细胞胚成熟率为21.83%。ABA质量浓度为1.0 mg·L-1时易形成畸形胚,且体胚数量降低。
将体胚接种在萌发培养基上,10 d后观察发现,子叶不断发育和伸长变绿,顶端胚芽开始生长,胚根伸长,体胚萌发形成完整植株(图1-D,E)。
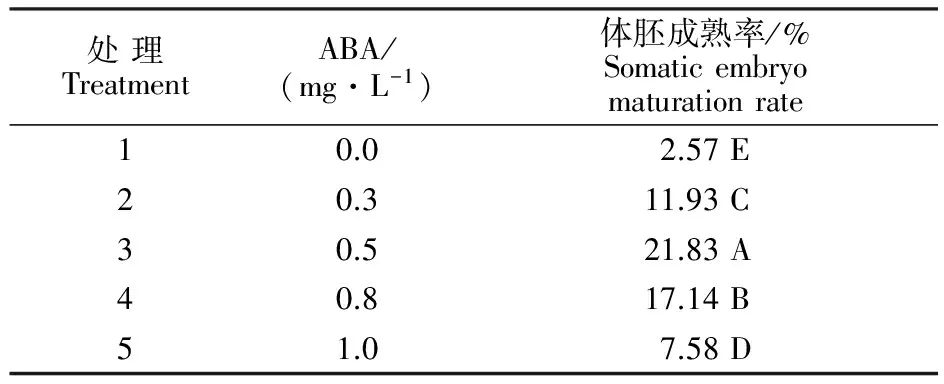
表5 不同质量浓度ABA处理获得‘小梨枣’成熟体胚的情况Table 5 Maturation rate of somatic embryos of Chinese jujube under different mass concentration of ABA
3 讨 论
体细胞胚的发生与外植体的来源和发育状态密切相关。Vikrant[8]认为未成熟合子胚因其细胞全能性高、脱分化容易,在诱导体细胞胚发生时具有显著优势。Ruan等[9]也认为分化程度较低的组织,如未成熟胚,更利于体细胞胚的诱导发生。但耿菲菲等[10]认为在幼胚的发育过程中,只有一个较短的阶段具有很强的体胚发生潜能。本研究将‘小梨枣’胚龄30~40 d幼胚经胚乳看护培养后,再进行胚性愈伤组织的诱导、体胚的发生、成熟和萌发,最终获得完整植株,从而建立枣幼胚体细胞胚发生及植株再生体系。这为今后进行枣快速繁育、遗传改良及基因转化有着重要意义。另外,利用枣幼小胚获得体细胞胚再生植株,为结合枣胚早期败育严重的问题,进行优良品种幼小胚的拯救奠定了基础。
植物体细胞胚发生是一个极其复杂的过程,植物激素是影响体细胞胚发生的重要因素。ABA是调节胚胎晚期的发育的关键因素,能促进体细胞胚的成熟和抑制畸形胚的发生,防止裂生多胚的产生,ABA在针叶树种、龙眼、胡萝卜、玉米、枸杞等植物体胚发生过程中的作用已有较多研究[11]。李玲等[12]认为体细胞胚发育需要一个生理上成熟的培养阶段才能正常萌发,添加ABA1.0 mg·L-1在橡胶次生体细胞胚成熟过程中起到促进作用。齐力旺等[13]添加16 mg·L-1ABA时,有利于华北落叶松体细胞胚的产生。Stasolla等[14]的研究表明,ABA与渗透调节剂PEG配合使用,可促进针叶树胚状体的分化与成熟。ABA的这一作用主要在于其能抑制细胞的不正常的扩大,从而使体胚能正常的发育和成熟[15-16]。但也有学者[17-19]得出不同的结论,认为ABA能够抑制体胚的发生。关于ABA在枣体胚发生过程中作用的研究还未见详细报道。本试验中添加0.5 mg·L-1时,体细胞胚结构完整,并产生较多的次生胚,促进了体胚的成熟。在体细胞发育过程的不同阶段,对ABA反应不同[20],今后还需进一步研究在体胚不同时期ABA作用的最佳质量浓度,深入探讨其在枣体胚发生过程中的作用机制,进而为提高枣育种效率提供理论依据。
Reference:
[1] 鲁旭东,萧浪涛,刘华英.脱落酸与植物体细胞胚胎发生关系的研究进展[J].生物技术通报,2003(5):19-26.
LU X D,XIAO L T,LIU H Y. Progress on relationship between abscisic acid and somatic embryogenesis[J].BiotechnologyBulletin,2003(5):19-26(in Chinese with English abstract).
[2] 赵 宁,冯建灿,叶 霞,等.枣组织培养及相关生物技术研究进展[J].果树学报,2015,32(6):1241-1252.
ZHAO N,FENG J C,YE X,etal. A review of tissue culyure and biotechnology in Chinese jujube [J].JournalofFruitScience,2015,32(6):1241-1252(in Chinese with English abstract).
[3] 陈维伦,郭东红.酸枣组织培养中胚状体的形成[J].植物生理学报,1981,7(1):83-84.
CHEN W L,GUO D H. Embryoid formation ofZizipusjujubavar.spinosueHu in tissue culture [J].JournalPlantPhysiology,1981,7(1):83-84(in Chinese with English abstract).
[4] 李登科,杜学梅,王永康,等.六月鲜枣愈伤组织诱导及胚状体发生[J].果树学报,2004,21(5):414-418.
LI D K,DU X M,WANG Y K,etal.Callus induction and embryogenesis ofZiziphusjujubecv.Liuyuexian[J].JournalofFruitScience,2004,21(5):414-418(in Chinese with English abstract).
[5] 郝建平,金竹萍,王永康,等.枣合子胚和体细胞胚发育过程的观察与比较[J].分子细胞生物学报,2006,39(5):423-430.
HAO J P,JIN ZH P,WANG Y K,etal. Study on embryo development and somatic embryogenesis of Jujube[J].JournalofMolecularCellBiology,2006,39(5):423-430(in Chinese with English abstract) .
[6] 张存智.枣幼胚愈伤组织诱导和胚状体发生[J].北方园艺,2011(13):125-127.
ZHANG C ZH. Callus induction and embryogenesis ofZiziphusjujuba[J].NortherHorticulture,2011(13):125-127(in Chinese with English abstract) .
[7] 王群瑛.枣胚与胚乳的发育[M].植物学报,1983,25(6):526-531.
WANG Q Y.Study on development of embryo and endosperm in Chinese Jujube[J].ChineseBulletinofBotany,1983,25(6):526-531(in Chinese with English abstract).
[8] VIKRANT R A.Somatic embryogenesis from immature and mature embryos of a minor milletPaspalumscrobiculatumtL[J].PlantCell,TissueandOrganCulture,2002,69(1):71-77.
[9] RUAN J Y,GEREND S J,HARDTER R,etal. Effect of nitrogen form and rootzone pH on growth and nitrogen uptake of tea(Ca-mellia sinensis) plants[J].AnnalsofBotany,2007,99(2):301-310.
[10] 耿菲菲,肖丰坤,吴 涛,等.思茅松成熟胚的胚性愈伤组织诱导与增殖[J].东北林业大学学报,2015,43(5):59-63.
GENG F F,XIAO F K,WU T,etal. Induction and proliferation of embryonic calluses from mature zygotic embryos ofPinuskesiyavar.langbianensis[J].JournalofNortheastForestryUniversity,2015,43(5):59-63(in Chinese with English abstract).
[11] 孙 丹,李宏博,李 千,等.北五味子体细胞胚发生过程中内源IAA、ABA和GA3含量的动态变化[J].植物生理学报,2013,49(1):70-74.
SUN D,LI H B,LI Q,etal. Dynamic variation of endogenous hormone during somatic embryo development ofSchisandraincarnata[J].PlantPhysiologyJournal,2013,49(1):70-74(in Chinese with English abstract).
[12] 李 玲,桂明春,管 艳,等.激素对橡胶树次生体细胞胚成熟培养的影响[J].中国农学通报,2015,31(31):30-35.
LI L,GUI M CH,GUAN Y,etal. Effects of plant hormones on maturation of secondary somatic embryos ofHeveabrasilliensis[J].ChineseAgriculturalScienceBulletin,2015,31(31):30-35(in Chinese with English abstract).
[13] 齐力旺,韩一凡,韩素英,等.麦芽糖、NAA及ABA对华北落叶松体细胞胚成熟及生根的影响[J].林业科学,2004,40(1):52-57.
QI L W,HAN Y F,HAN S Y,etal. Effects of Maltose,NAA and ABA on somatic maturation and radicle rooting ofLarixprincipis-rupprechtii[J].ScientiaSilvaeSinicae,2004,40(1):52-57(in Chinese with English abstract).
[14] STASOLLA C,KONG L,YEUNG E C,etal. Maturation of somatic embryos in conifers:morphogenesis,physiology,biochemistry and molecular biology[J].InVitroCellDev-PL,2002,38(2):93-105.
[15] STASOLLA C,YEUNG E C. Recent advances in conifer somatic embryogenesis:Improving somatic embryo quality[J].PlantCell,TissueandOrganCulture,2003,74(1):15-35.
[16] 项伟波,赵金凯,吴家胜,等.香榧体细胞胚发生、发育的形态与细胞学观察[J].园艺学报,2015,42(8):1477-1486.
XIANG W B,ZHAO J K,WU J SH,etal. Morphological and cytological observation of somatic embryogenesis and development in Torreya grandis‘Merrillii’ [J].ActaHorticulturaeSinica,2015,42(8):1477-1486(in Chinese with English abstract).
[17] 魏岳荣,杨 护,黄秉智,等. Picloram,ABA和TDZ对香蕉体细胞胚胎发生的影响[J].园艺学报,2007,34(1):81-86.
WEI Y R,YANG H,HUANG B ZH,etal.Effects of Picloram,ABA and TDZ on somatic embryogenesis of banana[J].ActaHorticulturaceSinica,2007,34(1):81-86(in Chinese with English abstract).
[18] ROHANI E R,ISMANIZAN I,NOOR N M.Somatic embryogenesis of Mangosteen[J].PlantCell,TissueandCulture,2012,110:251-259.
[19] 于 波,刘金梅,刘晓荣,等.白鹤芋胚性细胞悬浮培养和高效植株再生体系的建立[J].园艺学报,2015,42(4):721-730 .
YU B,LIU J M,LIU X R,etal. An efficient system of embryogenic cell suspension cultures and plant regeneration inSpathiphyllumcannifolium[J].ActaHorticulturaeScienca,2015,42(4):721-730(in Chinese with English abstract).
[20] 高述民,李凤兰.ABA对植物体细胞胚胎发育影响的研究进展[J].北京林业大学学报,2002,7(4):122-128.
GAO SH M,LI F L. Advances in researches on effeches on effects of ABA on somatic embryogenesis[J].JournalofBeijingForestryUniversity,2002,7(4):122-128(in Chinese with English abstract).
IndirectSomaticEmbryogenesisandPlantRegenerationfromYoungEmbryosofZiziphusjujubaMill.
REN Haiyan,DU Xuemei,LI Dengke,WANG Yongkang,XUE Xiaofang,ZHAO Ailing,SUI Chuanling and GONG Guihua
(Shanxi Key Laboratory of Genetic Improvement and Use of Pomology,Research Institute of Pomology,Shanxi Academy of Agricultural Science,Taigu Shanxi 030815,China)
The 30-40 d-aged young embryos at globular stage ofZiziphusjujuba‘Xiaolizao’ were used as explants and cultured in MS basic medium with different kinds of plant hormones. The effects of different combinations of plant hormones,including 6-BA,TDZ,IBA,NAA and ABA,on endosperm nursing culture,somatic embryogenesis,somatic maturation and somatic germination were studied in vitro culture. The results showed that the suitable hormone combination for endosperm nursing culture of ‘Xiaolizao’ immature embryos(30-40 d) was IBA0.2 mg·L-1+BA0.5 mg·L-1+ NAA 0.1 mg·L-1,with the embryo formation rate of 62.07%; the most suitable medium to induce embryogenic callus was TDZ0.6 mg·L-1+IBA1.5 mg·L-1+NAA0.1 mg·L-1with the induction rate of 53.32%; the hormone combination of somatic embryogenesis was 6-BA0.3 mg·L-1+NAA0.02 mg·L-1with the somatic embryogenesis rate of 71.43%; ABA can promote the normal development of somatic embryos,and when the mass concentration is 0.5 mg·L-1,and the somatic embryo maturation rate is 21.83% with the complete somatic embryo structure; the mature somatic embryos were transferred to the culture medium contraining IBA 0.03 mg·L-1+GA30.03 mg·L-1to germinate and the complete plants were obtained.
Chinese jujube; Young embryo; Somatic embryogenesis; Plant regeneration
2016-06-03
2016-08-25
The National Science-technology Support Plan Projects(No.2013BAD14B030103);Shanxi Youth Science and Technology Research Fund(No.2015021163);Shanxi Science and Technology Innovation Team(No.2013131017).
REN Haiyan,female,assistant research fellow.Research area:germplasm resources and breeding of Chinese jujube.E-mail:haiyan_101012@163.com
S665.1
A
1004-1389(2017)09-1349-06
(责任编辑:潘学燕Responsibleeditor:PANXueyan)
日期:2017-09-12
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170912.1740.024.html
2016-06-03
2016-08-25
国家科技支撑计划(2013BAD14B030103);山西省青年科技研究基金(2015021163);山西省科技创新重点团队项目(2013131017)。
任海燕,女,助理研究员,研究方向为枣种质资源与育种。E-mail:haiyan_101012@163.com
杜学梅,女,副研究员,从事枣种质资源与育种研究。E-mail:sxgsbjbdu@163.com
CorrespondingauthorDU Xuemei,female,associate research fellow.Research area:germplasm resources and breeding of Chinese jujube.E-mail:sxgsbjbdu@163.com
