母-胎免疫调节机制在妊娠高血压综合征病理过程中的作用
2017-09-21李丽娜徐振宇孔丽娜
李丽娜 徐振宇 孔丽娜
(皖南医学院弋矶山医院妇产科,芜湖241001)
母-胎免疫调节机制在妊娠高血压综合征病理过程中的作用
李丽娜 徐振宇①孔丽娜
(皖南医学院弋矶山医院妇产科,芜湖241001)
目的:分析妊娠高血压综合征(PIH)患者外周血中免疫细胞因子水平变化及滋养层细胞中免疫相关转录因子的基因、蛋白表达情况,探讨母-胎免疫调节机制在妊娠高血压综合征病理过程中的作用。方法:纳入PIH患者50例作为观察组,选择同期分娩的正常妊娠妇女40例作为对照组。ELISA法检测两组孕妇外周血中IFN-γ、IL-4、IL-17及TGF-β水平;实时荧光定量PCR(RT-qPCR)法和蛋白质印迹法(Western blot)分别测定两组孕妇胎盘滋养层细胞中转录因子T-bet、GATA-3、RORC、Foxp3的mRNA及蛋白表达情况。结果:①观察组外周血中IFN-γ和IL-17水平明显高于对照组,TGF-β水平明显低于对照组(P<0.05);两组间IL-4水平无明显差异(P>0.05);观察组IFN-γ/IL-4、IL-17/TGF-β比值均明显大于对照组(P<0.05)。②与对照组比,观察组T-bet、RORC的mRNA及蛋白表达水平均显著升高(P<0.05),而GATA-3、Foxp3的mRNA及蛋白表达水平均显著降低(P<0.05),T-bet/GATA-3及RORC/Foxp3比值均显著增大(P<0.05)。结论:PIH具有明显的Th1/Th2及Th17/Treg比例失衡现象,其病理机制可能与Th细胞介导的母-胎免疫耐受机制功能紊乱有关。
妊娠高血压综合征;母-胎免疫耐受;滋养层细胞;细胞因子;转录因子
妊娠高血压综合征(Pregnancy-induced hypertension,PIH)简称妊高征,是目前产科常见的并发症之一,也是妊娠期特有的疾病,包括妊娠期高血压、子痫前期、子痫、慢性高血压并发子痫前期以及慢性高血压合并妊娠[1]。PIH在健康产妇中的发生率为6%,在有妊高征病史的孕妇中甚至高达18%,严重危及母婴健康[2]。因此,明确PIH发病机制并及早防治对保障孕产妇及胎儿生命安全具有重要意义。但目前关于PIH的具体发病机制尚未完全明确,现有研究资料表明,PIH的发病与免疫因素有关,因母-胎免疫调节功能紊乱造成的妊娠失败仍是目前难以克服的问题[3]。本研究通过分析PIH患者的免疫细胞因子及其转录因子的表达情况,探讨其相关的母胎免疫调节机制在PIH病理过程中的作用。
1 材料与方法
1.1材料
1.1.1研究对象 选择2015年1~12月于本院妇产科就诊的PIH患者50例,作为对照组,年龄23~35岁,平均(29.8±3.9)岁;妊娠28~40周;其中PIH轻度16例、中度23例、重度11例。PIH的诊断及严重程度分级标准参照2013年人民卫生出版社出版的《妇产科学(第8版)》中推荐的标准[1]。排除妊娠前有心脏病、高血压、肾病、糖尿病及抗磷脂综合征等病史的患者。选择同期在本院就诊的正常健康妊娠妇女40例作为对照组,年龄24~37岁;平均(29.5±4.0)岁;妊娠28~40周。两组均为初产妇,年龄、孕周差异无统计学意义,具有可比性(P>0.05)。
1.1.2主要仪器和试剂 主要仪器:低温高速离心机(美国Thermo Fisher公司);多功能酶标仪(美国BioTeke公司),NanoDrop 2000C超微量分光光度计(美国Thermo Fisher公司),7500型实时荧光定量PCR系统(美国ABI公司),全自动凝胶成像分析系统(美国Thermo Fisher公司)。
主要试剂:肝素钠(150 U/mg)、IFN-γ、IL-4、IL-17及TGF-β ELISA检测试剂盒(美国Invitrogen公司);胎牛血清、细胞培养液、DMEM(美国Gibco公司);青霉素-链霉素混合溶液(100×双抗)、无菌PBS、胰蛋白酶(美国HyClone公司);Percoll细胞分离液、HEPES(北京索莱宝科技有限公司);DNaseⅠ胶原酶和抗体(美国Sigma公司);总RNA提取试剂盒、DEPC、逆转录试剂盒、蛋白提取试剂盒(美国Thermo Fisher公司);2×SYBR Green RT-qPCR 试剂盒(美国BioTeke公司);BCA蛋白浓度测定试剂盒(上海碧云天生物技术公司);T-bet、GATA-3、RORC、Foxp3引物(上海生工生物有限公司合成)。其余常规试剂均为国产分析纯。
1.2方法
1.2.1外周血细胞因子水平检测 两组孕妇均于入院后、产前采集外周静脉血,肝素抗凝后3 000 r/min 离心15 min,分离出血浆,ELISA法检测血浆中IFN-γ、IL-4、IL-17及TGF-β的水平。
1.2.2胎盘滋养层细胞获取 ①分别取两组中行剖宫产的孕妇术后的无菌胎盘组织,无菌条件下剪取蜕膜层与羊膜层之间的绒毛组织,以无菌磷酸缓冲盐溶液(PBS)洗净后剪碎,用0.25%的胰蛋白酶+DNaseⅠ型胶原酶消化30 min后离心、弃去上清并收集细胞,加入细胞培养基DMEM重悬,重复消化2次,共收集细胞3次。②将收集到的单细胞悬液用Percoll分离液进行分离、纯化,以含20%胎牛血清、1%双抗和25 mmol/L HEPES的高糖DMEM培养液重悬细胞沉淀并置于37℃,5% CO2培养箱中培养。
1.2.3滋养层细胞总RNA提取及检测 收集培养48 h后的滋养层细胞,Trizol法提取细胞中总RNA;RNA定量后参照逆转录试剂盒说明书进行逆转录操作;采用RT-qPCR法检测T-bet、GATA-3、RORC、Foxp3 mRNA表达;反应程序:95℃2 min(变性),95℃15 s(循环反应),60℃15 s(40个循环),4℃保存。
1.2.4滋养层细胞总蛋白提取及检测 收集培养48 h后的滋养层细胞,提取细胞总蛋白,100℃金属浴5 min使蛋白变性;BCA法测定总蛋白浓度;Western blot法检测T-bet、GATA-3、RORC、Foxp3蛋白表达。
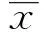
2 结果
2.1两组外周血中免疫细胞因子水平分析 与对照组比较,观察组孕妇外周血中IFN-γ和IL-17水平均明显较高(P<0.05),而TGF-β水平明显较低(P<0.05),IL-4水平有所降低但两组间差异无统计学意义(P>0.05);观察组的IFN-γ/IL-4和IL-17/TGF-β比值均明显大于对照组(P<0.05)。见表1。
2.2两组滋养层细胞中T-bet、GATA-3、RORC、Foxp3mRNA表达水平分析 与对照组比,观察组孕妇滋养层细胞中的T-bet、RORC mRNA表达水平均明显较高(P<0.05),而GATA-3、Foxp3 mRNA表达水平均明显较低(P<0.05),但T-bet/GATA-3及RORC/Foxp3比值显著增大(P<0.05)。见表2。
2.3两组滋养层细胞中T-bet、GATA-3、RORC、Foxp3蛋白表达水平分析 与对照组比,观察组孕妇滋养层细胞中的T-bet、RORC蛋白表达水平均明显较高(P<0.05),而GATA-3、Foxp3蛋白表达水平均明显较低(P<0.05),T-bet/GATA-3及RORC/Foxp3比值显著增大(P<0.05)。见图1。
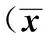


GroupsIFN-γ(ng/L)IL-4(ng/L)IL-17(ng/L)TGF-β(ng/L)IFN-γ/IL-4IL-17/TGF-βObservationgroup21.25±3.865.84±1.1518.62±2.685.22±0.843.92±1.163.46±0.72Controlgroup15.49±1.576.06±1.2810.55±1.439.64±1.572.71±0.651.14±0.18t8.615-1.65216.602-17.3895.88619.860P<0.0010.102<0.001<0.001<0.001<0.001



GroupsT-betGATA-3RORCFoxp3T-bet/GATA-3RORC/Foxp3Observationgroup5.24±1.331.01±0.203.26±0.811.14±0.395.52±1.832.95±1.23Controlgroup2.35±0.681.55±0.411.84±0.502.88±0.771.85±0.590.70±0.33t12.221-8.5688.591-15.06712.19611.242P<0.001<0.001<0.001<0.001<0.001<0.001

图1 两组滋养层细胞中T-bet、GATA-3、RORC、Foxp3蛋白表达Fig.1 T-bet,GATA-3,RORC and Foxp3 protein levels of placenta cytotrophoblast in two groupsNote:Compared with the control group,*.P<0.05.
3 讨论
母胎界面主要由来自母体的蜕膜基质细胞、蜕膜免疫细胞和来自胚胎的滋养细胞构成,是建立和维持妊娠的核心结构[4]。正常妊娠可看作是一种成功的同种异体移植,携带父系抗原的胚胎不仅不被母体免疫系统排斥,还能与母体建立独特的母-胎界面免疫耐受微环境,以维持成功妊娠,母-胎免疫耐受失调可导致子痫前期、自然流产等不良妊娠结局[5,6]。
母-胎免疫耐受机制中,Th细胞介导的适应性免疫应答至关重要。在不同细胞因子的刺激下,由初始CD4+T细胞分化的Th0细胞进一步分化为Th1、Th2、Th17及Treg细胞,并发挥不同的生物学作用[7]。Th1细胞主要分泌IFN-γ、TNF-α等细胞因子,具有细胞毒性作用,能够抑制滋养层细胞入侵并诱导其凋亡,并通过增强蜕膜巨噬细胞的活力来抑制胚胎植入,不利于妊娠的维持;Th2细胞与Th1相反,其分泌的细胞因子IL-4可刺激滋养层细胞生长和入侵,提高子宫容受性,对妊娠具有免疫营养和保护作用[8]。Th17细胞主要介导炎症性疾病及自身免疫性疾病,其分泌的细胞因子IL-17可促进绒毛外滋养细胞的侵袭并抑制其凋亡[9]。Treg细胞则通过分泌抑制性细胞因子如TGF-β,促进CD4+CD25-T向CD4+CD25+Treg分化,形成母-胎界面的Treg优势,间接发挥免疫调节作用[10]。因此,正常生理妊娠时主要呈现辅助型T细胞2(Th2)型免疫优势和调节性T细胞(Treg)扩增现象,Th1/Th2和Th17/Treg平衡是维持正常妊娠的必备条件[4]。而另一方面,Th1/Th2和Th17/Treg平衡对母-胎免疫耐受具有维持作用[11,12]。故推测母-胎免疫耐受可能参与妊娠高血压综合征(PIH)等病理妊娠过程,但其具体调节机制尚未完全清晰。
本研究通过对比分析PIH患者与正常妊娠妇女外周血中免疫细胞因子水平结果发现,与正常妊娠妇女相比,PIH患者外周血中IFN-γ和IL-17水平均明显升高,TGF-β水平明显降低,IL-4降低幅度不明显,但IFN-γ/IL-4和IL-17/TGF-β比值均明显增大,提示PIH患者存在Th1/Th2和Th17/Treg比例失衡,呈现Th2型及Treg免疫弱势。当Th1/Th2失衡时,滋养细胞发生浸润和增生障碍,导致胎盘发育不良,即可出现PIH等妊娠疾病。
为了进一步探讨PIH的发病机制,本研究从生物分子层面继续探讨母-胎免疫耐受机制在PIH病理过程中的作用。转录因子对细胞的分化具有重要的调控作用。转录因子T-bet、GATA-3、RORC及Foxp3分别是Th1、Th2、Th17及Treg细胞相应的特异转录因子,能够调控各类型Th细胞特征性细胞因子的表达[13]。T-bet/GATA-3和RORC/Foxp3比值的测定较其细胞因子水平测定更能客观反映Th1/Th2和Th17/Treg细胞的分化[14]。本研究RT-qPCR结果显示,PIH患者的T-bet及RORC的mRNA和蛋白表达水平均较对照组明显升高,而GATA-3及Foxp3的mRNA和蛋白表达水平均较对照组明显降低,因此PIH患者的T-bet/GATA-3和RORC/Foxp3比值显著增大,呈明显的Th2型及Treg免疫弱势,与血细胞因子水平表达变化趋势相一致。
综上所述,妊娠妇女若存在明显的Th1/Th2和Th17/Treg比例失衡则导致母-胎免疫耐受形成障碍,母体免疫排斥同种异体胎儿,引发PIH。因此PIH的发病可能与Th细胞介导的母-胎免疫耐受机制功能紊乱密切相关。
[1] 谢 幸,苟文丽.妇产科学[M].第8版.北京:人民卫生出版社,2013:64-71.
[2] 葛新梅,谷 强.妊娠高血压综合征发病机制及防治的研究进展[J].医学综述,2013,19(7):1270-1272.
[3] 吴 钊(综述),罗志娟(审校).妊娠高血压综合征的免疫学研究进展[J].实用医院临床杂志,2006,3(3):92-93.
[4] 王松存,杜美蓉,李大金.母-胎免疫耐受研究进展[J].科学通报,2016,61(27):2996-3001.
[5] Shirshev SV.Mechanisms of immune tolerance in physiological pregnancy[J].Usp Fiziol Nauk,2010,41(1):75-93.
[6] Braundmeier AG.Establishing maternal tolerance:the role of regulatory T cells(Tregs)in pregnancy and pathophysiology of preeclampsia[J].Current Women S Health Rev,2015,11(2):97-103.
[7] Mjösberg J,Berg G,Jenmalm MC,etal.FOXP3+regulatory T cells and T helper 1,T helper 2,and T helper 17 cells in human early pregnancy decidua.[J].Biol Reprod,2010,82(4):698-705.
[8] 王 宁,姜凤良.Th1/Th2,Th17/Treg细胞与母胎免疫耐受和病理妊娠[J].中国免疫学杂志,2016,32(1):136-139.
[9] Wu HX,Jin LP,Xu B,etal.Decidual stromal cells recruit Th17 cells into decidua to promote proliferation and invasion of human trophoblast cells by secreting IL-17.[J].Cell Mol Immunol,2014,11(3):253-262.
[10] Du MR,Guo PF,Piao HL,etal.Embryonic trophoblasts induce decidual regulatory T cell differentiation and maternal-fetal tolerance through thymic stromal lymphopoietin instructing dendritic cells[J].J Immunol,2014,192(4):1502-1511.
[11] 张 珺,杨 菁.Th17/Treg免疫失衡与原因不明复发性流产关系的研究进展[J].生殖医学杂志,2015,24(11):960-964.
[12] Rocca CL,Carbone F,Longobardi S,etal.The immunology of pregnancy:Regulatory T cells control maternal immune tolerance toward the fetus[J].Immunol Lett,2014,162(1 Pt A):41-48.
[13] Szabo SJ,Kim ST,Costa GL,etal.Pillars article:a novel transcription factor,T-bet,directs Th1 lineage commitment.Cell.2000.100:655-669.[J].J Immunol,2015,194(7):2961-2975.
[14] Lin ZW,Wu LX,Xie Y,etal.The expression levels of transcription factors T-bet,GATA-3,RORγt and FOXP3 in peripheral blood lymphocyte(PBL)of patients with liver cancer and their significance[J].Int J Med Sci,2015,12(1):7-16.
[收稿2016-12-22 修回2017-01-15]
(编辑 张晓舟)
Effectoffetal-maternalimmunetoleranceonpregnancy-inducedhypertension
LILi-Na,XUZhen-Yu,KONGLi-Na.
DepartmentofObstetricsandGynecology,WannanMedicalCollegeYijishanHospital,Wuhu241001,China
Objective:To analyze the levels of immune cytokine in peripheral blood(PB) and the expressions of immune related transcription factors in placenta cytotrophoblast,which in patients with pregnancy-induced hypertension(PIH).And to explore the effect of fetal-maternal immune tolerance on pregnancy-induced hypertension.Methods:50 cases patients with PIH were selected as the observation group,and 40 healthy people were chosen as the control group.Enzyme-linked immunoassay(ELISA) was performed to detect the levels of IFN-γ,IL-4,IL-17 and TGF-β in peripheral blood.Quantitative Real-time PCR(RT-qPCR) and Western blot were used to analyze the mRNA expressions and protein levels of T-bet,GATA-3,RORC and Foxp3 in placenta cytotrophoblast,respectively.Results:①Compared with the control group,the IFN-γ and IL-17 levels in peripheral blood in the observation group were obviously higher and the TGF-β level was greatly lower(P<0.05).There was no significant difference of IL-4 level between the two groups(P>0.05),but the ratios of IFN-γ/ IL-4 and IL-17/TGF-β in the observation group were larger than that in the control group(P<0.05).②Compared with the control group,the mRNA expressios and protein levels of T-bet and RORC in the observation group were increased significantly(P<0.05),but that of GATA-3 and Foxp3 were decreased greatly(P<0.05).Thus,the ratios of T-bet/GATA-3 and RORC/Foxp3 in the observation group were significantly larger than that in the control group(P<0.05).Conclusion:PIH is occurred with the imbalance of Th1/Th2 and Th17/Treg,and it might be associated with the mechanism of fetal-maternal immune tolerance disorder that induced by Th cells.
Pregnancy-induced hypertension;Fetal-maternal immune tolerance;Placenta cytotrophoblast;Cytokines;Transcription factors
10.3969/j.issn.1000-484X.2017.09.025
李丽娜(1976年-),女,博士,副教授,副主任医师,主要从事产科疾病及分子生物学方面的研究,E-mail:lilina765@163.com。
R714.2
A
1000-484X(2017)09-1398-04
①皖南医学院弋矶山医院药剂科,芜湖241001。
