特异性干扰survivin基因表达对人舌癌Tca8113细胞体外增殖和侵袭性的影响①
2017-09-21母润红刘永超王湘茗
母润红 马 方 刘永超 王湘茗
(北华大学基础医学院,吉林132011)
特异性干扰survivin基因表达对人舌癌Tca8113细胞体外增殖和侵袭性的影响①
母润红 马 方 刘永超 王湘茗
(北华大学基础医学院,吉林132011)
目的:探讨应用RNAi技术特异性沉默survivin基因表达对人舌癌细胞Tca8113增殖、凋亡、迁移的影响,阐明survivin在Tca8113细胞生物学行为中的作用。方法:取对数生长期的Tca8113细胞,分为干扰组、阴性对照组及空白对照组。采用RT-PCR和Western blot方法检测Tca8113细胞中survivin基因的mRNA及蛋白的表达水平;MTT法检测细胞的增殖状况;流式细胞术检测各组Tca8113细胞凋亡率;划痕实验检测Tca8113细胞的迁移状况。结果:RT-PCR 显示舌癌Tca8113细胞中survivin 的mRNA表达水平明显低于空白对照组 (P<0.05),Western blot 蛋白免疫印迹结果显示,与空白对照组比较,survivin蛋白表达水平减少(P<0.05)。survivin干扰组Tca8113细胞的增殖能力降低(P<0.05);细胞划痕实验发现转染Tca8113细胞48 h 后干扰组细胞的迁移距离明显短于空白对照组(P<0.05)。结论:特异性沉默siRNA-survivin的表达可有效抑制舌癌Tca8113细胞的体外迁移能力,可能与survivin表达减少有关,有望成为口腔舌癌生物治疗的潜在靶点。
survivin;siRNA;增殖;凋亡;迁移
鳞状细胞舌癌是口腔颌面部常见的恶性肿瘤,其特点是局部浸润生长及易发生颈部淋巴结转移。发生淋巴结转移患者的预后较差,颈淋巴结转移是导致舌鳞癌患者死亡的重要因素之一[1]。survivin基因是凋亡抑制蛋白家族(Apoptosis inhibitor protein,AIP)成员中分子量最小的一个,是迄今为止发现的最强凋亡抑制因子[2]。survivin在胚胎组织中及大多数的肿瘤组织中特异性表达,而在正常组织中低表达或不表达。survivin的高表达与肿瘤的复发、淋巴浸润及转移相关,常与患者的预后不良以及对化学治疗不敏感有关[3]。近年研究发现survivin基因与舌癌发生发展密切[4]。但其内在机制尚不清楚。本研究中,我们通过RNAi的方法,特异性干扰人舌癌细胞株Tca8113细胞中survivin基因的表达[5,6],探讨survivin基因在人舌癌发生发展中所发挥的作用,寻找抑制舌癌增殖、侵袭和转移新的治疗靶点。
1 材料与方法
1.1细胞、主要试剂盒仪器 人舌癌细胞株Tca8113惠赠于北华大学药学院李贺副教授。DMEM培养基购自美国Hyclone公司,小牛血清购于杭州四季青公司;转染试剂购于北京普利莱基因技术有限公司;Trizol试剂购于美国Invitrogen公司;mRNA反转录试剂盒与PCR反应Mix混合物购于TaKaRa公司;兔抗人survivin、GAPDH多克隆抗体购于武汉博士德公司;辣根过氧化物酶标记的山羊抗兔IgG抗体购于北京中杉金桥生物技术有限公司;四甲基偶氮唑蓝(MTT)购于美国Sigma公司;ECL化学发光试剂盒、Annexin V-FITC凋亡检测试剂盒、BCA蛋白测定试剂盒购于江苏省海门市碧云天生物技术有限公司。
1.2方法
1.2.1细胞培养 Tca8113细胞于含10%胎牛血清的DMEM完全培养基中培养,置于37℃、5%CO2及饱和湿度的培养箱中,每2 d传代1次,取对数生长期细胞用于后续实验。
1.2.2siRNA的选取 根据GenBank中人类survivin的mRNA序列(NM_001168.2;NM_001012270.1;NM_001012271.1;XR_243654.2),并参阅文献[6],确定靶向人survivin基因的特异性siRNA序列(名称及靶向序列见表1),含非靶向性错义RNA(Scramble RNA,SCR)作为阴性对照。本实验还采用了荧光Financial Analyst Meeting (FAM)标记的无靶向siRNA用于测定siRNA的细胞转染效率。以上siRNA均交由上海吉玛公司进行化学合成。
1.2.3细胞分组和转染 转染前一天,取对数生长期的Tca8113细胞,按照每孔5×105个细胞接种于6孔板中,待细胞铺满80%孔底面积后进行转染。转染前6 h将孔中培养基置换为无血清培养基,转染按照HifectinⅡ真核转染试剂提供的说明书进行。将细胞分为干扰组(转染siRNA-survivin)、对照组(转染SCR)及空白组(未处理),siRNA-survivin及SCR的终浓度均为100 nmol/L。转染后各组均置于37℃、5%CO2条件下继续培养5 h,换成含10%血清培养基继续培养,并且在荧光显微镜下观察细胞中绿色荧光的表达情况,转染效率=荧光阳性细胞数/筛选细胞总数×100%。
表1人survivin基因特异性干扰序列
Tab.1Specificinterferingsequencesofhuman-survivinGeneTargetsequence

NameStandSequence(5'-3')siRNA-surSensestrandGGCUGGCUUCAUCCACUGCTTAntisensestrandGCAGUGGAUGAAGCCAGCCTTSCRSensestrandCAGUCGCGUUUGCGACUGGTTAntisensestrandCCAGUCGCAAACGCGACUGTT
1.2.4RT-PCR检测Tca8113细胞中survivin mRNA的相对表达水平和沉默效率 细胞转染后48 h用TRIzol试剂提取各实验组Tca8113细胞总RNA,随后将所得RNA应用TaKaRa逆转录试剂盒逆转录为cDNA。以cDNA产物为模版,配置10 μl体系进行RCR扩增,检测survivin基因表达情况。PCR反应条件为:94℃预变性5 min, 94℃ 45 s,58℃ 30 s,72℃ 1 min 35个循环,最后72℃延伸10 min。survivin引物为:上游引物,5′-AACAGCCGAGATGACCTCC-3′;下游引物, 5′-AACTTCAGGTGGATGAGGAGAC-3′,产物大小为421 bp。内参基因GAPDH引物序列为:上游引物,5′-TGAAGGTCGGAGTCAACGGATTTGGT-3′,下游引物,5′-CATGTGGGCCATGAGGTCCACCAC-3′,产物大小为983 bp。PCR产物取经1.5%琼脂糖凝胶电泳后,在紫外成像仪中应用Tanon2500 Gel Imaging system 软件获取图像,以survivin/GADPH的灰度比值进行半定量分析。
1.2.5Western blot法检测各组Tca8113细胞中survivin蛋白的相对表达水平和沉默效率 细胞转染后48 h,按照试剂盒说明书裂解各组Tca8113细胞并提取总蛋白。使用二喹啉甲酸(BCA)法蛋白定量法检测总蛋白浓度。取等量的各组细胞总蛋白(50 μg)应用5%聚丙烯酰胺凝胶(SDS-PAGE)进行蛋白电泳分离,随后转印至硝酸纤维膜(PVDF)上,5%脱脂奶封闭1 h,用TBS洗膜,加入兔抗人survivin单克隆抗体(稀释浓度1∶200)或兔抗人GADPH单克隆抗体(稀释浓度1∶500),4℃过夜。TBST洗膜后,加入辣根过氧化物酶标记的山羊抗兔二抗(稀释浓度1∶2 000),室温孵育1 h。最后加入ECL显示液,反应3 min,入暗室曝光45 s,显影定影后扫描分析。结果采用Quantity One®software version 4.6.2图像分析软件进行灰度值分析,各组蛋白条带灰度值均以对应的内参照GADPH为基准进行校正,计算相对灰度值。
1.2.6MTT法检测细胞的增殖 收集对数生长期的Tca8113细胞接种于96孔板中,每孔细胞数3×103个,体积为100 μl,继续培养24 h后进行分组及细胞内转染,每组6个复孔。分别于转染后24、48、72 h时终止培养,每孔加入MTT (5 mg/ml) 20 μl,继续培育4 h,弃上清 ,每孔加入DMSO 100 μl,振荡10 min,使结晶充分溶解 ,在全自动酶标仪上测各孔490 nm波长处的吸光度。
1.2.7流式细胞术检测细胞凋亡率 细胞转染24 h后用胰酶消化细胞,每组细胞用PBS洗涤2次后再各用500 μl Binding buffer制备成细胞悬液,每组加入5 μl的Annexin V-FITC 和5 μl碘化丙啶(PI)染液,室温避光孵育10 min后在流式细胞仪上检测细胞凋亡情况。结果应用winMDI 2.9分析软件进行分析。
1.2.8细胞划痕实验 胰酶消化各组细胞,加入DMEM培养基,并将细胞浓度调至1×106个/ml,将各细胞悬液分别接种至6孔板各孔内,待细胞融合度达到80%左右时,按照以上所提及方法进行细胞分组及转染。转染24 h后弃瓶内培养基,以1 ml 枪头在孔内划线,PBS洗涤贴壁细胞2次,之后加1 ml无血清DMEM 培养基,24 h后在显微镜下拍摄划线区域细胞生长状态,测量肿瘤细胞的迁移距离,每孔测量5次。
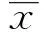
2 结果
2.1siRNA的转染效率鉴定 Tca8113细胞转染6 h后,用PBS缓冲液冲洗3次,在荧光显微镜下观察siRNA转染效果。如图1所示荧光主要集中在细胞质中,荧光转染细胞有明显的细胞轮廓,与背景反差明显。经计数,荧光标记siRNA转染效率大于70%,可以进行后续的实验。
2.2siRNA的干扰效果检测 RT-PCR 检测结果显示(图2),转染48 h后各组细胞均有亮度相似的GADPH基因条带表达,各组survivin/GADPH比值代表survivin基因的mRNA表达水平。干扰组的survivin基因mRNA表达水平(0.419 2±0.0174 6)较空白对照组(0.788 3±0.055 79)明显降低(P<0.05),阴性对照组(0.771 8±0.039 59)和与空白对照组比较无显著差异(P>0.05)。Western检测结果显示(图3):干扰组survivin蛋白条带明显变细,与空白对照组(0.680 8±0.053 56)比较,干扰组(0.223 5±0.021 91)Tca8113细胞中survivin蛋白的相对表达水平显著降低(P<0.05),阴性对照组(0.636 6±0.074 03)与空白对照组相比较差异无统计学意义(P>0.05)。

图1 荧光标记siRNA转染Tca8113细胞6 h后绿色荧光表达(×200)Fig.1 Expression of green fluorescence in Tca8113 cells 6 h post-transfection (×200)
2.3siRNA 对Tca8113增殖的影响 MTT法检测的细胞吸光度值表明,与空白组相比较,转染后24、48、72 h实验组Tca8113细胞的增殖均受到明显抑制(P<0.05),生长曲线低平,而在以上三个时间点对照组与空白组相比较细胞的增殖无明显差别(P>0.05),见表2、图4。
2.4siRNA对细胞凋亡的影响 应用流式细胞术检测Tca8113细胞的早期凋亡,结果显示转染48 h后,siRNA-survivin转染组细胞的凋亡率为(25.21±1.197)%,明显高于空白对照组(9.783±0.762 2)%及阴性对照组(9.643±0.437)%(F=109,P<0.000 1,图5)。

图2 细胞内转染48 h后Tca8113细胞survivin的mRNA表达Fig.2 Expressions of survivin mRNA 48 h in Tca8113 cells after transfection detected with RT-PCRNote: A.Interference group;B.Negative control group;C.Blank control group.*.P<0.05.

图3 细胞内转染48 h后Tca8113细胞survivin蛋白的干扰效果Fig.3 Expressions of survivin protein 48 h in Tca8113 cells after transfection detected with Western blotNote: A.Interference group;B.Negative control group;C.Blank control group.*.P<0.05.
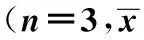


Groups24hODvalue48hODvalue72hODvalueInterferinggroup0.4182±0.044300.5793±0.033991.349±0.1565Negativegroup0.9341±0.052531.278±0.069012.004±0.09502Controlgroup0.8676±0.041411.241±0.084031.928±0.07789

图4 细胞内转染后各时段Tca8113细胞的增殖状况(24、48、72 h)Fig.4 Tca8113 cell proliferation detected with MTT(24,48,72 h)Note: A.Interference group;B.Negative control group;C.Blank control group.
2.5划痕实验结果 24 h之后空白对照组,阴性对照组和干扰组的细胞迁移距离分别为:(464.0+15.04)μmol/L 、(497.7+27.57)μmol/L和(245.7+16.90)μmol/L.其中干扰组与空白对照组相比较具有显著性差异(P<0.05),阴性对照组与空白对照组无明显差异(P>0.05,图6)。
3 讨论
我国口腔颌面部鳞癌发病率逐渐增高,且呈年轻化趋势[1]。舌癌因其特殊的解剖特点极易发生远处的侵袭和淋巴结转移,其侵袭转移机制目前并不完全清楚。Altieri等[7,8]指出survivin是迄今为止发现的最强的凋亡抑制因子,是一种哺乳类动物体内凋亡抑制蛋白家族的新成员。其表达具有相对特异性,在大多数正常组织不表达,仅在胚胎和肿瘤细胞上表达。研究发现survivin在胃癌组织中表达水平高低与其侵袭性及预后有关。阻断肿瘤细胞中survivin基因的表达,抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡,提高肿瘤细胞对放化疗药物的敏感性,因此抑制survivin的表达成为肿瘤治疗的一个理想靶点[9,10]。

图5 细胞内转染48 h后Tca8113细胞的凋亡状况Fig.5 Apoptotic rate of Tca8113 cell detected with flow cytometryNote: A.Interference group;B.Negative control group;C.Blank control group.1.Blank group;2.Control group;3.Experiment group.

图6 光学显微镜下观察划痕实验中Tca8113细胞的迁移距离Fig.6 Scape of Tca8113 cells in wound healing experim-ent observed under microscopeNote: A.Interference group;B.Negative control group;C.Blank control group.
本实验通过RT-PCR的方法对siRNA-survivin的转染效果进行了验证,结果显示转染48 h后转染组的survivin表达量较对照组及空白组均明显下降,初步提示RNA干扰survivin表达成功,为后续试验的有效性和真实性提供依据。Western检测,干扰组survivin Tca8113细胞蛋白的表达水平显著降低。说明在蛋白水平上可以抑制Tca8113细胞survivin的表达。流式细胞术检测Tca8113细胞siRNA-survivin转染组细胞的凋亡率为,明显高于空白对照组及阴性对照组。细胞划痕实验同时证实干扰siRNA-survivin表达后口腔舌癌Tca8113细胞迁移能力明显受到抑制。
综上,本研究发现干扰survivin 的表达可有效抑制口腔舌癌Tca8113细胞的转移能力,survivin在舌癌中的调控可能为舌癌的基因诊断和生物靶向治疗提供新的思路,但survivin在舌癌中的具体作用机制需要进一步深入研究。
[1] 段丽君,王 欣.Survivin在口腔鳞状细胞癌中的表达和研究进展[J].泸州医学院学报,2012,35(5):538-540.
[2] Karkkainen MJ,Petrova T. Vascular endothelial growth factor receptors in the regulation of angiogenesis and lymphangion genesis[J].Oncogene,2014,19(49) :5598-5605.
[3] Makboul R,Refaiy AE-RM,Badary FAM,etal.Expression of survivin in squamous cell carcinoma and transitional cell carcinoma of the urinary bladder:A comparative immunohistochemical study[J].Korean J Urol,2015,56(1):31-40.
[4] Muzio LL,Pannone G,Staibano S,etal.Survivin expression in oral squamous cell carcinoma[J].Br J Cancer,2003,89(12):2244-2248.
[5] Wang JW,Liu Y,Tian HM,etal.Effect of survivin SiRNA on drug sensitivity of osteosarcoma cell line MG-63[J].Chin J Cancer Res,2010,22(1):68-72.
[6] Wu Y,Wang G,Wei J,etal.Survivin protein expression positively correlated with proliferative activity of cancer cells in bladder cancer[J].Indian J Med Sci,2005,59(6):235-242.
[7] Altieri MS,Pryor A,Yang J,etal.Targeting survivin in cancer: novel drug development approaches[J].Bio Drugs,2014,28(1):27-39.
[8] Altieri MS,Yang J,Groves D,etal.A novel anti-apoptosis gene,survivin expressed in cancer and lymphon′m[J].Nat Med,1997,3:917-921.
[9] David E,Hui Z,Jean R,etal.Prevalidation of salivary Biomarkers for oral cancer Detecion[J].Cancer Epidemiol Biomarkers Prev,2012,21:664.
[10] Poomsawat S,Punyasingh J,Vejchapipat P.Overexpression of survivin and caspase 3 in oral carcinogenesis[J].Appl Immunohistochem Mol Morphol,2014,22(1):65-71.
[收稿2017-03-22 修回2017-04-20]
(编辑 许四平 刘格格)
InfluenceofspecificsiRNAsilencingsurvivingeneonproliferationandinvasionofhumantonguecancerTca8113cellsinvitro
MURun-Hong,MAFang,LIUYong-Chao,WANGXiang-Ming.
BasicMedicalCollegeofBeihuaUniversity,Jilin132011,China
Objective:To investigate the effect of siRNA interfering survivin gene on proliferation of human tongue cancer Tca8113 cells,and clarify the effect of survivin Tca8113 cells biomechanism.Methods: The Tca8113 cells at logarithmic growth phase were selected and divided into interference group,negative control group,and blank control group.The relative levels of survivin mRNA and survivin protein expression of 3 groups were detected by RT-PCR and Western blot assay,the inhibitory rate of proliferation of Tca8113 cells was checked by MTT method,the apoptotic rate was assessed by flow cytometry(FCM),the the migration ability of Tca8113 cells were detected by Wound healing assay.Results: Compared with control group,the survivin mRNA and protein expression was markedly down-regulated in Tca8113 cells following RNA interference treatment(P<0.05),the cell proliferation were down-regulated in interference group(P<0.05),the cell apoptotic rate were up-regulated in interference group(P<0.05),the migration ability was significantly decreased in interference group(P<0.05).Conclusion: The expression of siRNA-survivin can significantly inhibit the invasion in tongue cancer Tca8113 cells,indicating it might be a potential biological therapeutic target for tongue cancer.
survivin;siRNA;Proliferation;Apoptosis;Migration
10.3969/j.issn.1000-484X.2017.09.007
①本文受吉林省教育厅项目(No.2014第202)、江苏省检验医学重点实验室开放课题资助项目(No.JSKLM-2014-017)和吉林市科技局项目(No.201339052)。
母润红(1975年-),女,博士,副教授,硕士生导师,主要从事肿瘤免疫治疗的研究,E-mail:murunhong@126.com。
及指导教师:马 方(1971年-),男,副教授,主要从事口腔种植牙的研究。
R392.1
A
1000-484X(2017)09-1310-05
