中华蟾蜍DNA条形码鉴定△
2017-09-21赵群张恬高波李灯林杨艳李军德
赵群,张恬,高波,李灯林,杨艳,李军德*
(1.中国中医科学院 中药资源中心,道地药材国家重点实验室培育基地,北京 100700;2.皖西学院,安徽 六安 237012;3.安徽华润金蟾药业股份有限公司,安徽 淮北 235000)
·专题·
中华蟾蜍DNA条形码鉴定△
赵群1,2,张恬1,高波3,李灯林3,杨艳3,李军德1*
(1.中国中医科学院 中药资源中心,道地药材国家重点实验室培育基地,北京100700;2.皖西学院,安徽 六安237012;3.安徽华润金蟾药业股份有限公司,安徽 淮北235000)
目的:通过DNA条形码研究鉴别中药材中华蟾蜍BufogargarizansCantor及其混伪品的可行性。方法:从GenBank下载了6种蟾蜍属Bufo、2种林蛙属Rana、1种侧褶蛙属Pelophylax和1种小鲵属Hynobius的COI线粒体基因DNA序列。用Clustal X1.81和BioEdit软件分别对序列进行比对和编辑。利用MEGA4.0软件按照Kimura双参数法计算种内和种间的遗传距离。用贝叶斯法和简约法构建系统发育树对中华蟾蜍进行鉴定。结果:构建的系统发育树表明,中华蟾蜍的所有样本聚类为一个单系,能很好地与其他混伪品区分。结论:COI条形码DNA序列能够对中药中华蟾蜍进行准确鉴定。
中华蟾蜍;细胞色素C氧化酶I亚基基因;条形码;鉴定
中华蟾蜍BufogargarizansCantor隶属于蟾蜍科(Bufonidae)、蟾蜍属Bufo,由其获得的蟾皮和蟾酥是我国传统名贵中药材,该种动物为上述中药材的重要基源动物[1-3]。研究表明,在中华蟾蜍的皮中含有的水溶性化学成分具有显著的抗肿瘤作用,市场上已出现由其有效成分生产的抗肿瘤药华蟾素注射液[4-5]。目前,入药的中华蟾蜍主要来源于野生,但由于野生资源的逐年减少,市场上出现了以其他动物代替中华蟾蜍的混伪品[6]。由于混伪品中抗肿瘤活性成分低于中华蟾蜍[5,7],必须寻找鉴定中华蟾蜍真伪的有效方法,才能保证该种中药的临床用药安全和市场的有效监管。
目前,关于脊椎动物类药材的鉴定主要依据外部形态、骨片横断面特征、薄层色谱法和紫外光谱吸收特征对药材进行鉴别[2,8-9]。此外,核型和线粒体12S rRNA基因可用于中华蟾蜍与部分种类的鉴别[10-11]。然而,这些有的分辨率不高,有的复杂费时不利于推广,有的则涉及鉴别种类较少,没有对鉴别的可靠性和实用性作进一步研究。线粒体细胞色素C氧化酶I亚基cytochrome oxidase subunit I(COI)基因为蛋白质编码基因,其密码子第三位碱基受自然选择的压力影响较小,具有较大的变异,同时其他部位又具有一定的保守性,可以较为容易地设计通用引物,在不同物种中扩增出来,便于不同物种之间进行比较分析,用于物种的鉴定[12]。因此,COI基因可以作为DNA条形码的分子标记。本研究以COI基因为分子标记,研究用其鉴别中药材基源动物中华蟾蜍及其混伪品的可行性。
1 材料与方法
1.1材料
用于构建中华蟾蜍及其混伪品系统发育树的内群和外群的COI基因序列均来自于美国国家生物技术信息中心(NCBI)的GenBank。用于构建系统发育树内群的序列来自于6种蟾蜍属Bufo、2种林蛙属Rana和1种侧褶蛙属Pelophylax,详细信息见表1。外群则包括来自于小鲵属Hynobius中国小鲵Hynobiuschinensis的3条COI线粒体基因部分DNA序列(GenBank登录号为JN165870、JN165869和JN165868)。
用于待检真伪的蟾皮药材购于安徽亳州药材市场,从所购蟾皮药材中随机抽取3个样本进行真伪鉴定。3个样本分别命名为Sample1、Sample2、Sample3。
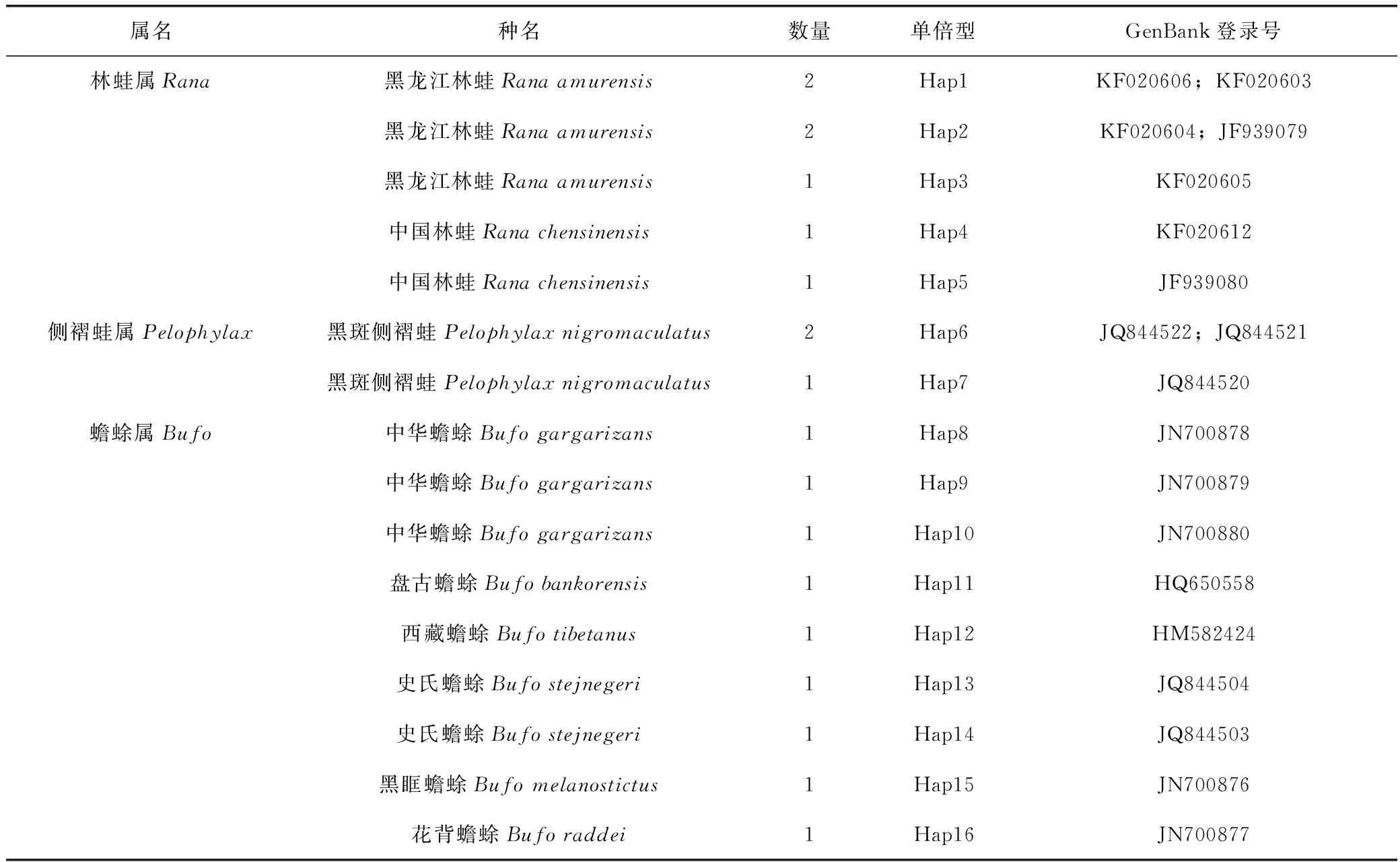
表1 中华蟾蜍及其混伪品COI序列及GenBank登录号
1.2方法
1.2.1序列分析 用软件ClustalX1.81对从GenBank下载的中华蟾蜍、混伪品及外群的COI基因部分序列进行比对和排序,用软件BioEdit7.0.9.0[13]对比对后的序列进行编辑,用MEGA4.0软件[14]统计所有序列的变异位点,利用MEGA4.0软件按照Kimura双参数法计算种内和种间的遗传距离。
1.2.2系统发育树的构建 基于比对和编辑过的所有COI基因部分序列,分别用贝叶斯法(Bayesianinference,BI)和简约法(maximumparsimony,MP)对中华蟾蜍和其混伪品进行系统发育分析,构建BI和MP两种系统发育树。其中BI树用MrBayes3.1.2[15]软件构建,MP树用PAUP*4.0beta10软件构建[16]。构建BI树时,由于COI基因3个密码子区域的分子进化模式不同,因此根据3个密码子所在的位置把整个序列分为三个部分。用MrModeltest2.3软件[17]根据AIC(AkaikeInformationCriterion)检验标准分别选择3个不同部分数据的最适进化模型。其中,第一个密码子位点所在部分的最适模型为(GTR+G),第二个密码子位点所在部分的最适模型是(HKY+I),第三个密码子位点所在部分的最适模型是(GTR+G)。马尔科夫链的蒙特卡洛方法(MarkovChainsMonteCarlo,MCMC)设置为四条链并运行2000000代。为了确定其收敛情况,MCMC分别运行两次。每100代抽取一个样本,共形成40002个样本。经过分析得知,整个运行在100000代后达到平稳,这样,总共剩余的样本数为38002,用剩余样本重建系统树,并估计其后验概率值。构建MP树时,设置自举重复次数bootstrapnreps为1000次,使用启发式搜索分析自举重复数据集,启发式搜索设置由随机逐步添加法产生起始树,重复10次,采用TBR分支交换。
1.2.3待检样本的真伪鉴别 基因组DNA的提取:用标准苯酚-三氯甲烷抽提和乙醇沉淀方法提取待测样本的整个基因组DNA。提取后的DNA置于-80℃中保存备用。
PCR扩增和DNA序列测定:用引物对Chmf4和Chmr4对待检样本的COI基因序列进行PCR扩增。其中,正向引物Chmf4的序列为5′-TYTCWACWAAYCAYAAAGAYATCGG-3′,反向引物Chmr4的序列为5′-ACYTCRGGRTGRCCRAARAATCA-3′[18]。PCR反应总体系为25μL,包括DNA模板0.5μL(5~50ng)、上游引物和下游引物各1μL(10pmol)、10×PCRBuffer2.5μL、MgCl2(25mmol·L-1)1.5μL、dNTPs(10mmol·L-1)0.5μL、TaqDNApolymerase(5u·μL-1)0.5μL、ddH2O17.5μL。PCR反应程序为95℃预变性5min;接着进行35个循环,每个循环包括94℃变性1min,46℃退火1min,72℃复性1min;最后72℃延伸10min。PCR产物由生工生物工程上海(股份)有限公司进行测序。测序引物分别为COI-C01和COI-C03,其中COI-C01的序列为5′-TYTCWACWAAYCAYAAAGAYATTGG-3′,COI-C03的序列为5′-ACYTCYGGRTGACCAAARAAYCA-3′[18]。
待检样本的真伪分析:利用ClustalX1.81和上述1.2.1序列分析步骤中的所有序列进行分析和比对。用MEGA4.0软件按照Kimura双参数法计算每个待检样本与其他各个物种之间的遗传距离。按上述1.2.2方法,将该步骤中所有物种的序列与待检样本的序列构建BI系统发育树和MP系统发育树。
通过以上方法,如果待检样本与中华蟾蜍之间的遗传距离小于与其他各物种之间的遗传距离,且待检样本与中华蟾蜍在系统发育树中聚类于同一分支上形成单系,则该待检样本为正品中华蟾蜍的蟾皮,反之则为伪品。
2 结果
2.1序列分析
中华蟾蜍、相关混伪品和外群的COI基因部分同源片段序列经过比对和编辑后,序列片断的长度为556bp,有223个变异位点,其中包含217个简约性信息位点(parsimony-informativecharacters)。所有序列的平均G+C含量为46.3%,中华蟾蜍的平均G+C含量为47.8%,因此中华蟾蜍与所有序列的平均G+C含量差异不大。中华蟾蜍种内遗传距离的范围为0.018~0.031,与其他种类的种间遗传距离为0.112~0.294。种内最大遗传距离为0.031,而种间最小遗传距离为0.112。因此,中华蟾蜍的种内遗传距离小于与其他混伪品之间的种间遗传距离。
2.2中华蟾蜍及其混伪品的系统发育树
通过BI法和MP法构建的系统发育树表明,2种方法构建的系统发育树主干基本一致,见图1。图1中各谱系分支的节点处标有BI树的后验概率值(posteriorprobability,PP)和MP树的自举支持度(Bootstrap,BS)。在BI和MP系统发育树中,中华蟾蜍所有序列的单倍型均聚类为1个分支。尽管该分支在BI树中的支持度不高(PP=0.67),但在MP树中,中华蟾蜍的单倍型以极高的支持度形成1个单系(BS=99)。
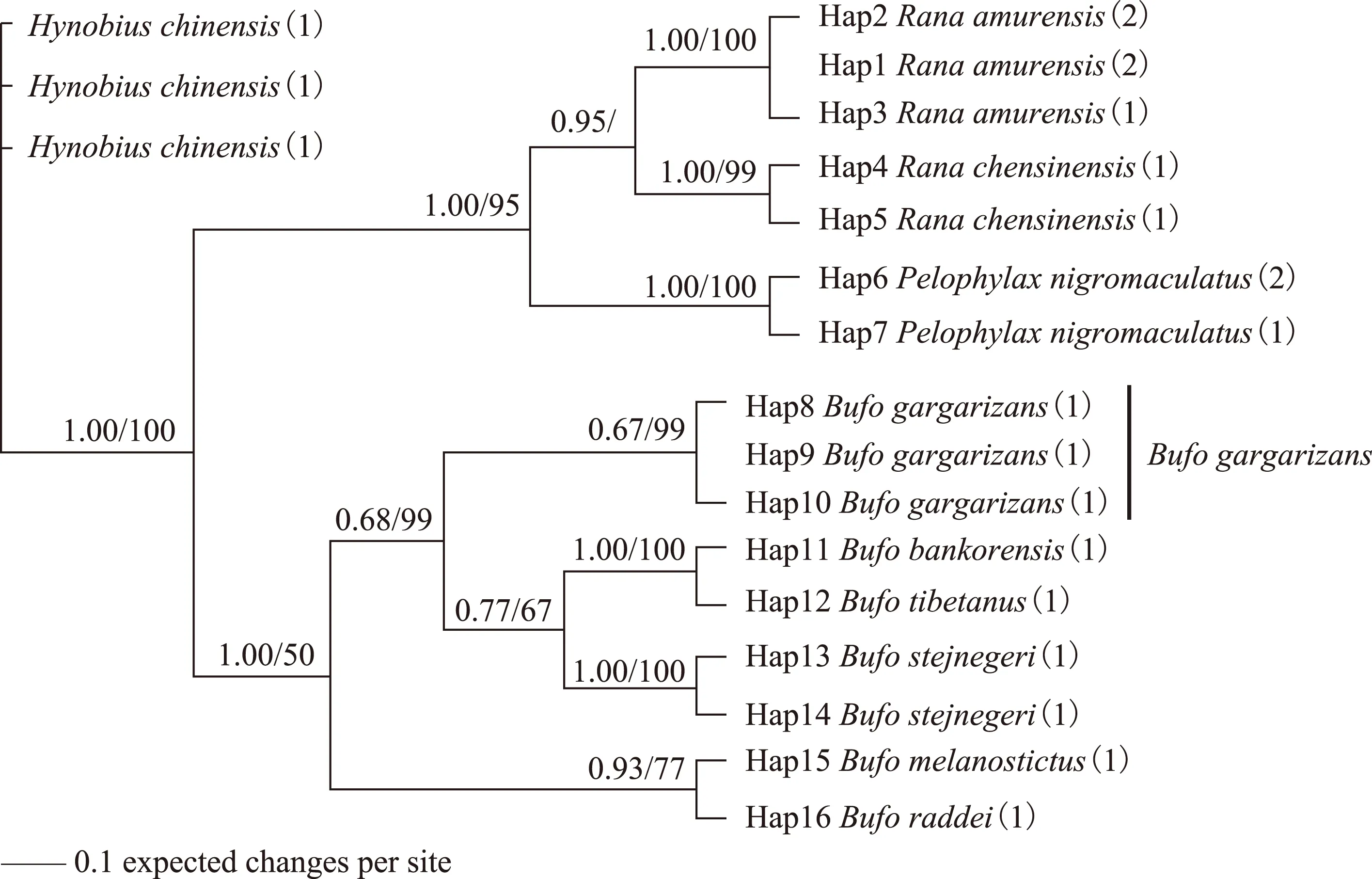
注:谱系分支节点上方为BI树的后验概率PP和MP树的自举支持度BS,其中,在斜线的左边为PP值,斜线的右边为BS值,斜线任何一边为空白,表明PP值小于0.5或BS值小于50。图1 中华蟾蜍及混伪品的系统发育树
2.3待检样本的真伪鉴别结果
通过比对和分析,3个待检样本形成1个单倍型,该单倍型用“Sample”表示。待检测样本与中华蟾蜍之间的遗传距离在0.002与0.033之间,小于与其他物种之间的遗传距离。同时,待检物种的单倍型Sample与中华蟾蜍的单倍型聚为1个分支形成单系,见图2,尤其是与中华蟾蜍的其中1个单倍型Hap9以极高的支持度聚类在一起(PP=0.95;BS=93)。

注:谱系分支节点上方为BI树的后验概率PP和MP树的自举支持度BS,其中,在斜线的左边为PP值,斜线的右边为BS值,斜线任何一边为空白,表明PP值小于0.5或BS值小于50。图2 待检样本、中华蟾蜍和混伪品的系统发育树
3 讨论
3.1COI基因序列分析
中华蟾蜍及其混伪品COI基因序列分析表明,中华蟾蜍种内遗传距离最大为0.031,而其与所有混伪品的种间遗传距离最小为0.112。因此,中华蟾蜍种内遗传距离小于与其他混伪品之间的种间遗传距离,可以用COI基因序列为分子标记,用来鉴别中华蟾蜍及其混伪品。由于在COI序列中存在中华蟾蜍不同于其他混伪品的特异性碱基位点,所以可以通过特异性碱基位点设计中华蟾蜍的特异性鉴别引物,用于中华蟾蜍的快速鉴定。目前,已有很多中药材可以通过特异性PCR进行快速鉴定[19-23]。
3.2系统发育树分析
通过贝叶斯法和简约法构建中华蟾蜍及其混伪品的系统发育树可以看出,中华蟾蜍的单倍型在系统发育树中聚类为一个单系,因此,通过构建系统发育树,可以把中华蟾蜍与混伪品区分开,以达到鉴别中华蟾蜍正品的目的。
3.3待检样本的真伪鉴别
由于3个待检样本的单倍型与中华蟾蜍之间的遗传距离最小,且与中华蟾蜍在系统发育树中聚类于同一分支上形成单系,因此3个待检样本为正品中华蟾蜍的蟾皮。
4 结论
本研究分析结果表明,线粒体COI基因序列能够通过比较待测样本、中华蟾蜍和其混伪品之间的遗传距离的远近,以及通过构建待测样本与这些物种之间的系统发育树来判断该样本是否为中华蟾蜍的蟾皮,从而达到对待测样本的真伪鉴定。因此,COI基因序列是较为理想的鉴定中华蟾蜍及其混伪品的DNA条形码。
[1] 费梁,胡淑琴,叶昌媛,等.中国动物志:两栖纲(中卷),无尾目[M].北京:科学出版社,2009.
[2] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2015.
[3] 江苏新医学院.中药大辞典:下册[M].上海:上海人民出版社,1977.
[4] 曾洋,张爱军,文筱.干蟾皮的研究进展[J].中国医药科学,2011,1(15):29-31.
[5] 王宏洁,杨立新,高波,等.高效液相色谱法测定不同种蟾皮中蟾蜍噻咛的含量[J].中国中医药信息杂志,2012,19(11):44-45.
[6] 乔淑芬.中华大蟾蜍生活习性及人工养殖场地选择[J].通化师范学院学报,2008,29(4):39-41.
[7] 张振海,王晋艳,陈彦,等.不同品种及产地蟾皮中抗肿瘤活性成分含量比较[J].中华中医药杂志,2011,26(11):2698-2701.
[8] 朱华,林冬杰,莫小玲,等.广西蛤蚧、泰国蛤蚧及其混伪品海蛤蚧(红瘰疣螈)的生药鉴定[J].广西中医药,1997,20(6):34-37.
[9] 王纯玉.蛤蚧及其伪品的鉴别[J].传统医药,2003,12(11):64.
[10]袁毅君,杨金义,袁惠群,等.甘肃中华蟾蜍和中国林蛙核型的初步研究[J].天水师范学院学报,2007,27(5):26-28.
[11]熊荣川,田应洲,李松,等.威宁中华蟾蜍的分子鉴定[J].贵州农业,2014,42(12):32-36.
[12]王鑫,黄兵.DNA条形编码技术在动物分类中的研究进展[J].生物技术通报,2006,4:67-72.
[13]HallTA.BIOEDIT:auser-friendlybiologicalsequencealignmenteditorandanalysisprogramforWindows95/98/NT[J].NucleicAcidsSymposiumSeries,1999,41(41):95-98.
[14]TamuraK,DudleyJ,NeiM,etal.MEGA4:MolecularEvolutionaryGeneticsAnalysis(MEGA)softwareversion4.0[J].MolecularBiologyandEvolution,2007,24(8):1596-1599.
[15]RonquistF,HuelsenbeckJP.MrBayes3:Bayesianphylogeneticinferenceundermixedmodels[J].Bioinformatics,2003,19(12):1572-1574.
[16]SwoffordDL.PAUP*:PhylogeneticAnalysisUsingParsimony(*andOtherMethods)[Z].SinauerAssociates,Sunderland,MA,2002.
[17]Nylander,JAA.PAUP*:MRMODELTESTversion2.1.Computerprogramdistributedbytheauthor[Z].UppsalaUniversity,Uppsala,2004.
[18]CheJ,ChenHM,YangJX,etal.UniversityCOIprimersforDNAbarcodingamphibians[J].MolecularEcology,2012,12(2):247-258.
[19]唐双焱,傅文,陈永久,等.中药材鹿鞭的分子鉴定研究[J].中国中药杂志,2002,27(8):573-575.
[20]冯成强,唐晓晶,黄璐琦,等.金钱白花蛇及其混淆品高特异性PCR的鉴别[J].中国中药杂志,2006,31(13):1050-1053.
[21]Sun X Q,Wei Y L,Qin M J,et al.Authentication of an Endangered Herb Changium smyrnioides from Different Producing Areas Based on rDNA ITS Sequences and Allele-Specific PCR[J].Archives of Pharmacal Research,2012,35(4):701-708.
[22]陈康,蒋超,袁媛,等.快速PCR方法在蛇类药材真伪鉴别中的应用[J].中国中药杂志,2014,39(19):3673-3677.
[23]Han B X,Yuan Y,Huang L Q,et al.Specific PCR identification betweenPeucedanumpraeruptorumandAngelicadecursivaand identification between them and adulterant using DNA barcode[J].Pharmacognosy Magazine,in press.
Identification ofBufogargarizansand Its Adulterants by DNA Barcoding Technique
ZHAO Qun1,2,ZHANG Tian1,GAO Bo3,LI DengLin3,YANG Yan3,LI JunDe1*
(1.National Resource Center for Chinese Materia Medica,China Academy of Chinese Medical Sciences,State Key Laboratory Breeding Base of Dao-di Herbs,Beijing,100700,P.R.China;2.West Anhui University,Lu’an 237012,P.R.China;3.Anhui China Resources Jinchan Pharmaceutical Co.,Ltd.,Huaibei 235000,P.R.China)
Objective:To study the feasibility of using DNA barcoding technique to identifyBufogargarizansand its adulterants based on COI gene.Methods:Sequences of partial mitochondrial DNA from cytochrome oxidase subunit I(COI)gene of 6 species fromBufo,2 species fromRana,1 species fromPelophylax,and 1 species fromHynobiuswere downloaded from the GenBank data library.The COI sequences were aligned and edited using ClustalX 1.81 and BioEdit 7.0.9.0 software,respectively.The interspecific and intraspecific genetic distances of different sequences were calculated by Kimura double parameter method using software MEGA 4.0.Based on all the aligned and edited COI sequences,the phylogenetic analyses were conducted using Bayesian inference(BI)and maximum parsimony(MP)to identifyB.gargarizansand adulterant.Results:COI sequence haplotypes of different samples ofB.gargarizanswere gathered together,formed its own monophyly,and distinguished from its adulterants by BI and MP trees.Conclusion:The COI sequence is ideal DNA barcode to identifyB.gargarizansand its adulterants correctly.
Bufogargarizans;COI;DNA barcode;identification
中央本级重大增减支项目(2060302);蟾蜍规范化养殖技术研究(3-YFB2014005);安徽省高校省级自然科学研究项目(KJ2016SD61)
] 李军德,研究员,研究方向:药用动物资源与动物药材鉴定,E-mail:jundeli99@163.com
10.13313/j.issn.1673-4890.2017.1.002
2016-09-02)
*[
