鹿茸:干细胞与其微环境相互的产物△
2017-09-21杨言慧焦晶雪李军德李春义
杨言慧,焦晶雪,李军德,李春义
(1.中国农业科学院 特产研究所,特种动物分子生物学省部共建国家重点实验室,吉林 长春 130112;2.吉林大学第二医院 吉林 长春130041;3.道地药材国家重点实验室培育基地,中国中医科学院 中药资源中心,北京 100700)
·基础研究·
鹿茸:干细胞与其微环境相互的产物△
杨言慧1,2,焦晶雪2,李军德3,李春义1*
(1.中国农业科学院 特产研究所,特种动物分子生物学省部共建国家重点实验室,吉林 长春 130112;2.吉林大学第二医院 吉林 长春130041;3.道地药材国家重点实验室培育基地,中国中医科学院 中药资源中心,北京 100700)
鹿茸的周期性再生是一个基于干细胞的过程,鹿茸干细胞(ASC)存在于生茸区骨膜(AP)与角柄骨膜(PP)中。本篇综述首先提出了一个假说,即紧密包裹的皮肤是ASC微环境的主要组成成分,之后通过一系列实验研究对这一假说进行了验证。通过插膜实验证明ASC和其紧密包裹皮肤之间的相互作用是鹿茸发生与再生不可或缺的,这一相互作用是通过交换游离小分子物质而实现的。AP组织的皮内移植实验表明,表皮和真皮毛乳头细胞参与了这一相互作用的过程。进一步的AP组织翻转实验表明,尽管自然情况下AP的纤维层紧贴皮肤,但诱发鹿茸发生和再生的信号来源于AP组织细胞层的细胞。通过实验改变鹿茸干细胞的微环境对鹿茸的发生产生了显著的影响。我们相信最终对这些相互作用分子的鉴别和分离不仅能够使我们进一步揭示鹿茸发生和再生的机制,更对再生医学有着重要意义。
鹿茸;角柄;鹿;干细胞;骨膜;组织相互作用
1 引言
实现器官再生,是现代再生医学“皇冠上的明珠”。但要实现这个终极目标,离不开再生生物学研究的支撑,即通过对不同生物医学模型的研究来揭示再生机制[1]。鹿茸作为唯一能够完全再生的哺乳动物附属器官在众多再生模型中尤为独特,同时为我们提供了一个绝佳的机会来揭示自然界是如何解决了哺乳动物复杂器官(包括骨、软骨、血管、神经以及皮肤组织)完全再生的问题[2]。

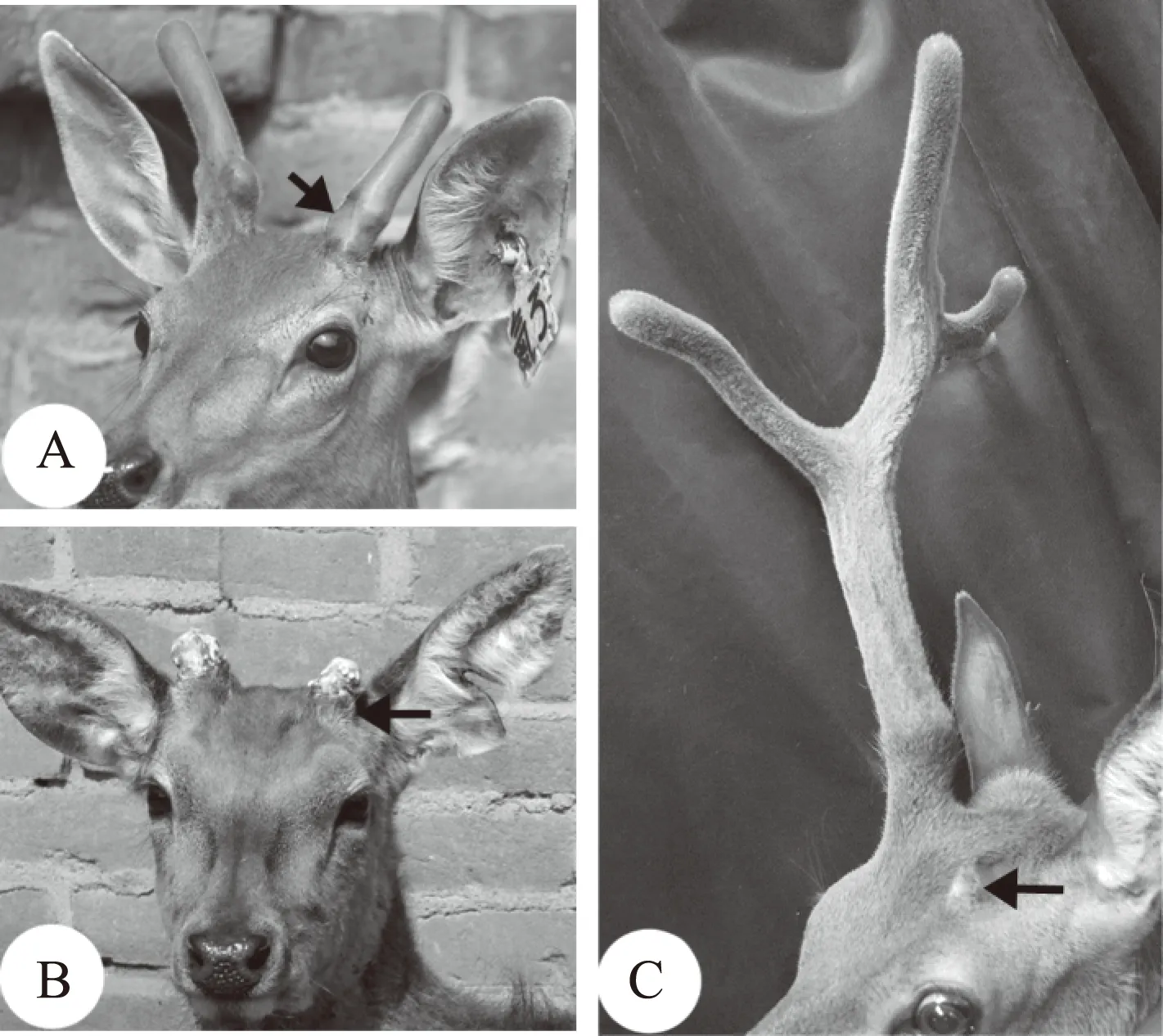
注:1.眉枝;2.冰枝;3.嘴头图1 梅花鹿三杈茸
鹿茸是鹿额骨上的一种附属器官,能够每年脱落并完全再生(图1)。鹿茸再生并不是直接在鹿头上进行的,而是发起于角柄的顶端。角柄是着生于鹿额骨上的永久性骨桩。鹿不是生来就带有角柄,而是当雄鹿进入青春期后,在雄激素的作用下从其头部额外嵴(眼窝后上方)上发生的。当角柄长到有种的特异高度(梅花鹿、赤鹿为5~6 cm)时,角柄顶端开始出现毛发稀疏并具有光泽的皮肤,预示着初角茸已经开始发生。生长期的鹿茸由这种带有天鹅绒样的皮肤所覆盖,所以人们称这种皮肤为茸皮。当繁殖季节到来时,初角茸完全钙化,血液供应被阻断,导致茸皮干枯。随后脱落,暴露出其下坚硬的骨角,即鹿角。在来年春天鹿角脱落,从而触发新一轮鹿茸由角柄上的再生。之后每年鹿茸的再生进入一个稳定的以年为周期的循环中:上一年完全骨化的鹿角在春天脱落,新茸开始再生,夏天鹿茸快速生长并成熟,秋天鹿茸完全钙化,茸皮脱落,整个冬季都保持着裸露的骨角状态[3]。鹿茸发生与再生是一种独特的生物学现象,揭示这一过程的机制将有助于我们揭开器官的发生与哺乳动物器官再生的秘密。鹿茸同时又是珍贵的传统中药,为动物药之首。为了保存鹿茸的最大药效,商业上每年要在鹿茸快速生长期将其锯下。为了不损伤来年再生鹿茸的生长点,锯茸的位点都选择在与角柄连接处之上的2 cm处。剩下的与角柄相连的两厘米长的茸根同鹿角一样在秋天骨化,在春天从角柄上脱落。这个茸根被称为花盘[4]。
2 鹿茸干细胞(ASC)
我们认为对于鹿茸干细胞的研究应当起始于1974年,当年Hartwig 和Schrudde 报道了他们的惊人发现,即鹿角柄和初角茸的发生都来源于覆盖于鹿额外嵴(未来生茸区)上的骨膜,即生茸区骨膜(AP)。将AP剔除,使原来生茸部位不能再发起角柄与鹿茸的生长,但如果将AP移植到鹿体的其他部位,在移植的部位都能诱导异位生茸[5]。随后Goss[6-7]通过实验确定了AP的面积与鹿不同部位的皮肤对异位生茸能力的影响。Li等[8]成功分离并离体培养了AP细胞,这为进一步对AP 细胞生物学特性的研究奠定了基础。
尽管已经通过组织剔除与移植实验令人信服地证明了AP是发起角柄和初角茸的组织基础,但利用相同的方法却没能找到发起鹿茸再生的组织基础。Wislocki和Goss都认为鹿茸再生的细胞来源于角柄的皮肤[2,9]。基于鹿茸“坐殿”现象(一种独特的现象),即上一差鹿角(花盘)脱落前,新鹿茸的再生已经开始并包裹了尚未脱落的鹿角(花盘)),并受到鹿茸的发生是由骨膜引起这一现象的启发,Kierdorf等[10]提出了可能是角柄骨膜诱导了鹿茸的再生。Li等[11-12]通过一系列的形态学与组织学实验终于成功鉴定出了鹿茸再生的细胞来源,实验发现鹿茸再生的生长中心仅来源于角柄顶端骨膜细胞的分裂繁殖。为了对这一发现进行功能验证,Li等[13]在鹿茸再生之前用手术的方法剔除了全部或部分的PP组织,结果发现在全部缺失PP组织的角柄上没能再生出鹿茸,而部分剔除PP后鹿茸在角柄骨干上长出,长出部位正是剩余PP的末端,而这一位置远离了自然鹿茸再生位点,即角柄顶端。因此可见,正是PP组织发起了鹿茸再生。
基于AP和PP的独特性,我们认为AP与PP细胞是一种干细胞。为了验证这一观点,我们随后对这些细胞特性进行了研究,结果发现这两种细胞都表达主要的胚胎干细胞标记物Oct4、 Sox2、 Nanog、 CD9、端粒酶以及核干因子,并具有多分化潜能,能够在离体条件下被诱导分化成软骨细胞、脂肪细胞、肌细胞和类神经元细胞[14]。综上所述,我们结论AP与PP细胞都是鹿茸干细胞(ASC)。AP是鹿茸发生的干细胞,而PP是鹿茸再生的干细胞。
3 ASC微环境假说的建立
3.1以前的实验结果提示包裹的皮肤为ASC提供了微环境
作为干细胞,ASC不仅要存在于特定的微环境中,还要与这个微环境进行相互作用。Goss[15]在诱导异位生茸实验中意识到,AP只有与其上覆盖的皮肤实现紧密接触时才能诱导异位鹿茸的发生,由此他认为AP与皮肤间的相互作用是鹿茸发生所必须的,而且两者的紧密接触有助于相互作用的建立。我们随后对鹿茸发生中由头皮转变为茸皮这一过程进行了详细的组织学研究[16],结果与Goss的这一观点相一致。因为组织学观察表明只有当位于这两种相互作用组织之间的皮下疏松结缔组织被全面压缩,使AP与皮肤变得紧密接触时,茸皮的转变才会发生。同样,鹿茸再生有可能也是依赖于PP与皮肤的紧密接触。Li等[13]在PP取样时注意到,PP与皮肤接触的紧密程度由角柄的远端到近端明显不同:角柄远端即鹿茸再生点接触紧密,而近端却疏松相连。有趣的是,随着鹿年龄的增长,角柄的高度逐年缩短,当角柄缩短到近端疏松相连处时,鹿茸再生仍然能够发生,这是由于此时近端疏松相连的PP与皮肤也已经变成了紧密接触[17]。总之,这些发现提示我们PP与皮肤的紧密接触是鹿茸再生必不可少的。由此可见,紧密接触的皮肤可能为ASC提供了鹿茸发生与再生的主要微环境。
3.2ASC微环境假说
基于上述发现,我们提出了一个鹿茸干细胞微环境假说:ASC与其微环境的相互作用(即与紧密包裹的皮肤)触发了鹿茸的发生或再生。ASC诱导头皮(角柄皮肤)转变成了茸皮,转变成茸皮后的反馈又有效地刺激了ASC的快速增殖与分化,进而发起鹿茸的生长。
4 ASC微环境假说的验证
4.1鹿茸发生或再生依赖于ASC和微环境细胞的相互作用
为了验证ASC与微环境细胞的相互作用对鹿茸生长是否必须,我们分别对鹿茸发生(初角茸)和再生进行了两个实验。在鹿茸发生的实验中,分别将一不通透性薄膜和半通透性薄膜插入到已经移植到前额皮下的AP和覆盖其上的皮肤之间。结果发现不通透性膜插入组完全抑制了鹿茸的发生,而半通透性膜插入组虽然延迟了茸皮转变的时间(到第二年才发生),但并未阻止这个过程[18]。在鹿茸再生的实验中,我们设计了两种不同的角柄残桩:即全长的角柄和2/3长的角柄。第一种是从角柄与鹿茸的连接处锯掉其上的鹿茸,以保留全长的角柄,可见此种角柄残桩末端的PP和包裹的皮肤为紧密接触;第二种是从角柄上1/3和下2/3交界处锯掉上1/3角柄和所连接的鹿茸,以保留其下2/3角柄,可见剩余角柄残桩的PP和包裹的皮肤为疏松相连。之后我们将不透性薄膜插入每种角柄残桩的PP与皮肤之间,使两种组织得到有效隔离。结果全长角柄残桩再生出了鹿茸,虽然再生的鹿茸没有皮肤包裹,因为与PP分隔后角柄的皮肤失去了再生的能力。与之相比,2/3角柄残桩却没能再生出鹿茸[13]。由此可见,在PP和包裹皮肤变的紧密相贴(建立相互作用)前将两者隔离,就会阻止鹿茸的再生;然而当这种紧密相贴(建立相互作用)已经建立后,皮肤的参与对鹿茸再生将不再是必须的。因此插膜实验说明,建立ASC与其上所覆盖皮肤间的相互作用是发起鹿茸发生和再生的前提。由于半通透性膜不能完全阻止这一相互作用和其后鹿茸的发生,所以这一过程可能是通过相互交换游离小分子物质而实现的。
4.2微环境细胞类型鉴定
ASC微环境不是均一的组织细胞,而是由表皮与真皮组成的,其中真皮包含几种细胞类型。在鹿茸发起过程中,头皮转变成了茸皮,由此可见表皮细胞参与了与ASC的相互作用。但目前还不清楚ASC与表皮细胞之间的相互作用是通过直接交换小分子物质,还是通过真皮细胞介导所完成的。Goss[15]在进行AP移植实验中发现,除了鼻镜、尾部腹面的皮肤外,鹿身上所有部位的皮肤都可以与移植的AP发生相互作用,从而发起鹿茸的生长。鼻镜与尾部腹面皮肤的共同点是都缺少毛囊与毛发,因此真皮毛乳头细胞(DPC),作为毛囊的唯一真皮组成成分,可能介导了ASC与表皮细胞间的相互作用。
为了确定DPC是否通过介导的形式参与了这个相互作用,Li等[14]将一小块鹿头皮真皮的内侧组织(包括部分真皮及与其相连的疏松结蹄组织)在靠近真皮毛乳头DPC的地方切下,然后将不带疏松结蹄组织的真皮与相同大小的AP缝合在一起,再移植到裸鼠头上。这样做是为了使真皮毛乳头DPC更贴近AP组织。移植复合物成功存活后发现,头皮的表皮完全转变成了茸皮的表皮(图2.A和B)。这个结果说明,鹿皮只要保留了表皮和含有毛囊DPC的真皮部分就可以和AP建立相互作用从而发起鹿茸的生长,而头皮中不含毛囊DPC的真皮和疏松结蹄组织部分却不是鹿茸发生所必须的。尽管如此,这一实验并没有为DPC是否参与相互作用提供直接的证据。因此我们又做了另外一个实验[19],即将1/8的AP组织量通过真皮内移植直接放到毛囊DPC的下面,同时以相同量的AP组织进行皮下移植以作对照。结果显示(图2.C和D),皮内移植的AP组织100%发起了鹿茸的生长;相比之下,皮下移植的AP组织无一成功诱导异位鹿茸发生(皮下移植所需AP的最小量是1/2)。与皮下移植相比,皮内移植成功发起鹿茸生长所需AP的量大大减少可能是因为在AP和毛囊DPC之间已经几乎不存在障碍物的缘故,从而使AP与DPC建立相互作用变得更加容易。因此推测毛囊DPC一定介导了ASC和表皮细胞间的相互作用。
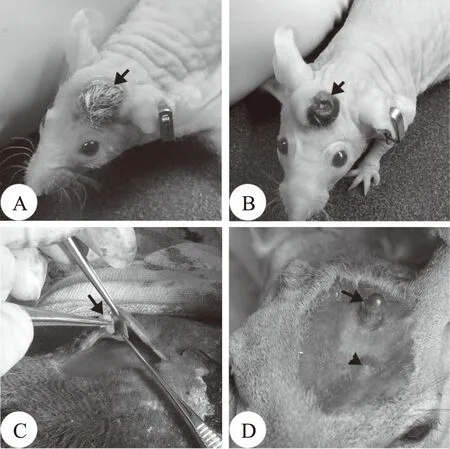
注:A.共同移植物成功存活(箭头);B.两个月后,鹿头皮转变成了茸皮(箭头);C.AP组织皮内移植;D.有移植AP组织诱导的异位鹿茸(箭头);注意:同量的AP组织皮下移植,未能发起异位鹿茸生长(无尾箭头)图2 裸鼠顶部AP组织与鹿头皮的共同移植
4.3诱导鹿茸发生分子的来源
与鹿皮肤相同,AP组织也是由两部分组成:纤维层(邻近皮肤)和细胞层(邻近骨质)。那么诱导鹿茸发起的因子是来源于AP的纤维层还是细胞层、还是两者都有呢?为了搞清楚这一问题,我们进行了下面的实验[20]。我们首先从鹿头两侧的未来生茸区分别取下AP组织,然后以不同的方向再放回去。其中对照侧直接将AP组织按原来的方向放回原处,另一侧则将AP组织上下翻转后(即让AP细胞层与皮肤相贴,纤维层与骨质相贴)再放回原处。结果显示,AP组织上下翻转侧,没有经过明显的角柄生长阶段就直接长出了鹿茸;而对照侧只有当角柄生长到种的特异高度时(梅花鹿约5cm)才发起了鹿茸的生长(图3)。这提示我们,诱导鹿茸发生的分子来源于AP细胞层而不是纤维层,正是这些诱导分子介导了ASC和微环境间的相互作用,触发了随后的鹿茸发生。
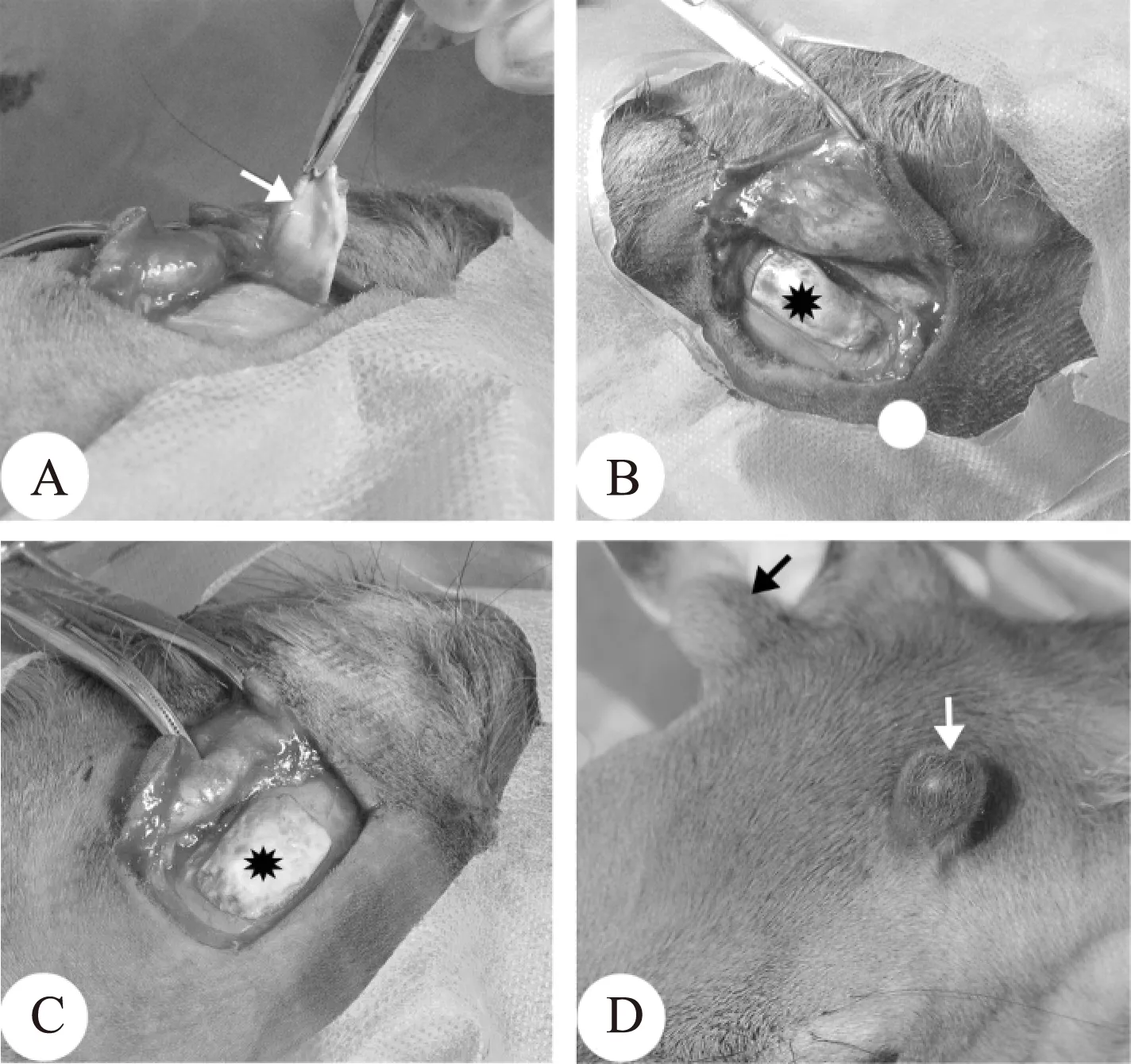
注:A.AP组织取材(箭头);B.将取下的AP组织按原来方向放回原位(星);C.将取下的AP组织上下翻转后放回原位(星);D.由翻转后AP发起的鹿茸生长几乎没有经过角柄阶段(白箭头),而由未翻转的AP发起的生长还在角柄阶段(黑箭头)图3 AP组织翻转实验
5 用微环境学说解释一些鹿茸领域非同寻常的现象
在鹿茸生物学领域,报道过很多非同寻常的现象,但都还没能被合理的解释。在角柄发生前,同时对皮肤和AP进行机械损伤通常会引起鹿茸直接发生而不经过明显的角柄阶段(图4.A和B),这可能是因为损伤有效地清除了位于AP和真皮毛乳头间的阻隔物(如部分真皮组织和相连的皮下疏松结缔组织),因此大大促进了ASC与其微环境间相互作用的建立,导致了鹿茸的直接发生。有时候皮下移植的AP需要经过几个生茸季节才能发起异位鹿茸的生长(图4.C),报道最长的是9年[21]。这可能是由于诱导鹿茸发生信号的微弱、阻隔物的低通透性或者是两者共同存在所导致的。有时候在未来鹿茸生长区只有局部能够发起鹿茸生长而不是整个生茸区(图4.D),这可能是由于只有那个部位的阻隔屏障通透性比较好,能够使足够的诱导分子通过,从而成功建立了ASC和微环境间的相互作用的结果。
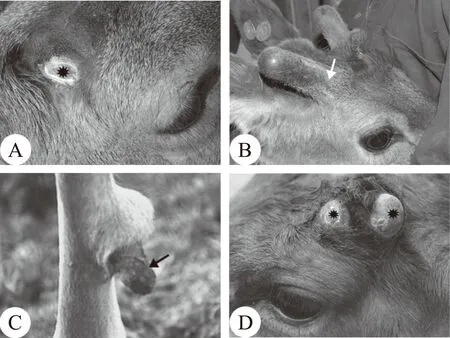
注:A.机械破坏未来生茸区的皮肤、皮下结蹄组织和AP(星);B.由该生茸区发起的鹿茸生长几乎不经过角柄阶段(箭头);C.鹿腿上的异位生茸,该鹿茸由移植9年后的AP组织发起(箭头);D.由生茸区局部发起的两个鹿茸生生长点(星)图4 鹿茸领域的异常现象
6 改变ASC微环境对鹿茸发生的影响
最近,我们通过实验改变了ASC的微环境,结果显著地影响了鹿茸的发生。当物理性增强了ASC与微环境间阻隔物(皮下疏松结缔组织和部分真皮组织)的渗透性时(通过对未来生茸区喷射液氮),大大促进了鹿茸发生的过程[22]。例如,梅花鹿一般当角柄长到5~6cm时才发起鹿茸的生长;但当物理性增加了阻隔物的渗透性后,鹿茸在角柄长到2厘时就开始发起生长。在角柄发育前如果致死未来生茸区中心的AP细胞,对AP组织与其微环境间相隔组织层的破坏与否会出现两种相反的结果:在相隔组织层受到破坏后(使通透性增加)则促进了周边AP细胞发起鹿茸生长,并几乎不经过角柄阶段(图5.A和B);而在相隔组织层不受破坏时抑制了未来生茸区周边的AP细胞(中心部位的AP细胞已被致死)发起鹿茸的生长(图5.C)。因此我们认为我们已经鉴定出了ASC微环境的主要组成成分。
注:A.破坏间隔组织层可诱导周缘AP细胞发起鹿茸生长,而这种生长几乎不经过角柄阶段(箭头);B.茸皮脱落后可见,几乎不含角柄组织(箭头);C.不破坏间隔组织层,导致阻止了鹿茸的发生(箭头)图5 破坏生茸区中央部位的AP细胞,同时破坏或不破坏与皮肤间的间隔组织所出现的相反结果
7 总结与展望
鹿茸发生与再生都依赖于ASC与其微环境之间的相互作用,这一相互作用是通过交换游离小分子物质而实现的。换言之,这些小分子物质触发了鹿茸的发生和再生。为了鉴定出这些小分子物质,我们近期建立了一套体外共培养体系,这套体系可以将参与鹿茸发生和再生主要类型的细胞巧妙地放到一起,以最大程度的模拟体内的情况。对这些小分子物质的最终鉴定与分离不仅能够帮助我们揭示鹿茸生长发育的机制,更对再生医学有着重要意义。
[1]StocumD.RegenerativeBiologyandMedicine[M].NewYork:AcademicPress,2006.
[2]GossRJ.DeerAntlers.Regeneration,FunctionandEvolution[M].NewYork,NY:AcademicPress,1983.
[3]LiC.Developmentofdeerantlermodelforbiomedicalresearch[J].RecentAdvancesandResearchUpdates,2003,4(2):256-274.
[4]LiC,ZhaoS,WangW.Deerantlers[M].Beijing:ChinesePressofAgriculturalSciences,1988.
[5]HartwigH,SchruddeJ.ExperimentelleuntersuchungenzurbildungderprimarenstirnauswuchsebeimReh(CapreoluscapreolusL.)[J].Z Jagdwiss,1974(20):1-13.
[6] Goss R J,Powel R S.Induction of deer antlers by transplanted periosteum.I.Graft size and shape[J].J Exp Zool,1985,235(3):359-373.
[7] Goss R J.Induction of deer antlers by transplanted periosteum.II.Regional competence for velvet transformation in ectopic skin[J].J Exp Zool,1987(244):101-111.
[8] Li C,Littlejohn R P,Suttie J M.Effects of insulin-like growth factor1and testosterone on the proliferation of antlerogenic cells in vitro.J Exp Zool,1999,284(1):82-90.
[9] Wislocki GB.Studies on the growth of deer antlers.I.On the structure and histogenesis of the antlers of the Virginia deer(Odocoileus virginianus borealis)[J].Am J Anat,1942,71:371-451.
[10]Kierdorf H,Kierdorf U.State of determination of the antlerogenic tissues with special reference to double-head formation.The Biology of Deer[M],New York:Springer-Verlag,1992.
[11]Li C,Suttie J M,Clark D E.Morphological observation of antler regeneration in red deer(Cervus elaphus)[J].J Morphol,2004,262(3):731-740.
[12]Li C,Suttie J M,Clark D E.Histological examination of antler regeneration in red deer(Cervus elaphus)[J].Anat Rec A Discov Mol Cell Evol Biol,2005,282(2):163-174.
[13]Li C,Mackintosh C G,Martin S K,et al.Identification of key tissue type for antler regeneration through pedicle periosteum deletion[J].Cell Tissue Res,2007,328(1):65-75.
[14]Li C.Annual antler renewal:a unique case of stem cell-based mammalian organ regeneration[C].19th Annual Queenstown Molecular Biology Meeting;Queenstown,2009.
[15]Goss R J.Of antlers and embryos.In:Bubenik G,Bubenik A,editors.Horns,Pronghorns,and Antlers[M].New York:Springer-Verlag,1990:299-312.
[16]Li C,Suttie J.Histological studies of pedicle skin formation and its transformation to antler velvet in red deer(Cervus elaphus)[J].Anat Rec,2000(260):62-71.
[17]Li C,Chu W.The regenerating antler blastema:the derivative of stem cells resident in a pedicle stump[M].Front Biosci(Landmark Ed),2016,21:455-467.
[18]Li C,Yang F,Xing X,et al.Role of heterotypic tissue interactions in deer pedicle and first antler formation-revealed via a membrane insertion approach[J].J Exp Zool B Mol Dev Evol,2008,310(3):267-277.
[19]Li C,Yang F,Haines S,et al.Stem cells responsible for deer antler regeneration are unable to recapitulate the process of first antler development-revealed through intradermal and subcutaneous tissue transplantation[J].J Exp Zool B Mol Dev Evol,2010,314(7):552-570.
[20]Gao Z,Yang F,McMahon C,et al.Mapping the morphogenetic potential of antler fields through deleting and transplanting subregions of antlerogenic periosteum in sika deer(Cervus nippon)[J].J Anat,2012,220(2):131-143.
[21]Kierdorf U,Kierdorf H.Delayed ectopic antler growth and formation of a double-head antler in the metacarpal region of a fallow buck(Dama dama L.)following transplantation of antlerogenic periosteum[J].Ann Anat,2000,182(4):365-370.
[22]Yang F,Wang W,Li J,et al.Antler development was inhibited or stimulated by cryosurgery to periosteum or skin in a central antlerogenic region respectively[J].J Exp Zool B Mol Dev Evol.2011,316(5):359-370.
Deer Antler:Derivative of Interactions between Antler Stem Cells and Niche
YANG Yanhui1,2,JIAO Jingxue2,LI Junde3,LI Chunyi1*
(1.Institute of Special Wild Economic Animals and Plants,Chinese Academy of Agricultural Sciences;State Key Lab for Molecular Biology of Special Animals,Changchun 130112,China;2.The 2nd Clinic Hospital of Jilin University,Changchun 130041,China;3.State Key Laboratory Breeding Base of Dao-di Herbs,National Resource Center for Chinese Materia Medica,China Academy of Chinese Medical Sciences,Beijng 100700,China)
Full regeneration of deer antlers is a stem cell-based process,and antler stem cells(ASC)reside in both the antlerogenic periosteum(AP)and pedicle periosteum(PP).In this review,we first advanced a hypothesis that the closely associated skin is the primary component of ASC niche and then provided results for testing of this hypothesis.Membrane insertion experiments demonstrated that interactions between the ASC and the associated skin are indispensible for both antler generation and regeneration,and these are realized through exchanging diffusible molecules.Intradermal AP graft study showed that both epidermal cells and dermal papilla cells of deer skin are involved in these interactions.Further,the AP inversion experiment indicated that the initial inductive signal originates from the ASC resident in the AP cellular layer,although the AP fibrous layer is naturally adjacent to skin.Experimental manipulation to the ASC niche has profound effects on antler development.We believe that eventual identification of these interactive molecules would not only greatly enhance our knowledge of antler development,but also have significant impacts on regenerative medicine in general.
Antler;pedicle;deer;stem cells;periosteum;tissue interactions
国家高技术研究发展计划(863)项目(2011AA100603);国家自然科学基金项目(31170950);吉林省重点科技攻关项目(20150204071NY);吉省自然科学基金项目(20140101139JC)
] 李春义,研究员,研究方向:鹿茸生物学、鹿茸活性成分与药效、鹿茸干细胞与组织器官再生;E-mail:lichunyi1959@163.com
10.13313/j.issn.1673-4890.2017.1.006
2016-09-02)
*[
