免疫球蛋白超家族成员CNTN5的研究进展
2017-09-21雷易萌韩芳石玉秀
雷易萌,韩芳,石玉秀
(中国医科大学1. 临床医学七年制;2. 基础医学院组织与胚胎学教研室PTSD研究室,沈阳 110122)
·综述·
免疫球蛋白超家族成员CNTN5的研究进展
雷易萌1,韩芳2,石玉秀2
(中国医科大学1. 临床医学七年制;2. 基础医学院组织与胚胎学教研室PTSD研究室,沈阳 110122)
接触蛋白 5(CNTN5)属免疫球蛋白超家族成员,高度表达于人脑的杏仁核区及枕叶区,在听觉系统的谷氨酸能神经元突触前末端表达丰富。近几年,人们通过动物实验以及免疫荧光实验发现CNTN5的生物学功能以及其与自闭症、阿尔兹海默症、神经性厌食症等精神障碍相关性疾病的联系。另外免疫荧光实验发现,CNTN5在下丘脑中只表达于谷氨酸能神经元,谷氨酸能神经元减少可导致突触的长时程增强,而长时程增强又是创伤后应激障碍(PTSD)的重要机制,这提示CNTN5基因突变是PTSD发生的机制之一。本文总结了CNTN5的研究进展,旨在找到CNTN5的未来研究方向。
接触蛋白5;创伤后应激障碍;自闭症;谷氨酸能神经元;基因突变
接触蛋白(contactin,CNTN)家族属于细胞黏附分子之一——免疫球蛋白(immunoglobulin,Ig)超家族的成员[1]。其结构简单,由 6 个 Ig结构域和 4 个纤连蛋白Ⅲ结构域构成。与其他Ig超家族成员不同,CNTN缺少胞内区及跨膜区,而通过糖基磷脂酰基醇锚定与细胞膜连接[2]。CNTN 成员间结构相似,有40%~60%的相同氨基酸序列[2]。CNTN 包括 6 个成员,CNTN1 与 CNTN2 属于 CNTN 中的典型成员,CNTN3~CNTN6主要存在于感觉神经元。
接触蛋白 CNTN5 作为 CNTN 的成员之一,由CNTN5基因表达,主要存在于听觉神经元[3]。在小鼠和大鼠的CNTN5基因敲除及转基因实验中,发现CNTN5蛋白对突触的形成及成熟起着重要的作用[4]。CNTN5 在传递跨膜信号时,可通过与其在同一细胞膜上的跨膜蛋白结合而发挥作用。研究发现,CNTN5与蛋白酪氨酸磷酸酶受体γ连接成复合体[5],蛋白酪氨酸磷酸酶受体 γ 在细胞的生长、分化及有丝分裂过程中都起到重要作用[6]。也有报道[7]称,CNTN5与接触蛋白相关蛋白4连接成的复合体可稳定脊髓处感觉神经元轴突与轴突间的连接。CNTN5还可与淀粉样前体蛋白 1 相结合发挥作用[8]。本文总结了 CNTN5 已知的基因突变类型、动物实验发现的生物学功能、与精神障碍相关性疾病的关系以及在谷氨酸能神经元的表达这四个方面的最新研究进展。
1 CNTN5已知的基因突变
在染色体 11q21-q22.2 处可见 CNTN5(NB-2)基因[3](图 1)。主要位于染色体 11q22.1 处,有 26 个外显子。RefSeq数据库2011年指出,CNTN5基因存在可变剪接转录,可产生若干具有不同结构与功能的蛋白异构体,这些剪接变异体与某些疾病的病变位点有关[9]。

图1 CNTN5基因位点图Fig.1 Location of CNTN5
目前发现的有关CNTN5的基因突变类型有3种:碱基对的缺失、重复以及单核苷酸变异。在美国国家生物信息技术中心网站上,详细记录了CNTN5的突变位点及临床症状[9]。其中,碱基对缺失引起的基因突变有 8 种。染色体 11q22.1 处不同位点碱基对缺失的患者分别表现为妊娠期糖尿病、主动脉关闭不全、发育迟缓,染色体 11q14.1-22.2 处碱基对缺失的患者表现为脸部畸形、肌张力减退,染色体 11q14.3-22.3 及 11q22.1-22.3 处碱基对缺失的患者表现为发育迟缓。碱基对重复引起的基因突变有 5 种,集中于染色体 11q22.1 处,患者主要表现为胎龄变小、并指畸形、发育迟缓。另外,在染色体 11q22.1 处存在单核苷酸变异,患者表现为先天性巨结肠症。由表1可知,11号染色体上CNTN5基因突变近年受到研究的关注,CNTN5突变后患者发育迟缓为最明显的症状,提示CNTN5基因可能与人的生长发育有关。
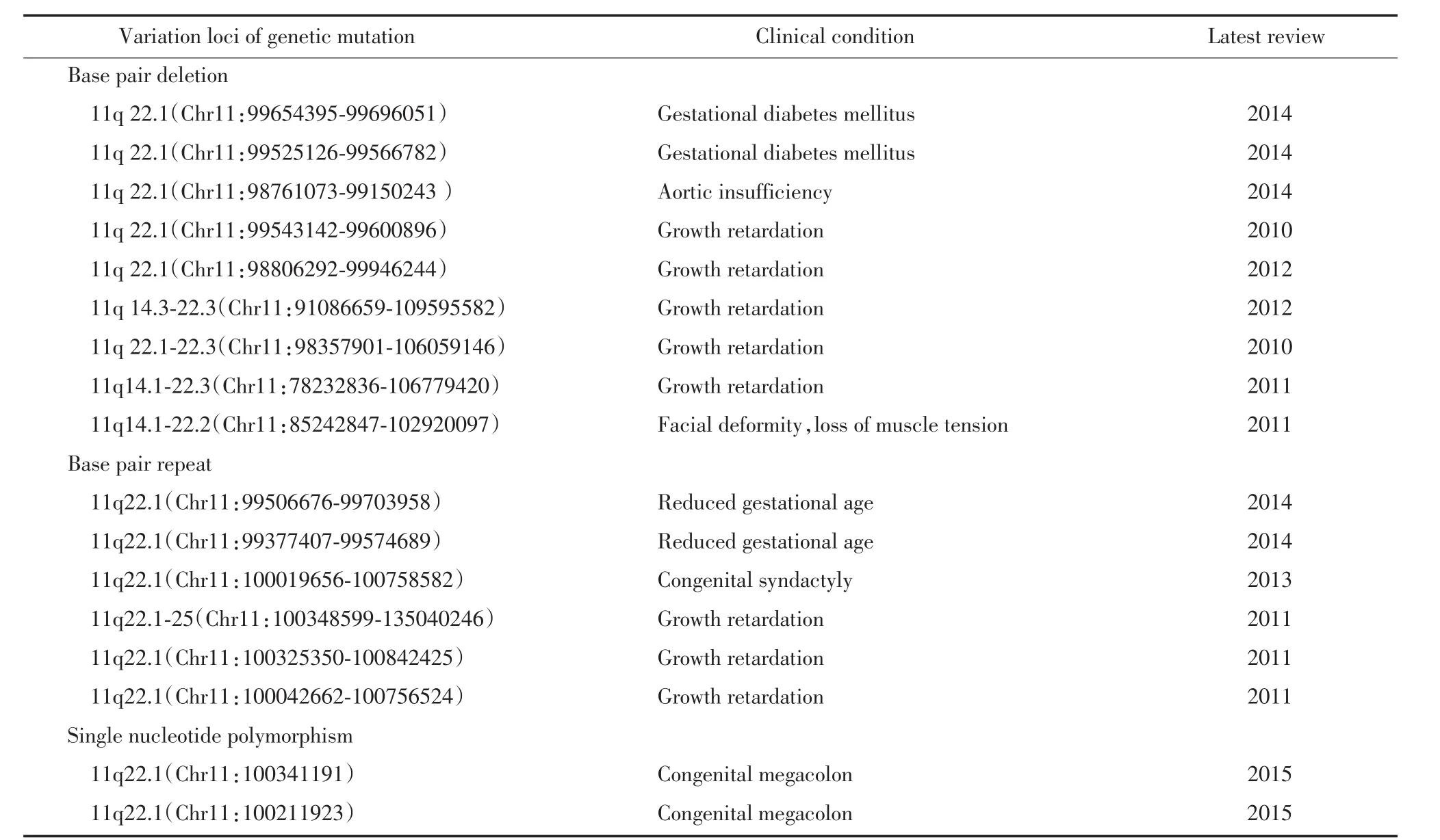
表1 CNTN5已知的基因突变类型、突变位点、患者症状、最新研究年份汇总Tab.1 A summary of genetic mutations,variation loci,patients’symptoms,and the year of the latest review about CNTN5
2 CNTN5的生物学功能
CNTN5基因广泛存在于黑猩猩、恒河猴、狗、小鼠、大鼠、鸡、斑马鱼以及青蛙体内[9],这些动物均可以作为研究CNTN5基因的实验动物,但目前基因敲除及转基因实验多数使用大鼠及小鼠,通过动物实验发现CNTN5的生物学功能。
将 Tau-LacZ基因敲入大鼠 CNTN5基因位点[10],LacZ基因编码 β-半乳糖苷酶,由于 β-半乳糖苷酶化学性质较稳定且染色后呈蓝色,可将β-半乳糖苷酶作为CNTN5基因的标志物。通过免疫组化结果观察到β-半乳糖苷酶在下丘脑的谷氨酸能神经元细胞中有表达。二次标记后发现,β-半乳糖苷酶表达于丘脑—皮层轴突处,信号由丘脑核流动到大脑皮层,在丘脑核及输入接收皮层中也可见β-半乳糖苷酶的表达[10]。感觉冲动便是通过丘脑—皮层特异投射系统,由丘脑传向大脑皮层的特定区域。实验结果提示CNTN5蛋白表达于下丘脑的谷氨酸能神经元内,可能控制丘脑—皮层特异投射系统,影响感觉冲动的传递。另外,研究人员认为CNTN5蛋白可能在胎儿发育时期丘脑束的形成中发挥作用[10]。
使用一些抗CNTN5的单克隆抗体(如3G12)将小鼠的 CNTN5基因功能封闭[11],发现小鼠脑干部位的 突 触 数 量 减 少[10],并 且 其 谷 氨 酸 受 体 发 生 改变[12]。另外,通过 c-Fos免疫组化实验检测 CNTN5基因突变的小鼠,在惊厥测试后,其下丘脑背部及外部皮层的神经元兴奋性明显减弱[13]。另外,在鸡的微阵列分析中发现,CNTN5蛋白在突触形成过程中表达上调[14]。这些实验结果提示 CNTN5 蛋白可促进突触的形成,也可影响应激后下丘脑神经元的兴奋性。
通过 Western blotting 检测小鼠脑中 CNTN5 蛋白的表达情况,发现 CNTN5 从胚胎期 15 d 开始表达[10],且在小鼠出生后不久在其小脑及大脑均可检测到CNTN5的表达。产后第3天CNTN5停止在小脑中的表达,但在大脑中的表达却可以延续到成年阶段[15]。这提示 CNTN5 蛋白对大脑内突触形成及大脑皮层对感觉冲动接收的影响可能持续到人的成年阶段。
3 CNTN5与精神障碍相关性疾病的关系
3.1 CNTN5与自闭症的关系
在CNTN5与精神障碍类疾病关系的研究中,最广泛的是CNTN5基因突变与自闭症发生机制的研究。早期有研究[16]称 CNTN5的基因拷贝数变异与自闭症谱系障碍有关。也有人指出,CNTN基因突变的研究重点都集中在基因拷贝数变异上,而对其他突变机制有所忽略,所以近年研究的重点转为重点基因的关联研究[17]。
有研究[10]称,在感觉形成的传递中(感觉皮质区S1BF、V1、V2)有CNTN5蛋白的表达,而自闭症谱系障碍表现出的异常语言能力、固执的行为模式等症状与人脑中不正常的感觉信息处理相关,由此提示CNTN5基因的缺失影响了感觉信息的传递,从而导致自闭症患者的临床症状。另外也有研究[13]称某些自闭症谱系障碍患者的听觉神经元兴奋性明显降低,而CNTN5基因缺失可导致听觉神经元兴奋性降低。这也提示自闭症谱系障碍患者存在CNTN5基因突变。
VAN DAALEN 等[2]发现,一个自闭症谱系障碍家庭中 3个患病男孩都有CNTN5基因的部分缺失。研究[13]表明,CNTN5基因的部分缺失可引起截短的CNTN5基因转录,也可引起无义介导的mRNA降解机制,导致不产生任何mRNA。这2种情况都将导致CNTN5的单倍剂量不足,从而致病。
CNTN5基因的部分缺失是如何遗传的仍不清楚。有研究[2]发现,CNTN5的父系基因传递缺失是导致自闭症谱系障碍的关键。但在近期的调查中发现,有3个患病男孩是从他们母亲的11号染色体遗传了缺失的基因[16]。这与父系遗传的理论相悖,需要进一步的研究求证。
3.2 CNTN5与阿尔兹海默症的关系
淀粉样前体蛋白是淀粉样蛋白Aβ的前体,而淀粉样蛋白Aβ是阿尔兹海默症老年斑的重要组成成 分[18]。 已 知 CNTN 的 其 他 2 个 成 员 CNTN2 和CNTN4与淀粉样前体蛋白结合发挥作用,而CNTN5与淀粉样前体蛋白 1 结合发挥作用[16]。这里淀粉样前体蛋白与淀粉样前体蛋白1都被认为与突触生长有关。另外,CNTN5与淀粉样前体蛋白1在突触前末端顺式结合,这提示CNTN5可通过影响淀粉样前体蛋白1的二聚化,从而影响淀粉样前体蛋白1的功能[8]。早年有学者称由于淀粉样前体蛋白 1 的改变或者过度生成可影响淀粉样前体蛋白的全部加工过程,淀粉样前体蛋白的异常会打破淀粉样蛋白Aβ的动态平衡,引起淀粉样蛋白Aβ在脑内的过度沉积,导致阿尔兹海默症。另外,研究人员也进行了全基因组关联分析,力求找出与阿尔兹海默症相关的基因[19]。
3.3 CNTN5与其他精神障碍相关性疾病的关系
通过单倍型关联分析发现,染色体11q22及染色体 1q41 上的基因片段与神经性厌食症相关[20]。其中染色体11q22上的基因片段有CNTN5基因的第 8 个和第 9 个内含子。同时 Northern blotting 分析发现,CNTN5 蛋白在人脑及甲状腺处均有表达[20]。也有研究[2]证明,额叶—丘脑系统兴奋性降低后患者出现厌食症状。这提示神经性厌食症患者除心理因素外,可能也受大脑额叶—丘脑系统影响,而CNTN5在人脑的额叶区及丘脑均有表达。这些实验结果提示,CNTN5基因缺失导致大脑额叶—丘脑系统发育受影响,从而诱导神经性厌食症的发生。
研究[3]发现,11 号染色体异常可导致 JACOBSEN综合征。JACOBSEN 综合征是一种罕见疾病,近年多篇研究报道了JACOBSEN综合征。该病患者一般表现为智力缺陷、面部畸形、语言发育延迟等症状[21],有些 JACOBSEN 综合征患儿还有注意力异常、行为缺陷的症状[22]。其中 11 号染色体异常包括家族性11号染色体不平衡易位、环形11号染色体以及 11 号染色体壁部分缺失[23]。同时,11 号染色体上的缺失范围从 7~20 Mb,也可从 11q23.3 一直延续到端粒[23]。而 CNTN5基因刚好在此范围内,这提示了CNTN5基因缺失可能与JACOBSEN 综合征的发生存在关联。
当然,神经性厌食症与 JACOBSEN 综合征和CNTN5基因缺失的关联研究目前还比较少,且不排除多基因关联致病的可能,需要进一步研究求证。
4 CNTN5与谷氨酸能神经元的联系
免疫荧光实验发现,CNTN5蛋白表达于发育中的谷氨酸能神经元,并且在中央听觉神经元的突触前 末 梢 表 达 较 丰 富[24]。 同 时 ,免 疫 荧 光 法 发 现CNTN5蛋白与上橄榄体及耳蜗神经腹侧核处的谷氨酸突触标志物囊泡膜谷氨酸转运体1及囊泡膜谷氨酸转运体 2 共定位[24],这说明 CNTN5 蛋白与囊泡膜谷氨酸转运体1及囊泡膜谷氨酸转运体2存在相互作用。同时,研究发现囊泡膜谷氨酸转运体2存在于未成熟的谷氨酸突触,随着听觉系统的发育,谷氨酸突触发育成熟,囊泡膜谷氨酸转运体2也转变为囊泡膜谷氨酸转运体 1[24]。已知当兴奋性神经递质谷氨酸被释放到突触间隙后,囊泡膜谷氨酸转运体能从胞外向胞内摄取谷氨酸,以保护神经元不受谷氨酸的毒性影响。囊泡膜谷氨酸转运体在谷氨酸突触的形成及保护中起重要作用。
原位杂交及免疫组化实验发现,在听觉系统发育的后期,CNTN5在脑干处谷氨酸突触的成熟过程中也起到了重要的作用[13]。另外,在 CNTN5基因敲除的小鼠体内发现谷氨酸能神经元减少[14]。这些研究都表明,CNTN5蛋白的存在有利于谷氨酸突触的形成、发育及保护,可使谷氨酸在神经元正常分泌与摄入。
假设当CNTN5基因突变后囊泡膜谷氨酸转运体可能受影响,谷氨酸能神经元也可能减少,从而导致应激后的谷氨酸不能被摄入到胞内而停留在突触间隙中。过多的谷氨酸可激活N-甲基-D-天冬氨酸受体,导致钙离子内流,触发一系列细胞内信号通路,最终引起 α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(AMPA受体)磷酸化,从而产生突触的长时程增强[2]。已知长时程增强是创伤后应激障碍(post-traumatic stress disorder,PTSD)发生的重要机制,发生在杏仁核区的长时程增强会增强恐惧记忆,这可能是PTSD患者闯入性恐惧记忆症状发生的机制之一(图2)。
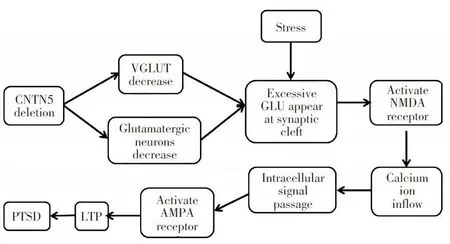
图2 设想CNTN5缺失引起PTSD机制图Fig.2 Potential mechanism of PTSD caused by deletion of CNTN5
综上所述,CNTN5蛋白在突触发育方面是一种较新的研究方向。它高度表达于人脑的杏仁核区及枕叶区,并主要存在于听觉神经元,对突触的形成、发育和保护起到重要作用。已知的CNTN5基因突变及小鼠的基因敲除及转基因实验方法为进一步研究CNTN5蛋白提供了方法和具体方向。笔者认为,未来研究应重点关注CNTN5基因突变与自闭症谱系障碍、阿尔兹海默症等精神障碍相关性疾病的关系,同时可着眼于疾病的多基因关联。另外,根据如上设想(图 2),CNTN5基因突变能否引起PTSD患者的恐惧性记忆增强这一问题尤为突出,未来可设计实验重点研究。
[1]SHIMODA Y,WATANABE K.Contactins emerging key roles in the development and function of the nervous system[J].Cell Adh Migr,2009,3(1):64-70.DOI:10.4161/cam.3.1.7764.
[2]ZUKO A,BOUYAIN S,VAN DER ZWAAG B,et al.Contactins:structural aspects in relation to developmental functions in brain disease[J].Adv Protein Chem Struct Biol,2011,84:143-180. DOI:10.1016/B978-0-12-386483-3.00001-X.
[3]KAMEI Y,TAKEDA Y,TERAMOTO K,et al.Human NB-2 of the contactin subgroup molecules chromosomal localization of the gene(CNTN5)and distinct expression pattern from other subgroup members[J].Genomics,2000,69(1):113-119.DOI:10.1006/geno.2000.6310.
[4]LI H,TAKEDA Y,NIKI H,et al.Aberrant responses to acoustic stimuli in mice deficient for neural recognition molecule NB-2[J]. Eur J Neurosci,2003,17(5):929-936.DOI:10.1046/j.1460-9568. 2003.02514.x.
[5]BOUYAIN S,WATKINS DJ.The protein tyrosine phosphatases PTPRZ and PTPRG bind to distinct members of the contactin family of neural recognition molecules[J].Proc Natl Acad Sci USA,2010,107(6):2443-2448.DOI:10.1073/pnas.0911235107.
[6]LAFORGIA S,MORSE B,LEVY J,et al.Receptor protein-tyrosine phosphatase gamma is a candidate tumor suppressor gene at human chromosome region 3p21[J].Proc Natl Acad Sci USA,1991,88(11):5036-5040.DOI:10.1073/pnas.88.11.5036.
[7]MERCATI O,DANCKAERT A,ANDRÉ-LEROUX G,et al.Contactin 4,-5 and-6 differentially regulate neuritogenesis while they display identical PTPRG binding sites[J].Biol Open,2013,2(3):163-324.DOI:10.1242/bio.20133343.
[8]SHIMODA Y,KOSEKI F,ITOH M,et al.A cis-complex of NB-2/ contactin-5 with amyloid precursor-like protein 1 is localized on the presynaptic membrane[J].Neurosci Lett,2012,510(2):148-153. DOI:10.1016/j.neulet.2012.01.026.
[9]SAUS E,BRUNET A,ARMENGOL L,et al.Comprehensive copy number variant(CNV)analysis of neuronal pathways genes in psychiatric disorders identifies rare variants within patients[J].J Psychiatr Res,2010,44(14):971-978.DOI:10.1016/j.jpsychires.2010. 03.007.
[10]KLEIJER KT,ZUKO A,SHIMODA Y,et al.Contactin-5 expression during development and wiring of the thalamocortical system[J].Neuroscience,2015,310:106-113.DOI:10.1016/j.neuroscience.2015.09.039.
[11]TOYOSHIMA M,SAKURAI K,SHIMAZAKI K,et al.Preferential localization of neural cell recognition molecule NB-2 in developing glutamatergic neurons in the rat auditory brainstem [J].J Comp Neurol,2009,513(4):349-362.DOI:10.1002/cne.21972.
[12]ZUKO A,OGURO-ANDO A,KLEIJER E,et al.Interaction of the autism gene product contactin-6 with synaptic proteins[J].Eur Neuropsychopharmacol,2014,24(Suppl 1):S21-S22.
[13]POOT M.Towards identification of individual etiologies by resolving genomic and biological conundrums in patients with autism spectrum disorders[J].Mol Syndromol,2013,4(5):213-226. DOI:10.1159/000350041.
[14]BRUSES JL.Identi fi cation of gene transcripts expressed by postsynaptic neurons during synapse formation encoding cell surface proteins with presumptive synaptogenic activity [J].Synapse,2010,64(1):47-60.DOI:10.1002/syn.20702.
[15]MOHEBIANY AN,HARROCH S,BOUYAIN S.New insights into the roles of the contactin cell adhesion molecules in neural development[J].Adv Neurobiol,2014,8:165-194.
[16]ZUKO A,KLEIJER KT,OGURO-ANDO A,et al.Contactins in the neurobiology of autism[J].Eur J Pharmacol,2013,719(1/3):63-74.DOI:10.1016/j.ejphar.2013.07.016.
[17]POOT M.A candidate gene association study further corroborates involvement of contactin genes in autism [J].Mol Syndromol,2014,5(5):229-235.DOI:10.1159/000362891.
[18]MAREI HE,ALTHANI A,SUHONEN J,et al.Common and rare genetic variants associated with Alzheimer’s disease[J].J Cell Physiol,2016,231(7):1432-1437.DOI:10.1002/jcp.25225.
[19]GUERREIRO R,HARDY J.Genetics of Alzheimer’s disease[J]. Neurotherapeutics,2014,11(4):732-737.DOI:10.1007/s13311-014-0295-9.
[20]NAKABAYASHI K,KOMAKI G,TAJIMA A,et al.Identification of novel candidate loci for anorexia nervosa at 1q41 and 11q22 in Japanese by a genome-wide association analysis with microsatellite markers[J].J Hum Genet,2009,54(9):531-537.DOI:10.1038/ jhg.2009.74.
[21]KRASNER A,WALLACE L,THIAGALINGAM A,et al.Cloning and chromosomal localization of the human BARX2 homeobox protein gene[J].Gene,2000,250(1/2):171-180.DOI:10.1016/ S0378-1119(00)00169-4.
[22]BOHM D,HOFFMANN K,LACCONE F,et al.Association of Jacobsen syndrome and bipolar affective disorder in a patient with a de novo 11q terminal deletion[J].Am J Med Genet A,2006,140A(4):378-382.DOI:10.1002/ajmg.a.31088.
[23]GALVÃO GOMES A,PAIVA GRANGEIRO CH,SILVA LR,et al. Complex mosaic ring chromosome 11 associated with hemizygous loss of 8.6 Mb of 11q24.2qter in atypical Jacobsen syndrome[J]. Mol Syndromol,2017,8(1):45-49.DOI:10.1159/000452681.
[24]TOYOSHIMA M,SAKURAI K,SHIMAZAKI K,et al.Preferential localization of neural cell recognition molecule NB-2 in developing glutamatergic neurons in the rat auditory brainstem[J].J Comp Neurol,2009,513(4):349-362.DOI:10.1002/cne.21972.
(编辑 陈 姜)
Progress in Research on CNTN5,a Member of the Immunoglobulin Superfamily
LEI Yimeng1,HAN Fang2,SHI Yuxiu2
(1.Seven-year Clinical Medicine,China Medical University,Shenyang 110122,China;2.PTSD Research Laboratory,Department of Histology and Embryology,College of Basic Medical Science,China Medical University,Shenyang 110122,China)
Contactin 5(CNTN5)belongs to a subgroup of the immunoglobulin superfamily.It is highly expressed in the amygdala and occipital lobe of the human brain as well as in the presynaptic terminal of glutamatergic neurons in the auditory system.In recent years,researchers have used animal experiments to identify the biological functions of CNTN5.They have also investigated the relationship between CNTN5 and mental disorders including autism,Alzheimer's disease,and anorexia nervosa among others.Furthermore,immunofluorescence assays have shown that CNTN5 is expressed in glutamatergic neurons in the hypothalamus.A reduction in the number of glutamatergic neurons can cause the long-term potentiation of synapses.Long-term potentiation is an important mechanism in post-traumatic stress disorder(PTSD).It suggests that mutation of CNTN5may be one of the mechanisms underlying PTSD.We reviewed the research concerning CNTN5 to identify future research directions.
contactin 5;post-traumatic stress disorder;autism;glutamatergic neurons;gene mutation
R329.4
A
0258-4646(2017)09-0848-05
http://kns.cnki.net/kcms/detail/21.1227.R.20170906.1318.036.html
10.12007/j.issn.0258-4646.2017.09.018
国家自然科学基金(81571324);沈阳市科学技术计划(F16-205-1-35,F16-205-1-53)
雷易萌(1995-),女,本科在读.
石玉秀,E-mail:shiyuxiu@163.com
2016-11-21
网络出版时间:2017-09-06 13:18
