氧杂三螺环化合物的简便合成
2017-09-16李正义沈银凯朱美兰孙小强
李正义, 沈银凯, 朱美兰, 殷 乐, 孙小强*
(1. 常州大学 石油化工学院,江苏 常州 213164; 2. 常州四药制药有限公司,江苏 常州 213004)
·快递论文·
氧杂三螺环化合物的简便合成
李正义1, 沈银凯1, 朱美兰2, 殷 乐1, 孙小强1*
(1. 常州大学 石油化工学院,江苏 常州 213164; 2. 常州四药制药有限公司,江苏 常州 213004)
以环酮和季戊四醇为原料,磷钨酸为催化剂,在甲苯中回流分水反应合成了系列氧杂三螺环化合物(3a~3h),其中5,9,14,17-四氧杂三螺[3.2.2.310.27.24]十七烷(3a)和7,11,18,21-四氧杂-3,15-二硫杂三螺[5.2.2.512.29.26]二十一烷(3f)为新化合物,其结构经1H NMR,13C NMR和HR-MS(ESI)表征。并以3c的合成为模板反应,对反应条件进行了优化。
环酮; 季戊四醇; 磷钨酸; 催化; 氧杂三螺环; 合成
多螺环化合物是一种由两个或更多个螺原子连接三个或更多个环组成的有机化合物。由于复杂的构象以及独特的刚性结构,使得这类化合物在光学材料、医药、农药等领域起着重要的作用[1-5],因此,设计并合成结构多样的多螺环化合物一直是有机合成领域的热点[6-8]。尤其是杂原子(N, O, S)掺杂的多螺环化合物,杂原子上的孤对电子和强的电负性使其表现出更多新的结构特点和性能[9-11]。其中氧杂多螺环化合物的合成大多较为困难,尽管已有文献报道利用季戊四醇与环酮双缩脱水环化为氧杂三螺环化合物的合成提供了一条简便途径,但仍存在诸多弊端且缺乏系统性研究。如该反应需要以可膨胀石墨[12]、纤维素硫酸[13]作催化剂或在SO3H-功能化离子液体IL [PsPy] [OTf][14]中进行,因此存在着催化剂制备复杂、成本相对偏高、后处理繁琐等缺点。Peng等[15]在微波照射下,利用磷钨酸在乙腈中催化合成了6,10,16,19-四氧杂三螺[4.2.2.411.28.25]十九烷和7,11,18,21-四氧杂三螺[5.2.2.512.29.26]二十一烷,但微波反应对设备要求较高,不易工业化生产,因此开发一种经济、简便、易于工业化的氧杂多螺环化合物合成方法具有重要的意义。
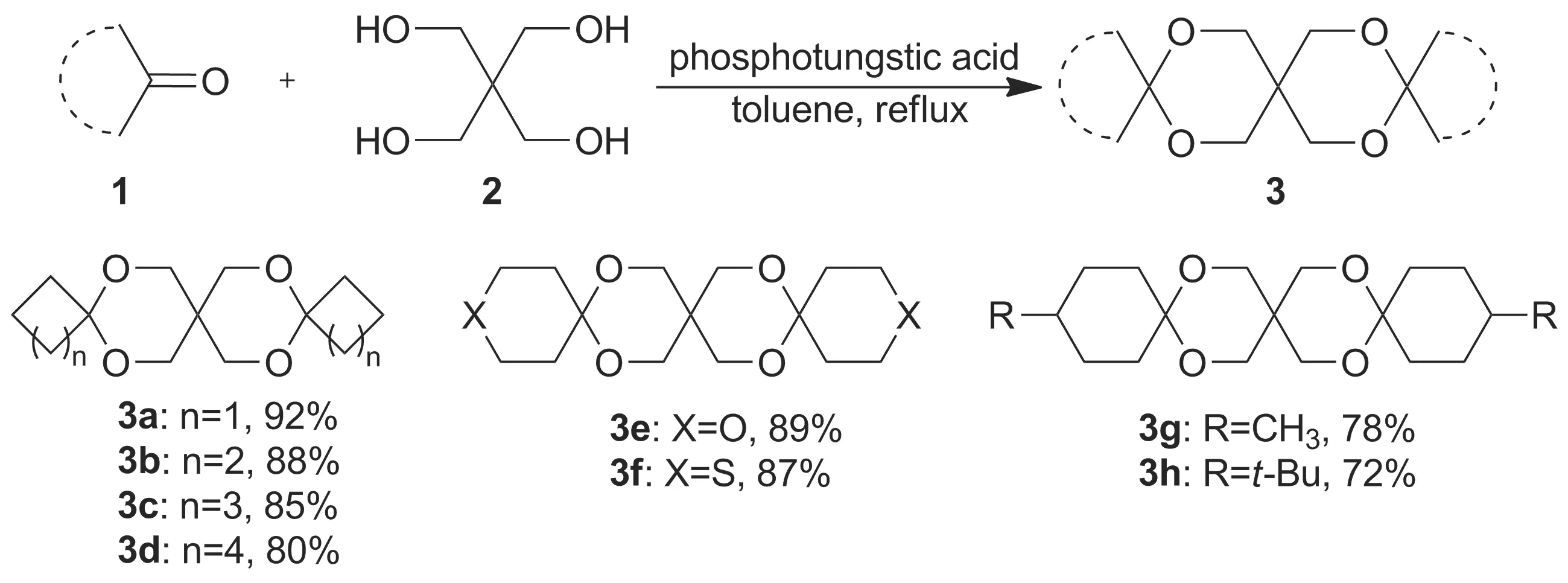
Scheme1
本文以环酮和季戊四醇(2)为原料,甲苯为带水剂,在磷钨酸催化下合成了8个氧杂三螺环化合物(3a~3h, Scheme 1),其中5,9,14,17-四氧杂三螺[3.2.2.310.27.24]十七烷(3a)和7,11,18,21-四氧杂-3,15-二硫杂三螺[5.2.2.512.29.26]二十一烷(3f)为新化合物,其结构经1H NMR,13C NMR和HR-MS(ESI)表征。并以3c的合成为模板反应,对反应条件进行了优化。该合成方法一步高效构建了氧杂三螺环骨架,为该类多螺环化合物的合成提供了一种简便的途径。
1 实验部分
1.1 仪器与试剂
SGW X-4型显微熔点仪(温度未校正);AVANCE 300 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Agllent 6540型质谱仪。
柱层析用硅胶,青岛海洋化工有限公司;所用试剂均为分析纯。
1.23a~3h的合成(以3c的合成为例)
在带有回流装置的三口瓶中依次加入环己酮1.47 g(15 mmol),21.02 g(7.5 mmol),甲苯20 mL和催化量的磷钨酸(2wt%),分水器分水,搅拌下回流反应3 h。冷却至室温,过滤,滤液减压浓缩后经硅胶柱层析[洗脱剂:A=V(乙酸乙酯)/V(石油醚)=1/10]纯化得3c1.89 g。
用类似方法合成3a,3b,3d~3h。
5,9,14,17-四氧杂三螺[3.2.2.310.27.24]十七烷(3a): 白色固体,收率92%, m.p.128~130 ℃;1H NMR(300 MHz, CDCl3)δ: 3.66(s, 8H, CH2), 2.23(t,J=8.1 Hz, 8H, CH2), 1.79~1.68(m, 4H, CH2);13C NMR(75 MHz, CDCl3)δ: 101.9, 64.6, 32.2, 11.6; HR-MS(ESI)m/z: Calcd for C13H21O4{[M+H]+}241.144 0, found 241.144 2。
6,10,16,19-四氧杂三螺[4.2.2.411.28.25]十九烷(3b): 白色固体,收率88%, m.p.135~136 ℃(137 ℃[16]);1H NMR(300 MHz, CDCl3)δ: 3.72(s, 8H, CH2), 1.86(t,J=7.2 Hz, 8H, CH2), 1.68~1.63(m, 8H, CH2);13C NMR(75 MHz, CDCl3)δ: 110.7, 65.4, 34.8, 32.4, 23.5。
7,11,18,21-四氧杂三螺[5.2.2.512.29.26]二十一烷(3c): 白色固体,收率85%, m.p.114~115 ℃(114 ℃~115 ℃[17]);1H NMR(300 MHz, CDCl3)δ: 3.73(s, 8H, CH2), 1.73(t,J=6.3 Hz, 8H, CH2), 1.55~1.47(m, 8H, CH2), 1.43~1.37(m, 4H, CH2);13C NMR(75 MHz, CDCl3)δ: 110.7, 65.4, 34.8, 32.4, 23.5。
8,12,20,23-四氧杂三螺[6.2.2.613.210.27]二十三烷(3d): 白色固体,收率80%, m.p.116~117 ℃(116~118 ℃[18]);1H NMR(300 MHz, CDCl3)δ: 3.69(s, 8H, CH2), 1.88(t,J=5.7 Hz, 8H, CH2), 1.54~1.49(m, 16H, CH2);13C NMR(75 MHz, CDCl3)δ: 102.9, 63.6, 35.5, 33.0, 29.3, 21.7。
3,7,11,15,18,21-六氧杂三螺[5.2.2.512.29.26]二十一烷(3e): 白色固体,收率89%, m.p.182~184 ℃(185~186 ℃[19]);1H NMR(300 MHz, CDCl3)δ: 3.76(s, 8H, CH2), 3.70(t,J=5.7 Hz, 8H, CH2), 1.88(t,J=5.4 Hz, 8H, CH2);13C NMR(75 MHz, CDCl3)δ: 96.3, 64.6, 63.2, 33.4, 33.0。
7,11,18,21-四氧杂-3,15-二硫杂三螺[5.2.2.512.29.26]二十一烷(3f): 白色固体,收率87%, m.p.128~130 ℃;1H NMR(300 MHz, CDCl3)δ: 3.72(s, 8H, CH2), 2.66(t,J=5.7 Hz, 8H, CH2), 2.06(t,J=5.7 Hz, 8H, CH2);13C NMR(75 MHz, CDCl3)δ: 95.9, 61.9, 33.0, 31.9, 24.3; HR-MS(ESI)m/z: Calcd for C15H25O4S2{[M+H]+}333.119 4, found 333.118 7。
3,15-二甲基-7,11,18,21-四氧杂三螺[5.2.2.512.29.26]二十一烷(3g): 白色固体,收率78%, m.p.90~91 ℃(88~89 ℃[20]);1H NMR(300 MHz, CDCl3)δ: 3.76(s, 4H, CH2), 3.70(s, 4H, CH2), 2.18~2.14(m, 4H, CH2), 1.57~1.53(m, 4H, CH2), 1.44~1.16(m, 8H, CH2), 1.12~1.07(m, 2H, CH), 0.90(d,J=6.3 Hz, 6H, CH3);13C NMR(75 MHz, CDCl3)δ: 98.6, 63.5, 63.3, 32.8, 31.9, 31.8, 30.7, 21.7。
3,15-二叔丁基-7,11,18,21-四氧杂三螺[5.2.2.512.29.26]二十一烷(3h): 白色固体,收率72%, m.p.184~185 ℃(182~183 ℃[21]);1H NMR(300 MHz, CDCl3)δ: 3.75(s, 4H, CH2), 3.70(s, 4H, CH2), 2.27~2.23(m, 4H, CH2), 1.64~1.60(m, 4H, CH2), 1.31~1.12(m, 8H, CH2), 1.05~0.98(m, 2H, CH), 0.85(s, 18H, CH3);13C NMR(75 MHz, CDCl3)δ: 98.5, 63.6, 63.3, 47.6, 32.9, 32.5, 32.3, 27.7, 23.3。
2 结果与讨论
2.1 反应条件优化
以环己酮(1c)与2的反应为模型,分别考察催化剂和带水剂种类、催化剂用量以及醇酮配比对3c收率的影响。
(1) 催化剂
1c(15 mmol),反应时间3 h,其余反应条件同1.2,考察催化剂对3c收率的影响,结果见表1。以四氯化锡为代表的路易斯酸催化效果较差(36%),其它质子酸具有相对较好的催化效果(68~85%),其中磷钨酸为催化剂时3c收率最高(85%),因此选择磷钨酸作为催化剂。

表1 催化剂对3c收率的影响
(2) 催化剂用量
1c(15 mmol),以磷钨酸为催化剂,其余反应条件同1.2,考察催化剂用量对3c收率的影响,结果见表2。随着磷钨酸的增加,产物收率相应提高,当催化剂增加到2.5wt%时,达到最佳状态(86%),继续添加磷钨酸的量,催化效率不再提高。由于2wt%用量时3c收率已达到85%,因此,从经济的角度出发,磷钨酸的用量以2wt%为宜。
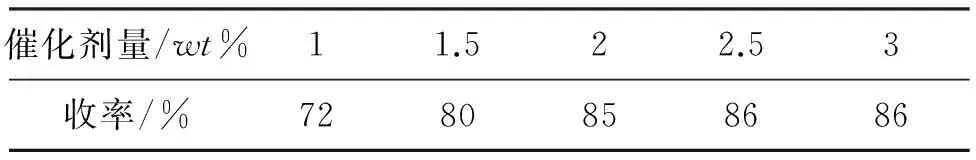
表2 催化剂用量对3c收率的影响
(3) 带水剂
1c(15 mmol),以2wt%磷钨酸为催化剂,其余反应条件同1.2,考察带水剂对3c收率的影响,结果见表3。由于环己酮的反应活性较低,以环己烷为带水剂时,回流温度较低,脱水效果不理想(68%);以甲苯为带水剂时,回流温度升高,脱水效果较好(85%);继续升高回流温度,以氯苯或二甲苯为带水剂时,3c收率反而下降(70~71%),可能是由于温度过高时环己酮易随带水剂一同逸出所致。因此,选择甲苯为带水剂。

表3 带水剂对3c收率的影响Table 3 Effect of solvent on the yield of 3c
(4) 醇酮配比
2(7.5 mmol),以2wt%磷钨酸为催化剂,甲苯为带水剂,其余反应条件同1.2,考察醇酮配比对3c收率的影响,结果见表4。随着环己酮用量的增加,产品收率也相应提高,当醇酮物质的量比为1 ∶2时,收率达到最高(85%),进一步增加环己酮的用量,收率逐渐下降,并且副反应增多。因此,醇酮物质的量比以1 ∶2为宜。
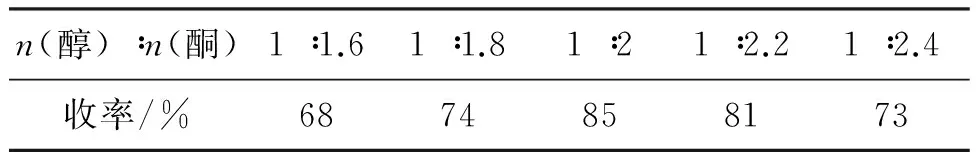
表4 醇酮物质的量比对3c收率的影响
2.2 底物拓展
以2wt%磷钨酸为催化剂,甲苯为带水剂,醇酮物质的量比为1 ∶2,进行底物拓展,实验结果见Scheme 1。结果表明,该方法具有良好的底物适应性(72%~92%),且环酮大小、掺杂原子和环上取代基的电子效应对反应具有一定的影响。环酮越小,反应活性越高(3a>3b>3c>3d);掺杂原子的电负性越强,对应的环酮反应活性越高(3e>3f);环上取代基供电子能力越强,反应活性越低(3g>3h)。
以环酮和季戊四醇为原料,甲苯为带水剂,在磷钨酸催化下一步高效构建了氧杂三螺环骨架,合成了系列氧杂三螺环化合物3a~3h,其中2个为新化合物。对反应条件进行了优化,最佳反应条件为:以2wt%磷钨酸为催化剂,甲苯为带水剂,醇酮物质的量比为1 ∶2。该合成方法具有较好的底物适应性(72~92%),环酮大小、掺杂原子和环上取代基的电子效应对反应具有一定的影响。
[1] Feuerbacher N, Voegtle F, Windscheidt J,etal. Synthesis of rodlike dispiro hydrocarbon skeletons for new liquid crystal compounds[J].Synthesis,1999,(1):117-120.
[2] De Meijere A, Kozhushkjov S I. The chemistry of highly strained oligospirocyclopropane systems[J].Chem Rev,2000,100(1):93-142.
[3] Allen W D, Quanz H, Schreiner P R. Polytriangulane[J].J Chem Theory Comput,2016,12(9):4707-4716.
[4] Novak I.Strain in [n]triangulanes[J].Tetrahedron Lett,2010,51(21):2920-2923.
[5] Cismas C,Terec A,Mager S,etal. Six-membered ring spiranes:Carbocycles and heterocycles with oxygen[J].Curr Org Chem,2005,9(14):1287-1314.
[6] Zinzalla G, Milroy L G, Ley S V. Chemical variation of natural product-like scaffolds:Design and synthesis of spiroketal derivatives[J].Org Biomol Chem,2006,4(10):1977-2002.
[7] Perron F, Albizati K F. Chemistry of spiroketals[J].Chem Rev,1989,89(7):1617-1661.
[8] Aho J E, Pihko P M, Rissa T K. Nonanomeric spiroketals in natural products:Structures,sources,and synthetic strategies[J].Chem Rev,2005,105(12):4406-4440.
[10] Burns N Z, Jacobsen E N. Catalysis in tight spaces[J].Nature,2012,483(7389):278-279.
[11] Haniotakis G, Francke W, Mori K,etal. Sex-specific activity of (R)-(-)- and (S)-(+)-1,7-dioxaspiro[5.5]undecane,the major pheromone of dacus oleae[J].J Chem Ecol,1986,12(6):1559-1568.
[12] Jin T S, Li T S, Zhang Z H,etal. Synthesis of diacetals by condensation of carbonyl compounds with bis(hydroxymethyl)-1,3-propanediol catalysed by expansive graphite[J].Synth Commun,1999,29(9):1601-1606.
[13] Reza S H, Fatemeh R. Acetalization of carbonyl compounds as pentaerythritol diacetals and diketals in the presence of cellulose sulfuric acid as an efficient, biodegradable and reusable catalyst[J].Chin J Chem,2012,30(3):695-698.
[14] Wang Y Y, Gong X X, Wang Z Z,etal. SO3H-functionalized ionic liquids as efficient and recyclable catalysts for the synthesis of pentaerythritol diacetals and diketals[J].J Mol Catal A-Chem,2010,322(1-2):7-16.
[15] Peng Y Q, Song G H, Qian X H. Microwave-assisted acetalization of pentaerythritol catalyzed by 12-tungstophosphoric acid[J].Synth Commun,2001,31(24):3735-3738.
[16] Kannan V, Speekumar K, Gil A,etal. Acetalation of pentaerithritol catalyzed by an Al-pillared saponite[J].Catal Lett,2011,141(8):1118-1122.
[17] Wang Y Y, Xu Y N, Wang Z Z,etal. A new approach to the synthesis of pentaerythritol diacetals (diketals) catalyzed by SO3H-functionalized ionic liquids[J].Chin Chem Lett,2010,21(5):524-528.
[18] Shaterian H R, Azizi K, Fahimi N. Protection of carbonyl compounds as diacetals using P2O5/SiO2and P2O5/Al2O3as catalysts[J].Chem Sci Trans,2012,1(1):85-90.
[19] 李正义,殷乐,葛琳,等. 季戊四醇双缩脂肪族醛(酮)螺环化合物的合成[J].合成化学,2014,22(5):672-675.
[20] Grosu I, Mager S, Ple G. Conformational analysis of some spiro and polyspiro 1,3-dioxane compounds with axial and helical chirality[J].J Chem Soc,1995,(7):1351-1357.
[21] Jermy B R, Pandurangan A. Efficient synthesis of diacetal of pentaerythritol under microwave irradiation using heteropoly acid H3PW12O40[J].Catal Commun,2006,7(12):921-925.
The Convenient Synthesis of Oxatrispirocyclic Compounds
LI Zheng-yi1, SHEN Yin-kai1, ZHU Mei-lan2, YIN Yue1, SUN Xiao-qiang1*
(1. School of Petrochemical Engineering, Changzhou University, Changzhou 213164, China;2. Changzhou Siyao Pharmaceuticals Co., Ltd., Changzhou 213004, China)
A series of oxatrispiro derivatives(3a~3h) were prepared by reflux of pentaerythritol with cyclic ketones in toluene using phosphotungstic acid as the catalyst. Among them, 5,9,14,17-tetraoxatrispiro [3.2.2.310.27.24]heptadecane(3a) and 7,11,18,21-tetraoxa-3,15-dithiatrispiro [5.2.2.512.29.26]henicosane(3f) were new compounds. The structures were characterized by1H NMR,13C NMR and HR-MS(ESI). The reaction conditions were optimized using synthesis of3cas the template reaction.
cyclic ketone; pentaerythritol; phosphotungstic acid; catalysis; oxatrispirocycle; synthesis
2017-03-06;
: 2017-07-19
国家自然科学基金资助项目(21572026); 江苏省高校自然科学研究重大项目(14KJA150002); 江苏省先进催化与绿色制造协同创新中心资助项目(ACGM2016-06-05)。
李正义(1979-),男,汉族,江苏扬州人,博士,主要从事有机合成及催化的研究。 E-mail: zyli@cczu.edu.cn
孙小强,教授, E-mail: sunxiaoqiang@yahoo.com
O624.42; O621.3
: ADOI: 10.15952/j.cnki.cjsc.1005-1511.2017.09.17049
