纳米二氧化钛催化二苯并1,10-菲咯啉衍生物的合成研究
2017-09-16许世虹王坚强楼庆童罗书平吴庆安
许世虹, 陈 浩, 王坚强, 楼庆童, 罗书平, 吴庆安*
(1. 浙江工业大学 绿色合成技术国家重点实验室培育基地,浙江 杭州 310014; 2. 浙江华义医药有限公司, 浙江 义乌 322000)
·研究论文·
纳米二氧化钛催化二苯并1,10-菲咯啉衍生物的合成研究
许世虹1, 陈 浩1, 王坚强2, 楼庆童2, 罗书平1, 吴庆安1*
(1. 浙江工业大学 绿色合成技术国家重点实验室培育基地,浙江 杭州 310014; 2. 浙江华义医药有限公司, 浙江 义乌 322000)
首次报道了纳米TiO2催化1,2-环己二酮与2-氨基苯甲酰衍生物的串联Friedlander反应,合成了9个二苯并1,10-菲咯啉的衍生物(3a~3i),其中3b,3c,3e~3g和3i为新化合物,其结构经1H NMR,13C NMR和HR-MS(ESI)表征。以6,7-二氢-5,8-二苯基苯并[1,10]菲咯啉(3a)的合成为例,对反应条件进行了优化。最佳反应条件为:锐钛型纳米二氧化钛用量为0.2 eq.,1a与2投料比为2.1 ∶1,乙腈为溶剂,于80 ℃反应7 h,收率83%。并对反应机理进行了探讨。
1,2-环己二酮; 2-氨基苯甲酰衍生物; 纳米TiO2; 催化; Friedlander反应; 1,10-菲咯啉; 合成
1,10-菲咯啉及其衍生物是典型的二齿氮配体,它是由三个六元芳香环组成的共轭体系,其中两个电子云密度较高的氮原子正好位于菲咯啉的1,10-位,使其能与金属形成稳定的五元螯合环[1]。

Scheme1
因此其可以与各种金属形成丰富多彩的配合物,可广泛用于催化反应[2]、金属检测[3]、荧光探针[4]、光解水制氢[5]等领域。
Friedlander反应不仅可以合成喹啉类衍生物,还是1,10-菲咯啉衍生物的重要合成方法。传统的Friedlander缩合的催化剂是Bronsted强酸(如盐酸、硫酸)[6-7],Lewis酸[8-10](如FeCl3)以及强碱[11-14](如甲醇钠、乙醇钠)等。这些传统的催化体系具有收率低、反应条件苛刻、毒副作用、反应时间较长及后处理麻烦等缺点,而且催化剂难以重复利用。为了解决上述问题,近年来,研究人员致力于寻找可回收再利用的绿色催化剂用于Friedlander缩合反应。催化剂如纳米氧化镍[15]、纳米氧化铝[16]、磁铁矿负载磺酸[17]及磷钨酸[18]等相继被报道。2014年kaushik课题组报道了纳米TiO2作为Friedlander反应的非均相催化剂[19],有效地催化合成了一系列喹啉衍生物。
本文在课题组前期工作基础上[20],以取代2-氨基苯甲醛衍生物(1a~1i)与1,2-环己二酮(2)为原料,在纳米二氧化钛催化下经一锅法反应合成了9个苯并1,10-菲咯啉衍生物,其中3b,3c,3e~3g和3i为新化合物,其结构经1H NMR,13C NMR和HR-MS表征。并对反应条件进行了优化,对反应机理进行了探讨。该合成方法具有反应条件温和、操作简便且催化剂可重复利用等优点。
1 实验部分
1.1 仪器与试剂
SGW X-4型显微熔点仪(温度未校正);Bruker Advance III 500MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);LCQ advantage型质谱仪;Agilent 6210 G1969A TOF LC/MS型液质联用仪;岛津20AT型高效液相色谱仪[流动相:甲醇/水(1%乙酸),柱温为25 ℃,色谱柱:CAPCELL PAK C18(5 μm, 4.6×250 mm),流速:1 mL·min-1,检测波长:254 nm]。
1a~1i和2(纯度>98%),锐钛型纳米二氧化钛(25 nm), 99.8%,阿拉丁试剂化学品有限公司;其余试剂均为分析纯。
1.2 合成
(1)3a~3i的合成(以3a为例)
在反应管中依次加入1a0.414 g(2.1 mmol),20.112 g(1 mmol),锐钛型纳米TiO20.016 g(0.2 mmol)和乙腈3 mL,搅拌下于80 ℃反应7 h。冷却至室温,减压浓缩,残余物经硅胶柱层析[洗脱剂:V(乙酸乙酯) ∶V(石油醚)=1 ∶3]纯化得3a0.360 g。
用类似方法合成3b~3i。
5,8-二苯基-6,7-二氢苯并[1,10]菲咯啉(3a): 无色晶体,收率83%, m.p.>300 ℃;1H NMRδ: 8.54(d,J=8.4 Hz, 2H, ArH), 7.75~7.70(m, 2H, ArH), 7.55~7.44(m, 10H, ArH), 7.36~7.31(m, 4H, ArH), 2.85(s, 4H, CH2);13C NMRδ: 147.91, 146.15, 146.13, 136.67, 131.26, 130.25, 129.57, 128.70, 128.62, 128.12, 127.81, 127.10, 125.88, 26.31。表征数据与文献[21]报道一致。
6,7-二氢-5,8-二苯基-3,10-二溴苯并[1,10]菲咯啉(3b): 白色固体,收率72%, m.p.>300 ℃;1H NMRδ: 8.37(d,J=9.0 Hz, 2H, ArH), 7.82~7.75(m, 2H, ArH), 7.62(d,J=2.2 Hz, 2H, ArH), 7.58~7.48(m, 6H, ArH), 7.31~7.27(m, 4H, ArH), 2.82(s, 4H, CH2);13C NMRδ: 152.47, 144.67, 140.95, 136.68, 133.24, 131.15, 130.15, 129.94, 129.44, 129.12, 128.60, 127.28, 125.29, 24.64; HR-MS(ESI)m/z: Calcd for C32H21N2Br2{[M+H]+}591.006 6, found 591.007 8。
6,7-二氢-5,8-二苯基-3,10-二氯-1,12-二溴苯并[1,10]菲咯啉(3c): 金黄色晶体,收率70%, m.p.>300 ℃;1H NMRδ: 8.05(d,J=2.2 Hz, 2H, ArH), 7.57~7.48( m, 6H, ArH), 7.41(d,J=2.2 Hz, 2H, ArH), 7.27~7.24(m, 4H, ArH), 2.83(s, 4H,CH2);13C NMRδ: 152.56, 146.06, 143.73, 135.31, 133.17, 132.83, 131.88, 129.27, 129.14, 128.91, 128.68, 128.02, 124.64, 25.87; HR-MS(ESI)m/z: Calcd for C32H19N2Cl2Br2{[M+H]+}658.928 7, found 658.928 3。
6,7-二氢-5,8-二苯基-3,10-二氯苯并[1,10]菲咯啉(3d): 无色晶体,收率65%, m.p.>300 ℃;1H NMRδ: 8.57(d,J=9.0 Hz, 2H, ArH), 7.80~7.74(m, 2H, ArH), 7.64~7.54(m, 6H, ArH), 7.52(d,J=2.3 Hz, 2H, ArH), 7.34~7.28(m, 4H, ArH), 2.92(s, 4H, CH2);13C NMR δ: 148.64, 143.47, 134.97, 134.55, 131.84, 131.13, 130.10, 129.13, 129.10, 129.06, 129.00, 125.05, 25.47。表征数据与文献[21]报道一致。
6,7-二氢-5,8-二(4-氟苯基)苯并[1,10]菲咯啉(3e): 无色晶体,收率57%, m.p.>300 ℃;1H NMRδ: 8.52(d,J=8.5 Hz, 2H, ArH), 7.76~7.70(m, 2H, ArH), 7.50~7.42(m, 4H, ArH), 7.30~7.21(m, 8H, ArH), 2.84(s, 4H, CH2);13C NMRδ:163.56, 161.59, 152.44, 147.84, 144.97, 132.30 (d,JC-F=3.5 Hz), 131.27(d,JC-F=5.0 Hz) 130.26, 128.79, 127.71, 127.26, 125.56, 115.72(d,JC-F=21.5 Hz), 26.21; HR-MS(ESI)m/z: Calcd for C32H21N2F2{[M+H]+}471.166 7, found 471.167 9。
6,7-二氢-5,8-二苯基-3,10-二硝基苯并[1,10]菲咯啉(3f): 白色固体,收率32%, m.p.>300 ℃;1H NMRδ: 8.67(d,J=9.2 Hz, 2H, ArH), 8.56~8.47(m, 4H, ArH), 7.67~7.57(m, 6H, ArH), 7.37~7.32(m, 4H, ArH), 2.95(s, 4H, CH2);13C NMRδ: 155.98, 147.69, 147.26, 144.20, 132.45, 132.40, 130.62, 129.71, 128.72, 128.65, 128.24, 126.38, 123.52, 24.67; HR-MS(ESI)m/z: Calcd for C32H21N4O4{[M+H]+}: 525.155 7, found 525.154 9。
6,7-二氢-3,10-二甲基-5,8-二苯基苯并[1,10]菲咯啉(3g): 白色固体,收率85%, m.p.>300 ℃;1H NMRδ: 8.40(d,J=8.6 Hz, 2H, ArH), 7.57~7.44(m, 8H, ArH), 7.33~7.27(m, 4H, ArH), 7.20(s, 2H, ArH), 2.79(s, 4H, CH2), 2.42(s, 6H, CH3);13C NMRδ: 151.80, 146.44, 145.14, 136.90, 136.79, 130.91, 130.86, 130.11, 129.49, 128.51, 127.89, 127.55, 124.55, 26.25, 21.91; HR-MS(ESI)m/z: Calcd for C34H27N2{[M+H]+}463.216 9, found 463.216 1。
6,7-二氢苯并[1,10]菲咯啉(3h): 白色固体,收率71%, m.p.179~182 ℃;1H NMRδ: 8.46(d,J=8.5 Hz, 2H, ArH), 8.05(s, 2H, ArH), 7.79(d,J=8.1 Hz, 2H, ArH), 7.74~7.69(m, 2H, ArH), 7.56~7.52(m, 2H, ArH), 3.23(s, 4H, CH2);13C NMRδ:152.30, 148.18, 134.58, 132.55, 130.94, 128.93, 128.38, 127.19, 126.74, 28.63。表征数据与文献[21]报道一致。
6,7-二氢-3,10-二氯苯并[1,10]菲咯啉(3i): 无色晶体,收率62%, m.p.196~198 ℃;1H NMRδ: 8.36(d,J=9.0 Hz, 2H, ArH), 7.97(s, 2H, ArH), 7.78(d,J=2.4 Hz, 2H, ArH), 7.68~7.62(m, 2H, ArH), 3.25(s, 4H, CH2);13C NMRδ: 152.22, 146.51, 133.78, 133.46, 133.20, 132.43, 130.15, 128.97, 125.51, 28.43; HR-MS(ESI)m/z: Calcd for C20H13N2Cl2{[M+H]+}m/z: 351.045 0, found 351.046 1。
2 结果与讨论
2.1 反应条件优化
基于文献工作基础,我们首先采用锐钛矿型纳米TiO2(25 nm)作为催化剂,以3a的合成为例,分别研究催化剂、溶剂和投料比等条件对反应的影响。
(1) 催化剂、溶剂和投料比
考察了催化剂、溶剂和投料比对3a收率的影响,结果见表1。由表1可见,在所筛选的催化剂中,传统路易斯酸催化剂的催化性能较低(No.1~5),纳米TiO2表现出最佳催化性能,收率可达79%(No.6)。进一步对溶剂进行筛选,发现甲苯,二氧六环,DMF,乙醇,氯苯,硝基苯等作为溶剂时,反应效果均不如乙腈(No.8~13)。该反应在无溶剂条件下也能进行,但产物收率不高(57%, No.7)。此外,还分别对粒径为0.2~0.4 um的TiO2和金红石型纳米TiO2为催化剂进行了考察(No.14和No.15),结果显示其纳米尺寸效应和构型效应与Kaushik课题组的报道结果相似[19]。改变投料比,发现当1a和2投料比为为2.1 ∶1时,反应收率最高为83%(No.16)。
综上所述,最佳反应条件为:锐钛型纳米二氧化钛用量为0.2 eq.,1a与2投料比为为2.1 ∶1,乙腈为溶剂,于80 ℃反应7 h,收率可达83%。

表1 不同反应条件对收率的影响Table 1 Different condition effect on the reaction
a1a(2 mmol),其余反应条件同1.2(1);b1a(2 mmol), TiO2NP(金红石型, 25 nm),其余条件同1.2(1);c反应条件同1.2(1);d1a(2.2 mmol),其余反应条件同1.2(1)。
2.2 催化剂的重复利用性
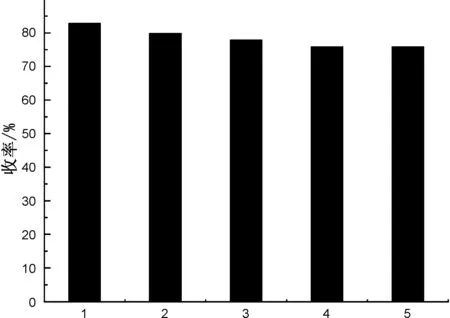
以3a的合成为例,在反应结束后,将反应液离心,将反应后的纳米TiO2分别用热乙醇和水洗涤,真空干燥后[19],加入底物进行催化反应,考察催化剂纳米TiO2的重复利用性,结果见图1。由图1可见,纳米TiO2循环使用5次,反应收率没有明显降低,说明TiO2催化活性得到保持,可以稳定重复利用5次以上。
循环次数
2.3 底物拓展
在最佳反应条件下对底物进行了拓展,结果见Scheme 1所示。可以看出,所选底物1a~1i均能在锐钛型纳米TiO2的催化下很好地与2发生反应,且收率较高(高达85%)。卤代的2-氨基二苯甲酮为底物时,收率也较为良好,但是相比于2-氨基二苯甲酮,产率有所下降,可能是吸电子基团对于该反应有钝化作用,2-氨基-5-硝基二苯甲酮为底物时,收率最低(32%);当取代基团R1由苯基变为氢时,反应物1的反应活性应该提高了,但是由于1本身不稳定,在高温下容易自聚,所以反应收率相对于2-氨基二苯甲酮有所下降。
2.4 反应机理
从液相跟踪检测可以看出,第一步Friedlander反应产物(中间体B)是先增加后缓慢减少的过程,且其生成速率比最终产物的生成速率低,说明B作为反应中间体都最终转换成产物。此外为理解和推测该合成反应的真实反应机理,运用质谱分析方法跟踪反应,捕获一些反应中间体信息。实验中发现,串联反应中亚胺中间体(中间体A)和第一步Friedlander反应产物(中间体B)的分子量都可以检测到。因此推测的可能反应机理如Scheme 2所示,综合图2可以看出纳米TiO2具有巨大的比表面积,在表面的羟基首先活化环己二酮的羰基碳,被2-氨基苯甲酰衍生物的氨基进攻后迅速脱水生成亚胺(中间体A),然后亚胺可以互变形成烯胺异构体,烯胺的不饱和碳进攻分子内的苯甲酰基碳,脱水芳构化生成中间体B,再经同样的催化过程完成另一个Friedlander反应就得到目标产物。
Scheme2

Time/h
研究了纳米TiO2催化的1,2-环己二酮与2-氨基苯甲酰衍生物的串联Friedlander反应,合成了一系列二苯并1,10-菲咯啉的衍生物。其中7个为新化合物。该合成方法具有反应条件温和、操作简便、催化剂绿色(无毒、价廉、可重复利用)等优点,底物适用范围较广,产率较高(可达85%),提供了一条简洁高效的催化方法。并通过液相和质谱分析确认了纳米TiO2的催化机理,为研究纳米TiO2催化反应提供很好的理论支撑。
[1] Dotsenko I A, Curtis M, Samoshina N M,etal. Convenient synthesis of 5-aryl(alkyl)sulfanyl-1,10- phenanthrolines from 5,6-epoxy-5,6-dihydro-1,10-phenanthroline[J].Tetrahedron,2011,67:7470-7478.
[2] Gao G L, Xia W J, Pankaj J,etal. Pd(II)-catalyzed C3-selective arylation of pyridine with(hetero)arenes[J].Org Lett,2016,18:744-747.
[3] Pantelis G R, Donald J P. Ruthenium(II)complexes as ion interaction reagents for the liquid C-hromatographic separation and indirect fluorometric detection of analyte anions[J].Anal Chem,1988,60:1650-1654.
[4] Karakaya S, Algi F. A novel dualchannel responsive zinc(II) probe[J].Tetrahedron Lett,2014,55:5555-5559.
[5] Luo S P, Mejía E, Friedrich A,etal. A noble-metal-free system for photocatalytic hydrogen production from water [J].Angew Chem Int Ed,2013,52:419-424.
[6] Dabiri M, Salehi P, Baghbanzadeh M,etal. A new and efficient one-pot procedure for the synthesis of 2-styrylquinolines[J].Tetrahedron Lett,2008,49:5366-5368.
[7] Wang G W, Jia C S, Dong Y W. Benign and highly efficient synthesis of quinolines from 2-am-inoarylketone or 2-aminoarylaldehyde and carbonyl compounds mediated by hydrochloric acid in water[J].Tetrahedron Lett,2006,47:1059-1063.
[8] Camps P, Gomez E, Torrero D M,etal. Introduction of benzo[h]quinoline and 1,10-phenanthroline subunits by Friedla1nder methodology[J].Tetrahedron:Asymmetry,2001,12:2909-2914.
[9] Genovese S, Epifano F, Marcotullio M C,etal. Base-mediated synthesis of quinolines:An unexpected cyclization reaction between 2-aminobenzylalcohol and ketones[J].Tetrahedron Lett,2011,52:3474-3477.
[10] Li B B, Nguyen S, Huang J J,etal. Synthesis and characterization of quinoline derivativesviathe Friedlander reaction[J].Tetrahedron Lett,2016,57:1958-1962.
[11] Elvira C R , Jin X Q , Randolph P. On the regioselectivity of the Friedlander reaction leading to huprines: Stereospecific acid-promoted isomerization of syn-huprines to their anti-regioisomers[J].J Org Chem,1996,61:3017-3022.
[12] Mierde H V, Voort P V D, Verpoort F. An alternative quinoline synthesis byviaFriedlander reaction catalyzed by Yb(OTf)3[J].Tetrahedron Lett,2008,49:6893-6895.
[13] Yang D Q, Jiang K L, Li J N. Synthesis of 1,8-naphthyridines from 2-aminonicotinaldehydes and terminal alkynes[J].Tetrahedron,2007,63:7654-7657.
[14] 杨定桥,刘春玉,曾和平,等. Friedlander反应合成2-(2-羟基苯基)-6,7-亚甲二氧基喹啉及其衍生物[J].有机化学,2002,22:275-278.
[15] Angajala G, Subashini R. Nickel nanoparticles:A highly efficient and retrievable catalyst for the solventless Friedlander annulation of quinolines and their in silico molecular docking studies as histone deacetylase inhibitors[J].RSC Adv,2015,5:45599-45610.
[16] Sadjadi S, Shiri S, Hekmatshoar R,etal. Nanocrystalline aluminium oxide:A mild and efficient reusable catalyst for the one-pot synthesis of poly-substituted quinolinesviaFriedlander hetero-annulation[J].Monatsh Chem,2009,140:1343-1347.
[17] Gawande M B, Rathi A K, Nogueira I D,etal. Magnetite-supported sulfonic acid:A retrievable nanocatalyst for the Ritter reaction and multicomponent reactions[J].Green Chem,2013,15:1895-1899.
[18] Chen M M, Zhang M, Xie F,etal. Convenient synthesis of novel heteroatom-substituted quinolinesviaFriedlander annulation using phosphotungstic acid as a reusable catalyst[J].Monatsh Chem,2015,146:663-667.
[19] Bandyopadhyay P, Prasad G K, Sathe M,etal. Titania nanomaterials:Efficient and recyclable heterogeneous catalysts for the solvent-free synthesis of poly-substituted quinolinesviaFriedlander hetero-annulation[J].RSC Adv,2014,4:6638-6645.
[20] Luo S P, Chen N Y, Sun Y Y,etal. Heteroleptic copper(I) photosensitizers of dibenzo[b,j]-1,10-phenanthroline derivatives driven hydrogen generation from water reduction[J].Dyes Pigmens,2016,134:580-585.
[21] Sridharan V, Ribelles P, Ramos M T,etal. Cerium(IV) ammonium nitrate is an excellent,general catalyst for the Friedlander and Friedlander-Borsche quinoline syntheses:Very efficient access to the antitumor alkaloid luotonin A[J].J Org Chem,2009,74:5715-5718.
Synthesis of Dibeno[b,j]-1,10-Phenanthroline Derivatives Catalyzed by Nano Titanium Dioxide
XU Shi-hong1, CHEN Hao1, WANG Jian-qiang2,LOU Qing-tong2, LUO Shu-ping1, WU Qing-an1*
(1. State Key Laboratory Breeding Base of Green Chemistry-Synthesis Technology, Zhejiang University of Technology, Hangzhou 310014, China; 2. Zhejiang HuaYi Pharmaceutical Co., Ltd., Yiwu 322000, China)
Nine dibeno[b,j]-1,10-phenanthroline derivatives(3a~3i,3b,3c,3e~3g,3iwere new compounds) were firstly synthesized by the tandem-Friedlander reaction of 1,2-cyclohexanedione with 2-amino benzoyl derivatives using nano-TiO2as catalyst. The structures were characterized by1H NMR,13C NMR, and HR-MS(ESI). The optimum reaction conditions for the model synthesis of 5,8-diphenyl-6,7-dihydrodibenzo[b,j][1,10]phenanthroline(3a) were obtained as follows: the mole ratio of1aand2was 2.1 ∶1, anatase titanium dioxide dosage was 0.2 eq., reaction at 80 ℃ for 7 h in acetonitrile. The yield of3ais up to 83%. Moreover, the reaction mechanism was also discussed.
1,2-cyclohexanedione; 2-amino benzoyl derivative; nano-TiO2; catalysis; Friedlander reaction; 1,10-phenanthroline; synthesis
2017-02-17;
: 2017-08-01
国家自然科学基金资助项目(21376222)
许世虹(1992-),男,汉族,浙江台州人,硕士研究生,主要从事含氮配体的合成及应用研究。 E-mail: 534627330@qq.com
吴庆安,副研究员, Tel. 0571-88320163, E-mail: qawu@zjut.edu.cn
O625.42; O626.4
: ADOI: 10.15952/j.cnki.cjsc.1005-1511.2017.09.17028
