不同纯度花生红衣原花青素的制备工艺研究
2017-09-16白欢欢刘睿杰王珊珊金青哲王兴国
白欢欢,刘睿杰,王珊珊,李 秋,金青哲,王兴国
(1.江南大学食品学院,江苏 无锡 214122; 2.山东鲁花集团有限公司,山东 烟台 265200)
综合利用
不同纯度花生红衣原花青素的制备工艺研究
白欢欢1,刘睿杰1,王珊珊2,李 秋2,金青哲1,王兴国1
(1.江南大学食品学院,江苏 无锡 214122; 2.山东鲁花集团有限公司,山东 烟台 265200)
研究了AB-8大孔吸附树脂分离纯化得到不同纯度花生红衣原花青素的制备工艺,并对产物进行了HPLC-MS分析鉴定。结果表明:最佳分离纯化条件为上样流速0.5 mL/min、洗脱流速1.0 mL/min、洗脱液20%和40%乙醇溶液,解吸后得到的原花青素纯度分别为98.7%和86.2%;此外,不同的收集方式也可得到不同纯度的原花青素;经AB-8大孔吸附树脂分离得到的纯化物均为低聚体原花青素,20%乙醇纯化物的主要成分为A型原花青素二聚体和A型原花青素三聚体,40%乙醇纯化物的主要成分为A型原花青素二聚体和A型原花青素四聚体。
花生红衣;原花青素;大孔吸附树脂;纯度;低聚体
花生红衣作为花生生产过程中价值极低的副产物,除了用于动物饲料外,大部分被当作废弃物而造成资源浪费[1]。近些年研究发现,花生红衣中富含多酚类物质,具有很高的营养和利用价值[2]。花生红衣中多酚类物质含量为90~125 mg/g,包括白藜芦醇、原花青素、酚酸等物质[3-4],其中原花青素占花生红衣总质量的17%,约有50%为生物活性较高的低聚体。原花青素具有较强的抗氧化能力,可作为防癌、防治心血管疾病药物的主要有效成分,可用作安全无毒的新型天然抗氧化剂[5-6]。目前,市场上原花青素产品大部分是葡萄籽来源的原花青素,葡萄籽中只含有B型原花青素,其聚合度较高,平均聚合度可达14.3。近年来研究较多的花生红衣富含A型原花青素,聚合度较低,平均聚合度为3.2[7]。研究发现只有低聚体原花青素(聚合度≤3)可以完全被胃肠道吸收,A型与B型原花青素在人体内发挥的作用不同[8]。鉴于花生红衣与葡萄籽来源的原花青素不同,有待于开发花生红衣来源的原花青素产品。
不同纯度的原花青素在食品、保健品、药品以及化妆品等领域有一定的应用[9],市场对其纯度的需求也不同。目前分离纯化方法主要有溶剂萃取法、层析法、液相制备色谱等,但大孔树脂法应用最为广泛,其设备简单、操作方便、便于工业化生产[10]。本文采用大孔吸附树脂对花生红衣原花青素进行分离纯化,并用HPLC-MS对纯化产物进行分析鉴定。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
花生红衣,山东鲁花集团有限公司提供;原花青素标准品:天津尖峰天然产物研究开发公司提供,纯度98.5%;大孔吸附树脂(AB-8、D101、HPD750、NKA-9),天津浩聚树脂科技有限公司。无水乙醇、甲醇、盐酸、甲酸、香草醛,均为分析纯;甲醇、乙腈,均为色谱纯;实验用水均为蒸馏水。
1.1.2 仪器与设备
BS-100A型自动部分收集器,DHL-A电脑数显型恒流泵,SHZ-3循环水多用真空泵,KH7200DB型数控超声波清洗器,SHZ-8气浴恒温振荡器,VDRTEX-5旋涡混合器,R-501型旋转蒸发器,小型高速粉碎机,HH-4数显恒温水浴锅,α-1500型紫外可见光分光光度计。
1.2 试验方法
1.2.1 花生红衣原花青素的提取
用小型高速粉碎机将花生红衣粉碎至过40目筛,每千克花生红衣采用10 L石油醚去除脂类物质,于30℃恒温水浴锅中脱脂5 h,抽滤,滤渣置于通风橱中去除石油醚,保存在干燥器中备用。每千克脱脂花生红衣采用10 L体积分数为70%的乙醇溶液提取,在超声功率120 W、超声温度35℃的条件下,超声提取10 min,相同条件下提取3次。合并过滤得到的滤液,旋转蒸发至干,得到花生红衣原花青素粗提物[11]。
1.2.2 大孔吸附树脂纯化花生红衣原花青素
1.2.2.1 大孔吸附树脂的预处理
大孔吸附树脂常含有一些单体、分散剂和致孔剂等,使用时需要除去这些有毒的有机残留物,所以必须经过预处理。预处理方法:无水乙醇浸泡24 h→用无水乙醇洗至流出液与水1∶5不浑浊→用去离子水洗至无醇味→5%HCl溶液浸泡2~4 h→用去离子水洗至流出液为中性→2%NaOH溶液浸泡2~4 h→去离子水洗至流出液为中性,备用。
1.2.2.2 大孔吸附树脂的静态吸附和解吸试验
将经预处理后的大孔吸附树脂抽滤并吸干其表面水分,准确称取4种预处理后的树脂1 g分别置于25 mL具塞锥形瓶中,各加入10 mL(质量浓度为5.02 mg/mL)花生红衣原花青素粗提液,摇匀,放入气浴恒温振荡器中,振荡速率为120 r/min,温度为30℃。在0.5、1、2、3、4、5、6、12、18、24 h时吸取上清液,测定上清液中原花青素的含量,并以吸附量对时间作图,得到各树脂的吸附动力学曲线。过滤吸附饱和的树脂,分别加入20 mL 95%乙醇,在气浴恒温振荡器中振荡24 h,过滤解吸液,测定其中原花青素含量。按下式计算吸附率、吸附量和解吸率。

(1)

(2)
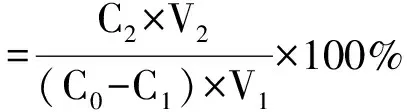
(3)
式中:C0为花生红衣原花青素粗提液质量浓度,mg/mL;C1为经树脂吸附后上清液中原花青素质量浓度,mg/mL;C2为原花青素解吸液质量浓度,mg/mL;V1为经树脂吸附后上清液体积,mL;V2为原花青素解吸液体积,mL;m为干树脂质量,g。
1.2.2.3 大孔树脂AB-8纯化花生红衣原花青素
称取已处理的AB-8大孔吸附树脂装填入层析柱,将一定质量浓度的花生红衣原花青素粗提液(以澄清为好)上柱,柱温为室温;洗脱时首先用4BV蒸馏水洗去相对分子质量较大的蛋白质、多糖等杂质;然后用4BV不同体积分数的乙醇溶液将吸附在树脂上的原花青素梯度洗脱下来,分批收集流出液,旋转蒸发至干,得到原花青素纯化物。接下式计算产物原花青素的纯度和回收率。
纯度=纯化物中原花青素质量/纯化物质量×100%
(4)
回收率=洗脱液体积×洗脱液中原花青素质量浓度/(上样液体积×上样液中原花青素质量浓度)×100%
(5)
1.2.3 原花青素的测定[11]
1.2.3.1 原花青素标准曲线的绘制
准确称取0.050 0g原花青素标准品,加甲醇溶解并定容至25mL,得到2.0mg/mL的原花青素标准溶液(现配)。分别精确量取0、0.5、1.0、1.5、2.0、3.0、4.0mL原花青素标准溶液于10mL棕色容量瓶中,用甲醇稀释至刻度线,此时得到质量浓度分别为0、0.10、0.20、0.30、0.40、0.60、0.80mg/mL的工作溶液。再各取1mL工作溶液于10mL试管中,分别加入6mL0.04g/mL香草醛甲醇溶液,3mL浓盐酸,摇匀,在(30±1)℃下恒温水浴保持20min,取出,在500nm波长下测定其吸光度,绘制标准曲线。回归方程为Y=1.330 6X+0.066 4,R2=0.996 6。
1.2.3.2 花生红衣原花青素的测定
取1mL稀释了一定倍数的花生红衣原花青素粗提液,分别加入6mL0.04g/mL香草醛甲醇溶液,3mL浓盐酸,摇匀,在(30±1)℃下恒温水浴保持20min,取出,在500nm波长下测定其吸光度,由标准曲线回归方程可计算样品中原花青素的质量浓度。
1.2.4HPLC-MS测定花生红衣原花青素
将洗脱级分10mg分别溶于10mL色谱纯甲醇中,经0.45μm滤膜过滤后进行HPLC-MS分析。
色谱条件:色谱柱为CSH柱(2.1mm×100mm,粒径 1.9μm);流动相A为乙腈,流动相B为0.1%甲酸水溶液;柱温45℃;进样量1μL;流动相洗脱条件为0~0.1min,5%A;0.1~30min,5%~20%A;30~32min,20%~80%A;32~32.5min,80%~5%A;32.5~35min,5%A。
质谱条件:ESI电离源,负离子模式;毛细管电压3.0kV,锥孔电压40.0V;离子源温度100℃,脱溶剂温度400℃;锥孔气流速50.0L/h,脱溶剂气流速700.0L/h;碰撞电压6V;相对分子质量扫描范围(m/z)50~2 000。
2 结果与讨论
2.1 4种大孔吸附树脂对花生红衣原花青素的静态吸附率和解吸率
大孔吸附树脂是吸附性和分子筛原理相结合的分离介质,其吸附力与吸附树脂和吸附质之间的范德华力和氢键作用有关。本试验所用大孔吸附树脂包括极性树脂(NKA-9)、中极性树脂(HPD750)、弱极性树脂(AB-8)和非极性树脂(D101),这4种大孔吸附树脂对花生红衣原花青素的吸附与解吸性能如表1所示,静态吸附动力学曲线如图1所示。

表1 4种大孔吸附树脂对花生红衣原花青素的吸附与解吸性能比较
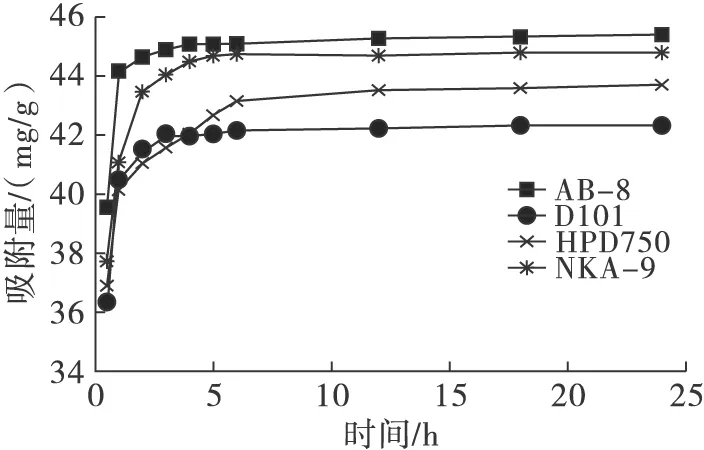
图14种大孔吸附树脂的静态吸附动力学曲线
由表1可知,NKA-9和AB-8大孔吸附树脂对原花青素均有较大的吸附率,D101大孔吸附树脂的吸附率低于其他大孔吸附树脂。原花青素分子中含有多个酚羟基,可形成氢键,具有一定的亲水性和极性,容易被极性、中极性和弱极性树脂吸附。除此之外,大孔吸附树脂的吸附能力还与其孔隙结构、比表面积等有关。HPD750比表面积大,孔径小,不利于原花青素分子通过树脂的孔径扩散到其内表面而被吸附。NKA-9表面极性大,对原花青素分子产生强烈吸附,会阻碍原花青素的解吸。大孔吸附树脂的静态动力学曲线一般可以分为两种类型:第1种是快速平衡型,其特征是在吸附的起始阶段吸附量迅速增加,很快达到吸附平衡;第2种是慢速平衡型,起始阶段吸附量较小,吸附量的上升速度缓慢,吸附平衡时间较长。由图1可以看出,AB-8、NKA-9、D101树脂对原花青素的吸附属于快速平衡型,而HPD750则属于慢速平衡型。因此,综合考虑树脂吸附量、解吸率以及静态吸附动力学特征发现,AB-8大孔树脂吸附量大、解吸容易并可以较快达到吸附平衡,故选用AB-8大孔吸附树脂作为分离纯化花生红衣原花青素的吸附材料。
2.2 上样流速对AB-8大孔吸附树脂吸附原花青素的影响
上样流速小,样液中溶质与树脂接触时间长,其吸附较为完全;流速过大,溶质分子来不及扩散到树脂的内表面进行吸附,导致吸附不充分,且浪费了样品[12]。因此,本试验研究上样流速对AB-8大孔吸附树脂吸附原花青素的影响,结果见图2。

图2 上样流速对AB-8大孔吸附树脂吸附原花青素的影响
由图2可以看出,上样流速为0.25 mL/min和0.5 mL/min时,大孔树脂对原花青素的吸附率比较高,泄漏时间分别出现在250 min和180 min。当上样流速为0.75 mL/min和1.0 mL/min时,泄漏时间出现较早,吸附过程不完全。考虑到实际的生产情况,选取0.5 mL/min上样流速较为合适。
2.3 洗脱流速对原花青素洗脱效果的影响
为了使洗脱液与AB-8大孔吸附树脂所吸附的溶质有充分的接触时间,进行有效地解吸,必须使洗脱液以合适的流速进行洗脱,因此考察了洗脱流速对原花青素洗脱效果的影响,结果见图3。

图3 洗脱流速对AB-8大孔吸附树脂解吸原花青素的影响
由图3可以看出,洗脱流速为0.5 mL/min和1.0 mL/min时,洗脱效果相差不大,而当洗脱流速达到2.0 mL/min以上时,洗脱效果明显变差,原花青素纯度也呈下降趋势。因此,选择洗脱流速为1.0 mL/min,此时原花青素的解吸率为89.31%,纯度为98.7%。
2.4 不同体积分数乙醇对原花青素的洗脱效果
大孔吸附树脂进行分离纯化时常用的洗脱剂为乙醇溶液,不同体积分数乙醇溶液的极性不同,其对原花青素的洗脱能力也有所差异,因此本试验研究了不同体积分数乙醇溶液对原花青素的洗脱效果的影响,结果见图4。
由图4可知,乙醇体积分数对花生红衣原花青素的洗脱曲线有很大的影响,其中40%乙醇溶液的洗脱曲线峰值最高,在0.8~2.5 BV范围内收集到的原花青素质量浓度相对较高。20%乙醇溶液对原花青素的洗脱效果较好,洗脱曲线有明显的峰值,稍有拖尾现象。10%和95%乙醇溶液对原花青素洗脱能力差,洗脱曲线无明显峰值。因此,可以通过收集不同范围内的洗脱液来制备不同纯度的原花青素。

图4 不同体积分数乙醇对原花青素的洗脱效果
2.5 洗脱方式或收集方式对原花青素解吸效果的影响
原花青素是由不同聚合度的儿茶素或表儿茶素组成的混合物,含有大量的酚羟基,树脂吸附过程中极有可能发生氢键吸附,则不同聚合度的原花青素被吸附和解吸的过程和速度必然存在差异。因此,梯度洗脱极有可能获得聚合度不同或纯度不同的原花青素。表2列出不同体积分数乙醇洗脱收集到4种原花青素的解吸效果。
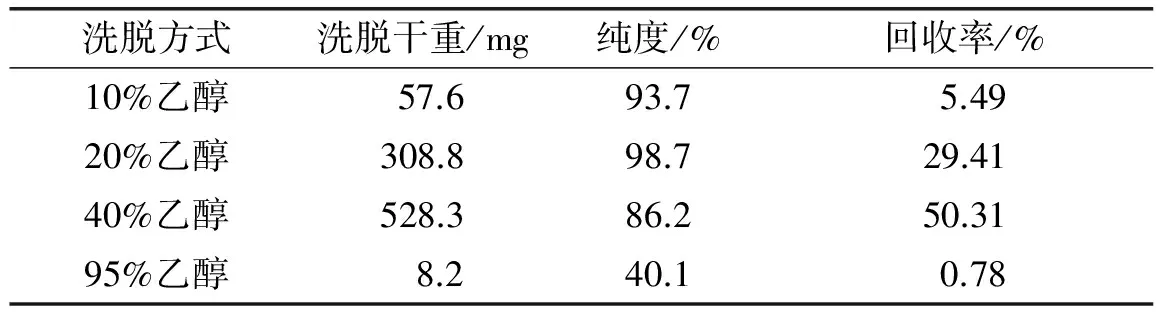
表2 不同体积分数乙醇洗脱的原花青素解吸效果
由表2可以看出,采用20%乙醇溶液进行洗脱得到的原花青素的纯度最高,采用40%乙醇溶液进行洗脱,原花青素的回收率最大。因此,选择20%和40%乙醇作为制备原花青素的洗脱剂。
另将20%和40%乙醇的洗脱液分别收集,结果见表3。

表3 20%与40%乙醇洗脱的原花青素解吸效果
由表3可以看出,20%乙醇洗脱解吸得到的干重从多到少,纯度从低到高再到低,在约2~3.5 BV收集到的洗脱液中原花青素纯度最高,占总干重的23.4%;40%乙醇洗脱解吸得到的干重从多到少,纯度从高到低,在约0~2 BV收集到的洗脱液中原花青素纯度最高,占总干重的84.2%。
在工业生产中可根据产品要求选择不同的洗脱方式或收集方式。当用20%乙醇进行洗脱时,收集2~3.5 BV洗脱液可得到纯度大于98%的原花青素,收集0~4 BV洗脱液时可得到纯度大于95%的原花青素;当用40%乙醇洗脱时,收集0~2 BV洗脱液可得到纯度85%~90%的原花青素,收集0~4 BV洗脱液可得到纯度约为80%的原花青素。
2.6 HPLC-MS对花生红衣原花青素纯化物的分析结果
图5和图6分别是20%乙醇和40%乙醇洗脱液的总离子色谱图,表4为两种花生红衣原花青素纯化物的HPLC-MS分析[13]。由图5、图6、表4可以看出,经AB-8大孔吸附树脂分离得到的纯化物均为低聚体原花青素,20%乙醇纯化物的主要成分为A型原花青素二聚体和A型原花青素三聚体,40%乙醇纯化物的主要成分为A型原花青素二聚体和A型原花青素四聚体。研究发现只有低相对分子质量低聚体(聚合度≤3)可以完全被胃肠道吸收。因此,试验所制备的花生红衣原花青素因其相对分子质量小,易于被人体吸收,在人体内可充分发挥其生理功能。

图5 20%乙醇洗脱液的总离子色谱图

图6 40%乙醇洗脱液的总离子色谱图
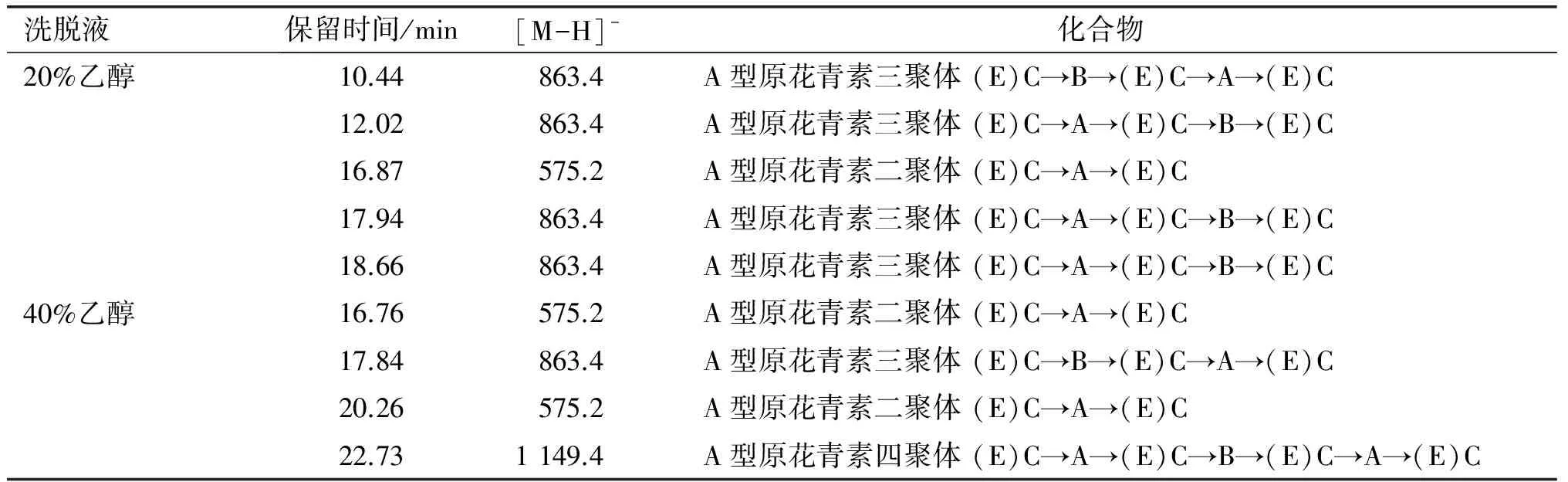
表4 对花生红衣原花青素纯化物的HPLC-MS分析
注:表中字母缩写为 (E)C代表(表)儿茶素;A代表A型键C4→C8,C2→0→C7;B代表B型键C4→C8。
3 结 论
研究了AB-8大孔吸附树脂分离纯化得到不同纯度花生红衣原花青素的制备工艺。最佳分离纯化条件为:上样流速0.5 mL/min,洗脱流速1.0 mL/min,洗脱液20%和40%乙醇溶液。解吸后得到20%乙醇纯化物和40%乙醇纯化物,20%乙醇纯化物纯度最高,可达98.7%,回收率较低,为29.41%,40%乙醇纯化物纯度为86.2%,回收率较高,为50.31%。通过不同的收集方式可得到不同纯度的原花青素,因此在工业生产中可根据产品要求选择不同的洗脱方式或收集方式。
由HPLC-MS分析可知,经AB-8大孔树脂分离得到的纯化物均为低聚体原花青素,20%乙醇纯化物的主要成分为A型原花青素二聚体和A型原花青素三聚体,40%乙醇纯化物的主要成分为A型原花青素二聚体和A型原花青素四聚体。
[1] 霍婷, 杨惠玲, 薛文通, 等. 花生红衣色素的研究进展[J]. 食品工业科技, 2008, 29(11): 289-290, 295.
[2] NEPOTE V, GROSSO N R, GUZMN C A. Optimization of extraction of phenolic antioxidants from peanut skins[J]. J Sci Food Agric, 2005, 85(1): 33-38.
[3] YU J M, AHMEDNA M, GOKTEPE I. Effects of processing methods and extraction solvents on concentration and antioxidant activity of peanut skin phenolics[J]. Food Chem, 2005, 90(1): 199-206.
[4] VAN HA H, POKORNY J, SAKURAI H. Peanut skin antioxidants[J]. J Food Lipids, 2007, 14(3): 298-314.
[5] KENNEDY J A, HAYASAKA Y, VIDAL S, et al. Composition of grape skin proanthocyanidins at different stages of berry development[J]. J Agric Food Chem, 2001, 49(11): 5348-5355.
[6] PEKIC B, KOVAC V, ALONSO E, et al. Study of the extraction of proanthocyanidins from grape seeds[J]. Food Chem, 1998, 61(1/2): 201-206.
[7] GU L W, KELM M A, HAMMERSTONE J F, et al. Screening of foods containing proanthocyanidins and their structural characterization using LC-MS/MS and thiolytic degradation[J]. J Agric Food Chem, 2003, 51(25): 7513-7521.
[8] RASMUSSEN S E, FREDERIKSEN H, KROGHOLM K S, et al. Dietary proanthocyanidins: occurrence, dietary intake, bioavailability, and protection against cardiovascular disease[J]. Mol Nutr Food Res, 2005, 49(2): 159-174.
[9] 温志英, 刘晶, 刘焕云. 花生红衣综合利用现状及发展前景[J]. 中国粮油学报, 2010, 25(1): 143-146.
[10] 李莹, 赵谋明, 于立梅,等. 采用大孔吸附树脂纯化马尾松树皮原花青素及其抗氧化性研究[J]. 食品与发酵工业, 2006, 32(12): 145-149.
[11] LIU Z Q, YANG Q L, ZHANG C S, et al. Optimization of ultrasonic extraction technique of proanthocyanidin from peanut skin[J]. Adv Mater Res, 2010(156/157):778-784.
[12] 赵平, 张月萍, 任鹏. AB-8大孔树脂对葡萄籽原花青素的吸附过程 [J]. 化工学报, 2013, 64(3): 980-985.
[13] SARNOSKI P J, JOHNSON J V, REED K A, et al. Separation and characterisation of proanthocyanidins in Virginia type peanut skins by LC-MSn[J]. Food Chem, 2012, 131(3): 927-939.
Preparationofprocyanidinsofdifferentpuritiesfrompeanutskins
BAI Huanhuan1, LIU Ruijie1, WANG Shanshan2, LI Qiu2, JIN Qingzhe1, WANG Xingguo1
(1.School of Food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu, China; 2.Shandong Luhua Group Co., Ltd., Yantai 265200, Shandong, China)
The preparation process of procyanidins of different purities from peanut skins with AB-8 macroporous adsorption resin was studied and the product was analyzed by HPLC-MS. The results showed that the optimal separation and purification conditions were obtained as follows: flow rate of sample 0.5 mL/min, eluention flow rate 1.0 mL/min, 20% and 40% ethanol solution as eluent. Under these conditions, the procyanidins purities after desorption were 98.7% and 86.2% respectively. In addition, procyanidins of different purities were obtained by different collection methods. Purified products separated by AB-8 macroporous adsorption resin were oligomeric procyanidins. The main purified products of 20% ethanol were A-type dimers of procyanidins and A-type trimers of procyanidins, and the main purified products of 40% ethanol were A-type dimers of procyanidins and A-type tetramers of procyanidins.
peanut skin; procyanidins; macroporous adsorption resin; purity; oligomer
2016-10-18;
:2017-03-24
“十三五”国家重点研发计划项目(2016YFD0401403);江苏省第五期“333工程”培养资金资助项目(BRA2016347);烟台市科技计划项目(2015NC044)
白欢欢(1992),女,硕士研究生,研究方向为油脂与植物蛋白(E-mail)bhh0210@163.com。
金青哲,教授,博士生导师(E-mail)jqzwuxi@163.com。
TS205;R284
:A
:1003-7969(2017)07-0074-06
