GC-MS分析毛霉型、细菌型、曲霉型豆豉中脂肪酸组成
2017-09-16谢艳华陈淼芬蒋立文陈力力
谢艳华, 谢 靓 , 李 跑 , 陈淼芬, 蒋立文,3, 陈力力,3
(1.湖南农业大学食品科技学院,长沙 410128; 2.兽用中药资源与中兽药创制国家地方联合工程研究中心,长沙 410128;3.食品科学与生物技术湖南省重点实验室,长沙 410128)
GC-MS分析毛霉型、细菌型、曲霉型豆豉中脂肪酸组成
谢艳华1, 谢 靓1, 李 跑1, 陈淼芬2, 蒋立文1,3, 陈力力1,3
(1.湖南农业大学食品科技学院,长沙 410128; 2.兽用中药资源与中兽药创制国家地方联合工程研究中心,长沙 410128;3.食品科学与生物技术湖南省重点实验室,长沙 410128)
采用正己烷提取大豆、毛霉型豆豉、细菌型豆豉和曲霉型豆豉中粗脂肪,通过氢氧化钾-甲醇和硫酸-甲醇对油脂进行甲酯化处理,采用GC-MS分析脂肪酸组成,用外标法对脂肪酸进行定量。结果表明:大豆、毛霉型豆豉、细菌型豆豉和曲霉型豆豉中均含有12种脂肪酸,其中饱和脂肪酸7种,单不饱和脂肪酸3种,多不饱和脂肪酸2种,以亚油酸含量最高,不饱和脂肪酸含量高于饱和脂肪酸含量。不饱和脂肪酸含量(以干基计)从高到低依次是毛霉型豆豉(23.52 g/100 g)、大豆(16.51 g/100 g)、细菌型豆豉(15.35 g/100 g)、曲霉型豆豉(7.00 g/100 g)。大豆经毛霉发酵成豆豉后,其主要脂肪酸含量得到提高,而经细菌和曲霉发酵成豆豉后,主要脂肪酸含量有所降低。
大豆;毛霉型豆豉;细菌型豆豉;曲霉型豆豉;脂肪酸;GC-MS
豆豉是大豆在微生物及酶的作用下制成的一种传统调味副食品, 因风味独特、营养丰富备受人们喜爱[1]。根据豆豉制曲过程中的微生物种类,可分为:毛霉型、细菌型、曲霉型、根霉型豆豉和脉孢菌型豆豉五大类。常见的是细菌型、毛霉型豆豉和曲霉型豆豉三大类。参与细菌型、毛霉型、曲霉型豆豉发酵的微生物分别是纳豆芽孢杆菌、毛霉、米曲霉。
豆豉制作过程中油脂成分会保留到最终成品中,使得豆豉富含脂肪酸。脂肪酸不仅是营养成分,而且是风味形成的前体物质,可以改善口感质构,同时有保健功效。豆豉中脂肪酸主要包含棕榈酸、油酸、亚油酸、亚麻酸等,这些脂肪酸能显著影响和改善人类神经或精神类疾病,作用于内分泌失调以及代谢综合症相关的疾病,如糖尿病等[2-3]。
发酵型产品微生物能够分泌脂肪酶,并且加入食盐、白酒、生姜、面粉等,体系复杂,对脂肪酸有一定的影响。徐春涛等[4]研究发现酱油渣油脂中的亚油酸占比为49.46%,亚麻酸为8.76%,硬脂酸为4.75%,油酸为20.68%。微生物发酵能够改变原料中脂肪酸含量,周思静等[5]研究丹贝中的营养成分,发现丹贝中的不饱和脂肪酸、亚油酸和亚麻酸的含量与大豆中的相比均显著性增加,分别增加了5.52、6.01、4.68倍。发酵过程中脂肪酸的变化趋势不固定,田甜[6]采用酸碱作为脂肪酸衍生化试剂,研究豆酱发酵过程中脂肪酸含量变化,发现不饱和脂肪酸含量在发酵45 d达到最大,随后有所降低。
本文拟在大豆发酵过程中,将毛霉、纳豆芽孢杆菌、米曲霉作为发酵剂分别接种,通过气相色谱-质谱(GC-MS)联用法进行分析、鉴定,并比较其脂肪酸组成和含量,以期为合理有效地开发、利用及推广发酵豆制品提供可靠数据。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
大豆,购于湖南农业大学东之源超市;毛霉 (CGMCC8700)、纳豆芽孢杆菌 (教研室从纳豆中分离并纯化)、米曲霉 (As3.042),湖南农业大学食品科技学院提供。
甲醇、正己烷,色谱纯;无水硫酸钠、氢氧化钾、硫酸,分析纯;37种脂肪酸甲酯混标,美国西格玛奥德里奇公司。
1.1.2 仪器与设备
LC-20AT气相色谱-质谱联用仪,日本岛津公司;ML204/02精密天平,梅特勒-托利多(上海)仪器有限公司;KQ5200DE超声波清洗器,昆山超声仪器有限公司;DHG-9246A电热恒温干燥箱;XW-80A旋涡混合器,上海青浦沪西仪器厂;HERMLE 2323K冷冻离心机,德国;FW100高速万能粉碎机,天津市太斯特仪器有限公司;
1.2 实验方法
1.2.1 纯种毛霉型、细菌型、曲霉型豆豉的制作
纯种毛霉型豆豉的制作:大豆精选去杂→浸泡约12 h→水洗→熟化(121℃、20 min)→冷却→接种扩大培养的毛霉(接种量1%)→前发酵(25℃、48~72 h)→后发酵(8%食盐、0.5%白酒、1%生姜、发酵时间30 d以上)→成熟。
纯种细菌型豆豉的制作:大豆精选去杂→浸泡约12 h使体积增加至2倍左右→熟化(121℃、20 min)→冷却→接种扩大培养的纳豆芽孢杆菌液(接种量1%)→40℃发酵24 h→冷藏48 h。
纯种曲霉型豆豉的制作:大豆精选去杂→浸泡(夏季4~6 h)→熟化(121℃、20 min)→摊凉→冷却→接种米曲霉(接种量1%)→制曲→拌料(8%食盐、2%白酒和1%的甜酒)→装坛→厌氧保温后发酵(35℃,15 d)。
1.2.2 大豆、细菌型豆豉、毛霉型豆豉和曲霉型豆豉粗脂肪提取
取大豆、成熟毛霉型豆豉、细菌型豆豉和曲霉型豆豉各60 g,置于80℃烘箱中干燥至恒重,研磨粉碎后过40目筛得到干粉。分别将准确称取的0.12 g干大豆粉和干豆豉粉置于15 mL试管中,加入6 mL正己烷。提取条件为:超声波功率350 W,提取温度40℃,提取时间30 min。
1.2.3 大豆、细菌型豆豉、毛霉型豆豉和曲霉型豆豉脂肪酸组成及含量测定。
1.2.3.1 脂肪酸标准曲线的制作
先将37种脂肪酸甲酯混标配制成标准储备液和标准工作液。
标准储备液:将1 mL 10 g/L 37种脂肪酸甲酯混标移至10 mL容量瓶中,并用正己烷定容。-20℃下避光保存。
标准工作液:吸取2.5 mL标准储备液于5 mL容量瓶中,并用正己烷定容,制成0.500 0 g/L的标准工作液,再从中吸取2.5 mL于新的5 mL容量瓶中,正己烷定容,制成0.250 0 g/L的标准工作液,以此类推,分别制成0.500 0、0.250 0、0.125 0、0.100 0、0.050 0 g/L的标准工作液以供GC-MS检测使用。每个质量浓度的标准储备液和标准工作液重复进样3次。
1.2.3.2 大豆、细菌型豆豉、毛霉型豆豉和曲霉型豆豉脂肪酸甲酯化
在已提取粗脂肪的15 mL试管中,加入0.5 mol/L氢氧化钾-甲醇溶液3 mL,60℃水浴酯化15 min,冷却至室温,加入体积分数5%硫酸-甲醇溶液3 mL,60℃水浴酯化15 min,冷却后加入少许无水硫酸钠,4 000 r/min离心2 min。静置分层,吸取上清液于干燥洁净试管中,使用旋涡混合器使其混合均匀,通过0.22 μm的滤膜过滤后注入干燥好的洁净样品瓶中。
1.2.3.3 GC条件
色谱柱:CD-WAX石英毛细管柱(30 m×0.25 mm,0.25 μm);升温程序:柱温45℃,保持1 min,以5℃/min速率升温至290℃,保持2 min。载气:高纯氦气(99.999%);流速1.0 mL/min;进样口温度为250℃;不分流进样;进样量1 μL。
1.2.3.4 MS条件
电子轰击离子源;离子源温度200℃;发射电流150 μA;倍增器电压1 037 V;萃取头接口温度220℃;电子能量70 eV;质量扫描范围 (m/z)45~500 。
1.2.4 数据处理
样品均进行3次重复,将检测结果进行定性和定量分析,采用SAS、Origin7.5等软件进行数据分析,比较不同方法之间的差异性。
定性分析:将检测信息用美国国家标准技术研究所NIST14s.LIB谱库检索,查询文献资料,对大豆、毛霉型豆豉、细菌型豆豉和曲霉型豆豉中各脂肪酸甲酯进行核对和确认(相似度值≥90%,相对含量≥0.1%)。
定量分析:采用峰面积归一化法计算各成分的相对含量,外标法计算各成分的绝对含量。
2 结果与分析
2.1 目标物的标准曲线及其相关系数
经过GC-MS分析得到37种脂肪酸甲酯混标总离子流图,结果见图1。根据各相关色谱峰的离子质量,并检索NIST14s.LIB谱库,确定其脂肪酸的种类。从图1可知,脂肪酸甲酯总离子流图基线稳定且离子峰基本分离。
图137种脂肪酸甲酯混标的总离子流图
根据不同质量浓度37种脂肪酸甲酯混标的总离子流图,以标准品质量浓度为横坐标(x),相对应的峰面积为纵坐标(y),进行线性回归,结果见表1。

表1 主要脂肪酸甲酯线性关系
从表1可知,各标准曲线的相关系数均在0.999 0以上,说明在测定质量浓度范围内,12种脂肪酸甲酯线性关系良好,适合于4种大豆及大豆制品相关脂肪酸的定量分析。
2.2 大豆、毛霉型豆豉、细菌型豆豉及曲霉型豆豉主要脂肪酸的组成及含量
采用NIST 14s.LIB质谱数据库和人工谱图解析相结合的手段将色谱图进行比对,对总离子流图中各组分进行峰面积归一化,结合脂肪酸甲酯标准曲线得出大豆、毛霉型豆豉、细菌型豆豉以及曲霉型豆豉中脂肪酸组成及含量(以干基计),结果见表2。
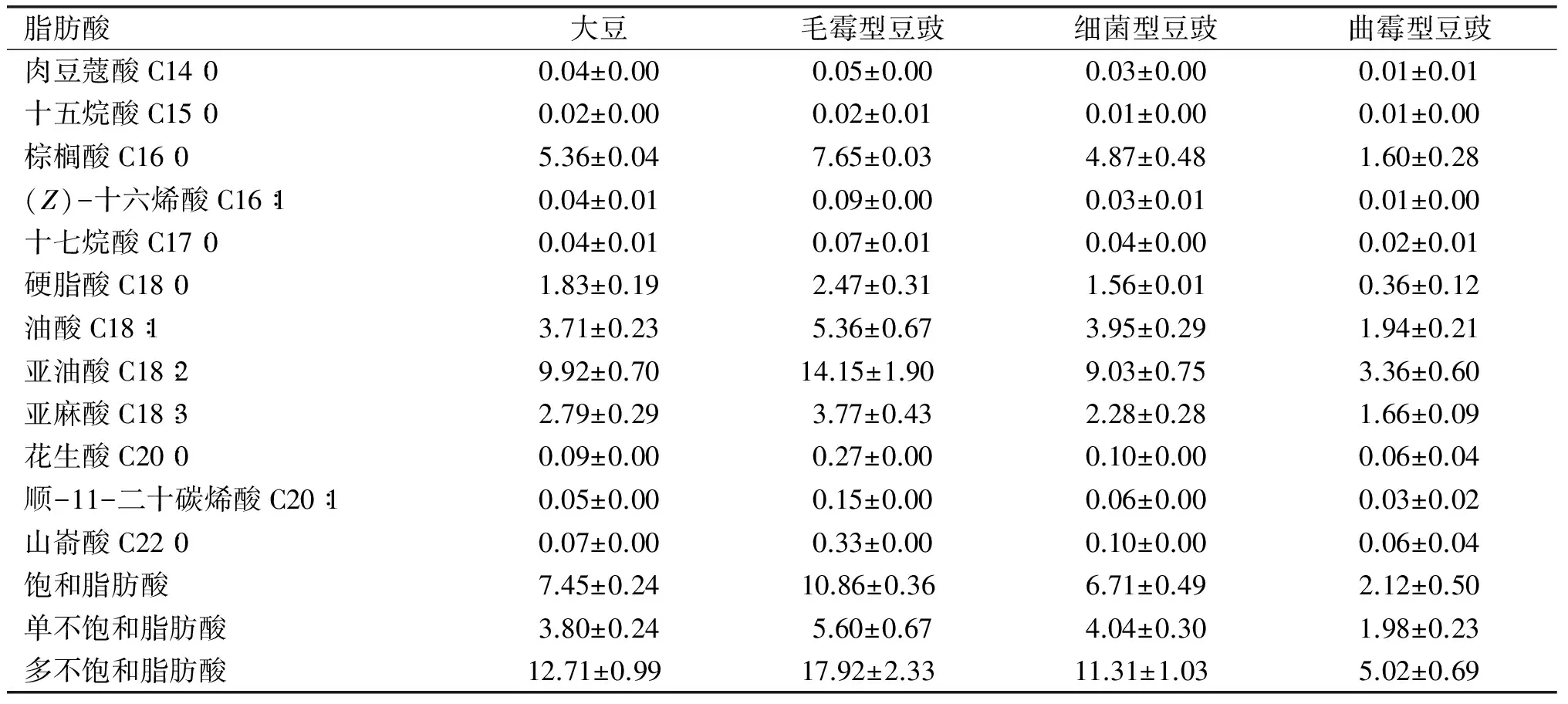
表2 大豆、毛霉型豆豉、细菌型豆豉、曲霉型豆豉的脂肪酸组成及含量 g/100 g
2.2.1 脂肪酸总含量异同分析
从表2可知,4 种样品主要的脂肪酸均由C14~C22之间的饱和及不饱和脂肪酸组成,均含有12种相同种类脂肪酸,其中7种饱和脂肪酸,5种不饱和脂肪酸,说明大豆发酵不会改变其脂肪酸种类。4种样品主要脂肪酸均为棕榈酸、硬脂酸、油酸、亚油酸和亚麻酸,这与邹筱等[7]研究大豆的结果一致,与雷雨和等[8]分析毛霉型豆豉的结果相同。脂肪酸种类与田甜等[9]用酸碱甲酯化法从豆酱中得到的脂肪酸种类相近,显著多于酸甲酯化法和碱甲酯化法处理豆酱检测得到的脂肪酸种类,表明甲酯化方法对脂肪酸分析结果的影响较大。
毛霉型豆豉的不饱和脂肪酸含量最高(23.52 g/100 g),分别是大豆、细菌型豆豉、曲霉型豆豉中不饱和脂肪酸的1.42倍、1.53倍、3.36倍。有研究发现丹贝(根霉型豆豉)中不饱和脂肪酸含量是原料大豆的5.52倍,纳豆(细菌型豆豉)的7.15倍[10]。表明不同微生物和不同加工工艺对脂肪酸有影响,具体原因有待进一步探究。毛霉发酵使大豆的不饱和脂肪酸含量升高,一方面可能是因为毛霉型豆豉后发酵阶段是一个厌氧发酵阶段,且食盐、白酒等的添加使大部分微生物生长受到抑制,在氧气含量较低及酯酶受到抑制的情况下,脂肪酸自动氧化速率大大降低;另一方面可能是亚麻酸是生物膜的结构材料,毛霉在发酵生长过程中具有超常的油脂合成能力,同时油脂中含有γ-亚麻酸,利用毛霉、雅致枝霉、根霉生产γ-亚麻酸早有报道[11],亚油酸含量升高也可能是这个原因,确切原因还有待进一步考究;纳豆芽孢杆菌和曲霉发酵大豆后不饱和脂肪酸含量有所降低,是因为发酵过程中微生物的生长需要能量,消耗了大量的碳水化合物之后,需要消耗脂肪作为能量补充。4种样品中多不饱和脂肪酸为亚油酸和亚麻酸,均为必需脂肪酸,是人体生长和发育的必需物质,必需脂肪酸摄入不足是免疫力降低、疲劳、健忘、视力减退以及各种心脑血管疾病和癌症等的诱因[12-13]。因此,适当多吃豆豉可以预防心血管等一系列疾病。
2.2.2 棕榈酸含量差异
棕榈酸又称软脂酸,是饱和脂肪酸的一种。传统观点认为碳链长度为C12~C16的饱和脂肪酸如肉豆蔻酸、棕榈酸等会引起血清总胆固醇的升高,而血清总胆固醇水平越高,心血管疾病的发病率就越高[14]。但是近期有研究表明,饱和脂肪酸与心血管疾病并没有直接联系[15]。且4种样品中,棕榈酸含量均不高,含量最高的是毛霉型豆豉,仅7.65 g/100 g,含量最低的是曲霉型豆豉(1.60 g/100 g),因此豆豉喜爱者不必有太多的担忧。
2.2.3 硬脂酸含量差异
硬脂酸也是饱和脂肪酸的一种,大豆硬脂酸含量为1.83 g/100 g,大豆经过曲霉和纳豆芽孢杆菌发酵后硬脂酸含量均有所降低,而经过毛霉发酵的大豆,硬脂酸含量提高到2.47 g/100 g,可见发酵菌种不同对于硬脂酸的变化有一定影响。有研究发现硬脂酸和ω-3多不饱和脂肪酸一样与心肌梗塞的发病率呈反比,这可能与硬脂酸和ω-3多不饱和脂肪酸与心肌梗塞的发病机理有关[16]。还有研究表明,硬脂酸能作为ω-3多不饱和脂肪酸的补充来源[17]。豆豉中含有少量硬脂酸,适量摄入可改善和提高人体的健康状况。
2.2.4 油酸含量差异
大豆、毛霉型豆豉、细菌型豆豉和曲霉型豆豉油脂中主要的单不饱和脂肪酸为油酸。4种样品中油酸含量均较高,含量从高到低依次是毛霉型豆豉、细菌型豆豉、大豆、曲霉型豆豉,表明大豆经毛霉和细菌发酵之后油酸含量均得到提高,而经过曲霉发酵其含量反而降低,毛霉型豆豉和细菌型豆豉其油酸含量升高是由于在发酵的过程中多不饱和脂肪酸氧化所得。同时油脂中油酸和亚油酸共存时,亚油酸可诱导油酸氧化,可能是在曲霉型豆豉中油酸氧化的速率大于多不饱和脂肪酸自动氧化成油酸的速率。多年来,对单不饱和脂肪酸的生理与保健作用存在争议,但近年来的研究普遍认为顺式单不饱和脂肪酸对胆固醇和血糖有明显的降低作用[18-19],即油酸有降低胆固醇和血糖的作用。
2.2.5 亚油酸含量差异
4种样品含有的多不饱和脂肪酸中亚油酸的含量最高。曲霉型豆豉中亚油酸含量最低,而毛霉型豆豉中亚油酸含量高达14.15 g/100 g。作为最早被确认的必需脂肪酸和重要的多不和脂肪酸,人体每天摄取6 g亚油酸,才能维持正常的生理代谢,它具有防癌抗癌、增强机体免疫力、 抗粥状动脉硬化和预防非酒精性脂肪肝以及炎症等多种生理功能[20]。对于需要摄入较多亚油酸的人群,适当地多食用毛霉型豆豉是比较适宜的。
2.2.6 亚麻酸含量差异
亚麻酸是一种必需脂肪酸,在体内代谢可生成二十二碳六烯酸和二十碳五烯酸。亚麻酸同样具备多不饱和脂肪酸的多种生理功能,突出表现在具有改善记忆力、健脑、预防老年痴呆症、增强机体免疫力以及对心血管疾病的防治上[21-22]。4种样品中亚麻酸含量均较高。
3 结 论
本研究在大豆、毛霉型豆豉、细菌型豆豉和曲霉型豆豉中均鉴定出12种脂肪酸,说明发酵不会改变大豆中的脂肪酸种类。4种样品中饱和脂肪酸以棕榈酸为主,单不饱和脂肪酸以油酸为主,且不饱和脂肪酸含量较高。另外还含有少量其他种类的脂肪酸如:十五烷酸、肉豆蔻酸、花生酸、山嵛酸等。研究表明:不同菌种发酵的大豆中脂肪酸在含量上均存在一定的差异,相比原料大豆,毛霉型豆豉脂肪酸含量大幅提高,细菌型豆豉和曲霉型豆豉脂肪酸含量有所降低。其中毛霉型豆豉中不饱和脂肪酸含量最高,达23.52 g/100 g。因此,毛霉型豆豉是不饱和脂肪酸的新型来源,可作为膳食营养补充剂添加到食品中,进一步开发为功能性食品。
[1] LI F. Angiotensin I-converting enzyme inhibitory activities of Chinese traditional soy-fermented douchi and soypaste: effects of processing and simulated gastrointestinal digestion[J]. Int J Food Prop, 2015, 18(4):934-944.
[2] YUICHI A, MASANORI H, HIROKI N, et al. Very-long-chain polyunsaturated fatty acids accumulate in phosphatidylcholine of fibroblasts from patients with Zellweger syndrome and acyl-CoA oxidase1 deficiency[J]. Biochim Biophys Acta, 2014, 1841(4):610-619.
[3] SERTOGLU E, KURT I, TAPAN S, et al. Comparison of plasma and erythrocyte membrane fatty acid compositions in patients with end-stage renal disease and type 2 diabetes mellitus[J]. Chem Phys Lipid, 2014, 178(1):11-17.
[4] 徐春涛, 冷小冰, 陈穗,等. 酱油渣油脂中功能性脂肪酸、反式脂肪酸及维生素E分析[J]. 中国酿造, 2014, 33(9):63-65.
[5] 周思静, 李淑荣, 王志东,等. 丹贝营养成分的研究[J]. 食品工业科技, 2013, 34(2):336-338.
[6] 田甜. 东北豆酱自然发酵过程中风味品质与微生物变化规律研究[D]. 沈阳:沈阳农业大学, 2015:14-29.
[7] 邹筱, 韩粉霞, 陈明阳,等. 大豆脂肪酸主要组分含量QTL定位[J]. 作物学报, 2014, 40(9):1595-1603.
[8] 雷雨和, 眭玥, 骞宇,等. 永川毛霉型豆豉中脂肪酸提取方法比较研究[J]. 中国调味品, 2014(5):114-117.
[9] 田甜, 武俊瑞, 岳喜庆. 传统豆酱中脂肪酸酯化方法的选择与组成分析[J]. 食品科学, 2014, 35(18):78-83.
[10] 周思静. 丹贝生产工艺优化及功能特性的研究[D]. 北京:中国农业科学院, 2012:19-23.
[11] JEENNOR S, LAOTENG K, TANTICHAROEN M, et al. Evaluation of inoculum performance for enhancinggamma-linolenic acid production fromMucorrouxii[J]. Lett Appl Microbiol, 2008, 46(4):421-427.
[12] KAUR N, CHUGH V, GUPTA A K. Essential fatty acids as functional components of foods—a review[J]. J Food Sci Technol, 2014, 51(10):2289-2303.
[13] 王莉梅, 刘睿杰, 金青哲,等. 多不饱和脂肪酸在癌症发生中的作用机制研究进展[J]. 中国油脂, 2014,39(8):37-41.
[14] EGUCHI K, MANABE I, OISHI-TANAKAA Y, et al. Saturated fatty acid and TLR signaling linkβ- cell dysfunction and islet inflammation[J]. Cell Metab, 2012, 15(4):518-533.
[15] LEGRAND P, RIOUX V. Specific roles of saturated fatty acids: beyond epidemiological data[J]. Eur J Lipid Sci Technol, 2015, 117(10):1489-1499.
[16] FLOCK M R, KRIS-ETHERTON P M. Diverse physiological effects of long-chain saturated fatty acids: implications for cardiovascular disease[J]. Curr Opin Clin Nutr Metab Care, 2013, 16(2):133-140.
[17] WALKER C G, JEBB S A, CALDER P C. Stearidonic acid as a supplemental source ofω-3 polyunsaturated fatty acids to enhance status for improved human health[J]. Nutrition, 2012, 29(2):363-369.
[18] FINUCANE O M, LYONS C L, MURPHY A M, et al. Monounsaturated fatty acid enriched high fat-diets impede adipose NLRP3 inflammasome mediated IL-1βsecretion and insulin resistance despite obesity[J]. Diabetes, 2015, 64(6):2116-2128.
[19] BARROS C R D, CEZARETTO A, CURTI M L R, et al. Realistic changes in monounsaturated fatty acids and soluble fibers are able to improve glucose metabolism[J]. Diabetolo Metab Syndr, 2014, 6(1):1-8.
[20] TAMMA S M, SHORTER B, TOH K L, et al. Influence of polyunsaturated fatty acids on urologic inflammation[J]. Int Urol Nephrol, 2015, 47(11):1753-1761.
[21] CHEN C, SUN B, GUAN W, et al.N-3 essential fatty acids in Nile tilapia,Oreochromisniloticus: effects of linolenic acid on non-specific immunity and anti-inflammatory responses in juvenile fish[J]. Aquaculture, 2016, 5(1):250-257.
[22] SALAVILA A, GUASCHFERRÉ M, HU F B, et al. Dietaryα-linolenic acid, marineω-3 fatty acids, and mortality in a population with high fish consumption: findings from the PRE vención con DIeta MEDiterránea (PREDIMED) study[J]. J Am Heart Assoc, 2016, 5(1):1-12.
GC-MSanalysisoffattyacidcompositioninmucor-type,bacterial-typeandaspergillus-typedouchi
XIE Yanhua1, XIE Jing1, LI Pao1, CHEN Miaofen2, JIANG Liwen1,3, CHEN Lili1,3
(1.College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China; 2.National and Provincial Union Engineering Research Center for the Veterinary Herbal Medicine Resources and Initiative, Changsha 410128, China; 3. Hunan Provincial Key Laboratory of Food Science and Biotechnology, Changsha 410128, China)
The crude fats in soybean, mucor-type, bacterial-type and aspergillus-type douchi were extracted by hexane and esterified with KOH-CH3OH and H2SO4-CH3OH. The fatty acid composition was analyzed by gas chromatography-mass spectrometry (GC-MS) and quantified by an external standard method. The results showed that twelve kinds of fatty acids were detected in soybean, mucor-type, bacterial-type and aspergillus-type douchi, including seven kinds of saturated fatty acids, three kinds of monounsaturated fatty acids and two kinds of polyunsaturated fatty acids. Among these fatty acids, the content of linoleic acid was the highest and the content of unsaturated fatty acids was higher than that of saturated fatty acids. The contents of unsaturated fatty acids (dry basis) from high to low were mucor-type douchi(23.52 g/100 g), soybean (16.51 g/100 g), bacterial-type douchi (15.35 g/100 g) and aspergillus-type douch (7.00 g/100 g). After soybean fermented into mucor-type douchi, the contents of main fatty acids increased. However, after soybean fermented into bacterial-type and aspergillus-type douchi, the contents of main fatty acids decreased.
soybean;mucor-type douchi;bacterial-type douchi; aspergillus-type douchi;fatty acid; GC-MS
2016-11-01;
:2017-03-20
国家自然科学基金项目(31371828)
谢艳华(1990),女,在读硕士,研究方向为粮食、油脂及植物蛋白工程(E-mail)1522129239@qq.com。
蒋立文,教授(E-mail)jlw_2002cn@yahoo.com.cn;陈力力,教授(E-mail)chenlili001@tom.com。
TS225.2; TQ644.3
:A
:1003-7969(2017)07-0115-06
