酶法全酯化合成富含EPA/DHA甘油酯工艺研究
2017-09-15朱东奇李道明王卫飞王永华
朱东奇 李道明 王卫飞 杨 博 王永华
(华南理工大学食品科学与工程学院1,广州 510640) (华南理工大学化学与化工学院2,广州 510640) (华南理工大学生物科学与工程学院3,广州 510006)
酶法全酯化合成富含EPA/DHA甘油酯工艺研究
朱东奇1李道明1王卫飞2杨 博3王永华1
(华南理工大学食品科学与工程学院1,广州 510640) (华南理工大学化学与化工学院2,广州 510640) (华南理工大学生物科学与工程学院3,广州 510006)
以富含EPA/DHA的脂肪酸为底物,采用两步酶法合成富含EPA和DHA的甘油酯。首先,以T1脂肪酶为催化剂催化富含EPA/DHA的脂肪酸和甘油反应;在最优条件为:反应温度40 ℃,水分添加量为底物混合物的3%、甘油与脂肪酸摩尔比3∶1和酶添加量50 U/g底物混合物时,富含EPA/DHA的脂肪酸的转化率达到62%以上,此时产物中甘油三酯、甘油二酯、甘油单酯的质量分数分别为10.52%、38.15%、25.64%。将游离酶催化酯化反应产物中的油相回收,利用自制的固定化CALB(Lipozyme®CALB L固定于环氧树脂ECR8285上)为催化剂,在真空条件下继续催化未反应的脂肪酸与偏甘油酯(甘油单酯和甘油二酯)继续酯化反应12 h,此时产物中甘油三酯、甘油二酯和甘油单酯的质量分数分别达到38.34%、51.02%、10.63%,没有检测到脂肪酸的存在。
全酯化 转化率 EPA/DHA甘油酯 游离酶 固定化酶
研究发现,二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)等ω-3型长链多不饱和脂肪酸,对人体具有重要的生理功能:降低人体脂肪过度积累、调节人体的脂质代谢、治疗和预防心脑血管疾病、抗癌等[1-4]。EPA和DHA是胎儿正常发育的必需脂肪酸,在怀孕期间摄取可以减少婴儿免疫反应,降低婴儿过敏的发病率[5-6]。随着生活水平的提高,人们对膳食营养越来越重视,近年来,作为重要的医药和保健食品原料的EPA和DHA的深加工技术受到越来越广泛的关注。EPA和DHA主要来源于深海鱼油,天然油脂中EPA和DHA含量较低。目前,多不饱和脂肪酸工业中,人们主要利用乙酯化、分子蒸馏、尿素包合、高真空精馏等工艺分离纯化海洋鱼油中的EPA和DHA,以获得高纯度的EPA和DHA乙酯或脂肪酸产品[7]。作为人和动物体脂类代谢的天然底物,甘油酯型的EPA和DHA产品稳定性更好、生物利用度更高。因此,近年来人们对将EPA、DHA乙酯或脂肪酸转化为甘油酯的生产工艺进行了大量研究[8-11]。
酶法加工技术反应条件温和,而且转化率高、具有良好的底物特异性,非常适用于多不饱和脂肪酸深加工工艺,避免了其他加工工艺在多不饱和脂肪酸深加工过程中因EPA和DHA等脂肪酸化学性质活泼而发生氧化及双键的反式等问题。在催化酯化反应体系中,游离脂肪酶作为催化剂具有反应速率快、传质效率高,但同时也存在PUFA酰基供体转化率较低的劣势。以固定化脂肪酶为催化剂时,可以在真空状态下除去反应过程中生成的水,使反应向产物生成的方向进行,从而提高PUFA酰基供体的转化率;但是,反应体系中高黏度的甘油限制了其传质效率,使得反应效率较低,一般只能通过添加有机溶剂或采用流加甘油的方式进行[12]。
本研究以游离脂肪酶和固定化脂肪酶为催化剂,采用两步酶法催化富含EPA/DHA的脂肪酸与甘油发生酯化反应制备富含EPA/DHA的甘油酯。首先,利用游离酶催化富含EPA和DHA的脂肪酸与甘油进行酯化反应,反应达到平衡后回收反应产物中的油相。随后以第1步回收的油相为底物,添加固定化酶为催化剂,在真空条件下催化未反应完的脂肪酸与甘油单酯或甘油二酯进一步酯化,以提高脂肪酸的转化率,最终得到以甘油三酯和甘油二酯为主的EPA/DHA甘油酯产品。
1 材料与方法
1.1 主要材料与试剂
D4455(Lipozyme®CALB L固定于大孔树脂ECR1030) 、环氧树脂ECR8285:漂莱特(英国)有限公司;T1脂肪酶[13]、固定化CALB (Lipozyme®CALB L固定于环氧树脂ECR8285):自制;富含EPA/DHA的脂肪酸(棕榈酸1.1%; 油酸2.18%;亚麻酸1.42%;EPA38.11%;DHA45.49%;甘油三酯18.66%;脂肪酸73.00%;甘油二酯6.93%;甘油单酯1.40%);甘油二酯(15%的1,2-DAG和85%的1,3-DAG,CAS no.25637-84-7)和甘油三酯(CAS no.122-32-7)标准品: Sigma-Aldrich(中国)有限公司;异丙醇、正己烷为色谱纯:thermo fisher(美国)科技公司;氢氧化钠、丙三醇为分析纯:上海润捷化学试剂有限公司。
1.2 主要仪器设备
Waters 2695型高效液相色谱议(配备Waters 2414型示差检测器):美国Waters公司;富斯特FX-8型旋片真空泵:上海富斯特真空泵有限公司。
1.3 试验方法
1.3.1 固定化CALB的制备
经过前期试验,环氧树脂(ECR8285)在pH为5,缓冲液离子浓度为1 mol/L,Lipozyme®CALB L(蛋白质量浓度为8 mg/mL)酶加量为120 mg/g载体时,通过共价结合方式固定化的Lipozyme®CALB L活力最高,可以达到22 967 U/g,固定化酶的比活力和蛋白吸附量分别可以达到208.32 U/mg和110.25 mg。将固定的Lipozyme®CALB L置于40 ℃真空干燥箱内真空干燥8 h,得到固定化CALB。
1.3.2 酶催化酯化反应
T1脂肪酶催化富含EPA/DHA的脂肪酸与甘油酯化:在50 mL具塞三角瓶中加入总质量为20 g的不同底物摩尔比的甘油和富含EPA/DHA的脂肪酸,并充氮气保护,然后将其置于恒温加热磁力搅拌器中预热到一定温度,添加一定量的游离酶后,开始反应。每隔一定时间取样分析反应混合物中的产物组成,酯化反应180 min后离心回收上层油相。
T1脂肪酶回收利用:将游离酶催化酯化反应平衡时的油相与甘油相分离,脂肪酶分散于甘油和水相中,将回收的甘油相在40 ℃、100 Pa的真空条件下降低水分含量至恒重,然后补加一定量的甘油、水和富含EPA/DHA的脂肪酸,使每个批次反应的条件一致,随后进行下一个批次反应。
固定化酶催化未反应的富含EPA/DHA的脂肪酸与偏甘油酯酯化:回收T1脂肪酶催化富含EPA/DHA的脂肪酸与甘油酯化反应的油相产物,置于50 mL具塞三角瓶中,并在恒温加热磁力搅拌器中预热到一定温度,添加一定量的固定化酶后开始反应,反应在100 Pa的真空条件下进行,每隔一定时间取样分析反应混合物中的产物组成。
1.3.3 反应混合物组成分析
取1 mL反应混合物,在10 000 r/min下离心5 min,取上层油相0.02 mL于2 mL EP管中,加入0.5 g的无水硫酸钠,1 mL的流动相(正己烷∶异丙醇∶甲酸=18∶1∶0.003,体积比),于10 000 r/min离心1 min,取0.8 mL上层有机相进行高效液相色谱分析。色谱柱为Phenomenex Luna Silica (2) (4.6 mm i.d.×250 mm, 5 μm particle size),色谱柱温为30 ℃,流动相流速1.0 mL/min。(物质的出峰顺序为:甘油三酯、脂肪酸、1,3-甘油二酯、1,2(2,3)-甘油二酯,1(3)-单甘油酯,2-单甘油酯不同组分利用标准品进行定性,各个组分含量按面积归一化法进行计算,结果采用平均值±标准差表示(n=3)。
1.3.4 脂肪酸转化率的计算
转化率按式(1)计算:

(1)
式中:M0为反应底物中脂肪酸的含量,Mt为t时刻反应体系中混合物中脂肪酸含量。
2 结果与讨论
2.1游离酶催化富含EPA/DHA的脂肪酸与甘油的酯化反应
2.1.1 不同酶加量对酯化反应的影响
与化学法催化不同,脂肪酶在催化酯化反应时,不同酶加量不仅影响反应达到平衡时的快慢,而且影响脂肪酸转化率及产物中甘油酯的组成[14]。本研究考察了酶的添加量对富含EPA/DHA的脂肪酸与甘油酯化反应的影响。反应条件为:常压条件下,甘油与富含EPA/DHA的脂肪酸的底物摩尔比为1∶1,酯化反应温度为40 ℃,水分添加量为反应混合物的3%,T1脂肪酶的添加量分别为25、50、75、100、125 U/g底物混合物。脂肪酸转化率及酯化反应180 min后产物组成如图1所示。


图1 酶加量对酯化反应的影响
由图1a可知,酶加量从25 U/g增加到50 U/g时,脂肪酸转化速率显著增加,继续增加酶加量到125 U/g时,反应达到平衡所需时间缩短,但脂肪酸转化率增加不明显。当酶加量为50 U/g时,酯化反应180 min后,脂肪酸转化率达到47.89%,由图1b可知,甘油三酯的质量分数为10.45%、甘油二酯的质量分数为34.61%、甘油单酯的质量分数为16.89%。当酶加量从50 U/g增加到125 U/g时,脂肪酸转化率和产物中甘油酯含量均变化不大。这是因为在酯化反应体系中酶以与底物络合物的形式存在,当酶加量较低时,这种酶与底物络合物的质量浓度不高,因此脂肪酸转化的速率较慢;随着酶加量的增加,酶与底物络合物的质量浓度增加,其转化率也增加。而酶加量过高时,由于酶与底物络合物的质量浓度达到饱和,脂肪酸转化速率不再增加。考虑到在实际生产工艺中酶加量过高将导致成本增加,因此选取50 U/g的酶加量进行后续试验。
2.1.2 底物摩尔比对酯化反应的影响
甘油的添加量对酶催化酯化反应效果有非常显著的影响。大量的甘油可以加快脂肪酸的酯化反应速率,增大酯化程度[15]。本研究以T1脂肪酶为催化剂,考察不同底物摩尔比的甘油与富含EPA/DHA脂肪酸对酯化反应的影响。反应条件为:常压条件下,酯化反应温度为40 ℃,水分添加量为反应混合物的3%,T1脂肪酶的添加为50 U/g底物混合物,甘油与富含EPA/DHA的脂肪酸的底物摩尔比为1∶2、1∶1、2∶1、3∶1、4∶1。脂肪酸转化率及酯化反应180 min后产物组成如图2所示。
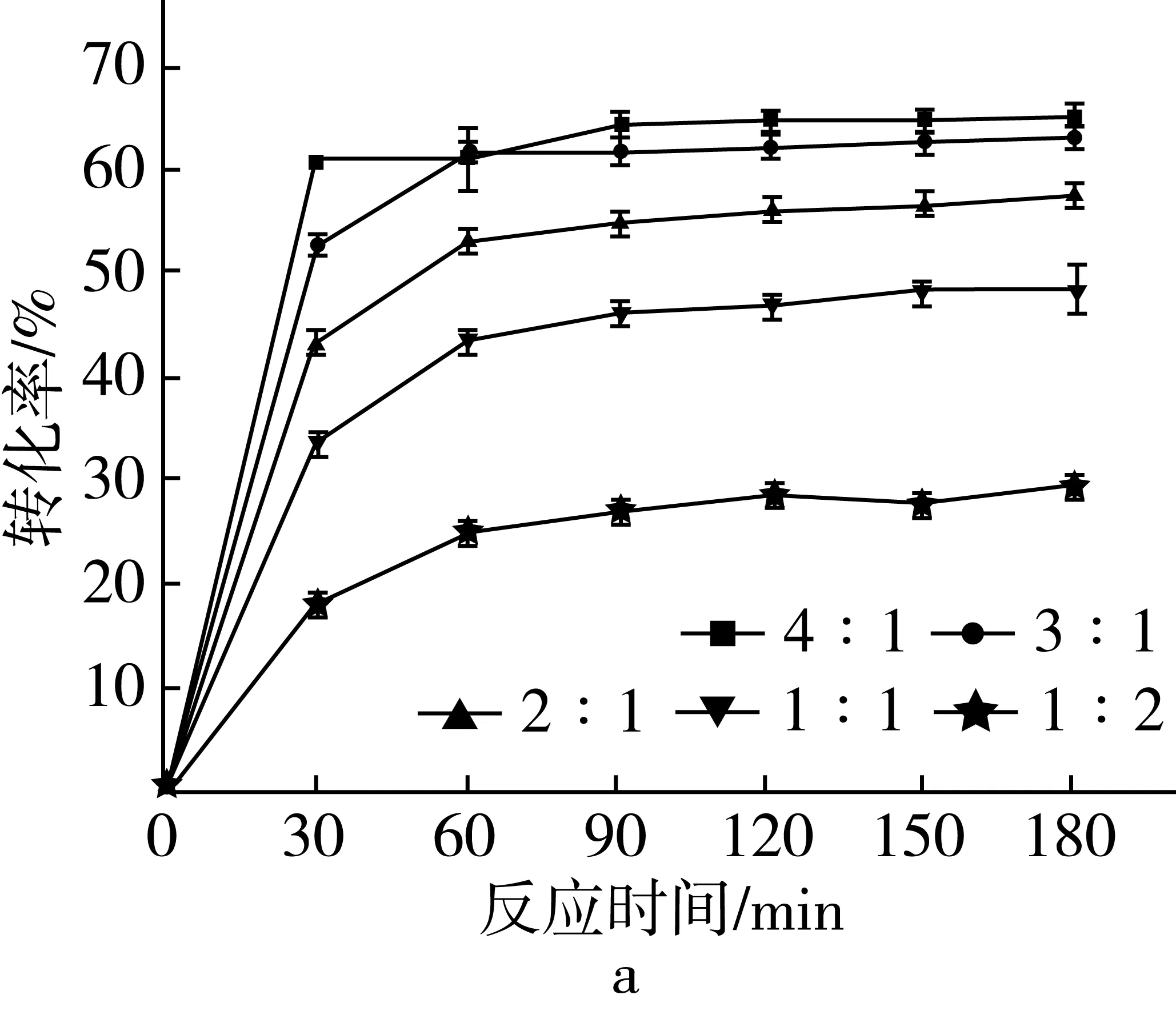

图2 底物摩尔比对酯化反应的影响
由图2a可知,随着底物混合物中甘油比例从1∶2增加到4∶1时,脂肪酸酯化的初始反应速率不断增加,说明大量甘油可以加快脂肪酸在酯化反应时的转化速率。当甘油和脂肪酸的摩尔比为1∶1,反应180 min时,脂肪酸的转化率为47.89%;当甘油和脂肪酸的摩尔比为3∶1,反应180 min时,脂肪酸的转化率为62.33%,产物中甘油三酯的质量分数为10.52%,偏甘油酯的质量分数为63.79%;继续增加底物摩尔比到4∶1时,虽然脂肪酸转化率达到最大的64.21%,但产物中甘油三酯8.75%和偏甘油酯65.11%的含量与3∶1时几乎相当。因此,选取甘油和脂肪酸的摩尔比为3∶1来进行后续试验。
2.1.3 反应温度对酯化反应的影响
温度不仅影响反应底物混合物的黏度,影响传质,还影响酶的半衰期、选择性、稳定性及酶活力,且酶反应的最适温度不仅与酶自身的特性也与反应底物性质有关[16-18]。本研究以T1脂肪酶为催化剂,考察不同温度对富含EPA/DHA脂肪酸和甘油酯化反应的影响。反应条件为:常压条件下,甘油与富含EPA/DHA的脂肪酸的底物摩尔比为3∶1,水分添加量为反应混合物的3%,T1脂肪酶的添加为50 U/g底物混合物,酯化反应温度分别为40、45、50、55、60 ℃。脂肪酸转化率及酯化反应180 min后产物组成如图3所示。


图3 反应温度对酯化反应的影响
由图3a可知,当反应温度从40 ℃升高至60 ℃时,脂肪酸初始转化速率迅速下降;当反应温度为55 ℃时,反应180 min后脂肪酸转化率仅为10.92%,且酯化反应30 min后脂肪酸转化率不在增加,说明在温度为55 ℃,反应30 min后,脂肪酶不再催化脂肪酸与甘油发生酯化反应,此时的脂肪酶可能由于高温已经变性失活,无法继续催化酯化反应。在反应温度为40 ℃,经过180 min反应后,脂肪酸转化率为62.33%,由图3b可知,产物中甘油三酯和偏甘油酯的质量分数分别达到10.52%和63.79%;随着反应温度的升高,脂肪酶不同程度的变性失活,脂肪酸转化率和产物中甘油三酯和偏甘油酯的含量逐渐降低。因此,选择反应温度为40 ℃来进行后续试验。
2.1.4 水分添加量对酯化反应的影响
在非水相体系中催化酯化反应时,酶对水分含量极其敏感,当加水量低于酶催化所需的临界水时,酶将不能维持其催化活性所需的三维构象。过高的水分含量会导致酶聚集成团,降低酶催化反应速率;同时,过多的水也会导致水解副反应的发生[9,19-21]。本研究以T1脂肪酶为催化剂,考察不同水分添加量对富含EPA/DHA脂肪酸和甘油酯化反应时的影响。反应条件为:常压条件下,甘油与富含EPA/DHA的脂肪酸的底物摩尔比为3∶1,T1脂肪酶的添加为50 U/g底物混合物,酯化反应温度为40 ℃,水分添加量分别为反应混合物质量的1%、3%、5%、7%、9%。脂肪酸转化率及酯化反应180 min后产物组成如图4所示。

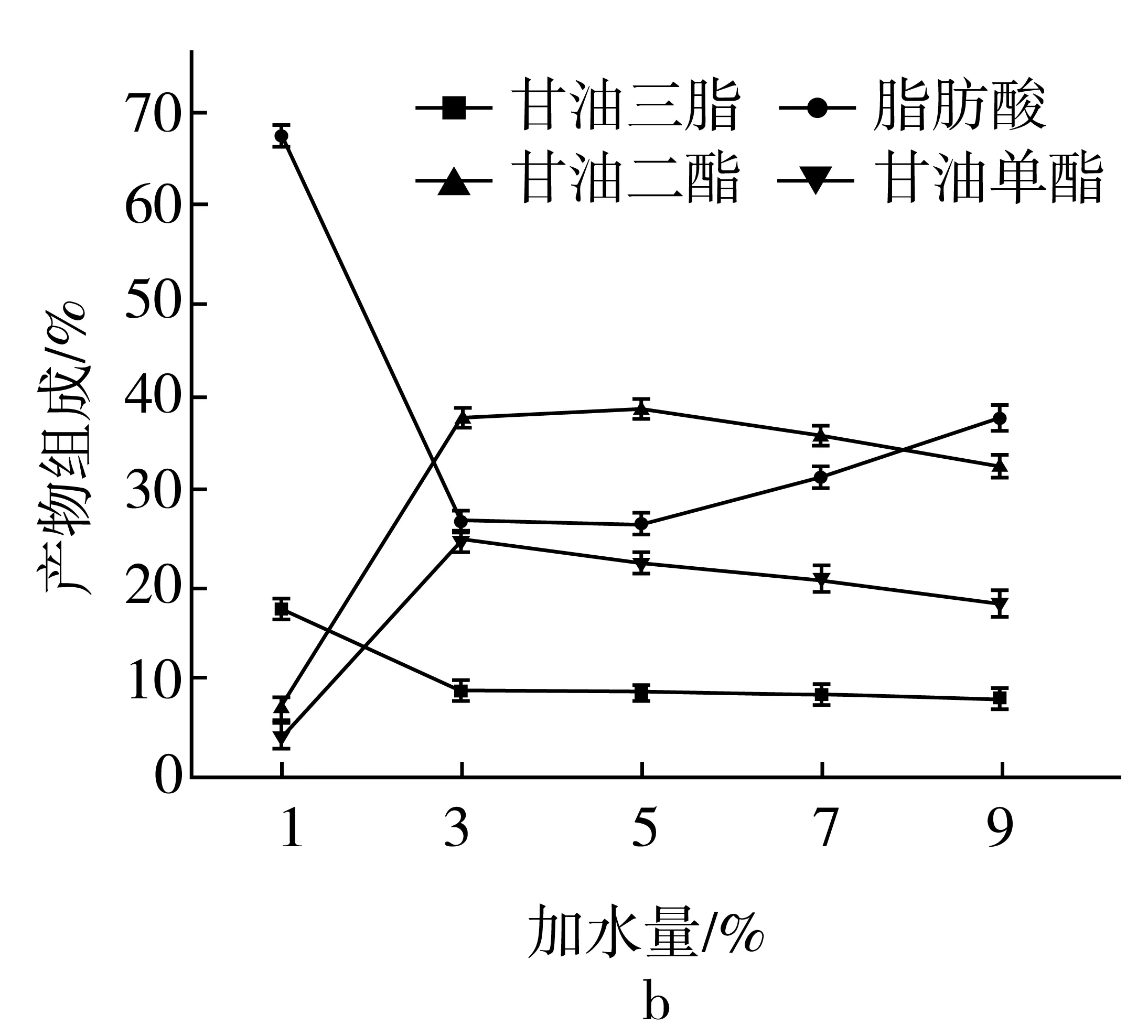
图4 水分添加量对酯化反应的影响
由图4a可知,当加水量为1%时,反应前30 min内,脂肪酸转化率增加迅速,随着反应的进行,脂肪酸转化率增加不明显,这说明脂肪酶需要一定量的水才能表现出其活力。当加水量从1%增加到3%时,反应180 min后,脂肪酸转化率从9.03%升高到62.33%,说明适量的水分对于脂肪酶催化酶促反应是必需的。当加水量从3%增加到5%时,脂肪酸的转化率几乎相当,但反应180 min后,由图4b可知,产物中偏甘油酯的质量分数前者(63.79%)略高于后者(62.27%)。当加水量从5%增加到7%和9%时,反应180 min后,脂肪酸转化率都较加水量为5%时有所下降,且加水量为9%的脂肪酸转化率(48.11%)低于加水量为7%的脂肪酸转化率(56.12%)。这可能是因为水作为酯化反应的产物之一,过量的水会阻碍反应向正向进行。因此,选取加水量为3%进行试验。
2.1.5 反应批次对游离酶催化酯化反应的影响
分离并回收酯化反应达到平衡时产物混合物中的油相和甘油相,脂肪酶分散于甘油和水相中。在油脂的酶法加工工艺中,酶制剂的使用成本是影响整个工艺经济性和可行性的关键因素之一。将回收的甘油相在40 ℃、100 Pa的真空状态下降低水分含量至恒重,然后补加一定量的甘油、水和富含EPA/DHA的脂肪酸,使反应体系达到:甘油与脂肪酸的总质量为20 g,甘油与富含PUFA的脂肪酸的底物摩尔比为3:1、水分添加量为3%底物混合物,常压条件下于40 ℃的恒温磁力搅拌器中进行下一个批次的反应,每个批次的反应时间为180 min,考察反应批次对游离脂肪酶催化富含EPA/DHA的脂肪酸与甘油酯酯化反应的影响,结果如图5所示。

图5 反应批次对酯化反应的影响
由图5可知,每个批次反应180 min,将脂肪酶回收后重复使用10个批次,脂肪酸的转化率仍可达到60%以上,这说明在本反应体系中T1脂肪酶的操作稳定性良好;同时由图可知每个批次反应产物中甘油三酯、甘油二酯和单甘油酯的含量变化不大,说明本工艺具有良好的重现性,这对于实现本工艺的产业化应用具有重要意义。同时测定180 min后每个批次反应体系中的过氧化值,均不高于8.68 mmol/kg。在本反应体系中以T1脂肪酶为催化剂催化富含EPA/DHA的脂肪酸与甘油酯化转化成甘油酯时,脂肪酸的转化率只能达到62%左右,而且产物甘油酯主要以偏甘油酯为主,甘油单酯的质量分数高于25%,甘油三酯质量分数低于11%。
2.2固定化酶催化未反应完的脂肪酸与甘油单酯或甘油二酯的酯化反应
大量研究表明,固定化酶 Novozyme 435在催化长链多不饱和脂肪酸特别是EPA和DHA的反应中,具有很高的催化效率[9-11,21]。本研究以游离脂肪酶催化富含EPA/DHA的脂肪酸与甘油酯化反应达到平衡时的油相产物为底物,利用商品化的D4 455及自制固定化酶CALB为催化剂,在真空条件为100 Pa,60 ℃下进行反应。脂肪酸转化率及酯化反应产物随时间变化如图6、图7所示。

图6 不同固定化酶对脂肪酸转化率的影响


图7 不同固定化酶对酯化反应产物组成的影响
由图6可知,D4455及固定化CALB 在真空条件下均可催化脂肪酸与偏甘油酯继续酯化。在相同酶量添加条件下,固定化CALB催化酯化时脂肪酸转化速率明显快于D4455,固定化CALB在催化酯化反应6 h时脂肪酸转化率达到96.9%,反应进行9 h时反应基本达到平衡,此时的转化率达到99.82%,接近100%;而D4455反应9 h时脂肪酸的转化率仅为97.96%,反应进行到12 h时酯化反应趋于平衡。固定化CALB催化酯化反应进行到12 h后,没有检测到脂肪酸的存在,说明脂肪酸全部转化为甘油酯。D4455催化酯化反应进行到24 h后,没有检测到脂肪酸存在。由图7可知,固定化CALB在催化脂肪酸与偏甘油酯酯化时,反应前6 h主要进行的是脂肪酸与甘油单酯生成甘油二酯,随着反应的进行,随后主要进行的是甘油二酯向甘油三酯转化;D4455在催化脂肪酸与偏甘油酯酯化时,反应前12 h主要进行的是脂肪酸与甘油单酯生成甘油二酯,随着反应的进行,随后主要进行的是甘油二酯向甘油三酯转化。D4455催化酯化反应12 h后的产物组成为:甘油三酯21.78%;甘油二酯63.50%;甘油单酯14.19%,此时反应体系中过氧化值为6.54 mmol/kg。固定化CALB催化酯化反应12 h后的产物组成为:甘油三酯38.34%;甘油二酯51.02%;甘油单酯10.63%,其中甘油三酯的质量分数约为D4455催化时的2倍,此时反应体系中过氧化值为6.37 mmol/kg。Liu等[22]通过利用Novozym 435在有机溶剂体系中催化甘油与n-3 多不饱和脂肪酸反应,在最优条件下,反应24 h后,酯化率可以达到90%,产物中甘油酯的质量分数分别为:甘油三酯为31.3%、甘油二酯为56.1%。固定化脂肪酶催化脂肪酸酯化合成甘油酯是较为成熟的生产工艺,本研究选取2种固定化酶催化酯化反应,结果表明固定化CALB酯化效果明显比D4455好,这可能是由于固定化CALB是Lipozyme®CALB L与环氧树脂ECR8285以共价结合的方式固定化,相对于以大孔吸附对Lipozyme®CALB L进行固定化的D4455,固定化CALB能结合更多的酶蛋白从而表现出更好的催化活性。
3 结论
3.1 以T1脂肪酶为催化剂催化富含EPA/DHA的脂肪酸与甘油酯化。在最优条件:反应温度为40 ℃,水分添加量为底物混合物的3%、甘油与脂肪酸摩尔比3:1和酶添加量为50 U/g底物混合物下反应达到平衡时PUFA的转化率可以达到62%以上,此时产物中甘油三酯、甘油二酯、甘油单酯的质量分数分别为10.52%、38.15%、25.64%,反应体系中的过氧化值为8.68 mmol/kg。
3.2 回收T1脂肪酶催化酯化反应达到平衡时产物中的油相和甘油相,将甘油相中T1脂肪酶回收利用10个批次后,脂肪酸转化率依然可以达到60%以上,并且甘油酯的组成没有显著性差异,说明T1脂肪酶在催化富含EPA/DHA的脂肪酸与甘油酯化时具有良好的操作稳定性。
3.3 以商品化D4455及实验室自制固定化CALB为催化剂分别在真空条件下催化游离酶催化酯化反应回收得到的油相继续进行酯化反应,反应24 h后均检测不到脂肪酸的存在,固定化CALB表现出比D4455更好的优势:达到平衡所需时间短,产物中甘油三酯含量高,反应达到平衡时,反应体系中的过氧化值为6.37 mmol/kg。
[1]Su K P, Huang S Y, Chiu T H, et al. Omega-3 fatty acids for major depressive disorder during pregnancy: results from a randomized, double-blind, placebo-controlled trial[J].Journal of Clinical Psychiatry,2008,69:644-51
[2]孙翔宇,高贵田,段爱莉,等.多不饱和脂肪酸的研究进展[J].食品工业科技,2012,33(7):418-423 Sun X Y,Gao G T,Duan A L, et al.Research progress in polyunsaturated fatty acids[J].Science and Technology of Food Industry,2012,33(7):418-423
[3]Smith G I, Atherton P, Reeds D N, et al.Dietary omega-3 fatty acid supplementation increases the rate of muscle protein synthesis in older adults: a randomized controlled trial[J]. American Journal of Clinical Nutrition,2011,93:402-412
[4]Conquer J A, Tierney M C, Zecevic J, et al.Fatty acid analysis of blood plasma of patients with Alzheimer’s disease, other types of dementia, and cognitive impairment[J].Lipids,2000,35:1305-1312
[5]Dunstan J A, Mitoulas L R, Dixon G,et al.The effects of fish oil supplementation in pregnancy on breast milk fatty acid composition over the course of lactation: a randomized controlled trial[J]. Pediatric Research,2007,62:689-694
[6]Swanson D,Block R, and Mousa S A.Omega-3 fatty acids EPA and DHA: health benefits throughout life[J].American Society for Nutrition, 2012(3):1-7
[7]马海昌,徐达,马永钧,等.响应面分析法优化尿素包合富集鱼油中EPA和DHA工艺研究[J].农业机械,2011,35(9):30-34 Ma H C,Xu D,Ma Y J,et al. Opitimization of enrichmentn of EPA and DHA in fish oils using urea complexation by respone surface methodology[J].Farm Machinery,2011,35(9):30-34[8]Patil D. Recent trends in production of polyunsaturated fatty acids (PUFA) concentrates [J]. Journal of Food Research and Technology ,2014,2(1):15-23
[9]Halldorsson A, Kristinsson B, Glynn C, et al. Separation of EPA and DHA in fish oil by lipase catalyzed esterification with glycerol [J]. Journal of the American Oil Chemists’Society ,2003,80(9):915-921
[10]Hong S I, Ma N, No D S, et al. Enrichment of DHA from tuna oil in a packed bed reactor via lipase-catalyzed esterification [J]. Journal of the American Oil Chemists’ Society,2014,91(11): 1877-1884
[11]Baik J Y, No D S, Oh S W,et al. Enrichment of stearidonic acid from echium oil via a two-step lipasecatalyzed esterification [J]. European Journal of Lipid Science and Technology,2014,116(5): 618-626
[12]王卫飞,马永钧,杨博,等. 酶法合成富含DHA、EPA甘油三酯的研究[J].中国油脂,2011,36(2):5-8 Wang W F, Ma Y J, Yang B,et al.Enzymatic production of DHA and EPA-enriched triacylglycerols[J].China Oils and Fats,2011,36(2):5-8
[13]Xu Y,Guo S H,Wang Y H.et al.Enzymatic hydrolysis of palm stearin to produce diacylglycerol with a highly thermostable lipase [J]. European Journal of Lipid Science and Technology,2013,115:564-570
[14]Kim J, Haam S, Park D W,et al. Biocatalytic esterification of β-methylglucoside for synthesis of biocompatible sugar-containing vinyl esters[J]. Chemical Engineering Journal,2004,99:15-22
[15]徐扬,王卫飞,王永华,等.偏甘油酯脂肪酶Lipase G50 催化酯化法制备甘油二酯[J].中国油脂,2011,37(2):46-50 Xu Y, Wang W F, Wang Y H,et al.Production of diacylglycerol by esterification of fatty acid with glycerol using Lipase G50[J].China Oils and Fats,2011,37(2):46-50
[16]Fan X, Niehus X, Sandoval G. Lipases as biocatalyst for biodiesel production[C]//Sandoval, editor. Methods in molecular biology, lipases and phospholipases:methods and protocols.London: Humana Press, Springer Protocols, 2012: 471-483
[17]Boon M A, Janssen A E, van Riet K. Effect of temperature and enzyme origin on the enzymatic synthesis of oligosaccharides[J]. Enzyme and Microbial Technology, 2000,26(2-4):271-281
[18]Shimada Y, Watanabe Y, Samukawa T, et al. Conversion of vegetable oil to biodiesel using immobilized Candida antarctica lipase[J]. Journal of the American Oil Chemists’ Society, 1999,76(7): 789-793
[19]Zaks A, Klibanov A M. The effect of water on enzyme action in organic media[J]. Journal of Biological Chemistry, 1998,263(17): 8017-8021
[20]Yang T, Xu X, He C,et al.Lipase-catalyzed modification of lard to produce human milk fat substitutes[J]. Food Chemistry, 2003,80(4):473-481
[21]Lee E J ,Lee M W, Kim H J,et al.Preparation of high purity docosahexaenoic acid from microalgae oil in a packed bed reactor via two-step lipase-catalysed esterification[J].Journal of Functional Foods, 2016,21:330-337
[22]Liu S C, Zhang C H, Hong P Z et al. Lipase-catalysed acylglycerol synthesis of glycerol and n-3 PUFA from tuna oil: Optimisation of process parameters[J].Food Chemistry,2007,103:1009-1015.
Technical Study of EPA/DHA-Enriched Glycerides by Enzymatic Holoesterification Process
Zhu Dongqi1Li Daoming1Wang Weifei2Yang Bo3Wang Yonghua1
(College of Food Sciences and Engineering, South China University of Technology1, Guangzhou 510640) (School of Chemistry and Chemical Engineering, South China University of Technology2, Guangzhou 510640) (School of Bioscience and Bioengineering, South China University of Technology3, Guangzhou 510006)
In this study, a two-step esterification process was developed for the synthesis of EPA/DHA-enriched glycerides using EPA/DHA-enriched polyunsaturated fatty acids as substrates. Firstly, T1 lipase was employed to catalyze esterification of EPA/DHA-enriched fatty acids and glycerol. The conversion rate of EPA/DHA-enriched fatty acids as high as 62% with triacylglycerol, diacylglycerol and monoacylglycerol content of 10.52%, 38.15% and 25.64% was obtained under the optimized conditions: reaction temperature of 40 ℃, water addition of 3% (m/m, with respect to the total substrates), molar ratio of glycerol to EPA/DHA-enriched fatty acids 3∶1, enzyme loading of 50 U/g with respect to the total substrates. Subsequently, the oil phase obtained in the first step was collected and an immobilizedcandidaantarcticlipase B (Lipozyme®CALB L immobilized onto an epoxy resin ECR8 285) was employed to further esterify the unreacted EPA/DHA-enriched fatty acids with monoacylglycerol or diacylglycerol under vacuum. After 12 h of reaction, the content of triacylglycerol, diacylglycerol, monoacylglycerol reached to 38.34%, 51.02% and 10.63% respectively and no fatty acids were detected in the final products.
holoesterification, conversion rate, EPA/DHA-enriched glycerides, free lipase, immobilized lipase
863计划(2014AA093601),广东省产学研项目(2013 B090200015)
2016-04-28
朱东奇,男,1990年出生,硕士,油脂化学
王永华,女,1973年出生,教授,酶工程、油脂工程与生物资源利用
TS224.2
:A
:1003-0174(2017)08-0063-08
