江西南昌市52株假丝酵母菌血症病原真菌的鉴定及其药敏特征
2017-09-15李若瑜曹先伟
肖 喻,刘 洋,王 千,张 浩,万 喆,李若瑜,刘 伟,曹先伟
(1 南昌大学第一附属医院,江西 南昌 330006; 2 北京大学第一医院真菌和真菌病研究中心,北京 100034)
·论著·
江西南昌市52株假丝酵母菌血症病原真菌的鉴定及其药敏特征
肖 喻1,刘 洋1,王 千2,张 浩2,万 喆2,李若瑜2,刘 伟2,曹先伟1
(1 南昌大学第一附属医院,江西 南昌 330006; 2 北京大学第一医院真菌和真菌病研究中心,北京 100034)
目的了解江西南昌市假丝酵母菌血症病原真菌构成及其药物敏感性。方法收集 2015年3—10月南昌某医院住院患者送检血标本分离的假丝酵母菌属真菌,扩增真菌的转录间隔间区(ITS区)和核糖体大亚基(26rRNA、D1/D2区)对菌株进行鉴定,同时检测菌株对抗真菌药物的敏感性。结果共收集血培养阳性标本1 332份,真菌阳性标本74份,占5.56%,其中检出假丝酵母菌属52株,以热带假丝酵母菌为最常见(17株,占32.69%),其次是白假丝酵母菌和近平滑假丝酵母菌复合体(均为16株,各占30.77%)。ITS区和D1/D2区的鉴定结果相同。52株假丝酵母菌对米卡芬净、卡泊芬净均敏感,两性霉素B的流行病学折点(ECV)结果显示,均为野生型。热带假丝酵母菌对氟康唑和伏立康唑的耐药率分别为29.41%、17.64%,伊曲康唑和泊沙康唑的ECV结果显示,野生型分别占82.35%、94.12%;白假丝酵母菌对氟康唑和伏立康唑的敏感率分别为93.75%、81.25%,伊曲康唑和泊沙康唑的ECV显示,野生型分别占75.00%、81.25%;近平滑假丝酵母菌复合体对氟康唑和伏立康唑均敏感,伊曲康唑和泊沙康唑的ECV结果显示,均为野生型;光滑假丝酵母菌对氟康唑均为中介,伏立康唑、伊曲康唑和泊沙康唑的ECV结果显示,野生型分别占66.67%、100.00%、100.00%。结论热带假丝酵母菌为江西南昌市假丝酵母菌血症最常见的病原真菌,其次是白假丝酵母菌和近平滑假丝酵母菌复合体,唑类和棘白菌素类抗真菌药物和两性霉素B仍是一线抗真菌药物。
假丝酵母菌血症; 分子鉴定; 抗真菌药物; 假丝酵母菌属
[Chin J Infect Control,2017,16(9):793-797]
近年来,随着抗菌药物、糖皮质激素、免疫抑制剂以及医疗器械的大量使用,假丝酵母菌属已成为医院真菌感染最主要的致病菌。假丝酵母菌属在美国和欧洲医院感染病原菌中居第四位和第六位。全球的假丝酵母菌血症约占假丝酵母菌感染的80%,其病死率高达40%[1-8]。假丝酵母菌血症的早期诊断和治疗对降低本病的高发病率、高病死率尤为重要,而假丝酵母菌血症病原真菌的鉴定和药物敏感性特征在诊断和治疗中必不可少。因此,本研究对江西南昌市某三级医院2015年3—10月住院患者血培养标本分离的52株假丝酵母菌血症病原真菌进行鉴定和药敏检测,现将结果报告如下。
1 材料与方法
1.1 实验菌株 对2015年3—10月南昌大学第一附属医院所有临床科室住院患者送检血培养标本分离的酵母样菌落真菌,转种至显色培养基,收集在显色培养基上菌落呈白色、绿色,蓝色、紫色的菌株。质控菌株:克柔假丝酵母菌ATCC 6258、近平滑假丝酵母菌ATCC 22019,由北京大学真菌和真菌病研究中心赠送。
1.2 主要仪器和试剂 显色培养基为河南郑州博赛生物技术股份有限公司产品,比浊仪为法国生物梅里埃公司(Biomerieux Densimat)产品,96孔细胞培养板为青岛阿尔发医疗器械有限公司产品,RPMI-1640粉(Gibco,USA),MOPS缓冲液为沃德赛斯生物公司产品,真菌DNA提取试剂盒购自天根生化科技(北京)有限公司。氟康唑、两性霉素B购自美国sigma公司,伏立康唑、伊曲康唑购自寿光富康制药公司,泊沙康唑、米卡芬净、卡泊芬净购自华中海威基因科技公司。引物设计和DNA测序均由生工生物工程有限公司完成。
1.3 菌株培养与鉴定 将菌株转种至土豆琼脂斜面培养基,置于35℃孵箱培养48 h,按照真菌DNA提取试剂盒的操作说明提取菌株DNA,利用标准化的分子生物学鉴定方法对菌株进行鉴定,依据文献[1-2]使用真菌ITS区和D1/D2区的常用引物和反应条件进行PCR扩增,测序后对分离菌株进行鉴定,测序结果差异≤1%则鉴定为同一菌种。
1.4 药敏试验
1.4.1 菌液制备 将受试菌在土豆琼脂平板上,35 ℃孵育24 h,转种2次,挑取>l mm菌落3~5个至5 mL无菌的0.85%NaCl溶液中,制成菌悬液,调整浊度,经血细胞计数板计数,菌浓度为1×106~5×106CFU/mL。
1.4.2 药物溶液的配制 氟康唑用无菌蒸馏水配制成浓度为1 600 μg/mL贮存液,卡泊芬净、米卡芬净用无菌蒸馏水配制成浓度为800 μg/mL贮存液,伊曲康唑、伏立康唑、泊沙康唑、两性霉素B用二甲基亚砜(DMSO)配制浓度为800 μg/mL的贮存液。
1.4.3 体外抗真菌药敏板制备 用RPMI-1640溶液培养基将氟康唑贮存液稀释成(64~0.125)μg/mL浓度梯度,将伊曲康唑、伏立康唑、两性霉素B、泊沙康唑、卡泊芬净、米卡芬净贮存液稀释成(16~0.03) μg/mL浓度梯度,将上述药物溶液按浓度梯度以微量加样器从低到高依次将药液加入无菌的96孔板内,每孔100 μL,第11孔为菌液阳性对照,第12孔为空白对照,密封,-70 ℃保存备用。
1.4.4 药敏试验 参考美国临床实验室标准化研究协会(CLSI)M27-A3方案[3]的微量稀释法进行,将浓度为(1×106~5×106)CFU/mL的菌悬液用RPMI-1640稀释1 000倍,加入制备的抗真菌药敏板中,每孔加100 μL,菌液终浓度为(0.5×103~2.5×103)CFU/mL,35 ℃孵箱培养24 h。
1.4.5 结果判读 参照CLSI M27-S4方案[3-4]进行, 7种抗真菌药物对酵母菌的最小抑菌浓度(MIC)的结果判读标准为:唑类和棘白菌素类抗真菌药物以抑制50%以上判读,两性霉素B以抑制100%判读。流行病学折点(epidemiological cutoff value,ECV) 是指用于区分非野生型菌株和野生型菌株的MIC阈值,其结果判读标准与MIC的判读标准一致[5,9-10],伊曲康唑、泊沙康唑和两性霉素B无推荐的折点,对上述三种抗真菌药物使用ECV判读。7种抗真菌药物的MIC或ECV的判断分界值参照CLSI M27-S4和相关文献[4-5]。
2 结果
2.1 假丝酵母菌血症病原真菌构成情况 2015年3—10月共收集血培养阳性标本1 332份,真菌阳性标本74份,占5.56%,其中检出假丝酵母菌属52株。52株假丝酵母菌属中以热带假丝酵母菌为最常见,为17株(占32.69%),其次是白假丝酵母菌和近平滑假丝酵母菌复合体,均为16株(各占30.77%),近平滑假丝酵母菌复合体包括2株拟平滑假丝酵母菌和14株近平滑假丝酵母菌,光滑假丝酵母菌为3株(占5.77%)。见表1。
表1假丝酵母菌血症病原真菌构成情况
Table1Constitute of pathogenic fungi causing candidemia

真菌菌株数构成比(%)热带假丝酵母菌1732.69白假丝酵母菌1630.77近平滑假丝酵母菌复合体1630.77光滑假丝酵母菌35.77合计52100.00
2.2 菌株鉴定结果 利用ITS区和D1/D2区对52株假丝酵母菌进行鉴定,ITS区和D1/D2区的鉴定结果相同。
2.3 药敏试验结果 52株假丝酵母菌对米卡芬净、卡泊芬净均敏感,两性霉素B的ECV结果显示,均为野生型。热带假丝酵母菌:对氟康唑和伏立康唑的耐药率分别为29.41%、17.64%,伊曲康唑和泊沙康唑的ECV结果显示,野生型分别占82.35%、94.12%;白假丝酵母菌:对氟康唑和伏立康唑的敏感率分别为93.75%、81.25%,伊曲康唑和泊沙康唑的ECV显示,野生型分别占75.00%、81.25%;近平滑假丝酵母菌复合体:对氟康唑和伏立康唑均敏感,伊曲康唑和泊沙康唑的ECV结果显示,均为野生型;光滑假丝酵母菌:对氟康唑均为中介,伏立康唑、伊曲康唑和泊沙康唑的ECV结果显示,野生型分别占66.67%、100.00%、100.00%。见表2。
3 讨论
在正常情况下,假丝酵母菌为人体的正常定植菌株之一,当人体的免疫力低下或处于抑制状态时,正常菌群可转变为致病菌,引起人体的皮肤黏膜、口腔等部位的真菌感染,甚至引起血液、肝、肾等部位的侵袭性感染。文献[11-12]报道,假丝酵母菌属在医院的真菌感染中居首位。
ITS区和D1/D2区为酵母样真菌常用的鉴定和分类区域,ITS区和D1/D2区还有相似的种内变异,一般选择任意一区对酵母样真菌进行鉴定[1-2]。如果待测菌株两个区的鉴定结果不同,且 D1/D2区>1%的突变时,通常认为此株待测菌株是一个新种[1]。本研究为保证鉴定结果的准确性,运用了ITS区和D1/D2区对52株假丝酵母菌进行鉴定,ITS区和D1/D2区的鉴定结果相同,未发现新的酵母样菌种。
本组研究结果显示,真菌血症的发病率为5.56%,高于江苏某医院的2.16%[13],但与本院之前报道的真菌发病率一致[14]。收集的52株假丝酵母菌,热带假丝酵母菌所占比率最高(32.69%),其次为白假丝酵母菌和近平滑假丝酵母菌复合体,各占30.77%,与之前报道文献的菌株分布相似[6]。研究[13,15]报道,白假丝酵母菌为假丝酵母菌血症中最主要的致病真菌,其次是近平滑假丝酵母菌复合体和热带假丝酵母菌,与本研究的结果不同,主要原因可能是假丝酵母菌属的菌种构成情况呈地域性分布,以及抗真菌药物对假丝酵母菌属的选择性作用。
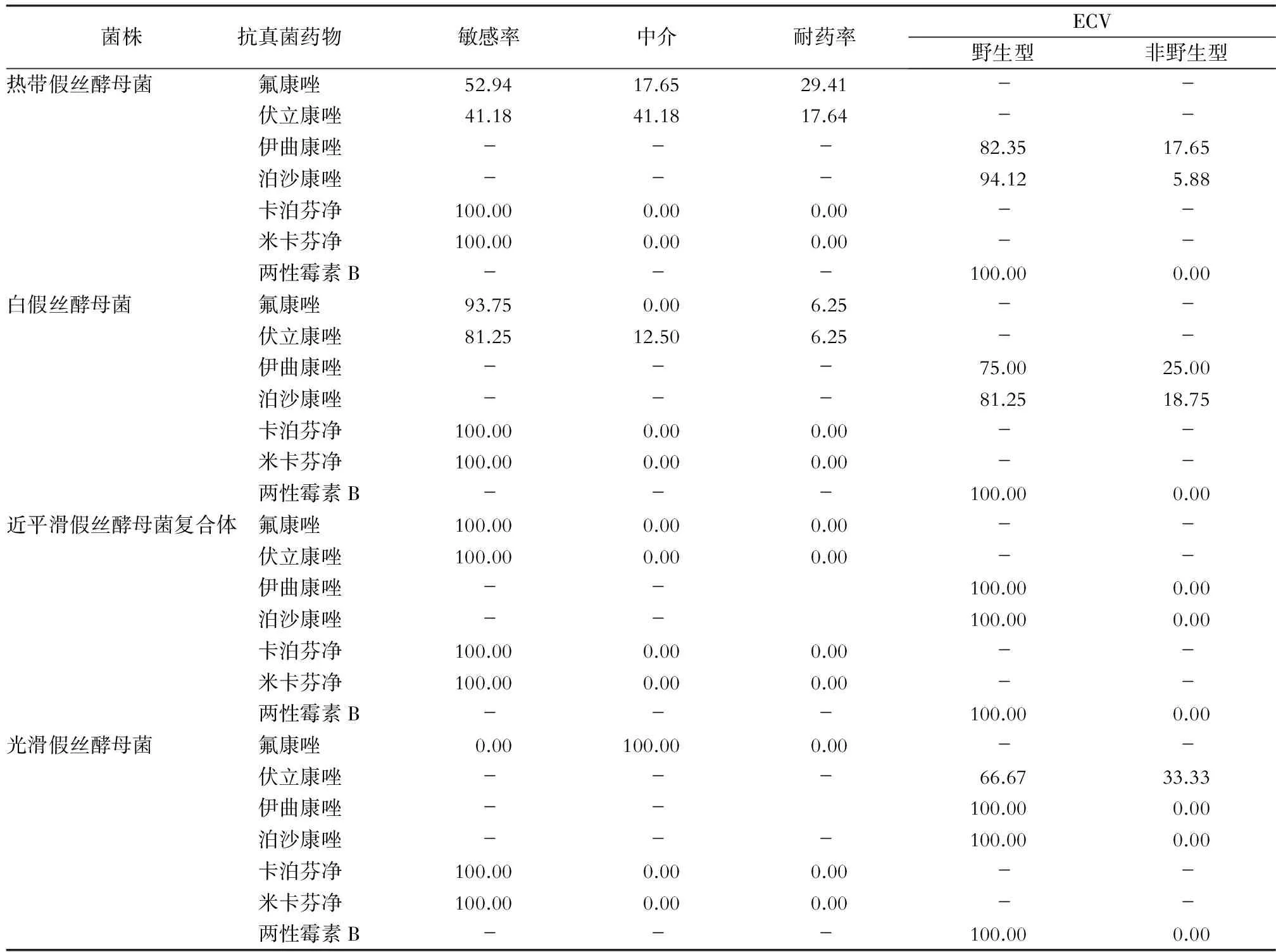
表2 假丝酵母菌血症患者分离真菌的药敏结果以及流行病学折点(%)
本研究中白假丝酵母菌对伊曲康唑的耐药率最高,其次是泊沙康唑、氟康唑和伏立康唑。热带假丝酵母菌对氟康唑和伊曲康唑的抗真菌药物的耐药率比其他菌株高。白假丝酵母菌和热带假丝酵母菌对氟康唑的耐药率,以及伊曲康唑非野生型所占比例均高于文献[15-16]报道,可能是因为唑类药物的副作用相对较小。本院临床科室对氟康唑和伊曲康唑的使用时间较长,使用量较多,使用的适应证范围较广(包括浅部和深部的感染),从而导致诱导性耐药。本研究发现2株对多种唑类药物耐药菌株(白假丝酵母菌和热带假丝酵母菌各1株),但这两株菌对泊沙康唑的敏感性较好。分析患者临床资料,发现其住院期间较长时间使用过伊曲康唑,而未使用泊沙康唑,耐药菌株的产生可能与使用抗真菌药物的诱导有关。但假丝酵母菌对棘白菌素类药物的敏感性均为100.00%,表明棘白菌素类和多烯类抗真菌药物仍为较好的一线抗真菌药物。本院临床医生在用唑类药物预防和治疗假丝酵母菌血症应更规范,尤其对热带假丝酵母菌和白假丝酵母菌引起的菌血症。
本研究首次调查江西南昌市假丝酵母菌血症病原真菌的鉴定和药物敏感性,有助于了解江西南昌市假丝酵母菌血症病原真菌的流行病学情况,为预防假丝酵母菌血症的发生、暴发,以及治疗有着重要的意义。但本研究的调查时间短,收集的菌株数量较少,后续研究将延长收集时间,增加菌株数量,完善江西省南昌市的假丝酵母菌血症的流行病学调查。
[1] Lu HZ, Jia JH, Wang QM, et al.Candidaasparagisp.nov.,Candidadiospyrisp.nov. andCandidaqinlingensissp.nov., novel anamorphic, ascomycetous yeast species[J]. Int J Syst Evol Microbiol, 2004, 54(Pt 4): 1409-1414.
[2] 李娟,白逢彦.26S rDNA单链构象多态性分析在临床酵母菌菌种鉴定中的应用[J].微生物学报,2009,49(8):1011-1017.
[3] Clinical and Laboratory Standards Institute. Reference method for broth dilution antifungal susceptibility testing of yeasts; Approved Standard M27-A3[S]. Wayne, PA, USA, CLSI, 2008.
[4] Clinical and Laboratory Standards Institute. Reference method for broth dilution antifungal susceptibility testing of yeasts, 4th informational supplement M27-S4[S]. Wayne, PA, USA, CLSI, 2013.
[5] Pfaller MA, Diekema DJ. Progress in antifungal susceptibility testing ofCandidaspp.by use of Clinical and Laboratory Standards Institute broth microdilution methods, 2010 to 2012[J]. J Clin Microbiol, 2012, 50(9): 2846-2856.
[6] Yang ZT, Wu L, Liu XY, et al. Epidemiology, species distribution and outcome of nosocomialCandidaspp.bloodstream infection in Shanghai[J]. BMC Infect Dis, 2014, 14: 241.
[7] 路晓钦,黎莉华,周丽,等. 白假丝酵母菌感染分布及耐药性分析[J]. 中国感染控制杂志,2007, 6(6):419-421.
[8] 郭维钧,蔡玉珍,刘书芳.244株真菌鉴定结果分析[J].中国感染控制杂志,2003,2(3):207-208.
[9] Bywater R, Silley P, Simjee S. Antimicrobial breakpoints-definitions and conflicting requirements[J]. Vet Microbiol, 2006, 118(1-2): 158-159.
[10] Simjee S, Silley P, Werling HO, et al. Potential confusion regarding the term ‘resistance’ in epidemiological surveys[J]. J Antimicrob Chemother, 2008, 61(1): 228-229.
[11] Guinea J, Zaragoza ó, Escribano P, et al. Molecular identification and antifungal susceptibility of yeast isolates causing fungemia collected in a population-based study in Spain in 2010 and 2011[J]. Antimicrob Agents Chemother, 2014, 58(3): 1529-1537.
[12] Dong D, Li Z, Zhang L, et al. Clinical and microbiological investigation of fungemia from four hospitals in China[J]. Mycopathologia, 2015, 179(5-6): 407-414.
[13] 严佳斌,马蔡昀.2012—2014年住院病人血培养阳性标本病原菌分布及耐药性分析[J].中国病原生物学杂志,2015,10(12):1136-1139,1143.
[14] 彭卫华,廖晚珍,孙爱娣,等. 7893例血培养标本中病原菌的分布及耐药分析[J]. 江西医学检验, 2007, 25(6):626-628
[15] Arendrup MC. Candida and candidaemia. Susceptibility and epidemiology[J]. Dan Med J, 2013, 60(11): B4698.
[16] Wisplinghoff H, Ebbers J, Geurtz L, et al. Nosocomial bloodstream infections due toCandidaspp.in the USA: species distribution, clinical features and antifungal susceptibilities[J]. Int J Antimicrob Agents, 2014, 43(1): 78-81.
(本文编辑:豆清娅、左双燕)
Identificationandantimicrobialsusceptibilityof52pathogenicfungicausingcandidemiainNanchangCityofJiangxiProvince
XIAOYu1,LIUYang1,WANGQian2,ZHANGHao2,WANZhe2,LIRuo-yu2,LIUWei2,CAOXian-wei1
(1TheFirstAffiliatedHospitalofNanchangUniversity,Nanchang330006,China; 2ResearchCenterforMedicalMycology,PekingUniversityFirstHospital,Beijing100034,China)
ObjectiveTo explore the constitute and antimicrobial susceptibility of pathogenic fungi causing candidemia in Nanchang City of Jiangxi Province.MethodsCandidaspp.isolated from blood specimens of patients at a hospital in Nanchang in March-October 2015 were collected, fungal strains were identified by amplifying the internal transcribed spacer (ITS) and large ribosomal subunit (D1/D2 region of 26rRNA), antifungal susceptibility of fungi was detected.ResultsA total of 1 332 positive blood culture specimens were collected, including 74 fungal positive specimens, accounting for 5.56%, 52 strains ofCandidaspp.were obtained, most wereCandidatropicalis(n=17,32.69%),followed byCandidaalbicans(n=16, 30.77%) andCandidaparapsilosiscomplex(n=16, 30.77%). Identification results of ITS and D1/D2 region were identical. 52 strains ofCandidaspp.were sensitive to both micafungin and caspofungin, epidemiological cutoff value(ECV) of amphotericin B showed that 52 strains were all wild type. Resistance rates ofCandidatropicalisto fluconazole and voriconazole were 29.41% and 17.64% respectively, ECV of itraconazole and posaconazole showed that wild type accounted for 82.35% and 94.12% respectively;resistance rates ofCandidaalbicansto fluconazol and voriconazole were 93.75% and 81.25% respectively, ECV of itraconazole and posaconazole showed that wild type accounted for 75.00% and 81.25% respectively;Candidaparapsilosiscomplexstrains were sensitive to both fluconazole and voriconazole, ECV of itraconazole and posaconazole showed that all were wild type; allCandidaglabratastrains had intermediate resistance rates to fluconazole, ECV of voriconazole, itraconazole, and posaconazole showed that wild type accounted for 66.67%, 100.00%, and 100.00% respectively.ConclusionCandidatropicalisis the most common pathogenic fungus causing candidemia in Nanchang of Jiangxi, followed byCandidaalbicansandCandidaparapsilosiscomplex. Azole, echinocandin, and amphotericin B are still first-line antifungal agents.
candidemia; molecular identification; antifungal agent;Candidaspp.
2016-10-09
国家自然科学基金(81471925)
肖喻(1990-),男(汉族),湖北省荆州市人,硕士研究生,主要从事深部真菌的分子流行病学研究。
曹先伟 E-mail:ndyfyygk@163.com
10.3969/j.issn.1671-9638.2017.09.001
R379.3
A
1671-9638(2017)09-0793-05
