生物催化法制备手性酮基布洛芬的研究进展
2017-09-12胡琦蔚张俊伟王远山
胡琦蔚,张俊伟,王远山
(1.浙江工业大学 生物工程学院,浙江 杭州 310014;2.杭州安诺过滤器材有限公司,浙江 杭州 311404)
生物催化法制备手性酮基布洛芬的研究进展
胡琦蔚1,张俊伟2,王远山1
(1.浙江工业大学 生物工程学院,浙江 杭州 310014;2.杭州安诺过滤器材有限公司,浙江 杭州 311404)
酮基布洛芬是一种重要的消炎镇痛药,广泛应用于风湿、类风湿性关节炎、脊髓炎和痛风等疾病的治疗,成为处方量最大的药物之一.市售的酮基布洛芬以外消旋体为主,(S)-酮基布洛芬为其活性对映体,(R)-酮基布洛芬的存在会加重肝脏的代谢负担.目前手性酮基布洛芬主要通过化学合成法生产,与传统的化学法相比,生物催化法具有反应条件温和、对环境友好等优点,成为近年来研究的热点.生物催化法主要利用脂肪酶、酯酶和腈水合酶/酰胺酶双酶体系等催化制备手性酮基布洛芬.同时对生物催化法制备手性酮基布洛芬的研究进展进行了综述.
生物催化;酮基布洛芬;脂肪酶;酯酶
酮基布洛芬(ketoprofen,3-苯甲酰基-α-甲基苯乙酸)是一种2-芳基丙酸类强效非甾体抗炎药.最早由法国化学家Rhone Poulenc于1967年合成,并于1973年引入法国和美国作为抗炎药使用[1],对风湿、类风湿性关节炎、脊髓炎和痛风等疾病有良好的效果,且消炎作用强于布洛芬,不良反应轻于布洛芬.在同等剂量下,其消炎镇痛作用是阿司匹林的150倍,解热作用是消炎痛的4倍、阿司匹林的100倍.由于酮基布洛芬具备药效高、半衰期较短、代谢简单和不良反应少而轻等优点,已广泛应用于治疗各种类型的疼痛、炎症症状、感冒及手术后的消炎止痛.由于风湿、类风湿和痛风等是我国多发性疾病,近年来酮基布洛芬等非甾体抗炎药发展迅速,市场需求量巨大.而酮基布洛芬具有“R”和“S”两种对映体,并有着明显不同的药理活性,(S)-(+)-酮基布洛芬(S-ketoprofen)是(R,S)-酮基布洛芬的活性对映体,其消炎镇痛等作用是外消旋体的两倍[2],而(R)-酮基布洛芬抗炎镇痛作用极弱,常作牙膏添加剂以预防和治疗由牙周炎导致的骨质疏松[3],也可用于缓解触觉性异常疼痛.目前,市售的以外消旋体为主,疗效较(S)-(+)-酮基布洛芬弱且肝脏代谢负担大.因此,开发低成本的单一对映体的(S)-(+)-酮基洛芬制备工艺具有重要意义.
1 化学法制备(S)-(+)-酮基布洛芬
1.1 结晶法
1.1.1 非对映体结晶法
非对映体结晶法是利用拆分剂(如光学纯的酸)拆分外消旋体得到非对映体盐,再通过选择性结晶从而得到光学纯的对映体.Yoneyoshi等[4]将外消旋酮洛芬和酮洛芬胺加热溶解在甲醇中,冷却后静置过夜得到结晶,过滤后用1%的盐酸将结晶溶解,用甲苯萃取两次后减压蒸馏得到(S)-(+)-酮基布洛芬,产率为43%,e.e.值为79.1%.Lukas等[5]则用异丙醇溶解外消旋酮洛芬,加入苯乙胺作为手性试剂,搅拌后冷却结晶,用0 ℃的异丙醇洗涤结晶两次得到(S)-(+)-酮基布洛芬,产率为40%,文中未提及产物的e.e.值.
1.1.2 优先结晶法
优先结晶是在饱和或过饱和的外消旋体溶液中加入其中一种对映异构体的晶体作为晶种,造成不对称环境,诱导结晶按非平衡的过程进行,从而达到拆分的效果.Van Eikeren等[6]通过加热搅拌使外消旋的酮洛芬溶解在乙腈-水混合物中,以(1R,2S)-cis-1-aminoindan-2-ol作为拆分剂,加入(S)-ketoprofen-(1R,2S)-cis-1-aminoindan-2-ol作为晶种,得到的结晶用乙腈洗涤两次后真空干燥,最终获得66.4 g (S)-(+)-酮基布洛芬,e.e.值达到97.2%.Manimaran等[7]用甲醇稀释外消旋酮洛芬的乙酸乙酯溶液,冷却后加入(S)-ketoprofen-cinchonidine晶体,得到的结晶在真空条件下过滤,并用乙酸乙酯和乙醚洗涤三次,真空干燥后得到成品,(S)-(+)-酮基布洛芬的产率为31%,e.e.值为97%.
由于利用结晶法制备(S)-(+)-酮基布洛芬的过程中均涉及重结晶这一步骤,耗时且增加了成本、降低了产率.另外,结晶中所用到的基质昂贵且不稳定,难以循环利用[8],制备过程中对温度和压力的要求也较高,尤其是结晶时,往往需要低温保证结晶的顺利进行,由于这些缺陷的存在,结晶法并未被广泛应用于工业生产中.
1.2 不对称合成法
1.2.1 Sharpless环氧化法
Hamon等[9]通过6步反应,由烯丙醇通过Sharpless环氧化制备得到(2S,3S)环氧化合物,再加入手性位移试剂,经过对映体选择性氢解后生成二醇,在RuO4/NaIO4的催化下,最终得到(S)-(+)-酮基布洛芬,e.e.值达到98%.Sharpless环氧化法制备(S)-(+)-酮基布洛芬的途径为[9]

1.2.2 α-芳基丙烯酸氢化法
具有前手性的不饱和羧酸经手性BLNAP-Ru的二羧酸酯络合物氢化后可得到光学活性的饱和羧酸,该方法可用于(S)-(+)-酮基布洛芬的制备.Laue等[10]以(S)-(+)-RuBLNAP(OAc)2为催化剂在高压下氢化,最终得到的产物e.e.值达到80%.利用手性络合物制备(S)-(+)-酮基布洛芬的途径[10]为

目前,市售(S)-(+)-酮基布洛芬主要通过传统的化学法生产,这种方法的产率和对映体选择性较为理想,但是均需要用到传统的化学催化剂以促使反应快速进行,而大部分催化剂毒性较高、易燃且会造成环境污染,还有可能引入有害的副产物.另外,手性催化剂的制备过程较为困难,有时其本身的制备反应也需要昂贵催化剂的参与.
2 酶法制备(S)-(+)-酮基布洛芬
酶法制备(S)-(+)-酮基布洛芬属于动力学拆分的范畴,由于其具有反应条件温和、较好的底物特异性和对映体选择性以及对环境友好等优点[11-13],受到了广泛的重视.生物催化法常以外消旋酮基布洛芬或其衍生物为底物,通过酶拆分得到(S)-(+)-酮基布洛芬.
2.1 酯酶和脂肪酶
酯酶和脂肪酶是(S)-(+)-酮基布洛芬制备中最为常用的酶.根据催化原理的不同,可以大致分为对映体选择性酯化和对映体选择性水解两类[14].
2.1.1 对映体选择性酯化
在对映体选择性酯化制备(S)-(+)-酮基布洛芬的过程中,通常以外消旋的酮洛芬和醇类作为底物,在具有选择性的酯酶或脂肪酶的催化下,优先将(R)-(-)-酮基布洛芬酯化为(R)-酮基布洛芬酯,而保留(S)-(+)-酮基布洛芬,再通过中和或加入饱和NaHCO3将剩余的酮洛芬与酮洛芬酯分离,以获得较纯的(S)-(+)-酮基布洛芬.通过对映体选择性酯化法制备(S)-(+)-酮基布洛芬的途径为
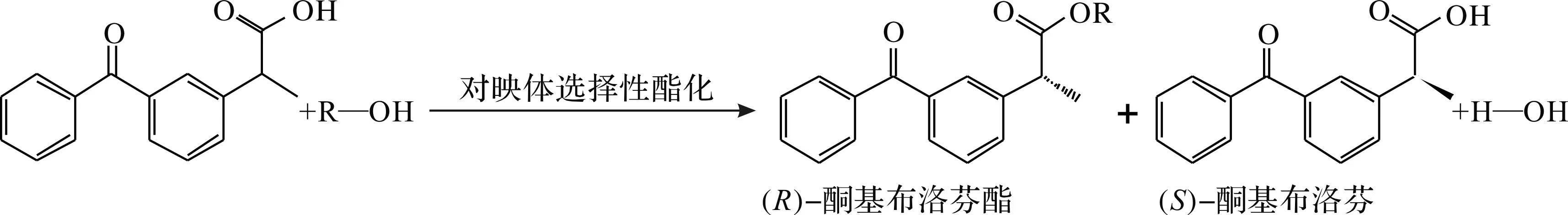
Park等[15]利用Candidaantarctica脂肪酶Novozym 435酯化外消旋的酮洛芬,发现以甲醇作为烷基供体时转化率和对映体选择性均较佳,转化9 h后,转化率达到59%,e.e.值为75%,E为6.Ong等[16]利用南极假丝酵母脂肪酶(C.antarcticalipase B,CALB,Novozym 525)拆分外消旋酮洛芬,比较了游离酶和固定化酶的催化特性,发现固定化酶在催化效率、热稳定性和重复利用等方面均要高于游离酶.以丁醇为烷基供体,在最佳条件下利用固定化酶反应24 h后,(R)-酮基布洛芬的转化率达到73%,剩余底物中(S)-(+)-酮基布洛芬的对映体过量值为87.8%.Candidacylindrecca所产脂肪酶(CCL)是用于选择性水解外消旋酮基布洛芬酯衍生物最有效的酶之一,以该酶为催化剂的报道较多,但其拆分反应需要大量手性环糊精参与.也有学者利用其他来源的酶进行对映体选择性酯化反应,如Li等[17]利用来源于Burkholderiacepacia的固定化脂肪酶G63,在37 ℃下反应22.5 h后得到(S)-(+)-酮基布洛芬,E为10.01.
2.1.2 对映体选择性水解
对映体选择性水解以外消旋的酮洛芬酯为底物,通过脂肪酶或酯酶优先水解其中一种对映体生成(S)-(+)-酮洛芬和醇.Kim等[18]从ArchaeoglobusfulgidusDSM 4304基因组中克隆出一个耐高温的酯酶,结合易错PCR和定点饱和突变对该酶进行改造,得到一个双突变体V13G/L200R,在70 ℃下反应1 h,可以将5 mmol/L外消旋的酮基布洛芬乙酯转化为(S)-(+)-酮基布洛芬,e.e.值为(89.2±0.2)%,E为19.5±0.5.Kim等[19]从Candidarugosa中得到的脂肪酶可以将100 mmol/L酮洛芬乙酯转化为(S)-(+)-酮基布洛芬,e.e.值达99%,转化率为49%,但所需时间为3 d.Zhang等[20]利用固定化Trichosporonlaibacchii酵母脂肪酶在含有Tween-80的水相中水解(R,S)-酮洛芬乙酯,45 ℃下反应33 h,转化率达到46.3%,产物的光学纯度达到94.4%.其余利用脂肪酶或酯酶制备(S)-(+)-酮基布洛芬的例子如表1所示.利用T.laibacchii脂肪酶水解(R,S)-酮洛芬乙酯生成(S)-(+)-酮基布洛芬[20]的途径为

表1 利用脂肪酶或酯酶制备(S)-(+)-酮基布洛芬
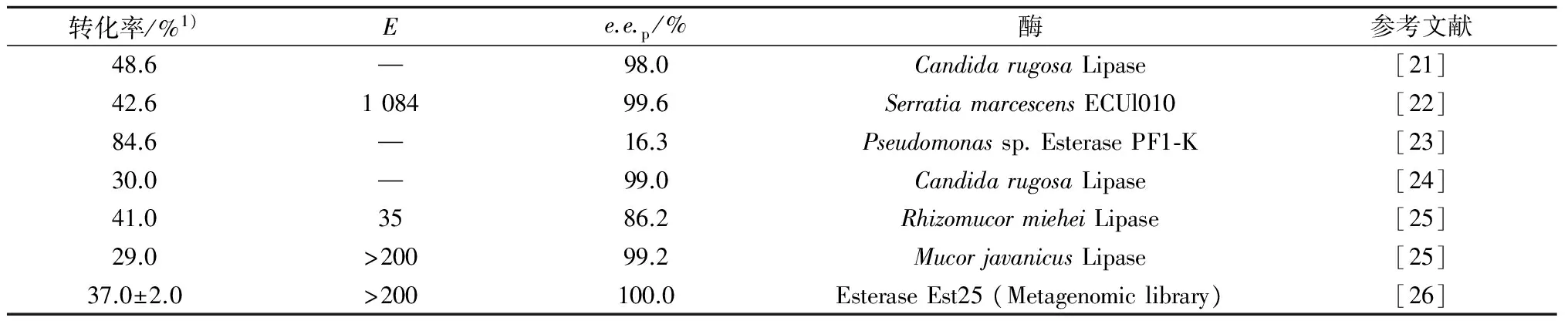
转化率/%1)Ee.e.p/%酶参考文献48.6—98.0CandidarugosaLipase[21]42.6108499.6SerratiamarcescensECUl010[22]84.6—16.3Pseudomonassp.EsterasePF1⁃K[23]30.0—99.0CandidarugosaLipase[24]41.03586.2RhizomucormieheiLipase[25]29.0>20099.2MucorjavanicusLipase[25]37.0±2.0>200100.0EsteraseEst25(Metagenomiclibrary)[26]
注:1) 转化率为质量分数.
(R)-(-)-酮基布洛芬制备的相关研究较少.Gérard等[27]得到一个来源于酵母Yarrowialipolytia的脂肪酶Lip2p,该酶可催化酮洛芬乙酯生成酮基布洛芬,但其对映体选择性不佳,对其进行定点饱和突变后获得一突变体V232F,可选择性催化底物生成(R)-(-)-酮基布洛芬,E≥300.Hu等[28]利用来源于Aspergillusterreus的脂肪酶催化酮洛芬乙烯酯,得到(R)-(-)-酮基布洛芬,转化率为(16.0±1.3)%,E为11.4,e.e.值为(82±2.7)%,后对其进行固定化,最大转化率、E和e.e.值分别提高到了45.9%,128.8和(96±0.1)%.
2.2 腈水合酶/酰胺酶双酶体系
目前也有利用腈水合酶和酰胺酶双酶体系制备光学纯酮洛芬的报道.Layh等[29]以酮洛芬腈为唯一氮原筛选得到的RhodococcusequiK2a能将酮洛芬腈及酮洛芬酰胺转化为(S)-(+)-酮基布洛芬,e.e.值均为99%,转化率分别为27%和25%;Heinemann等[30]筛选得到的Agrobacteriumsp. LK中含有的腈水合酶/酰胺酶双酶体系能够催化2-(3-苯甲酰苯基)丙腈转化成酮基布洛芬,e.e.值为91%;Salvo等[31]利用Agrobacteriumradiobacter30″60 (NCIMB 41108)静息细胞水解酮洛芬腈,(S)-(+)-酮基布洛芬的产率为45%,光学纯度为96%.利用腈水合酶/酰胺酶双酶体系制备(S)-(+)-酮基布洛芬[30]的途径为

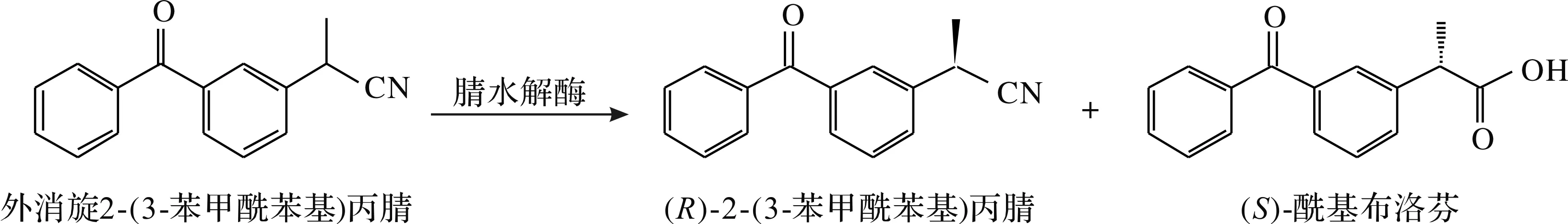
2.3 腈水解酶
目前尚无利用腈水解酶制备(S)-(+)-酮基布洛芬的报道,但本课题组通过基因挖掘从NCBI数据库中挖掘得到一个腈水解酶Nit1,可选择性水解(R,S)-2-(3-苯甲酰苯基)丙腈生成(S)-(+)-酮基布洛芬,e.e.值为14.2%.对其进行分子改造后获得一个突变体W56G,该突变体的对映体选择性有了明显的提升.利用腈水解酶制备(S)-(+)-酮基布洛芬的途径为
3 结 论
生物催化法具有条件温和,化学选择性、区域选择性及对映体选择性高等特点,且其对环境友好、耗能低,符合绿色发展的理念,建立酶法制备(S)-(+)-酮基布洛芬的新工艺,具有重要的意义.尽管在生物催化法制备(S)-(+)-酮基布洛芬方面进行了大量的研究,但由于酶拆分法存在着反应时间长、稳定性差等缺陷,该法还没有得到产业化应用.目前,已有较多通过对酶进行改造、固定化等手段从而改善了酶催化特性的例子,一定程度上突破了上述的限制,基因工程及酶工程的发展将极大推动生物催化制备(S)-(+)-酮基布洛芬技术的发展.
[1] 石开云, 余清宝, 邹晓川. 酮洛芬合成方法研究进展[J]. 精细化工, 2015, 32(8):841-848.
[2] HUTT A J, CALDWELL J. The importance of stereochemistry in the clinical pharmacokinetics of the 2-arylpropionic acid non-steroidal anti-inflammatory drugs[J]. Clinical pharmacokinetics, 1984, 9(4):371-373.
[3] 赵运英, 刘瑞恩, 许丽娟, 等. 拆分获得(S)-酮基布洛芬脂肪酶基因在枯草芽孢杆菌中的克隆与表达[J]. 微生物学报, 2010, 50(5):634-640.
[4] YONEYOSHI Y, KUDO J, NISHIOKA T. Optically active secondary amine compound, process for producing optically active secondary amine compound and process for producing optically active carboxylic acid by using said compound: US5510519[P]. 1994-03-29.
[5] LUKAS H, SCHUSTER O, RAU G. Process to separate mixtures of enantiomeric arylpropionic acids: US 4983765 A[P]. 1991-01-08.
[6] VAN E P, FRANCIS M X, LOPEZ J L. Process for resolving chiral acids with 1-aminoindan-2-ols: US 5677469 A[P]. 1997-10-14.
[7] MANIMARAN T, POTTER A A. Resolution of ketoprofen: US5162576[P]. 1992-11-10.
[8] BLASCHKE G, SCHULTE K E. Process for obtaining enantiomers of 2-arylpropionic acids: US 4973745[P]. 1990-11-27.
[9] HAMON D P G, MASSY-WESTROPP R A, NEWTON J L. ChemInform abstract: enantioselective syntheses of 2-arylpropanoic acid non-steroidal antiinflammatory drugs and related compounds[J]. Cheminform, 1996, 27(11):12645-12660.
[10] LAUE C, SCHRÖDER G, ARLT D. 2-Arylpropenic acids and their utilisation in the preparation of 5-ketoprofen: EP0529444[P]. 1997-04-16
[11] WANG Y, LI Q, ZHANG Z, et al. Solvent effects on the enantioselectivity of the thermophilic lipase QLM in the resolution of (R,S)-2-octanol and (R,S)-2-pentanol[J]. Journal of molecular catalysis B enzymatic, 2009, 56(2/3):146-150.
[12] 胡艾希, 董先明. 2-芳基丙酸类消炎药的酶催化拆分研究进展[J]. 中国医药工业杂志, 2001, 32(6):284-288.
[13] MCCOY M. Making drugs with little bugs[J]. Chemical & engineering news, 2010, 79(21):37-43.
[14] AI L O, KAMARUDDIN A H, BHATIA S. Current technologies for the production of (S)-ketoprofen: process perspective[J]. Process biochemistry, 2005, 40(11):3526-3535.
[15] PARK H J, CHOI W J, HUH E C, et al. Production of optically active ketoprofen by direct enzymatic esterification[J]. Journal of bioscience & bioengineering, 1999, 87(4):545-547.
[16] ONG A L, KAMARUDDIN A H, BHATIA S, et al. Enantioseparation of (R,S)-ketoprofen usingCandidaantarcticalipase B in an enzymatic membrane reactor[J]. Journal of separation science, 2008, 31(31):2476-2485.
[17] LI X, LIU T, XU L, et al. Resolution of racemic ketoprofen in organic solvents by lipase fromBurkholderiacepacianG63[J]. Biotechnology and bioprocess engineering, 2012, 17(6):1147-1155.
[18] KIM J, KIM S, YOON S, et al. Improved enantioselectivity of thermostable esterase fromArchaeoglobusfulgidustoward (S)-ketoprofen ethyl ester by directed evolution and characterization of mutant esterases[J]. Applied microbiology and biotechnology, 2015, 99(15):6293-6301.
[19] KIM S H, KIM T K, SHIN G S, et al. Enantioselective hydrolysis of insoluble (R,S)-ketoprofen ethyl ester in dispersed aqueous reaction system induced by chiral cyclodextrin[J]. Biotechnology letters, 2004, 26(12):965-969.
[20] ZHANG Y Y, LIU J H. Kinetic study of enantioselective hydrolysis of (R,S)-ketoprofen ethyl ester using immobilizedT.laibacchiilipase[J]. Biochemical engineering journal, 2011, 54(1):40-46.
[21] MIN G K, LEE E G, CHUNG B H. Improved enantioselectivity ofCandidarugosa, lipase towards ketoprofen ethyl ester by a simple two-step treatment[J]. Process biochemistry, 2000, 35(9):977-982.
[22] LONG Z D, XU J H, ZHAO L L, et al. Overexpression ofSerratiamarcescenslipase inEscherichiacolifor efficient bioresolution of racemic ketoprofen[J]. Journal of molecular catalysis B enzymatic, 2007, 47(3):105-110.
[23] SATHISHKUMAR M, JAYABALAN R, MUN S P, et al. Role of bicontinuous microemulsion in the rapid enzymatic hydrolysis of (R,S)-ketoprofen ethyl ester in a micro-reactor[J]. Bioresource technology, 2010, 101(20):7834-7840.
[24] WANG Y H, YANG B, REN J, et al. Optimization of medium composition for the production of clavulanic acid byStreptomycesclavuligerus[J]. Process biochemistry, 2005, 40(3/4):1161-1166.
[25] ZHANG W W, JIA J Q, WANG N, et al. Improved activity of lipase immobilized in microemulsion-based organogels for (R,S)-ketoprofen ester resolution: long-term stability and reusability[J]. Biotechnology reports, 2015, 7:1-8.
[26] YOON S, KIM S, PARK S, et al. Improving the enantioselectivity of an esterase toward (S)-ketoprofen ethyl ester through protein engineering[J]. Journal of molecular catalysis B enzymatic, 2014, 100(4):25-31.
[27] GÉRARD D, GUÉROULT M, CASAS-GODOY L, et al. Efficient resolution of profen ethyl ester racemates by engineeredYarrowialipolyticaLip2p lipase[J]. Tetrahedron asymmetry, 2017, 28(3):433-441.
[28] HU C, NA W, ZHANG W, et al. Immobilization ofAspergillusterreuslipase in self-assembled hollow nanospheres for enantioselective hydrolysis of ketoprofen vinyl ester[J]. Journal of biotechnology, 2015, 194:12-18.
[29] LAYH N, KNACKMUSS H J, STOLZ A. Enantioselective hydrolysis of ketoprofen amide byRhodococcussp. C3II andRhodococcuserythropolisMP 50[J]. Biotechnology letters, 1995, 17(2):187-192.
[30] HEINEMANN U, KIZIAK C, ZIBEK S, et al. Conversion of aliphatic 2-acetoxynitriles by nitrile-hydrolysing bacteria[J]. Applied microbiology and biotechnology, 2003, 63(3):274-281.
[31] SALVO G, BRANDT A, CECCHETELLI L. A micro-organism possessing enantioselective and regioselective nitrile hydratase/amidase activities: EP1291435[P]. 2003-03-12.
(责任编辑:朱小惠)
Progress in biosynthesis of chiral ketoprofen
HU Qiwei1, ZHANG Junwei2, WANG Yuanshan1
(1.College of Biotechnology and Bioengineering, Zhejiang University of Technology, Hangzhou 310014, China; 2.Hangzhou Anow Microfiltration Co., Ltd., Hangzhou 311404, China)
Ketoprofen is one of the most prominent non-steroidal anti-inflammatory drugs,which was widely used in rheumatism, rheumatoid arthritis, myelitis, gout and other diseases. Most of the commercially available ketoprofen drugs are racemic. However, the (S)-enantiomer has therapeutic activity against inflammation and pain, while the existence of (R)-enantiomer resulted in increased physiological side effects and toxicity. Chiral ketoprofen is currently produced by chemical synthesis. Compared to chemical methods, biosynthesis of ketoprofen is preferable because of its mild reaction conditions and eco-friendliness. In this review, the progress in biosynthesis of chiral ketoprofen with lipase, esterase, and nitrile hydratase/amidase bienzyme system as biocatalysts was summarized.
biocatalysis; ketoprofen; lipase; esterase
2017-05-27
浙江省公益技术研究社会发展项目(2014C33223)
胡琦蔚(1992—),女,浙江嵊州人,硕士研究生,研究方向为生物催化与生物转化,E-mail:hudei92@sina.com.通信作者:王远山副教授,E-mail:yuanshan@zjut.edu.cn.
Q814
A
1674-2214(2017)03-0153-05
