可激活磁共振成像纳米探针的制备及生物医学应用
2017-09-12王艺茹汪乐乐胡学勤胡建宇李菁菁
王艺茹,汪乐乐,陈 颖,胡学勤,胡建宇,李菁菁,2*
(1.徐州医科大学 医学影像学院,江苏 徐州 221004; 2.徐州医科大学附属医院 医学影像科,江苏 徐州 221006)
可激活磁共振成像纳米探针的制备及生物医学应用
王艺茹1,汪乐乐1,陈 颖1,胡学勤1,胡建宇1,李菁菁1,2*
(1.徐州医科大学 医学影像学院,江苏 徐州 221004; 2.徐州医科大学附属医院 医学影像科,江苏 徐州 221006)
在生物医学领域,磁共振成像是一种非常重要的疾病诊疗技术. 近50%的磁共振检查已经涉及造影剂的应用. 可激活磁共振成像纳米探针以优化信噪比为原则,借助特异性的生物分子识别作用或分子交互作用增强磁共振信号,提高了磁共振诊断的敏感性与特异性,推动着磁共振成像在生物医学领域的广泛应用. 本文就目前国内外热门研究的可激活磁共振纳米探针的种类、原理等方面进行阐述,详细介绍了可激活磁共振纳米探针在生物医学上的应用,在前景方面也进行了展望.
磁共振成像;造影剂;可激活纳米探针
自1973年LAUTERBUR首次实现磁共振成像(magnetic resonance imaging,MRI)并应用于人体疾病诊断以来,这一技术已在生物、医学等领域得到迅速发展和广泛应用[1]. 与X-CT、超声波成像相比,MRI具有诸多突出优点:无电离辐射;可实现多参数成像;无需体位改变即可实施任意方位层面的扫描;较高空间分辨率和对比度、无骨质伪影、能反应被检测组织水质子周围环境并获取相关生理生化信息;可提高对心脏、大血管形态和功能的诊断等. 此外,还可对器官移植进行检测[2]. 目前已成为临床常规影像诊断方法和手段之一. 据统计,有近50%的MRI检查已经涉及MRI造影剂[3]. 尽管如此,MRI灵敏度的相对有限性激励着人们去寻找更加敏感的造影剂. 近年来,研究人员通过对不同纳米材料进行表面改性制备出了许多生物功能性材料,广泛应用于生物医药等各个领域[4],纳米造影剂就是其中之一,基于纳米造影剂的磁共振成像受到了越来越多研究者的青睐,构建了一系列磁共振分子成像纳米探针用于肿瘤检测,如AS1411适配体结合Gd2O3纳米颗粒[5]、能穿透细胞膜的TAT多肽修饰超顺磁Fe3O4纳米粒子[6]等. 为了进一步提高MRI灵敏度,以优化信噪比(target to background ratio, TBR)为原则的可激活MRI纳米探针逐渐被开发. 这类可激活MRI纳米探针借助特异性的生物分子识别作用或分子交互作用实现MRI信号的增强,提高诊断的准确性[7]. 下面,我们以可激活MRI纳米探针为中心,就MRI造影剂的种类、原理、生物医学应用等方面进行详细阐述.
1 MRI纳米造影剂
在MRI技术中,造影剂的使用对于更好地反映活体条件下生物细胞内的正常或病理状态具有重要作用. 常用的MRI造影剂分为两类:一类是以Fe3O4纳米粒子为基础的阴性信号造影剂(negative contrast agent),能产生强烈的T2阴性信号造影,在MRI和多模式成像中应用较多. Tat蛋白转导结构域(Tat-PTD)是HIV-I反式蛋白激酶TAT中一段具有独立跨膜转运能力的富含碱性氨基酸短序列[8],β-淀粉蛋白是阿尔滋海默症(AD)病理特征老年斑(SP)的主要组成部分. ZHAN等利用热分解法获得水相磁性Fe3O4纳米颗粒(MNPS),经过表面官能氨基修饰,通过N-琥珀酰-3-2-联硫基吡啶-丙酸盐(SPDP)偶联及超滤纯化等方法,将Tat-PTD肽段和Aβ40肽段分别与氨基化的MNPS进行生物连接,制备出特异性与老年斑相结合的靶向纳米铁造影剂Aβ40-MNPS-Tat PTD. 实验证明所获得的靶向纳米材料Aβ40-MNPS-Tat PTD能特异性地针对小鼠脑内的老年斑病变进行负性强化和标记[9]. 此外,研究表明表皮生长因子(EGFR)在鼻咽癌有淋巴结转移或治疗后局部残留和复发的患者中存在高表达. ZHANG选择EGFR的单克隆抗体西妥昔单(C225)作为超小型超顺磁性氧化铁(USPIO)连接的单抗,特异性竞争受体EGFR分子上的特殊结合位点. 实验结果表明,C225-USPIO孵育的人鼻咽低分化磷状细胞癌细胞株的T2信号强度明显降低,而正常支气管上皮细胞信号强度未见明显改变,C225-USPIO成为一种低毒性、纳米级、特异性靶向的分子造影剂[10].
另一类是以钆离子螯合物马根维显(Magnevist, Gd-DTPA)为代表的阳性信号造影剂(positive contrast agent),在临床上广泛使用. 除此之外,T1磁共振成像纳米造影剂随着纳米技术的快速发展而进入人们的视野,比如使用不同外壳如聚乙二醇(PEG)[5,11]、葡萄糖酸[12]、牛血清白蛋白(BSA)[13]等包裹的Gd2O3纳米颗粒(Gd2O3NPs)作为T1阳性造影剂已经成功应用于肿瘤的MRI. 除了Gd2O3NPs,MnO纳米颗粒(MnO NPs)作为一种T1阳性造影剂,首先被HYEON团队应用于小鼠乳腺癌的选择性磁共振成像,也取得了良好的显像效果[14]. Gd3+周围有7个不成对电子,而Mn2+周围有5个不成对电子,这使得MnO NPs与Gd2O3NPs相比具有较低的弛豫效能. MnO NPs尽管其阳性信号增强能力有限,但具有较好的生物相容性,受到了研究者的青睐. 基于Gd的阳性信号造影剂具有导致肾源性系统性纤维化(NSF)的潜在毒性,这促使研究者寻求更佳的材料[15-16].
2 可激活MRI纳米探针
由于病变与正常组织在酸碱度(pH)、金属离子、酶活性、小生物分子等方面存在差异[7],进入病变组织的可激活MRI纳米探针可被这些事件激活,产生信号增强效果,大大优化了TBR. 得益于纳米材料的特性,MRI纳米对比剂的开发加速了可激活MRI纳米探针的设计与制备,下面将详细介绍基于Fe3O4、Gd2O3、MnO和MnO2纳米粒子的可激活MRI纳米探针的设计原理.
2.1 基于Fe3O4的可激活MRI纳米探针
作为MRI纳米造影剂的先锋,T2阴性造影剂Fe3O4纳米粒子能缩短T2弛豫时间,在T2加权图像上产生低信号,形成明显的对比作用. 基于Fe3O4的可激活MRI纳米探针主要是利用聚合的Fe3O4较分散的Fe3O4纳米粒子能够更有效地减小T2弛豫时间,从而在T2加权图像上表现出更低信号. 基于这个原理,PEREZ等实现了DNA与DNA之间、蛋白与蛋白之间、蛋白与小分子之间以及酶反应的相关研究(图1)[7].
2.2 基于Gd2O3的可激活MRI纳米探针
基于Gd螯合物的可激活MRI已被广泛研究,但是基于Gd2O3纳米粒子的可激活MRI探针却不多,CHAN等将DEG-Gd2O3纳米粒子包裹在疏水性和可生物降解的聚合物粒子内,这样可有效阻止DEG-Gd2O3纳米粒子与周围水环境的接触,从而产生猝灭的T1信号. 一旦在酸性环境或活性氧浓度增高的环境中,聚合胶囊的降解导致释放的DEG-Gd2O3纳米粒子与水环境充分接触,从而产生增强的T1信号(图2)[17].

图1 基于Fe3O4的可激活MRI纳米探针用于蛋白质(a)和酶活性(b)的传感应用Fig.1 Iron oxide nanoparticle-based activatable MRI for protein(a) and enzyme activity(b) sensing

图2 可降解聚合物控制Gd2O3纳米粒子与水之间的相互作用Fig.2 Degradable polymer matrix controls the interaction of water with the Gd oxide nanoparticles
2.3 基于MnO的可激活磁共振成像纳米探针
作为人体的必须微量元素,锰在人体内参与骨质形成、脂肪和糖类新陈代谢、血糖调节和钙吸收等多种生理活动[18-19]. 与钆相似,锰的强化特性随对比剂浓度改变而呈双向性变化,即低浓度时缩短T1,T1WI呈高信号;高浓度时缩短T2,T2WI呈低信号[20]. 考虑到钆造影剂有引起DSF的可能性,锰对比剂作为替代物是很好的T1造影剂. 自HYEON团队首次将MnO纳米材料应用于MRI以来[15],对MnO纳米材料的研究逐渐兴起. MnO纳米材料多采用高热分解法以锰油酸复合物为原料制备,并经过表面修饰包壳,改变疏水性,增加生物相容性,同时增强了磁共振成像信号[21-23]. HUANG等采用一种简易的二步合成法,用人血清白蛋白(HSA)包裹MnO纳米颗粒制作磁共振对比剂,并在U87MG脑胶质瘤动物实验中得到了验证[24]. 此外,聚乙二醇(PEG)[25]、聚乙烯吡咯烷酮(PVP)[26]、二巯基琥珀酸(DMSA)[27]、磷脂[28]等也被应用于MnO纳米颗粒的包裹修饰. MnO纳米粒子在低的pH环境中能够释放出Mn2+这一特性被用于肿瘤的可激活MRI. HSU等将MnO纳米颗粒和香豆素-545T共同包裹在杂交二氧化硅纳米壳中形成复合物,同时负载了对肿瘤细胞高亲和力的叶酸,增强纳米探针的特异性. 在肿瘤细胞吞噬叶酸的过程中,复合物进入细胞,肿瘤细胞的酸性环境还原MnO,释放Mn2+,在胞内产生T1加权像上的磁共振增强信号. 同时,入胞前被MnO猝灭了荧光信号的香豆素-545T也恢复了原有的荧光强度(图3)[29]. HOWELL等用油酸包裹MnO纳米颗粒,并将其封装在聚乙二醇(PEG-2000)、磷脂酰乙醇胺(PE)、胆固醇(DC-cholesterol)和二油酰磷脂酰乙醇胺(DOPE)组成的胶团内,同时负载了质粒DNA和阿霉素,在人胚肾细胞(HEK293)中得到了验证,取得了诊疗一体的良好效果[23]. 同时HUANG等设计的mPEG&cRGD-g-PAsp@MnO 可激活MRI纳米探针在鼠肿瘤磁共振成像中也显示了高度的特异性与敏感性[30].

图3 叶酸、香豆素-545T、MnO和SiO2纳米壳复合物示意图Fig.3 Schematic illustration of synthesis and working principle of the coencapsulation of MnO nanoparticles, coumarin-545T inside a poly(ethylene oxide)(PEO)-based silica nanocapsules
2.4 基于MnO2的可激活MRI纳米探针
基于Fe3O4、 Gd2O3和MnO纳米粒子的可激活MRI探针因为纳米粒子本身的MRI信号会存在信噪比低的缺陷. 不同于MnO纳米粒子,MnO2纳米片中的Mn原子被6个氧原子限制在八面体的几何结构内而远离水环境,对水质子的纵向或横向弛豫没有贡献,因此MnO2纳米片呈现出很低的T1或T2信号,但是在被还原为Mn2+后会表现出强的T1信号,这种从“Off-On”的信号响应呈现出更高的信噪比,该还原可以在低pH环境下实现,也可以在谷胱甘肽等还原性环境中完成[31]. 目前,MnO2纳米材料多采用两种制备方法. 一是由高锰酸钾(KMnO4)在乙磺酸(MES)溶液中还原制备[32-34],二是在四甲基氢氧化铵的存在下,过氧化氢(H2O2)氧化氯化锰(MnCl2)制备[35-36]. ZHAO等制备的Cy5-MnO2纳米材料,在体内谷胱甘肽(GSH)的作用下,MnO2还原为Mn2+,造成了周围水质子的纵向/横向弛豫率的改变. 但是没有被GSH还原的MnO2仅表现出微弱的弛豫率的变化,两者之间因此形成了明显的信号差异,优化了肿瘤背景比值. MnO2被还原分解的同时,被MnO2猝灭荧光信号的Cy5恢复其荧光信号,这种荧光/磁共振双模态的可激活纳米探针明显提高了疾病诊断的准确性(图4)[31]. GALLO等制备的碳量子点/二氧化锰双模态探针也达到了类似的效果[37]. 同时考虑到片层结构的物质具有较大的比表面积,能够提高药物负载量,基于MnO2纳米片的可激活MRI纳米探针也是实现了药物靶向递送的目的.
CHEN等制备了一种负载阿霉素(DOX)的MnO2纳米片,并通过Mn-N之间的配位结合作用修饰聚乙二醇(PEG5000-NH2),增加MnO2的生物相容性. 当纳米材料进入细胞后,MnO2被肿瘤酸性环境中的H+还原分解,释放DOX,显示出磁共振信号的变化. 结果表明,这种pH激活的MRI纳米探针不仅增快了DOX的释放速度,而且能够灵敏的监测肿瘤药物治疗过程(图5)[38]. FAN等用MnO2纳米片负载光敏剂二氯吩卟e6(Ce6)标记的脱氧核酶(DNAzymes),保护DNAzymes免受酶的消化作用. 受体内GSH的还原作用,MnO2分解为Mn2+,在增强磁共振信号的同时,Mn2+充当辅酶因子催化了DNAzymes的基因沉默疗法进程. 同时,在体循环的过程中,Ce6中单线态氧(1O2)的释放也极大地提升了光能疗法的效果(图6)[39]. 这种多功能的基于MnO2纳米片的可激活MRI纳米探针在疾病的诊疗方面表现出了巨大的优越性.
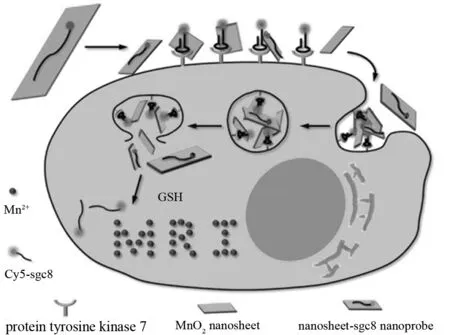
图4 Cy5-MnO2纳米材料示意图Fig.4 Activation mechanism of the MnO2 nanosheet-aptamer nanoprobe for fluorescence/MRI bimodal tumor cell imaging

图5 PEG-MnO2纳米片合成示意图(a)和PEG-MnO2纳米片的pH激活磁共振及诊疗机制(b)Fig.5 Schematic illustration of synthetic procedure for 2D PEG-MnO2 nanosheets(a) and theranostic function of PEG-MnO2 nanosheets for intracellura pH-responsive drug delivery and T1-MRI(b)
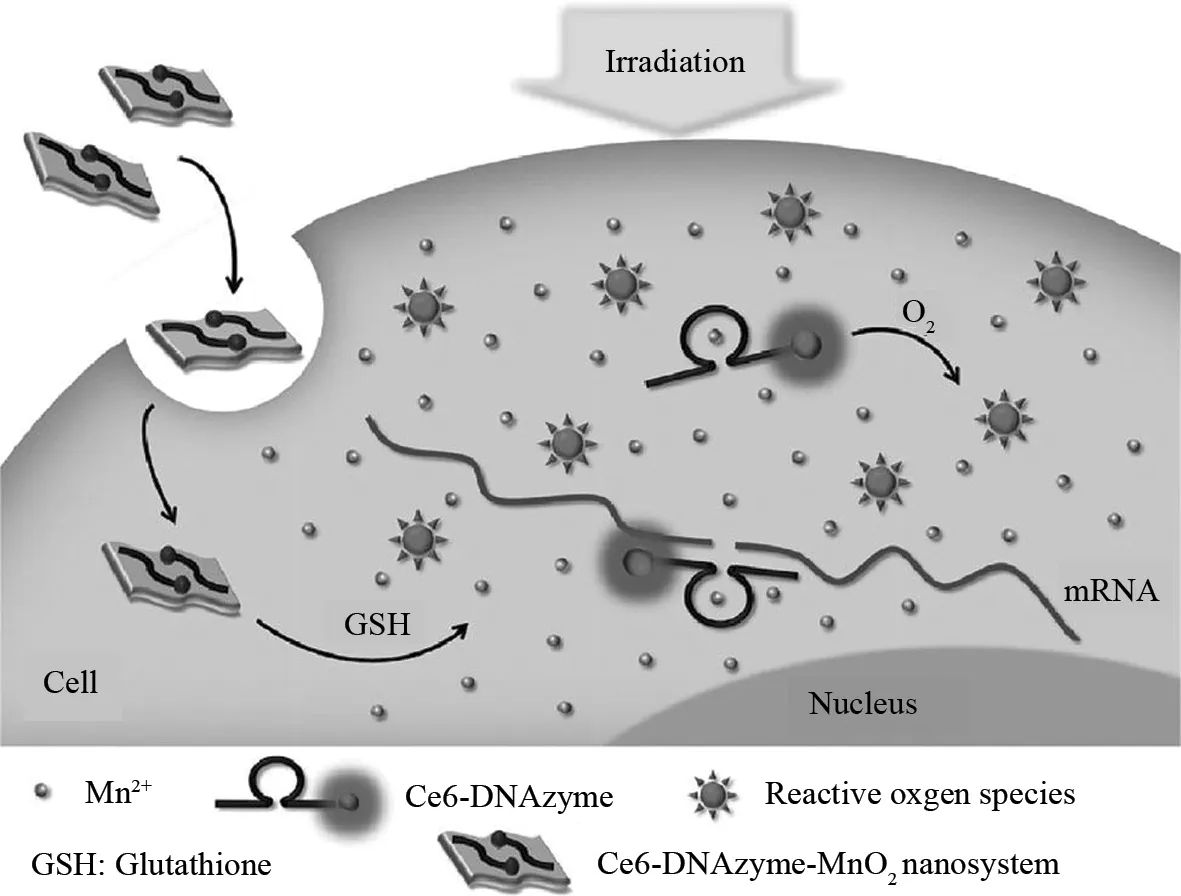
图6 Ce6-DNAzymes-MnO2纳米片示意图Fig.6 Activated mechanism of the Ce6-DNAzyme-MnO2 nanosheets
3 结论
随着MRI在疾病诊疗中的广泛应用,人们对于MRI敏感性与特异性的要求也必然越来越高. 可激活MRI纳米探针在体内病变组织中酸碱度(pH)、金属离子、酶活性、小生物分子等变化的影响下产生激活效应,在成像诊疗方面体现了巨大的优势. 虽然目前对于可激活磁共振成像纳米探针的研究相对较少,且缺乏一定的临床试验,但是我们相信,在不久的将来,这一技术必将得到飞速的发展. 更多的高靶向性、良好生物相容性、高弛豫效能、低毒性、易排出的可激活MRI纳米探针被开发出来,特别是载药相关的诊疗一体化性能方面. 基于MnO2纳米片的可激活磁共振成像纳米探针,依靠其高载药率、高灵敏性的优势,也将受到人们青睐.
[1] LAUTERBUR P C. Image formation by induced local interaction: examples employing nuclear magnetic resonance [J]. Nature, 1973, 242: 190-191.
[2] 张伟禄. 靶向磁共振成像造影剂的合成及其在癌症早期诊断中的应用[D]. 上海: 华东师范大学, 2010.
ZHANG W L. The synthesis of tumor-targeted magnetic resonance imaging contrast agents and their application in early diagnosis of cancer [D]. Shanghai: East China Normal University, 2010.
[3] SHIRAISHI K, KAWANO K, MAITANI Y, et al. Polyion complex micelle MRI contrast agents from poly(ethylene glycol)-b-poly(l-lysine) block copolymers having Gd-DOTA; preparations and their control of T(1)-relaxivities and blood circulation characteristics [J]. Journal of Controlled Release: Official Journal of the Controlled Release Society, 2010, 148(2): 160-167.
[4] 邹雪艳, 董烁, 李宾杰, 等. 纳米材料在蛋白质分离中的应用[J]. 化学研究, 2014, 25(5): 544-550.
ZHOU X Y, DONG S, LI B J, et al. Application of nanometer materials in protein seperation [J]. Chemical Research, 2014, 25(5): 544-550.
[5] LI J J, YOU J, DAI Y, et al. Gadolinium oxide nanoparticles and aptamer-functionalized silver nanoclusters-based multimodal molecular imaging nanoprobe for optical/magnetic resonance cancer cell imaging [J]. Analytical Chemistry, 2014, 86(22): 11306-11311.
[6] JOSEPHSON L, TUNG C, MOORE A, et al. High-efficiency intracellular magnetic labeling with novel superparamagnetic-Tat peptide conjugates [J]. Bioconjugate Chemistry, 1999, 10(2): 186-191.
[7] LI J J, CHENG F F, HUANG H P, et al. Nanomaterial-based activatable imaging probes: from design to biological applications [J]. Chemical Society Reviews, 2015, 44(21): 7855-7880.
[8] 汪飞鹏, 桂向东, 宋礼华, 等. hCu,Zn-SOD-TAT PTD的融合表达及其跨膜转运性质的初步研究[J]. 药物生物技术, 2004, 11(1): 11-15.
WANG F P, GUI X D, SONG L H, et al. Expression and trans-membrane activity of human Cu, Zn-SOD-TAT PTD [J]. Pharmaceutical Biotechnology, 2004, 11(1): 11-15.
[9] 湛彦强, 吴军, 许杰, 等. 靶向纳米铁磁共振造影剂特异性标记阿尔茨海默病鼠脑内老年斑[J]. 中华神经科杂志, 2011, 44(7): 500-503.
ZHAN Y Q, WU J, XU J, et al. Study of specially labeling amyloid plaques in vivo in Alzheimer transgenic mice with targeted magnetic nano-iron contrast agent [J]. Chinese Journal of Neurology, 2011, 44(7): 500-503.
[10] 张军. 针对EGFR的靶向纳米磁共振造影剂C225-USPIO体外检测[D]. 武汉: 华中科技大学, 2011.
ZHANG J. In-vitro test of targeted nano magnetic resonance contrast medium C225-USPIO against EGFR [D]. Wuhan: Huazhong University of Science and Technology, 2011.
[11] FAUCHER L, TREMBLAY M, LAGUEUX J, et al. Rapid synthesis of PEGylated ultrasmall gadolinium oxide nanoparticles for cell labeling and tracking with MRI [J]. ACS Applied Materials & Interfaces, 2012, 4(9): 4506-4515.
[12] PARK J Y, BAEK M J, CHOI E S, et al. Paramagnetic ultrasmall gadolinium oxide nanoparticles as advanced T1 MRI contrast agent: account for large longitudinal relaxivity, optimal particle diameter, and in vivo T1 MR images [J]. ACS Nano, 2009, 3(11): 3663-3669.
[13] SUN S K, DONG L X, CAO Y, et al. Fabrication of multifunctional Gd2O3/Au hybrid nanoprobe via a one-step approach for near-infrared fluorescence and magnetic resonance multimodal imaging in vivo [J]. Analytical Chemistry, 2013, 85(17): 8436-8441.
[14] NA H B, LEE J H, AN K, et al. Development of a T1 contrast agent for magnetic resonance imaging using MnO nanoparticles [J]. Angewandte Chemie (International Edition in English), 2007, 46(28): 5397-5401.
[15] ZHEN Z P, XIE J. Development of manganese-based nanoparticles as contrast probes for magnetic resonance imaging [J]. Theranostics, 2012, 2(1): 45-54.
[16] CHEN R, LING D S, ZHAO L, et al. Parallel comparative studies on mouse toxicity of oxide nanoparticle- and gadolinium-based T1 MRI contrast agents [J]. ACS Nano, 2015, 9(12): 12425-12435.
[17] VIGER M L, SANKARANARAYANAN J, DE GRACIA-LUX C, et al. Collective activation of MRI agents via encapsulation and disease-triggered release [J]. Journal of the American Chemical Society, 2013, 135(21): 7847-7850.
[18] KEEN C L, ENSUNSA J L. Manganese metabolism in animals and humans including the toxicity of manganese [J]. Metal Ions in Biological Systems, 2000, 37: 89-121.
[19] BOWMAN A B, KWAKYE G F, HERRERO HERNANDEZ E, et al. Role of manganese in neurodegenerative diseases [J]. Journal of Trace Elements in Medicine and Biology: Organ of the Society for Minerals and Trace Elements (GMS), 2011, 25(4): 191-203.
[20] 龚明福, 杨华. 锰对比剂磁共振成像研究进展[J]. 中国医学影像技术, 2013, 29(1): 142-145.
GONG M F, Yang H. Progress in research of magnetic resonance imaging of manganese contrast agent [J]. Chinese Journal of Medical Imaging Technology, 2013, 29(1): 142-145.
[21] SHIN J, ANISUR R M, KO M K, et al. Hollow manganese oxide nanoparticles as multifunctional agents for magnetic resonance imaging and drug delivery [J]. Angewandte Chemie (International Edition in English), 2009, 48(2): 321-324.
[22] HOWELL M, MALLELA J, WANG C, et al. Manganese-loaded lipid-micellar theranostics for simultaneous drug and gene delivery to lungs [J]. Journal of Controlled Release: Official Journal of the Controlled Release Society, 2013, 167(2): 210-218.
[23] LEE S H, KIM B H, NA H B, et al. Paramagnetic inorganic nanoparticles as T1 MRI contrast agents [J]. Wiley Interdisciplinary Reviews. Nanomedicine and Nanobiotechnology, 2014, 6(2): 196-209.
[24] HUANG J, XIE J, CHEN K, et al. HSA coated MnO nanoparticles with prominent MRI contrast for tumor imaging [J]. Chemical Communications (Cambridge, England), 2010, 46(36): 6684-6686.
[25] CHEN N, SHAO C, LI S, et al. Cy55 conjugated MnO nanoparticles for magnetic resonance/near-infrared fluorescence dual-modal imaging of brain gliomas [J]. Journal of Colloid and Interface Science, 2015, 457: 27-34.
[26] HU X Q, JI Y X, WANG M L, et al. Water-soluble and biocompatible MnO@PVP nanoparticles for MR imaging in vitro and in vivo [J]. Journal of Biomedical Nanotech-nology, 2013, 9(6): 976-984.
[27] LETOURNEAU M, TREMBLAY M, FAUCHER L, et al. MnO-labeled cells: positive contrast enhancement in MRI [J]. The Journal of Physical Chemistry B, 2012, 116(44): 13228-13238.
[28] COSTANZO M, SCOLARO L, BERLIER G, et al. Cell uptake and intracellular fate of phospholipidic manganese-based nanoparticles [J]. International Journal of Pharmaceutics, 2016, 508(1/2): 83-91.
[29] HSU B Y, NG M, TAN A, et al. pH-Activatable MnO-based fluorescence and magnetic resonance bimodal nanoprobe for cancer imaging [J]. Advanced Healthcare Materials, 2016, 5(6): 721-729.
[30] HUANG H T, YUE T, XU K, et al. Fabrication and evaluation of tumor-targeted positive MRI contrast agent based on ultrasmall MnO nanoparticles [J]. Colloids and Surfaces. B, Biointerfaces, 2015, 131: 148-154.
[31] ZHAO Z L, FAN H H, ZHOU G F, et al. Activatable fluorescence/MRI bimodal platform for tumor cell imaging via MnO2nanosheet-aptamer nanoprobe [J]. Journal of the American Chemical Society, 2014, 136(32): 11220-11223.
[32] WANG Y H, JIANG K, ZHU J L, et al. A FRET-based carbon dot-MnO2nanosheet architecture for glutathione sensing in human whole blood samples [J]. Chemical Communications (Cambridge, England), 2015, 51(64): 12748-12751.
[33] LI N, DIAO W, HAN Y Y, et al. MnO2-modified persistent luminescence nanoparticles for detection and imaging of glutathione in living cells and in vivo [J]. Chemistry (Weinheim an der Bergstrasse, Germany), 2014, 20(50): 16488-16491.
[34] CAI Q Y, LI J, GE J, et al. A rapid fluorescence “switch-on” assay for glutathione detection by using carbon dots-MnO2nanocomposites [J]. Biosens Bioelectron. 2015, 72: 31-36.
[35] HE D G, YANG X X, HE X X, et al. A sensitive turn-on fluorescent probe for intracellular imaging of glutathione using single-layer MnO2nanosheet-quenched fluorescent carbon quantum dots [J]. Chemical Communications (Cambridge, England), 2015, 51(79): 14764-14767.
[36] PENG L L, PENG X, LIU B R, et al. Ultrathin two-dimensional MnO2/graphene hybrid nanostructures for high-performance, flexible planar supercapacitors [J]. Nano Letters, 2013, 13(5): 2151-2157.
[37] GALLO J, VASIMALAI N, FERNANDEZ-ARGUELLES M T. Green synthesis of multimodal ‘OFF-ON’ activatable MRI/optical probes [J]. Dalton Transactions (Cambridge, England: 2003), 2016, 45(44): 17672-17680.
[38] CHEN Y, YE D L, WU M Y, et al. Break-up of two-dimensional MnO2nanosheets promotes ultrasensitive pH-triggered theranostics of cancer [J]. Advanced Materials (Deerfield Beach, Fla.), 2014, 26(41): 7019-7026.
[39] FAN H H, ZHAO Z L, YAN G B, et al. A smart DNAzyme-MnO2nanosystem for efficient gene silencing [J]. Angewandte Chemie (International Edition in English), 2015, 54(16): 4801-4805.
[责任编辑:刘红玲]
The preparation and their biomedical applications of activatable magnetic resonance imaging nanoprobes
WANG Yiru1, WANG Lele1, CHEN Ying1, HU Xueqin1, HU Jianyu1, LI Jingjing1,2*
(1.CollegeofMedicalImaging,XuzhouMedicalUniversity,Xuzhou221004,Jiangsu,China;2.DepartmentofRadiology,AffiliatedHospitalofXuzhouMedicalUniversity,Xuzhou221006,Jiangsu,China)
Magnetic resonance imaging (MRI) has played a significant role in the theranostic of diseases in biomedicine. Approximately 50% of MRI scannings have been involved with contrast agent. In order to optimize target to background ratio, activatable MRI nanoprobes were designed to amplify or boost imaging signals only in response to specific biomolecular recognition or interaction, which improved the sensitiviety and selectivity of MRI diagnosis and broaden the applications of MRI in biomedical area. In this review, the types and principles of commonly studied activatable MRI nanoprobes as well as their biomedical applications were included, and prospects were also discussed.
magnetic resonance imaging; contrast agent; activatable nanoprobe
2017-01-17.
江苏省高等学校大学生实践创新训练计划项目(201610313045Y), 江苏省“青蓝工程”中青年学术带头人项目, 江苏省“科教强卫”青年医学人才项目.
王艺茹(1995-), 女, 硕士生,研究方向为医学影像学.*
, E-mail:qingchao0124@163.com.
R445.2
A
1008-1011(2017)04-0529-08
