臭氧氧化优尼素红B-B染料废水及脱色动力学研究
2017-09-12许佩华陶仲冶李贵梅赵如松
赵 莎,许佩华,陶仲冶,李贵梅,赵如松
(北京石油化工学院 化学工程学院,北京 102617)
臭氧氧化优尼素红B-B染料废水及脱色动力学研究
赵 莎,许佩华,陶仲冶,李贵梅,赵如松*
(北京石油化工学院 化学工程学院,北京 102617)
研究了在鼓泡反应器中,臭氧氧化优尼素红B-B模拟染料废水在10~70 ℃范围内的脱色反应动力学. 发现并解释了不同温度下出现的反应速率交叉现象,利用紫外可见分光光度法定量分析染料特征颜色(浓度)变化情况. 结果表明,在不同温度下,表观脱色反应动力学都符合一级动力学规律,相关系数都达到了0.95以上. 40 ℃下,反应速率常数为0.011 83 s-1,臭氧氧化脱色过程符合y=exp(0.521-0.014x+5.02×10-6x2)方程. 随着温度的升高,臭氧在高温下氧化染料的反应速率小于臭氧的分解速率,低温时臭氧氧化的速率高于臭氧的分解速率,导致高温下氧化速率变慢. 在40~50 ℃时,臭氧氧化优尼素红B-B染料废水脱色率最高,利用紫外可见分光光度法对氧化后废水进行分析,结果表明脱色率达到了99.5%.
臭氧氧化;脱色;反应动力学;染料废水
臭氧在水处理中应用广泛,臭氧氧化电势为2.07 V[1],氧化能力仅次于氟. 臭氧氧化不产生二次污染和污泥,是一种高效、清洁的氧化剂,臭氧能够氧化分解多种难降解有机污染物,如芳香化合物、杂环化合物、羟基、氨基、醛基等. 印染污水的主要污染来源于染料,其水质色度大,属难处理污水之一. 目前对臭氧氧化印染废水的研究主要集中在pH值,反应物浓度等方面[2-5],对温度在氧化过程中的影响研究较少. 本文作者以优尼素红B-B染料为代表主要研究了在不同温度下臭氧降解染料废水的动力学,为其他研究提供实验依据.
1 实验材料及方法
1.1 实验药品及仪器
臭氧发生器(规格:3 g/h),优尼素红B-B(某公司提供),550 mL透明容器瓶,恒温水浴锅,烧杯,秒表,玻璃棒,量筒,电子天平(HZT-A500 型,福州华志科学仪器有限公司),药匙,称量纸,容量瓶,自制容器若干,紫外-可见分光光度计(岛津UV-2700).
1.2 实验步骤及分析方法
1) 用电子天平称取0.2 g优尼素红B-B,置于烧杯中溶解,转移至2 000 mL容量瓶中定容至刻度,摇匀待用(为方便,以下简称A溶液).
2) 各取10 mL A溶液稀释至2、3、6、10、20倍,取最大浓度的溶液测量其吸光度,选取最大吸收峰处吸收波长为测量波长,依次测量该波长下其他浓度所对应的吸光度,以吸光度为纵坐标,浓度为横坐标绘制标准曲线.
3) 用量筒量取300 mL A溶液于透明容器瓶中,分别在12、16、30、40、50、60、70 ℃下通入臭氧(空气气源,臭氧产生量为3 g/h),于30、60、90、120、150、180、240、300、360、540、720、960 s时各取样3 mL于自制容器中备用.
4) 用紫外-可见分光光度计扫描200~800 nm波段,测量氧化后各个时间段A溶液的吸光度. 根据朗伯-比尔定律计算出各个时间段的浓度,求出动力学方程.
5) 测量不同温度下各氧化时间段最大吸收波长处的吸光度,绘制出氧化降解曲线.
2 结果与讨论
2.1 优尼素红B-B染料废水的标准曲线方程
2.1.1 最大波长的确定
分别配置不同浓度的优尼素红B-B溶液(质量浓度),在紫外可见分光光度计上扫描200~800 nm范围内的吸光度,以波长λ为横坐标,吸光度A为纵坐标,绘制曲线如图1所示,确定最大波长,在可见光区的最大吸收波长为514 nm.
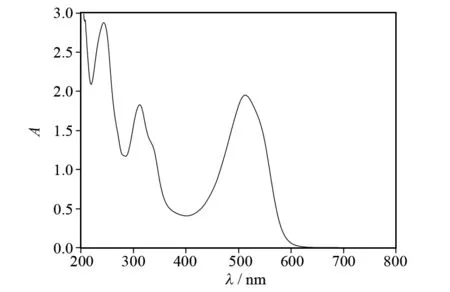
图1 优尼素红B-B的吸光度曲线Fig.1 Unisol red B-B absorbance curve
2.1.2 标准曲线
使用UV-2700紫外可见分光光度计测定不同浓度下优尼素红B-B在514 nm处的吸光度,如下表1所示.

表1 最大吸收波长处的吸光度
以浓度为横坐标,吸光度为纵坐标,绘制A-ρ曲线,如图2所示.
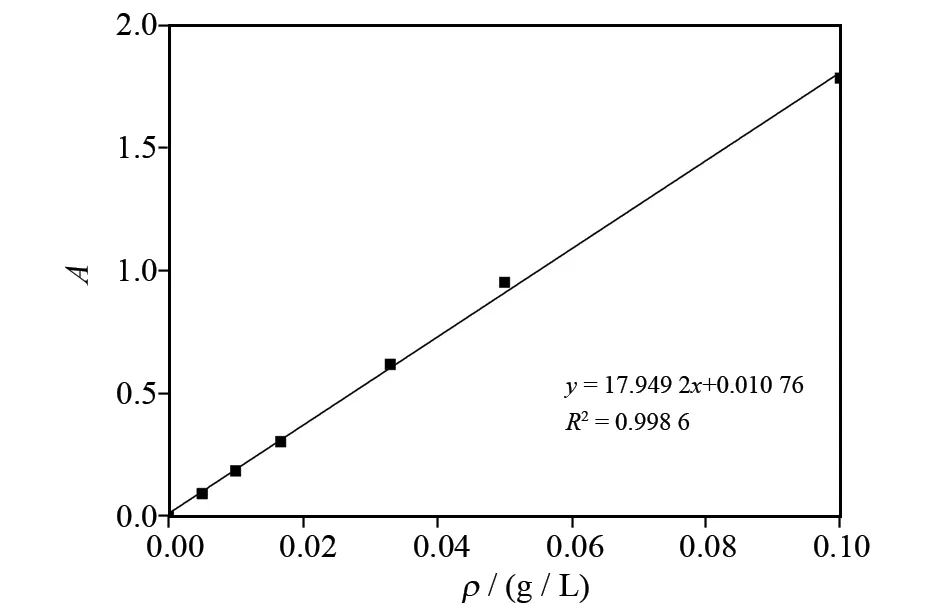
图2 优尼素红B-B 标准曲线Fig.2 Unisol red B-B standard curve
标准曲线方程为y=17.949 2x+0.010 76,相关系数为0.998 6. 根据朗伯-比尔定律,吸光度与浓度呈线性关系,测量未知浓度下的吸光度即可知道浓度.
2.2 优尼素红B-B染料废水的氧化吸光度曲线
以40 ℃下氧化曲线为例,优尼素红B-B氧化吸光度曲线如图3所示.

图3 优尼素红B-B降解过程吸光度变化曲线Fig.3 Unisol red B-B degradation absorbance curve
从图3中可以看出在200~250 nm范围内有强吸收峰,这是分子结构中共轭体系中的π→π*跃迁产生的;在270~350 nm范围内有吸收峰,这是分子结构中的C=O中的n→π*电子跃迁产生的;在可见光区出现较大的吸收峰,这是整个分子中的共轭体系产生的n→π*电子跃迁产生的[6].
从图3中纵向可以看出,在前240 s,可见光区的吸光度随着时间的变化比较明显,吸光度随着时间的变化其下降率增加的快,而在240 s后,其下降率减慢. 这是由于刚开始通入臭氧的时候,臭氧在水中溶解逐渐增大,反应速率增大,而随着通入时间的增加,臭氧在水中的溶解达到平衡,再继续增加臭氧,臭氧来不及溶解便会从水溶液中逸出[7-9]. 另一方面,在刚开始通入臭氧时,首先与染料分子中的发色团发生反应,从而导致吸光度下降较快,而在发色团被氧化完后,一些小分子中间产物才开始被氧化,因而在氧化后期吸光度变化缓慢[10]. 从图3中横向来看,紫外光区的吸光度下降速度比可见光区下降速度慢. 表2为紫外光区和可见光区最大吸收波长处对应时刻的吸光度,在0~30 s时间段内,各个波长下吸光度变化率分别为21.5%,24.2%,36.7%,这说明臭氧在氧化过程中首先氧化键能较低的基团而后再氧化键能较高的基团[6]. 在960 s时,脱色率达到了99.5%,色度与自来水持平.
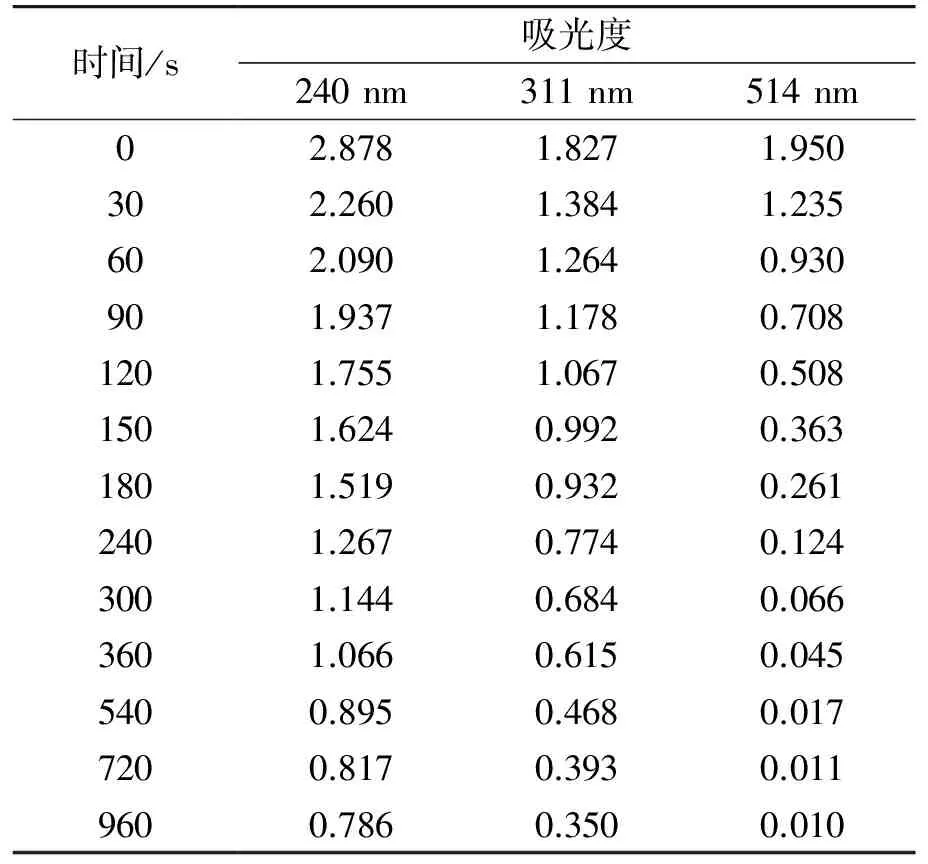
表2 不同吸收波长处的吸光度
2.3 臭氧氧化优尼素红B-B染料废水的动力学级数的确定
根据动力学方程式可知,对于零级反应,cA~t呈直线关系,对于一级反应,lncA~t呈直线关系,对于二级反应,1/cA~t呈直线关系. 分别作出各级反应的曲线,求出动力学方程和相关系数. 如表3所示(以40 ℃为例).

表3 各级反应动力学方程及相关系数
从表3中可以看出,臭氧降解优尼素红B-B 染料废水的动力学适宜用一级反应动力学方程表达,相关系数达到0.989 2,与章飞芳等[11]在研究活性艳红KE-3B染料废水,崔伟[12]研究的某工业废水以及杨海洋等[13]研究的某染料废水的动力学相符合. 臭氧在水中的反应可分为两条途径:一条是直接反应,另一条是生成自由基进行反应[14].
直接反应:发色团(助色团)+O3→中间产物或产物.
间接反应:发色团(助色团)+·OH→CO2+H2O+无机盐.
因此,臭氧氧化脱色的动力学表达式可以写为:

式中: kO3、kOH为臭氧间接氧化和直接氧化的表观速率常数,[发色团(助色团)]为发色团色浓度,[O3]为臭氧投加量,t 为反应时间.
有学者认为,在pH 一定时,[·OH]、[O3]的比值是常数R,当臭氧浓度相对于反应需求量充足时,臭氧在反应过程中处于平衡态,臭氧浓度可以以常数形式合并到表观动力学常数中,上式可简化为:

臭氧氧化脱色的反应的表观动力学级数近似为一级. 与已有相关文献[14-16]研究相符合.
2.4 温度对臭氧降解优尼素红B-B染料废水的影响
不同温度下的降解曲线如图4所示,图5和图6分别为局部放大图.

图4 不同温度下臭氧降解优尼素红B-B染料废水吸光度曲线随时间变化的规律Fig.4 Under different temperature and ozone degradation in unisol red B-B dye wastewater absorbance curve changing with time
1)0~300 s各温度下氧化对比.

图5 0~300 s各温度氧化曲线对比Fig.5 Comparison of oxidation curves of 0-300 s at various temperatures
2)300~960 s各温度氧化曲线对比.

图6 300~960 s各温度氧化曲线对比Fig.6 Comparison of oxidation curves of 300-960 s at various temperatures
综合以上各图可以看出,各温度下臭氧氧化规律大致相同,以40 ℃为例,臭氧氧化规律符合方程y=exp (0.521-0.014x+5.02×10-6x2),不同温度下方程系数稍有差别. 随着温度的升高,吸光度呈下降趋势,即脱色程度增大,但在70 ℃时吸光度反而比60 ℃时高. 在氧化前期阶段,随着温度的升高,吸光度下降明显,而在氧化末期,低温下的吸光度却比高温下的吸光度还要低. 分析认为,这是由于随着温度的升高,温度占主导作用,臭氧在高温下氧化染料的的反应速率小于臭氧的分解速率,而在低温时臭氧氧化的速率高于臭氧的分解速率. 因此,在高温下,臭氧没来得及反应便已经分解掉,从而导致高温下氧化速率变慢.
2.5 各温度下的氧化动力学
以40 ℃下的氧化曲线为例,测定不同氧化时间段下优尼素红B-B在最大吸收波长处的吸光度,根据标准曲线计算出氧化后的浓度,以ln(c0/ct)为纵坐标,以时间为横坐标,绘制曲线如图7所示. 表4列出了从12~70 ℃时臭氧降解的反应速率方程、相关系数、半衰期等.

图7 40 ℃动力学曲线Fig.7 40 ℃ kinetic curve

表4 各温度下氧化动力学
从表4中可看出各个温度下相关系数都在0.95 以上,最高可达0.99,相关度高,说明臭氧氧化脱色适宜用一级动力学方程来进行表达.
3 结论
1) 臭氧氧化优尼素红B-B动力学符合一级动力学方程,各温度下相关系数都达到了0.95以上. 给其他印染废水的处理提供了理论依据.
2) 利用紫外-可见分光光度法测定吸光度来表征脱色率达到99.5%,臭氧降解先降解键能低的基团再氧化键能高的基团.
3) 臭氧氧化效率随温度的升高先上升再下降,最适宜温度在40~50 ℃. 而在低温下的末期动力学要好于高温下的末期动力学,目前认为是与臭氧在水中的溶解度有关,具体机理有待研究.
4) 臭氧氧化过程符合y=exp(0.521-0.014x+5.02×10-6x2)方程.
[1] 钟理, KUO C H. 废水中甲苯的臭氧氧化动力学的研究[J]. 环境科学研究, 2000, 13(2): 20-22.
ZHONG L, KUO C H. Study on ozonation kinetics of toluene in wastewater [J]. Environmental Science Research, 2000, 13(2): 20-22.
[2] 张静, 杜亚威, 刘晓静, 等. 臭氧微气泡处理酸性大红3R废水特性研究[J]. 环境科学, 2015, 36(2): 584-589.
ZHANG J, DU Y W, LIU X J, et al. Study on characteristics of acidic red 3R wastewater treated by ozone microbu-bble [J]. Environmental Science, 2015, 36(2): 584-589.
[3] 唐庆丽, 郭卫民, 申哲民, 等. 有机污染物臭氧氧化反应动力学研究[J]. 计算机与应用化学, 2013, 30(5): 507-510.
TANG Q L, GUO W M, SHEN Z M, et al. Study on kinetics of organic pollutants with ozonation [J]. Computer and Applied Chemistry, 2013, 30(5): 507-510.
[4] 胡俊生, 任雪冬, 郝苓汀, 等. 臭氧高级氧化技术处理印染废水[J]. 沈阳建筑大学学报(自然科学版), 2009, 25(4): 747-752.
HU J S, REN X D, HAO L T, et al. Ozone advanced oxidation process for dyeing wastewater treatment [J]. Journal of Shenyang Construction University (Natural Science Edition), 2009, 25(4): 747-752.
[5] 赵伟荣, 史惠祥, 汪大翚, 等. 阳离子红染料的臭氧氧化动力学研究[J]. 高校化学工程学报, 2005, 19(1): 108-112.
ZHAO W R, SHI H X, WANG D H, et al. Study on ozonation kinetics of cationic red dye [J]. Journal of Chemical Engineering of Universities, 2005, 19(1): 108-112.
[6] 侯海锋. 臭氧氧化降解印染废水的机制及其应用研究[D]. 常州: 常州大学, 2011: 15-22.
HOU H F. Study on the mechanism and application of ozone oxidation degradation of dyeing wastewater [D]. Changzhou: Changzhou University, 2011: 15-22.
[7] 代欣欣, 李汴生. 水中臭氧溶解特性的研究[J]. 食品科技, 2008, 33(8): 84-87.
DAI X X, LI B S. Study on dissolution characteristics of ozone in water [J]. Food Science and Technology, 2008, 33(8): 84-87.
[8] 王华然, 王尚, 李昀桥, 等. 臭氧在水中的溶解特性及其影响因素研究[J]. 中国消毒学杂志, 2009, 26(5): 481-483.
WANG H R, WANG S, LI Y Q, et al. Study on dissolution characteristics of ozone in water and its influencing factors [J]. Chinese Journal of Disinfection, 2009, 26(5): 481-483.
[9] 程江, 杨卓如, 梅慈云, 等. 臭氧在水中的吸收和自分解[J]. 华南理工大学学报(自然学版), 1997, 25(5): 80-84.
CHENG J, YANG Z R, MEI C Y, et al. Ozone absorption and self-decomposition in water [J]. Journal of South China University of Technology (Natural Science Edition), 1997, 25(5): 80-84.
[10] 田兆龙, 汪晓军, 葛启龙, 等. 臭氧氧化酸性玫瑰红染料模拟废水及动力学特性分析[J]. 水处理技术, 2011, 37(11): 66-68.
TIAN Z L, WANG X J, GE Q L, et al. Analysis of ozonation of acid rose dye simulated wastewater and its kinetics characteristics [J]. Water Treatment Technology, 2011, 37(11): 66-68.
[11] 章飞芳, YEDILER A, 张青, 等. 臭氧氧化活性染料及其降解产物毒性研究[J]. 精细化工, 2003, 20(11): 682-684.
ZHANG F F, YEDILER A, ZHANG Q, et al. Study on ozonation of reactive dyes and the toxicity of their degradation products [J]. Fine Chemicals, 2003, 20(11): 682-684.
[12] 崔伟. 工业污水厂尾水色度的去除研究[J]. 广州化工, 2017, 45(1): 104-106.
CUI W. Study on removal of chromaticity of tail water in industrial wastewater treatment plant [J]. Guangzhou Chemical Industry, 2017, 45(1): 104-106.
[13] 杨海洋, 郭然, 齐蒙蒙, 等. 超声波辐照和臭氧氧化协同降解废水中的结晶紫[J]. 化学研究, 2013, 24(3): 269-273.
YANG H Y, GUO R, QI M M, et al. Degradation of crystal violet in wastewater by ultrasonic irradiation and ozone oxidation [J]. Chemical Research, 2013, 24(3): 269-273.
[14] VON G U. Ozonation of drinking water: part I. Oxidation kinetics and product formation [J]. Water Research, 2003, 37(7): 1443-1467.
[15] 郑雪松, 朱世云, 李道棠. 臭氧氧化去除吐氏酸溶液COD的动力学研究[J]. 上海环境科学, 2001, 20(7): 326-328.
ZHENG X S, ZHU S Y, LI D T. Study on the kinetics of COD removal from turing acid solution by ozonization [J]. Shanghai Environmental Science, 2001, 20(7): 326-328.
[16] 何志桥, 宋爽, 杨岳平, 等. 臭氧法降解水中氟苯的动力学研究[J]. 高校化学工程学报, 2007, 21(2): 298-303.
HE Z Q, SONG S, YANG Y P, et al. Kinetics of degradation of fluorobenzene in water by ozone [J]. Journal of Chemical Engineering of Universities, 2007, 21(2): 298-303.
[责任编辑:吴文鹏]
Study on the decolorization kinetics of unisol red B-B simulated dyeing wastewater with ozonization
ZHAO Sha, XU Peihua, TAO Zhongye, LI Guimei, ZHAO Rusong*
(BeijingInstituteofPetrochemicalTechnology,SchoolofChemicalEngineering,Beijing102617)
The decolorization kinetics of unisol red B-B simulated dyeing wastewater with ozonization in the range of 10-70 ℃ in a bubbling reactor was studied. The reaction rate crossover phenomenon at different temperatures was found and explained, and the change of dye characteristic color (concentration) was quantitatively analyzed by UV-visible spectrophotometry. The results show that the apparent kinetics of decolorization at different temperatures is in accordance with the first order kinetics, and the correlation coefficients reach 0.95 or more. At 40 ℃, the reaction rate constant is 0.011 83 s-1, and the decolorization process of ozonization is in accordance with the equation ofy=exp(0.521-0.014x+5.02×10-6x2). With the increase of temperature, the reaction rate of ozonization at high temperature is less than the decomposition rate of ozone, and the rate of ozonization at low temperatures is higher than the rate of decomposition of ozone, resulting in slower ozonization rates at high temperatures. At 40-50 ℃, the decolorization ratio of unisol red B-B simulated dyeing wastewater with ozonization was the highest, and the decolorization ratio was 99.5% analyzed by UV-visible spectrophotometry.
ozone oxidation; decoloration; reaction kinetics; dye wastewater
2017-05-02.
赵 莎(1989-),女,硕士生,研究方向为水处理.*
, E-mail:zhaorusong@bipt.edu.cn.
X791
A
1008-1011(2017)04-0462-06
