超微血流成像对颈动脉斑块内新生血管的诊断价值
2017-09-11张红雪杜建文
张红雪, 杜建文, 王 洪*
(1.承德医学院第二临床学院, 河北 承德 0670002.河北省承德市中心医院超声科, 河北 承德 0670003.中国人民解放军第266医院超声科, 河北 承德 067000)
超微血流成像对颈动脉斑块内新生血管的诊断价值
张红雪1, 杜建文2, 王 洪2*
(1.承德医学院第二临床学院, 河北 承德 0670002.河北省承德市中心医院超声科, 河北 承德 0670003.中国人民解放军第266医院超声科, 河北 承德 067000)
目的:探讨超微血流成像(SMI)对颈动脉斑块内新生血管的诊断价值,预测脑卒中发生的危险性。方法:选择2015年2月至2016年2月39例颈动脉严重狭窄预行颈动脉斑块剥脱患者,应用SMI和超声造影技术(CEUS)检测斑块内新生血管,术后标本免疫组织化学CD34染色。结果:SMI和CEUS分级具有很好地一致性(Kappa=0.860>0),不同SMI分级具有不同的新生血管密度(P<0.001),且临床症状与SMI分级呈正相关(rs=0.592>0)。结论:SMI对斑块内新生血管的观察效果与超声造影及病理学有很好的一致性,SMI可对卒中事件严重性进行评估。
颈动脉粥样硬化斑块; 新生血管; 超微血流成像; 颈动脉内膜剥脱术
脑卒中致残率全球第一,严重威胁着人类的健康[1]。2005年,Virman等[2]研究发现斑块内新生血管可以促进粥样硬化病变的发展,诱发斑块内出血和破裂,引发卒中事件。另研究发现[3],斑块新生血管数目与临床表现呈正相关。因此,新生血管的检测对于预测斑块的稳定性和临床卒中风险评估具有重要意义。超声微泡造影剂具有类似红细胞的血流动力学特征,可作为血管内示踪剂,准确地检测和定量新生血管。超微血流成像通过自适应的计算方法可有效屏蔽重叠的组织运动伪像,精确检测低速血流信号。本研究旨在探讨超微血流成像(SMI)与超声造影技术(CEUS)检测斑块内新生血管是否有一致性,并用病理学加以验证,进一步探讨临床症状在SMI分级上是否存在差异性,为临床诊治提供依据。
1 资料与方法
1.1 研究对象:2015年2月到2016年2月我院常规超声确诊的颈动脉严重狭窄(>70%)预行CEA的患者39例,男27例,女12例,年龄42~75岁,平均年龄60±4岁,签署造影检查知情同意书。排除以下患者:①非颈动脉病变原因引起脑卒中事件的患者;②其他严重疾病不能耐受手术的患者;③对白蛋白、衍生蛋白或者CEUS造影剂过敏者;④肾损害(肌酐水平>150μmoL/L)
1.2 仪器与方法
1.2.1 仪器:东芝Aplio500超声诊断仪,11-L4探头,频率4-11MHz。造影剂:SonoVue(Brauo公司)。
1.2.2 超声检查:患者取平卧位,头偏向检查对侧,暴露颈部,探头自上而下横向、纵向扫查颈动脉,在纵切面测量斑块最厚处,以收缩期流速最大值PSV>230mm/s,舒张期流速最大值EDV>100mm/s,狭窄段收缩期流速最大值PSV与狭窄远段收缩期流速最大值PSVdist>4.0,狭窄远段频谱呈低速低搏动改变的诊断标准确定颈动脉重度狭窄(70%~99%)[4]。保持探头不动,启动SMI模式,检查斑块内新生血管并储存图像。启动CEUS再次行新生血管检查,将机械指数降低至0.12~0.20,以避免造影早期微泡的破裂。将5mL造影剂溶解在5mL生理盐水中,向肘静脉注造影剂2.4mL,并根据病人的具体情况调整剂量,最大不超过4.8mL,连续观察5min并储存图像,造影剂注射结束后用5mL生理盐水冲刷。检查后记录发生新生血管的部位及范围。
1.2.3 超声图像分级标准:0级:斑块内无增强,Ⅰ级:斑块内1~4个点状增强或1~2条线状增强,Ⅱ级:>4个点状增强或>2条短线状增强。
1.2.4 病理学检查:用斑块外翻剥脱技术行颈动脉内膜剥脱术。在超声观察到新生血管标记处取材进行切片,用10%的中性福尔马林固定、脱钙、横切成5mm的组织,用石蜡固定。应用自动石蜡切片机切割成5微米厚切片,用HE和CD34染色。应用Image-Pro Plus 6.0软件分析3~5张切片,每张切片在200倍显微镜下选出5个血管分布最密集的视野,计数微血管个数/mm2,求其均数。
1.3 统计学方法:采用SPSS 17.0统计学软件。用Kappa检验SMI和CEUS分级结果一致性,kappa>0表明有意义,kappa越大,一致性越好。用单因素方差分析方法探究SMI分级在免疫组织化学CD34染色检出新生血管密度差异,用Spearman方法探究SMI与临床症状的相关性,相关系数rs>0表示正相关,rs<0表示负相关,rs=0表示零相关。
2 结 果
2.1 患者颈动脉超声检查情况:一致性Kappa检验结果:Kappa=0.860>0,表明SMI和CEUS检验斑块内新生血管有很好的一致性。见表1。

表1 SMI和CEUS分级结果
2.2 免疫组织化学检查结果:新生血管密度(均数±标准差,单位:mm2)分别是,0级:1.79±0.41,Ⅰ级:2.26±0.73,Ⅱ级:3.11±0.48。单因素方差分析结果:除SMI0级跟Ⅰ级之间无统计学差异(P1~2=0.836>0.05),其他两组之间有统计学差异(P1~3=0.000<0.05,P2~3=0.041<0.05),Ⅱ级高于Ⅰ级,Ⅱ级高于0级。
2.3 SMI分级与临床症状之间相关性:纳入本研究的39例患者中临床症状表现为无症状患者8例(20.5%,8/39),短暂性脑缺血发作(transient ischemia attack,TIA)患者20例(51.3%,20/39),脑卒中患者11例(28.2%,11/39)。Spearman秩相关检验rs=0.592>0,表明临床症状与SMI分级之间存在正相关。见表2。
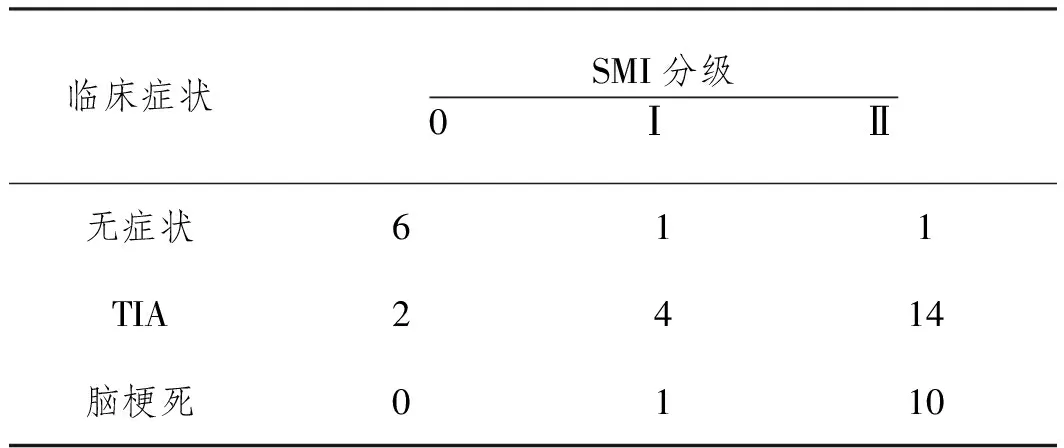
表2 SMI分级与临床症状
3 讨 论
正常情况下,颈动脉中外膜的滋养血管为管壁提供氧气和营养物质并排除代谢产物,由于斑块形成,导致动脉壁增厚,阻止了氧的弥散过程,使局部缺氧。低氧刺激机体产生致血管性物质,比如:血管内皮生长因子(VEGF)、PDGF、Ang等等,形成新生血管(从外膜的滋养血管起始到血管腔)[5]。超声造影时,可以观察到多数斑块内造影剂的充盈方向是从动脉管壁的外膜至斑块内部,一部分伴有由动脉管腔至斑块内部,只有少数造影增强的斑块表现为造影剂仅从动脉管腔内向斑块内的增强。这些新生血管绝大多数仅有简单的内皮细胞围成,周围没有支撑的结缔组织,没有基膜。这些特性致使它脆性大、渗透性大,促进了炎症细胞浸润和脂肪沉淀,进一步加重斑块发展和不稳定[6]。因此新生血管在斑块易损性发挥着重要的作用。
目前,在临床上,我们选用超声造影检测斑块内新生血管,并且已有研究指出超声造影和免疫组织半定量检查结果有很好的相关性[7,8]。但是超声造影费用高,有一定致敏风险,限制了CEUS的临床应用。近来越来越多的研究表明SMI能很好地检测出新生血管。
本研究一致性Kappa检验结果表示SMI与CEUS检测斑块内新生血管有一致性,与薛红元等[9]研究结论相一致。单因素方差分析说明SMI能够在某种程度上很好地区分新生血管的密度。但是SMI0级跟Ⅰ级之间无统计学差异,可能是样本量太小,需要进一步研究。卢晓潇等[10]研究表明,缺血性脑卒中患者更易形成不稳定斑块。本研究Spearman秩相关检验表明SMI分级能在一定程度上预示脑卒中发生的危险性,SMI等级越高,出现脑卒中的危险性越大。
本研究尚有不足之处,样本量较小,单中心研究,存在一定的误差;未能对有临床价值的微小血管的流速及阻力指数等参数进行定量分析,为临床对缺血性脑卒中易损斑块的防治提供有价值的客观依据。
综上所述,SMI检测新生血管的发现率与超声造影及病理学结果有很好的一致性,能够反映斑块内新生血管的发生情况,能够反映卒中事件的严重程度,且SMI技术为非介入及药物方法,在常规超声检查中进行,具有容易操作,对患者无附加伤害等优点,可适于所有颈动脉粥样硬化斑块的评估,对于临床脑卒中风险评估及诊治,有很好的指导作用。
[1] Mozaffarian D, Benjamin EJ, Go AS, Arnett DK,et al.Heart disease and stroke statistics-2015 update: A report from the American Heart Association[J].Circulation,2015,131(4):29~322.
[2] Virmani R,Kolodgie FD,Burke AP,et al.Atherosclerotic plaque progression and vulnerability to rupture:angiogenesis as a source of intraplaque hemorrhage[J].Arterioscler Thromb Vasc Biol,2005,25(10):2054~2061.
[3] Mofidi R, Crotty TB, McCarthy P,et al.Assoiation between plaque instability,angiogenesis and sysmptomatic carotid occlusive disease[J].Br Surg.2001,88(7):945~950.
[4] 管泽宇,高涌.颈动脉狭窄的诊断和血管重建术的现状[J].中华全科医学杂志,2011,5(9):794~796.
[5] Sluimer JC, Gasc JM, van Wanroij JL,et al.Hypoxia,hypoxia-inducible transcription factor,and macrophages in human atherosclerotic plaques arecorrelated with intraplaque angiogensis[J].Am Coll Cardiol.2008,51(13):1258~65.
[6] Taqueti VR, Di Carli MF, Jerosch-Herold M,et al.Increased microvascularization and vessel permeability associate with active inflammation in humanatheromata[J].Circ Cardiovasc Imaging,2014,7(6):920~929.
[7] Shah F,Balan P,Weinberg M,et al .Contrast-enhanced ultrasound imaging of atherosclerotic carotid plaque neovascularization: a new surrogate marker of atherosclerosis[J].Vasc Med,2007,12(4):291~297.
[8] Magnoni M,Coli S,Marrocco-Trischitta MM,et al.Contrast-enhanced ultrasound imaging of periadventitial vasa vasorum in human carotid arteries[J].Eur Echocardiogr,2009,10(2):260~264.
[9] 高丽,薛红元,叶玉泉,等.超微血管成像及超声造影评价不同厚度颈动脉斑块内新生血管的研究[J].中华超声影像学杂志,2016,25(8):93~94.
[10] 卢晓潇,赵景波,郑春梅,等.颈动脉粥样硬化斑块与缺血性脑卒中关系的病例对照研究[J].黑龙江医药科学,2014,37(4):72~73.
1006-6233(2017)08-1343-03
A
10.3969/j.issn.1006-6233.2017.08.031
*【通讯作者】王 洪, 王海丽2, 杨静茹3, 姜建慧2, 卢 欢2, 刘欢颜1
