同步放化疗联合恩度治疗ⅢB和ⅠV期非小细胞肺癌临床研究*
2017-09-04刘丽李涛郎锦义张军李柏森徐柯
刘丽, 李涛, 郎锦义, 张军, 李柏森, 徐柯
610041 成都 四川省肿瘤医院,四川省癌症防治中心·电子科技大学医学院 放疗科
•临床研究•
同步放化疗联合恩度治疗ⅢB和ⅠV期非小细胞肺癌临床研究*
刘丽, 李涛△, 郎锦义, 张军, 李柏森, 徐柯
610041 成都 四川省肿瘤医院,四川省癌症防治中心·电子科技大学医学院 放疗科
目的: 评价同步放化疗(TP方案)联合恩度治疗ⅢB和ⅠV期非小细胞肺癌的近期疗效和安全可行性。方法:60例ⅢB及ⅠV期非小细胞肺癌患者,随机分为2组,A组(观察组)给予顺铂(25mg/m2/d,d1~d3)和紫杉醇(135mg/m2,d1)联合化疗,化疗同时使用恩度(15mg/d,d1~d14)持续泵入,共四个周期。肺部原发灶及远处转移灶进行图像引导下的适形调强放射治疗,纵隔病灶照射剂量65~70Gy,胸部非纵隔病灶照射剂量66~90Gy,淋巴结照射剂量65~70Gy。远处转移病灶进行累及野照射,颅内转移灶照射剂量70~90Gy,骨转移灶照射剂量40~55Gy,其他转移灶40~60Gy。B组(对照组)除不使用恩度外,其余治疗均与A组相同。结果:所有患者均完成治疗计划。A组:放射性食管炎13%(4例),放射性肺炎3%(1例),中性粒细胞下降67%(20例),1年生存率为50%,局部复发率为23%(7例),远处转移率为37%(11例)。B组:放射性食管炎17%(5例),放射性肺炎3%(1例),中性粒细胞下降83%(25例),1年生存率为67%,局部复发率为20%(6例),远处转移率为47%(14例)。远处转移是死亡的主要原因。结论:同步放化疗联合恩度治疗ⅢB期和ⅠV期NSCLC安全可行,近期疗效较好,远期疗效有待进一步研究。
非小细胞肺癌; 放化疗法; 恩度; 近期疗效
在全球恶性肿瘤发病率和死亡率排行榜中,肺癌均占第一位。在中国,癌症已经成为首位死亡原因,是严重的公共卫生问题。2015年中国新发癌症4,292,000例,肺癌成为最常见的新发癌症类型和首位癌症死亡原因[1]。对于ⅢB期的非小细胞肺癌患者,放化综合治疗是其标准治疗手段,且同步放化疗优于序贯治疗已在业内达成共识。尽管如此同步放化疗对于不可切除的Ⅲ期肺癌患者5年生存率也仅有20%左右[2]。为了更好地保护正常器官,肿瘤局部放疗剂量受到限制[3],图像引导下的适形调强放射治疗(IGRT)在保护正常器官上具有一定优势,可以减少放疗并发症的发生。恩度作为血管生成抑制剂在NSCLC的治疗上取得了一定的疗效[4]。但同步放化疗联合恩度治疗ⅢB和ⅠV期NSCLC相关研究少有报道。因此我们设计了采用IGRT与TP方案(紫杉类+卡铂)同步并联合恩度持续泵入治疗ⅢB及ⅠV期NSCLC的研究,对60例NSCLC患者进行了治疗观察,并分析了治疗效果,现将研究结果报道如下。
1 材料与方法
1.1 临床资料
选取本院自2013年12月~2015年1月收治的ⅢB期和ⅠV期NSCLC患者,所有患者均有病理学(纤维支气管镜活检)或细胞学(痰脱落细胞学、肺穿刺细胞学或经纤维支气管镜纵膈淋巴结穿刺)确诊。纳入标准:首次治疗的患者;ECOG评分PS为0~2分;血常规、肝功能、肾功能、凝血功能正常;心脏、骨髓功能正常;心电图正常;经病理确诊的NSCLC(鳞状细胞癌或腺癌);UICC (TNM)分期为ⅢB或ⅠV期;在平扫或增强CT上肿瘤边界能清楚辨认,肿瘤大小可测量;无恶性胸腔积液;既往无肿瘤病史;既往无可能影响治疗按期完成的疾病;既往未接受过放疗和/或化疗;预计生存期3个月以上;患者和/或家属签署知情同意书。排除标准:无明确病理依据;临床分期为Ⅰ、Ⅱ及ⅢA;病灶在CT上无法明确辨认或测量;有重要脏器功能不全和/或严重心脏疾病;既往有生物制剂过敏史;正在接受其他相关抗肿瘤治疗;妊娠期或哺乳期妇女;有精神病史且未得到良好控制的患者;有严重的智力障碍或认知功能障碍的患者;同时参加了其他临床试验的患者。患者临床特征如下表1。随机分成2组,其中观察组30例,对照组30例,两组临床基本情况比较,差异无统计学意义(P>0.05)。见表1。
1.2 治疗方法
1.2.1 放射治疗 治疗前所有患者均使用热塑体模进行治疗体位固定,然后进行定位CT扫描,扫描同时测量病灶动度。在IGRT工作站进行靶区勾画,进行靶区勾画的医生事先指定。同时在IGRT工作站勾画脊髓、心脏、食管、双侧肺组织等重要器官。靶区定义如下:GTV-T:CT上可见肿瘤组织;CTV-T:在GTV的基础上外放6mm,如为中心型NSCLC并侵犯主支气管或叶支气管,则外放10mm;PTV-T:根据定位CT测得的数据在X,Y,Z三个方向进行外放。GTV-N:短径≥10mm的淋巴结[5]。PTV-N:根据定位CT测得的数据在X,Y,Z三个方向进行外放。处方剂量如下:中央型肺癌GTV-T:2~2.5Gy/f,一周照射五次,每天一次,总剂量达到65~70Gy(总剂量是指生物等效剂量,Biological Equivalent Dose,BED);周围型肺癌GTV-T:3~5Gy/f,隔一天照射一次,总BED为66~90Gy;
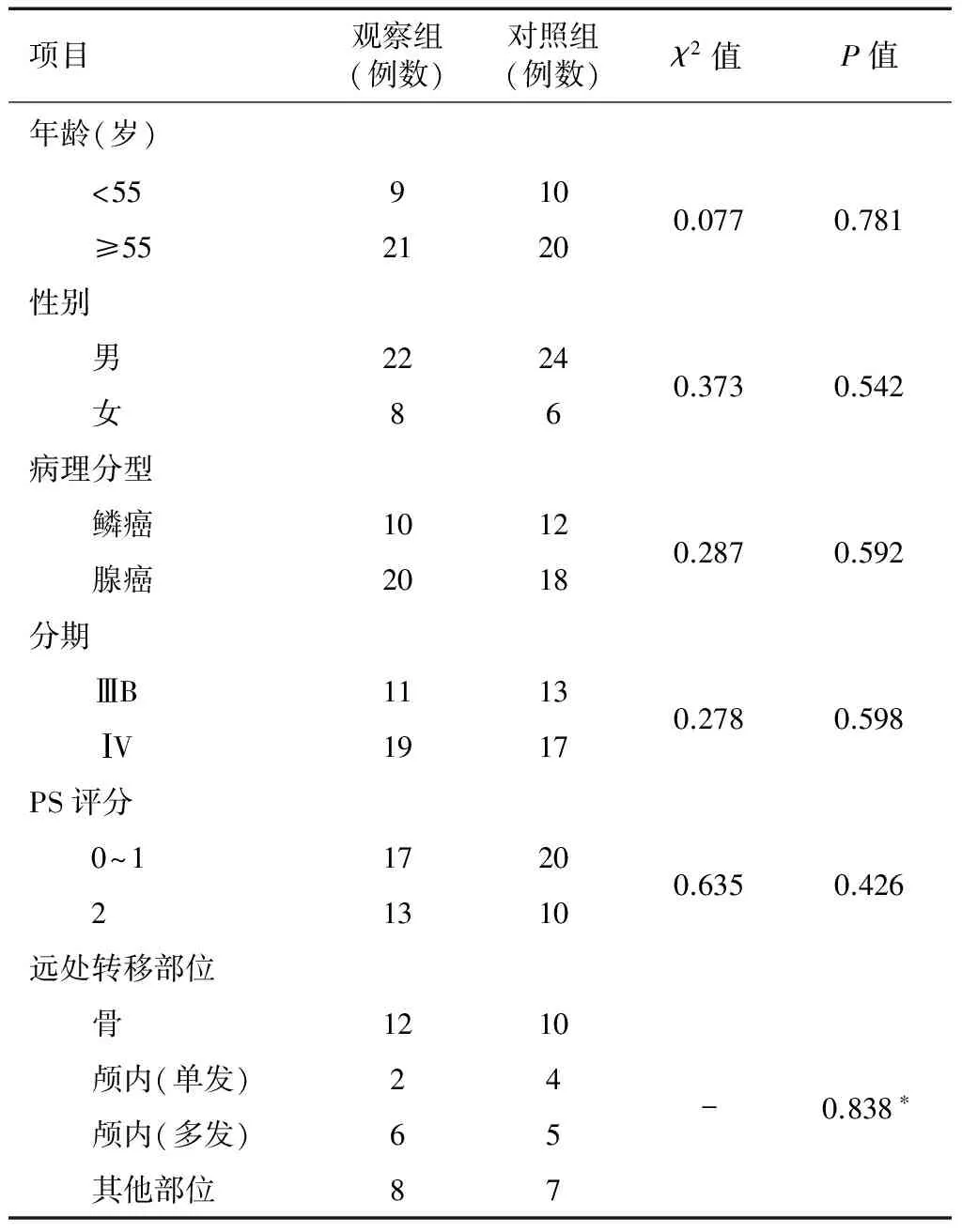
表1 患者临床特征
注:*由于其中两格期望频数小于5,故使用Fisher确切概率法进行差异性分析。其余均采用χ2检验进行差异性检验。
CTV-T单次分割剂量同相对应的GTV-T,总BED46~56Gy;GTV-N:2~2.5Gy/f,BED为65~70Gy。出现颅内转移的患者,如果转移灶是单发,则对全脑进行照射,剂量为30Gy/15f/21d,如转移灶为多发,则全脑照射剂量为30Gy/10f/14d,全脑放疗同时针对转移病灶行IGRT或立体定向放射治疗(SRT),最终使颅内转移灶的总BED达到70~90Gy,对于发生了骨转移且有疼痛的患者针对转移部位进行照射,总BED达到40~55Gy,其他部位出现的转移病灶,对直径≥10mm者进行照射,BED达到40~60Gy。治疗执行全部采用瑞典医科达公司Axesse加速器,配备160片Agility MLC。正常组织评价标准如下:脊髓1CC剂量≤40Gy,Dmax≤45Gy;健侧肺V20≤20%,V5≤60%;患侧肺V20≤30%,V5≤65%;食管V05≤50%,Dmax≤60Gy;心脏V50≤20%。治疗期间当GTV-T剂量达到40~50Gy时复查带膜CT,修改放疗计划。
1.2.2 化疗方案如下 紫杉醇剂量为135mg/m2,d1+顺铂25mg/m2/d,d1~3,21~28天为一个周期,化疗药物使用前給予预处理,常用药物为地塞米松,苯海拉明等。治疗期间常规給予止吐治疗,使用粒细胞集落刺激因子或粒细胞/巨噬细胞集落刺激因子治疗骨髓抑制。
1.2.3 恩度治疗方案 每个化疗周期第一天开始联合使用恩度(15mg,d1~d14),恩度采用持续泵入的方式给药,共使用4个周期。
1.3 治疗效果和毒副作用评价
采用RTOG标准评价放疗毒副反应,采用WHO标准评价化疗毒副反应,采用RECIST标准评价治疗效果,分为完全缓解(CR),部分缓解(PR),稳定(SD)及病变进展(PD)。以RR(CR+PR)/总例数×100%为总有效率。治疗结束后第一年,每三个月复查一次血常规、生化、胸部CT、头部MRI、腹部彩超,治疗后第2~3年每6个月复查一次上述项目。
1.4 统计学方法
以SPSS 22.0软件进行计算,比较两组临床特征的差别时,两格期望频数小于5使用Fisher确切概率法进行差异性分析,其他情况采用χ2检验进行差异性检验。观察组和对照组的疗效及毒副作用比较采用Wilcoxon秩和检验进行差异性检验。
2 结 果
2.1 近期效果
采用RECIST标准评价结果如下:观察组:CR 10例,PR 10例,SD 6例,PD 4例。有1例于治疗后3个月死亡。RR为67%。对照组:CR 8例,PR 9例,SD 8例,PD 5例。RR为57%。具体参见表2。采用Wilcoxon秩和检验对观察组和对照组的疗效进行差异性检验,差异有统计学意义(P<0.05)。

表2 两组患者近期疗效比较
2.2 毒副反应结果
整个放疗及随访期间有1例出现3级急性放射性食管炎。根据治疗结束后6个月患者的胸部CT结果进行晚期损伤评估,结果有1例出现Ⅲ级肺损伤(以上2例患者均出现在观察组)。发现后立即停止放疗,给予相关对症处理后2周,症状缓解,修改放疗计划后顺利完成后续治疗。化疗引起的毒副反应,根据WHO对毒副反应的评价标准,出现Ⅲ级毒副反应的主要是中性粒细胞下降和血小板下降,但是两组差异没有统计学意义,其他的毒副作用分级都在1~2级。发现后给予对症处理,效果良好,均未影响化疗进程。见表3。

表3 两组放化疗毒副反应比较
注:*由于四格表中存在期望频数小于5的情况,故使用Fisher确切概率法进行差异性分析。其余均采用χ2检验进行差异性检验。晚期食管损伤、头昏头痛由于数据原因无法进行χ2检验
2.3 生存率比较
对两组生存情况进行了随访,生存曲线见图1。观察组:随访时间为3~33个月,中位随访12.5个月,随访率97%(有1例失访)。1年生存率为50%。局部复发率为23%(7/30),远处转移率为37%(11/30)。 对照组:随访时间为3~33个月,中位随访13.5个月,随访率97%(有1例失访)。1年生存率为67%。局部复发率为20%(6/30),远处转移率为47%(14/30)。采用log-rank检验对两组的生存曲线进行差异性分析,结果显示,χ2=1.320,P=0.251,差异无统计学意义。
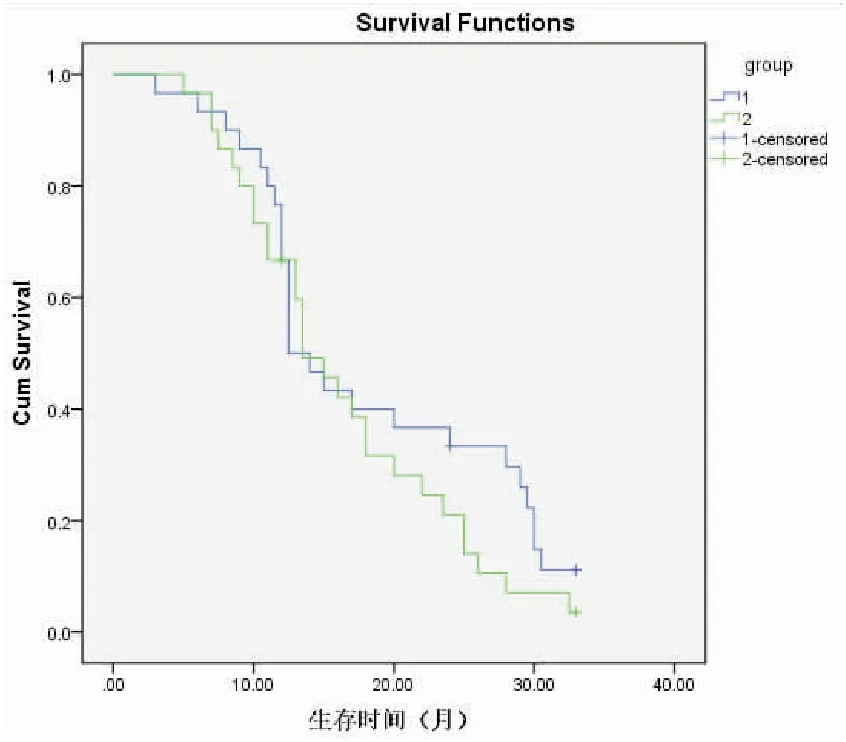
图1 两组生存曲线比较
3 讨 论
肺癌患者就诊时大部分已经是Ⅲ期或者ⅠV期,基本丧失手术机会。对于这部分患者,治疗方案必须局部与全身并重,放化综合治疗已成为一种主要的治疗方式。新近的研究都显示在同步放化疗和序贯放化疗的比较中,同步放化疗显示出了总生存率上的优势[6],但同时也表现出了较严重的毒性和副作用,既往的研究显示改变放疗技术可以将肿瘤的治疗剂量提高10~20Gy,同时不会引起严重的放疗反应[7]。因此在本项研究中我们使用IGRT作为放疗方式,希望在治疗中和治疗后可以降低毒副反应,从而改善患者对治疗的耐受性,提高患者生存质量。
由于IGRT在提高靶区剂量的同时又考虑了器官内运动带来的误差,充分发挥了放射治疗的优势,在缓解患者因肺部肿瘤引起的局部症状的同时也为化疗更好的发挥作用奠定了基础。而利用动态CT根据肿瘤的退缩情况修改放疗计划,则达到了精确放射治疗的目的,同时也减少了对正常肺组织和靶区周围其他正常组织不必要的照射。我们的研究显示采用IGRT进行同步放化疗Ⅲ级急性放射性食管炎的发生率是3%(只有1例),而传统同步放化疗导致的重度放射性食管炎的发生率是8%[8],我们的研究中出现2级急性放射性肺炎的患者只有1例,没有患者出现3级急性放射性肺炎。晚期肺损伤的结果是:观察组有33%(10例)患者出现了2级晚期肺损伤,3%(1例)出现晚期3级肺损伤;对照组有26%(8例)患者出现了2级晚期肺损伤,没有出现晚期3级肺损伤。既往研究显示急性放射性肺炎的发生率大概为22%~40%[9],3级晚期肺损伤的发生率大概为3%[10]。同步放化疗的患者在治疗期间往往会出现骨髓抑制,大部分为1~2级[11],我们的研究结果与之基本相符,整个治疗期间3级中性粒细胞下降的发生率在观察组和对照组分别为7%和13%,没有一例出现3级中性粒细胞下降,这些都与精确放疗优势有关。非小细胞肺癌脑转移发生率高[12],NCCN指南推荐对于1~3个脑转移灶可手术患者行手术序贯全脑放疗(whole brain radiotherapy,WBRT)(1类推荐),或者立体定向放射治疗(stereotatic radiosurgery,SRS),单发脑转移瘤患者行SRT+WBRT(1类推荐)。尽管有研究提示WBRT联合SRS在延长总生存率上无获益[13],但是在降低颅内复发率方面具有明显优势[14]。所以我们在本研究中采用了这种方法。
同期放化疗的疗效虽然得到了广泛肯定,但是究竟该选择哪种化疗药物以及该化疗药物的剂量到底该选择多大,目前还有很多争议。在药物选择上目前研究比较多的主要有以下几种:紫杉醇类,长春瑞滨,吉西他滨,依立替康等。不论选择哪种药物几乎所有的研究都同时联合了铂类[15](其中大多数是联合顺铂)。关于剂量方面有两种选择,一是全量或接近全量的化疗,另一种是每周方案的化疗。由于CALGB39801和LAMP研究发现[16-17]小剂量每周同期化疗方案力度不足,对提高疗效获益不大,因此我们选择了同步全量周期方案化疗。自从1971年Folkman提出肿瘤生长依赖血管形成的观点以来,研究人员在抑制新生血管方面进行了大量的工作。研究证实抗血管生成治疗已经成为治疗肿瘤侵袭和转移的一个重要研究领域[18-19],在本研究中我们设计并且选用了血管内皮抑素—恩度。与化疗药物不同,血管内皮抑素没有明显的毒性[20],而且它也不会诱导耐药性的产生,这是因为它的作用靶点为遗传稳定的血管内皮细胞。国内外的研究均显示恩度与化疗联合可以显著提高晚期NSCLC的疗效[21-22]。且恩度与放疗联合也取得了很好的短期疗效[23]。
报道显示血管抑制剂联合化疗治疗转移性的NSCLC,1年生存率为50%[24],我们的研究观察组为50%,与文献报道相符。但近期疗效明显高于对照组,差异有统计学意义(P<0.05),初步判断提高的原因可能是与恩度改善了细胞的乏氧状态,对放化疗的共同增敏效应所致[25]。有研究证实当放疗与抗血管生成药物联用不但能提高肿瘤的氧合状态、延缓肿瘤生长,还可以提高局控率[26]。已有研究证实,对内皮细胞而言放疗致死的主要原因是细胞凋亡,血管内皮生长因子拮抗剂能减少血管内皮生长因子的表达,与放射治疗起到协同作用[27]。而恩度通过促进细胞凋亡、对肿瘤细胞的抑制发挥细胞周期非特异性[28]。本研究发现同步放化疗联合恩度进行抗血管生成治疗不但近期效果明显,而且没有明显毒副反应。
在本研究中治疗前有4例脑转移患者伴有头昏、头痛或呕吐,经治疗后症状全部缓解,缓解率为100%,治疗前因骨转移有疼痛症状的患者共8例,经治疗后有7例疼痛完全缓解,缓解率为87%。证实了IGRT在晚期NSCLC的治疗中具有提高疗效,改善生存质量的重要意义。整个治疗过程中没有患者发生死亡,对治疗方案的耐受性也比较好,表示同步放化疗联合恩度持续泵入的治疗在临床具有可行性,值得积累病例继续推广。但生存曲线显示两组差异没有统计学意义(P>0.05),分析原因可能有以下几点:1.样本数量偏少,由于该项研究对患者一般情况及经济情况均要求较高,因此符合条件的病例数相对较少,入组较慢;2.ⅢB期患者局部肿瘤大小、位置及淋巴结转移情况均不同,IV期患者转移的部位、数量及放疗剂量也有差异,混杂因素较多。本研究是一个初期探讨,证明该治疗方案的安全可行性,下一步应进行更深一步的临床研究,比如设计多中心临床试验,扩大样本量,增加入组速度,并且对所有患者的分期、肿瘤大小、部位、转移灶情况等进行分层分析,相信不断深入的研究会为我们带来更加准确的结果。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
[1] Chen W,Zheng R,Baade PD,et al.Cancerstatistics in China[J].2015,CA Cancer J Clin,2016,66(2):115-132.
[2] Rengan R,Maity AM,Stevenson JP,et al. New strategies in non-small cell lung cancer:improving outcomes in chemoradiotherapy for locally advanced disease[J].Clin Cancer Res,2011,17(13):4192-4199.
[3] Bradley JD,Paulus R,Komaki R,et al.Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage IIIA or ⅢB non-small cell lung cancer(RTOG0617):a randomized two-by-two factorial phase 3 study [J].Lancet Oncol,2015,16(2):187-199.
[4] Bao Y,Peng F,Zhou QC,et al. Phase Ⅱ trial of recombinant human endostatin in combination with concurrent chemoradiotherapy in patients with stage Ⅲ non-small-cell lung cancer[J].Radiother Oncol,2015,114(2):161-166.
[5] 曾海,谢丛华.非小细胞肺癌纵膈淋巴结转移CT与病理的一致性研究[J].国际肿瘤学杂志,2013,40(4):316-318.
[6] Caro CK,Sanne JW,Joost GD,et al. Toxicity of concurrent radiochemotherapy for locally advanced non--small-cell lung cancer:a systematic review of the literature[J].Clinical lung cancer,2013,14(5):481-487.
[7] Kong FM,Zhao J,Wang J,et al .Radiation dose effect in locally advanced non-small cell lung cancer[J].Journal of Thoracic Disease,2014,6 (6):336-347.
[8] 杨燕光,王金云, 张珏,等.局部晚期非小细胞肺癌调强放疗与三维适形放疗的剂量学及临床疗效分析[J]. 中国肿瘤,2014,23 (10):873-877.
[9] 陈云萍,李建成,张江灵.不同化疗方案联合放疗对放射性肺炎的发生率的影响[J]. 现代肿瘤医学,2016,24(5):743-746.
[10]蒋华勇,王雅杰,贾朝阳,等.诱导化疗后调强适形放疗治疗局部进展期非小细胞肺癌临床结果分析[J]. 医学研究杂志,2014,43(4):95-99.
[11]张凌云 ,雷琳 ,孙志华 .培美曲塞加奈达铂联合放疗同步治疗局部晚期肺腺癌的临床观察[J]. 癌症进展,2014,(1):75-78.
[12]Kocher M,Soffietti R,Abacioglu U,et al. Adjuvant whole-brain radiotherapy versus observation after radiosurgery or surgical resection of one to three cerebral metastases: results of the EORTC 22952-26001 study[J]. J Clin Oncol,2011,29(2): 134-141.
[13]姜镕,马春华,朱子龙,等. 脑脊液循环肿瘤细胞检测在非小细胞肺癌脑膜转移诊断中的应用[J]. 中国现代神经疾病杂志,2014,14(8):704-707.
[14]Soffietti R,Kocher M,Abacioglu UM,et al. A European Organisation for Research and Treatment of Cancer phase III trial of adjuvant wholebrain radiotherapy versus observation in patients with one to three brain metastases from solid tumors after surgical resection or radiosurgery:quality-of-life results[J]. J Clin Oncol,2013,31(1):65-72.
[15]Jae O,Kim KS, Kim YC,et al. A phase III concurrent chemoradiotherapy trial with cisplatin and paclitaxel or docetaxel or gemcitabine in unresectable non-small cell lung cancer : KASLC 0401[J]. Cancer Chemother Pharmocol,2013(72):1247-1254.
[16]Vokes EE,Herndon JE,Kelley MJ,et al.Induction chemotherapy followed by concomitant chemoradiotherapy(CT/XRT) versus CT/XRT alone for regionally advanced unresectable non-small cell lung cancer(NSCLC):initial analysis of a randomized phase III trial[J].Proc Am Soc Clin Oncol,2004(22):7005.
[17]Belani CP,Choy H,Bonomi P,et al.Combined chemoradiotherapy regimens of paclitaxel and carboplatin for locally advanced non-small cell lung cancer:arandomized phase II locally advanced multi-modality protocol[J].J Clin Oncol,2005,23:5883-5891.
[18]Ebos JM,Lee CR,Cruz-Munoz W,et al. Accelerated metastasis after short-term treatment with a potent inhibitor of tumor angiogenesis[J]. Cancer Cell,2009,15:232-239.
[19]Paez-Ribes M,Allen E,Hudock J,et al.Antiangiogenic therapy elicits malignant progression of tumors to increased local invasion and distant metastasis [J].Cancer Cell,2009,15:220-231.
[20]Folkman J. Role of angiogenesis in tumor growth and metastasis[J].Semin Oncol,2002,29(6 Suppl 16):15-18.
[21]杨晓军,李强,庄翔,等.VEGFR基因表达与接受恩度治疗的Ⅲa期非小细胞肺癌疗效相关性研究[J].肿瘤预防与治疗,2016,29(6):320-322.
[22]Yang JJ,Wu YL. Insight into early-phase trials for lung cancer in the United States[J]. Chinese Journal of Cancer,2015,(7):288-294.
[23]Jiang XD,Dai P,Wu J,et al. Effect of recombinant human endostatin on radiosensitivity in patients with non-small-cell lung cancer[J]. Int J Radiat Oncol Biol Phys,2012,83(4):12721277.DOI:10.1016/j.ijrobp.2011.09.050.
[24]徐舒曼,张幸平,甘露,等.重组人血管内皮抑素联合化放疗治疗晚期恶性肿瘤的临床观察[J]. 现代生物医学进展,2015,15(14):2685-2688.
[25]彭芳,王瑾,邹毅,等.重组内皮抑素对肿瘤血管结构和乏氧改善作用的实验观察[J]. 中华放射肿瘤学杂志,2011,20(1):22-25.
[26]王慧敏,戈伟,曹德东,等.重组人血管内皮抑素联合放疗对Lewis肺癌小鼠肿瘤生长及VEGF表达的影响[J]. 微循环学杂志,2010,20(4):21-23.
[27]Hsu HW,Gridley DS,Kim PD,et al. Linifanib (ABT-869) enhances radiosensitivity of head and neck squamous cell carcinoma cells[J]. Oral Oncol, 2013,49(6):591-597.
[28]Zhang L,Ge W,Hu K,et al. Endostar down-regulates HIF-1 and VEGF expression and enhances the radioresponse to human lung adenocarcinoma cancer cells[J]. Mol Biol Rep,2012,39(1):89-95.
StudyonConcomitantRadiotherapyandChemotherapyCombinatingwithEndostatinforⅢBandⅠVStageNon-smallCellLungCancer*
Liu Li, Li Tao△, Lang Jinyi, Zhang Jun, Li Baisen, Xu Ke
(DepartmentofRadiationOncology,SichuanCancerHospital&Institute,SichuanCancerCenter,SchoolofMedicine,UniversityofElectranicScienceandTechnologyofChina,Chengdu610041,Sichuan,China)
Objective: To evaluate the efficacy and toxicity of concomitant radiotherapy and chemotherapy combinating with endostatin for IIIB and IV stage non-small cell lung cancer (NSCLC).Methods: 60 cases of IIIB and IV stage NSCLC were enrolled and randomized into two groups. Group A:30 cases with IIIB and IV stage NSCLC were treated with 4 cycles of paclitaxel (135mg/m2,d1),cisplatin(25mg/m2/d,d1~d3)and endostatin (15mg/d,d1~d14). By concomitant radiotherapy(IGRT) ,the dose of central tumor and lymph node are the same: 65-70Gy,peripheral tumor is 66-90Gy. Group B:30 cases were treated with the same way besides endostatin.Results: All patients finished treatment. Acute radiation-induced esophagitis was 13% and 17%, pneumonitis was 3% for the two groups, leucopenia was 67% and 83%,the 1-year overall survival rate was 77% and 67%,the 1-year local progression-free survival rate was 60% and 50% respectively in group A and B.Conclusion: Concomitant radiotherapy and chemotherapy combinating with endostatin for IIIB and IV stage NSCLC can be well tolerated and the toxicity is tolerable. Results of this study are encouraging, though long-term results should be followed up.
Non-small cell lung cancer; Chemoradiotherapy; Endostatin; Prognosis
2016- 12- 14 [
] 2017- 05- 25
*四川省科技厅科研项目(编号05SG022-013)
△李涛,E-mail:litaoxmf@126.com
R730.53;R730.54;R734.2
A
10.3969/j.issn.1674- 0904.2017.04.005
Liu L, Li T, Lang JY,et al. Study on concomitant radiotherapy and chemotherapy combinating with endostatin for ⅢB and ⅠV stage non-small cell lung cancer[J]. J Cancer Control Treat, 2017,30(4):265-270.[刘丽,李涛,郎锦义,等. 同步放化疗联合恩度治疗ⅢB和ⅠV期非小细胞肺癌的临床研究[J].肿瘤预防与治疗,2017,30(4):265-270.]
