393例ⅠB1~ⅡA2期子宫颈癌患者的临床病理与预后分析
2017-09-04王登凤石宇张国楠裴姣史洵玮
王登凤, 石宇, 张国楠, 裴姣, 史洵玮
610041成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 妇科肿瘤中心(王登凤,石宇,张国楠,史洵玮),临床研究中心(裴姣)
•临床研究•
393例ⅠB1~ⅡA2期子宫颈癌患者的临床病理与预后分析
王登凤, 石宇, 张国楠△, 裴姣, 史洵玮
610041成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 妇科肿瘤中心(王登凤,石宇,张国楠,史洵玮),临床研究中心(裴姣)
目的: 探讨影响早期子宫颈癌患者预后的临床病理因素。方法:回顾性分析2009年11月1日至2014年10月31日经组织病理学确诊并在我中心接受手术治疗的ⅠB1~ⅡA2期子宫颈癌患者的情况。结果:共393例患者,随访至2016年12月31日,92.37%(363/393)完成随访。中位年龄45岁,高发年龄在40~50岁,占53.17%。90.63%(329/363)无瘤生存,2.48%(9/363)复发转移,6.89%(25/363)死亡。5年总体生存率(overall survival,OS)为92%,5年无瘤生存率(disease free survival,DFS)为89%。通过Cox比例风险回归分析发现,FIGO分期、肿瘤类型、间质浸润深度与OS相关,前两者还与DFS相关(P<0.05)。结论:子宫颈癌好发于40~50岁,鳞癌最常见。FIGO分期、肿瘤类型、间质浸润深度是影响患者预后的独立因素。虽然嗜神经侵袭(perineural invasion, PNI)不是影响预后的独立因素,但PNI的发生与淋巴结转移(lymph node metastasis, LNM)具有显著相关性。新辅助化疗可能使一些原本阳性的高危病理因素出现“假阴性”,对于术前接受过新辅助化疗者,应适当放宽术后辅助治疗的指征。
宫颈肿瘤; 妇科外科手术; 放化疗; 预后
子宫颈癌是最常见的女性生殖道恶性肿瘤。据统计,我国每年子宫颈癌新发病例约13万[1],占全世界的1/3,且近年来发病呈现年轻化的趋势[2]。随着对子宫颈癌筛查的日益重视以及筛查、诊断技术的不断进步,多数子宫颈癌患者在早期即得到确诊,其中FIGO分期为Ⅰ期和Ⅱ期的患者约占3/4[3]。手术和放疗是子宫颈癌的主要治疗方法,手术是早期患者的首选治疗手段[4],Ⅰ期患者的5年生存率在90%以上,术后患者的生存率还与是否存在预后相关的危险因素有关,如手术切缘阳性、淋巴结转移(lymph node metastasis,LNM)、宫旁浸润是已知明确的高危因素,而肿瘤直径大、宫颈间质深层浸润、淋巴脉管间隙浸润(lymphovascular space invasion,LVSI)被认为是中危因素。术后辅助放疗、化疗可以减少有中高危因素的子宫颈癌患者的复发,改善患者预后。虽然关于早期子宫颈癌患者的治疗方面已有较为详细和权威的指南,但经过一些“标准”治疗后,仍有不少早期患者出现肿瘤复发、远处转移。是否存在一些尚未引起人们重视的其他病理或治疗方面的因素影响着患者的预后?鉴于此点,本文回顾性分析了我中心393例早期子宫颈癌患者资料,以期发现与预后相关的临床病理因素。
1 资料与方法
1.1 临床资料
选择2009年11月1日至2014年10月31日在我中心接受手术治疗的、临床病理资料完整,并符合以下条件的患者为研究对象,进行回顾性分析:(1)FIGO(2009)版临床分期为ⅠB1~ⅡA2期的子宫颈癌患者;(2)术前经我院或其他三级甲等医院的组织病理学确诊;(3)术前未行放疗;(4)未合并其他恶性肿瘤;(5)在我中心接受根治性子宫切除术+盆腔淋巴结切除术±腹主动脉旁淋巴结取样术。其中,ⅠB2和ⅡA2期患者在手术前接受了1~3周期的紫杉醇+卡铂方案的新辅助化疗至病灶直径<4cm。
1.2 治疗方法
新辅助化疗方案为:紫杉醇175mg/m2,静脉滴注3小时,d1;卡铂浓度时间曲线下面积(area under concentration-time curve,AUC)5,静脉滴注,d1;每21天一个周期。对于有高危、中危因素的患者给予术后辅助放化疗。术后辅助放疗主要包括两部分:适型调强放射治疗(intensity-modulated radiation therapy,IMRT)全盆外照射,周一至周五每天一次,200cGy/次,共23~25次;腔内后装放疗2次,500cGy/次,一周内完成。总放疗剂量5 600~6 000cGy。化疗方案为:紫杉醇135mg/m2,静脉滴注3小时,d1;卡铂AUC 5,静脉滴注,d1;每28天一个周期。
1.3 随 访
随访时间截止至2016年12月31日。全部治疗结束后的2年内,每3~6个月随访一次,第3~5年每6~12个月随访一次。随访内容包括:妇科查体、阴道残端细胞学检查、盆腹腔彩超、胸部X线检查,必要时行CT、MRI等检查。
1.4 统计分析
所有统计分析均采用IBM SPSS 22.0软件。生存分析采用Kaplan-Meier法,生存资料起点为手术日期,终点为患者死亡[总生存时间,(overall survival,OS)],或肿瘤复发[无瘤生存时间,(disease free survival,DFS)]。生存相关因素的分析采用log-rank检验和Cox’s比例风险回归分析。两组间比较采用秩和检验。P<0.05认为差异具有统计学意义。
OS和DFS的计算采用了寿命表法对所有病例(包括失访的30例)进行了生存资料分析。
2 结 果
2.1 患者的临床病理特征
共纳入393例患者,其中失访30例(7.63%),完成随访363例(92.37%)。 中位年龄45岁(范围20~71岁),发病高峰年龄40~50岁(53.17%);Ⅰ期280例(77.13%),Ⅱ期83例(22.87%);鳞癌292例(80.44%),非鳞癌71例(19.56%)。术前接受新辅助化疗患者152例,占41.87%;接受术后辅助治疗的患者315例,占86.78%。
2.2 患者预后情况
363例患者中,329例(90.63%)无瘤生存,9例(2.48%)复发转移,25例(6.89%)死亡,详见表1。5年OS为92%,DFS为89%,中位生存时间为84个月。各期的OS和DFS详见表2。采用Kaplan-Meier法中的Log-rank对数秩检验比较不同FIGO分期的OS,统计量χ2=20.90,P<0.001,差异有统计学意义,生存曲线见图1。
2.3 影响ⅠB1~ⅡA2期子宫颈癌患者预后的单因素及多因素分析结果
采用Kaplan-Meier法中的Log-rank对数秩和检验对不同FIGO分期、不同肿瘤类型、不同肿瘤分级、是否宫旁浸润、是否手术切缘阳性、是否LVSI、间质浸润深度、是否PNI阳性、是否放疗的生存曲线进行单因素差异性分析,统计量及P值见表3。其中,FIGO分期、肿瘤类型、宫旁浸润、间质浸润深度、PNI不同分组间差异有统计学意义,P<0.05。
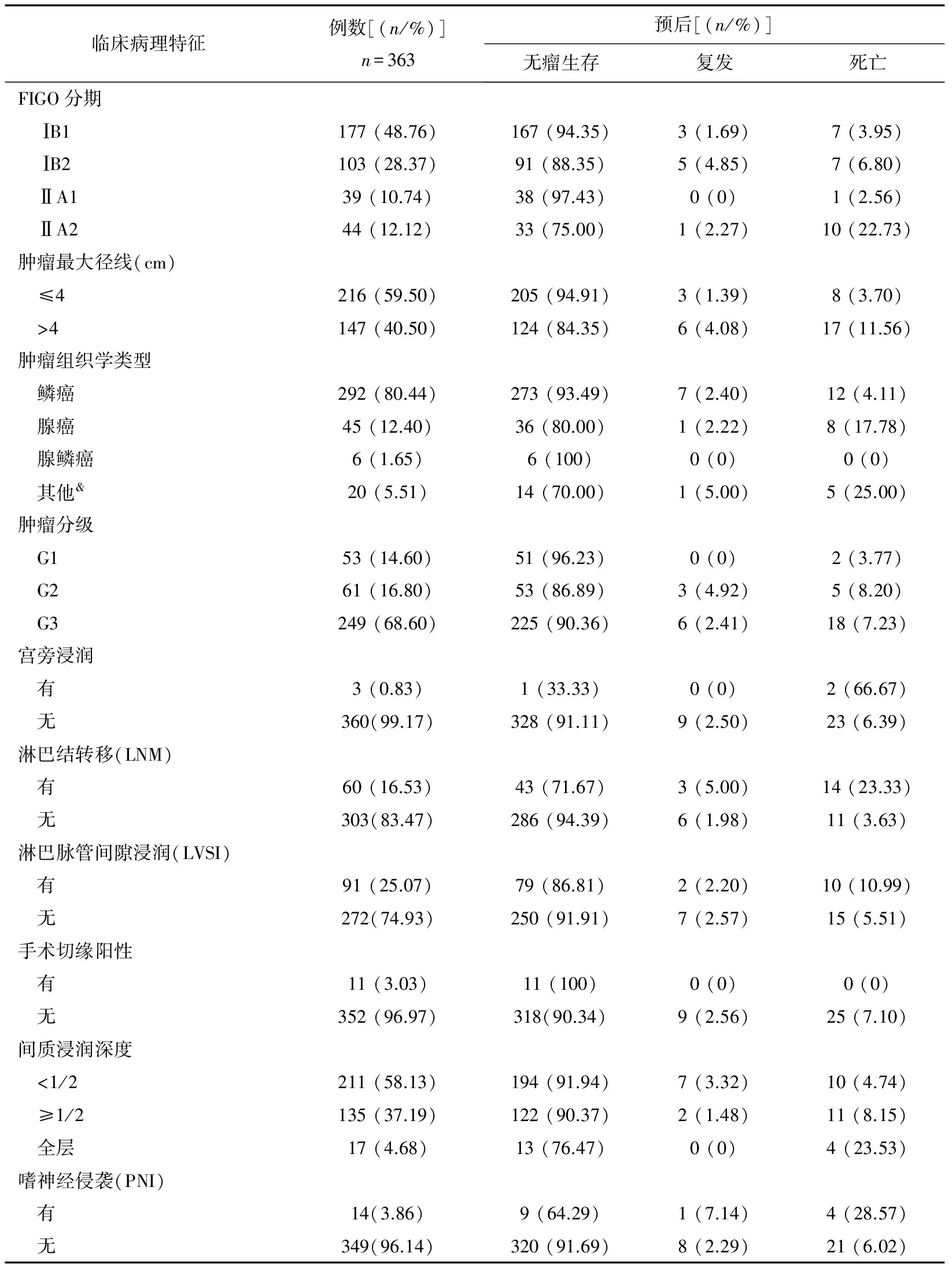
表1 363例子宫颈癌患者的临床病理特征及预后情况
&:神经内分泌癌、透明细胞癌、混合类型癌。

表2 各期子宫颈癌患者的OS和DFS

图1 各期子宫颈癌的生存曲线
采用Cox比例风险模型分别单独纳入转移淋巴结个数和术后辅助化疗周期数进行两次单因素分析,得到结果为:不同淋巴结转移个数的患者预后分布差异有统计学意义,P<0.05。采用Cox’s比例风险模型多因素分析,分别以OS、DFS为因变量,采用Wald检验,结果如下表4和表5。
由以上结果可以看出,FIGO分期、肿瘤类型、间质浸润深度与OS相关,而FIGO分期、肿瘤类型还与DFS相关(P<0.05)。
2.4 PNI相关因素分析
本研究中,PNI阳性有14例(3.86%),包括宫颈间质或宫旁组织中存在PNI。通过Logistic分析发现,PNI的发生与LNM具有显著相关性(P<0.05,OR为1.835);而与FIGO分期、肿瘤类型、肿瘤分级、宫旁浸润、切缘阳性、LVSI、间质浸润深度无显著相关性(P>0.05),详见表6。

表3 与预后有关的单因素分析结果
注:&:神经内分泌癌、透明细胞癌、混合类型癌; /:这一分类下的患者随访时间未达到5年,无法计算相应数据。

表4 Cox’s比例风险模型建模结果(OS)
注:FIGO分期包括:ⅠB1、ⅠB2、ⅡA1、ⅡA2; 间质浸润深度包括:<1/2、≥1/2、全层; &:神经内分泌癌、透明细胞癌、混合类型癌。

表5 Cox’s比例风险模型建模结果(DFS)
注:FIGO分期包括:ⅠB1、ⅠB2、ⅡA1、ⅡA2; 间质浸润深度包括:<1/2、≥1/2、全层; &:神经内分泌癌、透明细胞癌、混合类型癌。

表6 Logistic回归模型建模结果(PNI)
注:间质浸润深度包括:<1/2、≥1/2、全层; FIGO分期包括:ⅠB1、ⅠB2、ⅡA1、ⅡA2; 肿瘤分级包括G1、G2、G3; &:神经内分泌癌、透明细胞癌、混合类型癌。
3 讨 论
根据2009 FIGO临床分期标准,宫颈癌ⅠB2期是指肉眼可见病灶最大径线>4cm,ⅡA2期除了肉眼可见病灶最大径线>4cm外,癌灶超出宫颈,累及阴道穹窿、但未达阴道下1/3,无明显宫旁浸润。由于这部分患者局部病灶较大,ⅠB2期和ⅡA2期习惯上被称为“局部晚期”子宫颈癌,预后较差,其5年生存率明显低于ⅠB1期和ⅡA1期患者。在本研究中,也得出了同样的结果,由图1的生存曲线可以看到:ⅠB2期和ⅡA2期患者预后较ⅠB1期和ⅡA1期患者差。ⅠB1期5年OS、DFS分别为96%和95%,而ⅠB2期仅为92%和82%;ⅡA1期5年OS、DFS分别为94%和96%,而ⅡA2期仅为77%和75%。“局部晚期”子宫颈癌在治疗方面仍存在较大争议,寻找最佳治疗方案一直都是妇科肿瘤领域的研究热点。根据2016年NCCN指南推荐[5],ⅠB2期和ⅡA2期子宫颈癌的治疗可选择:(1)盆腔放疗+顺铂同期化疗+阴道近距离放疗,A点剂量≥85Gy(1级证据);(2)广泛性子宫切除+盆腔淋巴结切除±主动脉旁淋巴结取样(2B级证据)。(3)盆腔放疗+顺铂同期化疗+近距离放疗,A点剂量75~80Gy,放疗结束后行辅助性子宫切除术(3级证据)[6]。目前,有不少学者把同步放化疗作为局部晚期子宫颈癌的标准治疗方案[7],而在我国,由于拥有放疗设备及技术的医院比较少等原因,对于这部分患者的治疗更多倾向于手术为主的方案。有研究报道经根治性放疗后,ⅠB2期子宫颈癌患者3年OS为72%[8]。Goksedef等[9]报道,经同步放化疗后,ⅠB2期子宫颈癌患者的3年OS和DFS分别为86%和79%。本研究中,ⅠB2期和ⅡA2期子宫颈癌患者经过新辅助化疗后再行手术治疗,必要时术后辅助放化疗,ⅠB2期子宫颈癌患者的5年OS为92%,DFS为82%,ⅡA2期子宫颈癌患者的5年OS为77%,DFS为75%,高于文献报道的根治性放疗和同步放化疗后的数据。Park等[10]的研究也得出了类似的结论,他们比较了ⅠB2期和ⅡA2期子宫颈癌患者行同步放化疗或根治性手术,5年OS分别为67%和78%,P<0.05,差异具有统计学意义,因此认为根治性手术治疗局部晚期子宫颈癌的疗效优于同步放化疗。
PNI又称为恶性肿瘤的亲神经现象或神经周围浸润,是恶性肿瘤发生转移的途径之一,是肿瘤沿着神经鞘浸润进展的一种病理特征。PNI已被证实存在于多种恶性肿瘤中,并且是一个新的预后不良的病理因素[11-12]。但是,关于PNI与早期手术治疗的子宫颈癌患者预后关系的研究并不多,且结论也各有不同。最早在2003年,Memarzadeh等[13]报道,93例接受手术治疗的早期子宫颈癌(ⅠA2~ⅡA期)患者中,PNI阳性7例,而宫旁PNI、肿瘤直径≥4cm、LVSI、宫颈间质受侵深度>2/3是子宫颈癌复发的高危因素。此后,也有3项研究得出了类似的结论[14-16],认为PNI的发生与子宫颈癌的肿瘤大小、LVSI密切相关,但仅有Horn等[15]的研究得出PNI是影响子宫颈癌患者总体生存率的独立危险因素。2013年,Cho等[17]回顾性分析了185例ⅠA~ⅡA2期的子宫颈癌患者临床资料,结果显示,PNI阳性率为7%(13/185),PNI阴性率与FIGO分期、LNM相关;PNI阳性患者的5年生存率较PNI阴性者低,但差异无统计学意义。2015年,国内学者对238例早期子宫颈癌患者病理和预后进行了回顾性分析[18],结果显示:PNI的发生与肿瘤直径、间质浸润深度、宫旁浸润、LVSI、LNM明显相关,PNI阳性患者的DFS和OS较PNI阴性患者均明显缩短,差异均有统计学意义(P<0.05),但多因素分析显示PNI不是影响患者DFS或OS的独立因素。虽然这些研究的结果尚不能直接表明PNI是预后不良的独立危险因素,但却能表明PNI与已知的复发危险因素密切相关。与本研究的结果相似:虽然PNI不是影响预后的独立因素,但PNI的发生与LNM密切相关,应该引起病理科医师和妇科肿瘤医师的重视。也许随着研究的不断深入,能更清楚地认识PNI在子宫颈癌预后中的作用。
在本研究中,术前行新辅助化疗者有152例,而ⅠB2和ⅡA2期患者总数仅147例,原因主要是:(1)3例患者在来我院前已在外院行化疗;(2)有2例患者因自身原因最初不愿接受手术治疗,要求行放化疗,第一周期化疗后又改变主意要求手术。因考虑这5例患者仍符合本研究的纳入标准,且其治疗方案上的特殊之处对于总体结果影响较小,故未进行排除。
另外,本研究中,手术切缘阳性者5年OS为100%,切缘阴性者5年OS为92%,虽然P>0.05,差异无统计学意义,但分析手术切缘阳性者5年OS反而略高的原因,可能是:(1)手术切缘阳性者例数较少,仅11例;(2)手术切缘阳性者中,绝大多数患者(90.91%)完成了术后辅助放化疗,仅1例ⅡA1期患者因自身原因拒绝术后辅助治疗。
在预后相关的多因素分析中,仅得出FIGO分期、肿瘤类型、间质浸润深度与患者预后相关,而如手术切缘阳性、LNM、宫旁浸润、LVSI等已知的危险因素未能得出阳性结果,可能与本研究中术前新辅助化疗的患者数较多有关,占41.87%。由于新辅助化疗的作用,可能使得一些原本阳性的高危病理因素出现了“假阴性”,一定程度掩盖了疾病原有的情况,从而可能影响患者术后辅助治疗方案的制定。按照NCCN指南推荐[6]:如术后病理发现存在淋巴结转移、手术切缘阳性、宫旁受侵这些高危因素时推荐进行术后辅助放化疗;存在一些符合“Sedlis标准”的中危因素的,如肿瘤尺寸大、间质浸润深、LVSI等,推荐进行术后辅助放疗或放化疗。但是,我们认为,对于术前接受过新辅助化疗的子宫颈癌患者,应根据患者个体情况适当放宽术后辅助放化疗的指征,也许能进一步减少肿瘤复发,改善早期子宫颈癌患者的预后,但有待进一步研究加以证实。
对于年轻患者,保留卵巢是否对患者预后有影响也是一直以来备受关注的问题,但因本研究中保留卵巢的患者例数少,未能得出相关数据,我们将在后续研究中重点关注这一问题。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
[1] 马亚琪,刘爱军. 宫颈癌及癌前病变病理诊断及研究进展[J].实用妇产科杂志,2015,31(11):803-805.
[2] Li S, Hu T, Lv W, et al. Changes in prevalence and clinical characteristics of cervical cancer in the People’s Republic of China: a study of 10012 cases from a nationwide working group[J]. Oncologist,2013,18(10):1101-1107.
[3] Howlader N, Noone AM, Krapcho M, et al. SEER cancer statistics review, 1975-2010, National Cancer Institute[EB/OL]. http://seer.cancer.gov/csr/1975_2010/, based on November 2012 SEER data submission, posted to the SEER web site, 2013-06-14..
[4] 张国楠. 从PNI看宫颈癌NSRH术式的适应症[J].肿瘤预防与治疗,2015,28(6):307-309.
[5] Lai JC, Chou YJ, Huang N, et al. Survival analysis of stage IIA1 and IIA2 cervical cancer patients [J]. Taiwan J Obstet Gynecol,2013,52(1):33-38.
[6] National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology (NCCN guidelines): cervical cancer. Verision 1.2016[EB/OL]. https://www.nccn.org/professionals/physician_gls/pdf/cervical.pdf,2016-01-18
[7] 李鹏程,冯艺兰,范子煊,等. 宫颈癌体外放射治疗技术进展[J].肿瘤预防与治疗,2016,29(1):53-58.
[8] Keys HM, Bundy BN, Stehman FB, et al. Radiation therapy with and without extrafascial hysterectomy for bulky stage IB cervical carcinoma: a randomized trial of the Gynecologic Oncology Group [J]. Gynecol Oncol,2003,89(3):343-353.
[9] Goksedef BP, Kunos C, Belinson JL, et al. Concurrent cisplatin-based chemoradiation International Federation of Gynecology and Obstetrics stage IB2 cervical carcinoma [J]. Am J Obstet Gynecol,2009,200(2):175. el-5.
[10]Park JY, Kim DY, Kim JH, et al. Comparison of outcomes between radical hysterectomy followed by tailored adjuvant therapy versus primary chemoradiation therapy in IB2 and IIA2 cervical cancer[J]. J Gynecol Oncol,2012,23(4):226-234.
[11]张国楠. 重视子宫颈癌嗜神经侵袭的基础与临床病理研究[J].中华妇产科杂志,2015,50(12):923-925.
[12]Cui L, Shi Y, Zhang GN. Perineural invasion as a prognostic factor for cervical cancer: a systematic review and meta-analysis[J]. Arch Gynecol Obstet, 2015, 292(1):13-19.
[13]Memarzadeh S, Natarajan S, Dandade DP, et al. Lymphovascular and perineural invasion in the parametria: a prognostic factor for early-stage cervical cancer[J]. Obstet Gynecol,2003,102(2): 612-619.
[14]Ozan H, Ozuysal S, Ediz B. Perineural invasion in early-stage cervical carcinoma[J]. Eur J Gynaecol Oncol,2009,30(4):379-383.
[15]Horn LC, Meinel A, Fischer U, et al. Perineural invasion in carcinoma of the cervix uteri: prognostic impact[J]. J Cancer Res Clin Oncol,2010,136(10):1557-1562.
[16]Elsahwi KS, Barber E, Illuzzi J, et al. The significance of perineural invasion in early-stage cervical cancer[J]. Gynecol Oncol,2011,123(3):561-564.
[17]Cho HC, Kim H, Cho HY, et al . Prognostic significance of perinerual invasion in cervical cancer[J]. Int J Gynecol Pathol,2013,32(2): 228-233.
[18]张国楠,阳燕,朱熠,等. 嗜神经侵袭对早期子宫颈癌患者预后的影像[J].中华妇产科杂志,2015,50(9):673-678.
TheClinicalandPrognosticAnalysisof363CasesofStageⅠB1~ⅡA2CervicalCancer
Wang Dengfeng1, Shi Yu1, Zhang Guonan1△, Pei Jiao2, Shi Xunwei1
(1.GynecologicOncologyCenter,SichuanCancerHospital&Institute,SichuanCancerCenter,SchoolofMedicine,UniversityofElectronicScienceandTechnologyofChina,Chengdu610041,Sichuan,China; 2.InstituteofDrugClinicalTrial,SichuanCancerHospital&Institute,SichuanCancerCenter,SchoolofMedicine,UniversityofElectronicScienceandTechnologyofChina,Chengdu610041,Sichuan,China)
Objective: To investigate prognosis-related clinicopathologic factors in early stage cervical cancer patients.Methods: Stage IB1~ⅡA2 cervical cancer patients who accepted surgical treatment in our center between Nov. 1st,2009 and Oct. 31th,2014 were included in this study. The clinicopathologic and prognostic data of all the patients were analyzed retrospectively.Results: A total of 393 patients were followed up until Dec. 31th, 2016 with a follow-up rate of 92.37% (363/393). The median age was 45 years old, with a peak age between 40 and 50 years. The recurrence-free survival rate was 90.63% (329/363), the recurrence rate was 2.48% (9/363) and the mortality rate was 6.89% (25/363) . The 5-year overall survival (OS) rate and disease free survival (DFS) rate was 92% and 89%, respectively. The result of Cox’s proportional hazard regression analysis showed that FIGO stage, histopathological type, and depth of cervical stromal invasion were related with OS. In addition, the first two factors were also related with DFS(P<0.05).Conclusion: Cervical cancer typically occurs between 40 and 50 years of age. The most common histopathological type is cervical squamous carcinoma. FIGO stage, histopathological type, and depth of cervical stromal invasion are independent prognostic factors. Although perineural invasion (PNI) is not an independent poor prognostic factor, it is closely related with lymph node metastasis (LNM). Furthermore, as neoadjuvant chemotherapy may cause false-negative result of some risk factors, appropriate broadening of the indications of postoperative adjuvant radiotherapy and chemotherapy is recommended.
Uterine cervical neoplasms; Gynecologic surgical procedures; Chemoradiotherapy; Prognosis
2017- 03- 14 [
] 2017- 07- 21
△张国楠, E-mail: zhanggn@hotmail.com
R737.33
A
10.3969/j.issn.1674- 0904.2017.04.003
Wang DF, Shi Y, Zhang GN, et al. The clinical and prognostic analysis of 363 cases of stage ⅠB1~ⅡA2 cervical cancer [J]. J Cancer Control Treat, 2017,30(4):354-360.[ 王登凤,石宇,张国楠,等. 393例ⅠB1~ⅡA2期子宫颈癌患者的临床病理与预后分析[J].肿瘤预防与治疗,2017,30(4):354-360.]
