姜黄素诱导肿瘤细胞凋亡机制的研究进展*
2017-09-04张朋飞综述孙剑经张林西审校
张朋飞 综述, 孙剑经, 张林西审校
075000河北 张家口,河北北方学院 研究生部(张朋飞); 075000河北 张家口,河北北方学院附属第一医院 消化内科(孙剑经);075000河北 张家口,河北北方学院 生命科学研究中心(张林西)
•综述•
姜黄素诱导肿瘤细胞凋亡机制的研究进展*
张朋飞 综述, 孙剑经, 张林西△审校
075000河北 张家口,河北北方学院 研究生部(张朋飞); 075000河北 张家口,河北北方学院附属第一医院 消化内科(孙剑经);075000河北 张家口,河北北方学院 生命科学研究中心(张林西)
姜黄素是从姜科姜黄素属植物中提取的一种多酚类化合物,具有抗肿瘤、 抗炎、 抗氧化等作用,姜黄素能够在多方面起到抗肿瘤作用, 而且不良反应小。姜黄素诱导肿瘤细胞凋亡,是其发挥抗肿瘤作用的重要机制之一。本文主要针对姜黄素诱导肿瘤细胞凋亡的作用靶点、作用途径及分子机制的研究进展作一综述。
姜黄素; 肿瘤细胞; 细胞凋亡
姜黄素是一种从姜黄科植物的根茎中提取出来的多酚类化合物,是中药姜黄的主要成分,印度学者Kuttan等[1]在1985年首次提出姜黄素具有抗癌活性,由于其来源广泛,价格便宜、毒副作用小、且耐受性良好的优点,其抗肿瘤作用日益受到国内外研究者的关注,成为人们研究的热点。随着国内外研究的不断深入,发现姜黄素的抗癌性涉及多种机制,其中诱导肿瘤细胞凋亡是其重要机制之一,姜黄素诱导肿瘤细胞凋亡涉及调控细胞内外多种蛋白家族、蛋白分子和不同的分子通路,现就姜黄素诱导肿瘤细胞凋亡机制的研究进展予以综述。
1 姜黄素的一般特性
姜黄素(Curcumin,diferuloyl methane)分子量:368.39,分子式为C21H20O6,结构如图1。姜黄素微溶于水,易溶于甲醇、乙醇、丙二醇、二甲基亚砜等有机溶剂。口服肠道吸收差,半衰期短及生物利用度低,近些年科研人员通过改变姜黄素用药途径,设计相应姜黄素剂型,有效地增大了姜黄素的水溶性并减缓体内代谢速度从而提高了其生物利用度[2-5]。

图1 姜黄素的化学结构式
2 姜黄素的广谱抗癌性
姜黄素在日常生活中可用于调味品、食品上色等,研究证实姜黄素还具有广谱抗癌性、抗动脉粥样硬化、抗炎、抗氧化、抗凝、抗类风湿、抗突变等药理功效[6]。美国国立癌症研究所将其列为第3代癌化学预防药。姜黄素可以作用于多种靶肿瘤细胞,如乳腺癌、宫颈癌、结直肠癌、胰腺癌等[7],姜黄素的广谱抗癌性涉及多种机制,包括诱导肿瘤细胞凋亡、抑制肿瘤的侵袭及转移、抑制肿瘤细胞的增殖、逆转肿瘤细胞的多药耐药,增加肿瘤对化疗的敏感性、干扰基因的表达等。
3 姜黄素通过诱导肿瘤细胞凋亡起到抗肿瘤的作用
随着研究的不断深入,发现姜黄素抗肿瘤作用的重要机制之一是诱导肿瘤细胞凋亡[8-10]。在对耐药肿瘤细胞的研究中发现姜黄素还通过诱导肿瘤细胞凋亡参与逆转肿瘤细胞的耐药[11-12]。细胞凋亡是机体维持自身稳定的重要因素,当机体组织细胞增殖和凋亡失衡,容易引发肿瘤。姜黄素诱导肿瘤细胞凋亡能力较强,其过程包含一系列较为复杂的生物学反应,涉及调控细胞内外多种蛋白家族、蛋白分子如caspase蛋白家族、细胞凋亡抑制蛋白(IAPs)家族、Bcl-2家族蛋白以及不同的分子通路,如p53、NF-κB、PI3K-Akt、MAPK通路等,其中不同的调控路径有不同的调控形式,各调控路径之间构成了复杂的网络,网络内部既有交叉,也有重叠。综合既往的研究成果,姜黄素主要通过以下几种途径诱导肿瘤细胞凋亡。
3.1 调控caspase蛋白家族
caspase全称是含半胱氨酸的天冬氨酸蛋白水解酶,是一组存于细胞质中,选择性切割某些蛋白质,进而引起真核生物细胞凋亡,并参与细胞的分化、生长等的一组蛋白酶。caspase按其功能不同分为两大类:炎症相关性caspase及凋亡相关性caspase[13]。第一类caspase包括caspase-1/4/5/11/12/13,后者包括效应caspase-3/6/7及起始caspase-2/8/9/10。凋亡相关caspase诱导细胞凋亡的途径分为两种,一种是外源性细胞凋亡(死亡受体)途径,一种是内源性细胞凋亡(线粒体依赖)途径。外源性细胞凋亡途径主要是通过活化caspase-8进一步激活caspase-3,活化后的caspase-3与特定的凋亡底物结合,诱导细胞凋亡。内源性细胞凋亡途径通过刺激作用于靶细胞,释放细胞色素C(CytochromeC,CytC),在胞质中聚集凋亡酶激活因子-1(apoptotic protease activating factor-1,Apaf-1)和caspase-9组成凋亡小体,进而使caspase-9活化,并进一步活化caspase-3,使多腺苷二磷酸核糖聚合酶[poly(ADP-ribose) polymerase, PARP]裂解,启动内源性细胞凋亡。在内源性细胞凋亡途径和外源性细胞凋亡途径中,caspase3/7最终起细胞凋亡执行者的作用。 Chang等[14]研究证实姜黄素纳米颗粒可以通过上调caspase-3、caspase-9、CytC、Apaf-1的表达水平,诱导内源性细胞凋亡。Wilken等[15]研究显示,姜黄素可以通过上调外源性细胞凋亡途径中的Fas、Fas相关死亡结构域蛋白(Fas-associated protein with death domain,FADD)、caspase-8和caspase-3的表达,介导外源性的细胞凋亡作用。Hu等[16]对头颈部鳞状细胞癌的研究证实,姜黄素通过激活caspase-8和caspase-9同时激活内源性及外源性细胞凋亡。Yang等[17]研究表明,姜黄素及其衍生物3,5-(E)-二(2-氟亚苄基)哌啶-4-酮醋酸盐抑制人骨肉瘤Saos-2的增殖并诱导细胞凋亡同时涉及到内、外源性细胞凋亡途径。综上可见,姜黄素诱导不同种类的肿瘤细胞凋亡的机制涉及到不同的凋亡通路,关于其作用的不同机制目前研究尚不完全清楚,有待进一步研究。
3.2 调控细胞凋亡抑制蛋白(IAPs)家族
细胞凋亡抑制蛋白(inhibitor of apoptosis proteins,IAPs),是一类高度保守的内源性抗细胞凋亡蛋白家族,其具体成员见表1。目前认为IAPs参与介导的抑制细胞凋亡是肿瘤细胞产生耐药性的可能原因之一。其抑制肿瘤细胞凋亡的机制是通过对caspase蛋白家族的活性的抑制以及调控核转录因子-κB(nuclear factor-κB, NF-κB)而实现。当前在IAPs家族参与细胞凋亡过程中研究较为深入、较为广泛的是凋亡相关蛋白survivin。survivin是IAPs蛋白家族内的新成员,大多数在胚胎组织、胎儿组织以及多数恶性肿瘤组织的细胞内表达,且在恶性肿瘤细胞中呈高表达状态,survivin抑制细胞凋亡的可能机制是通过抑制 caspase-3和caspase-7的活性,进而抑制细胞凋亡,故其与恶性肿瘤的发生、发展、治疗疗效、病理分期、生存期以及预后等关系密切。Watson等[18]研究证实,姜黄素作用于卵巢癌细胞,可激活p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)信号通路,而切断蛋白激酶B(protein kinase B,AKT ) 信号通路,引起survivin和B淋巴细胞瘤-2基因(B-cell lymphoma-2, Bcl-2)的表达水平下降,诱导卵巢癌细胞凋亡。Sun等[19]研究显示,葡萄糖调节蛋白78(glucose regulated protein 78kD, GRP78 )的表达下调在肝癌细胞内与survivin 表达下降可能有关,姜黄素通过对GRP78的表达下调,进而阻止survivin 表达,使肝癌细胞走向凋亡。Khaw等[20]研究证实姜黄素诱导细胞凋亡与增加caspase-3/7的活性、BAX的过表达及下调Bcl-2 和survivin的表达水平相关。Survivin也可增加化疗药物的敏感性,Weng等[21]在对白血病干细胞KG1a细胞的研究中发现,姜黄素通过下调survivin的表达可以增强白消安抗肿瘤的敏感性。survivin是IAPs蛋白家族内作用最强的凋亡抑制因子,肿瘤细胞的多药耐药(multidrug resistance, MDR)与survivin引起的凋亡抑制关系密切。Lu等[22]对姜黄素作用于对长春新碱耐药的结肠癌细胞的研究中发现,姜黄素在体内体外均可逆转人结肠癌细胞的多药耐药,其机制与降低survivin和多药耐药相关蛋白1(multidrug resistance-associated protein1,MRP1)有关。故姜黄素通过下调survivin的表达,诱导肿瘤细胞凋亡,有望作为化疗药物对肿瘤细胞的多药耐药的一个作用靶点。
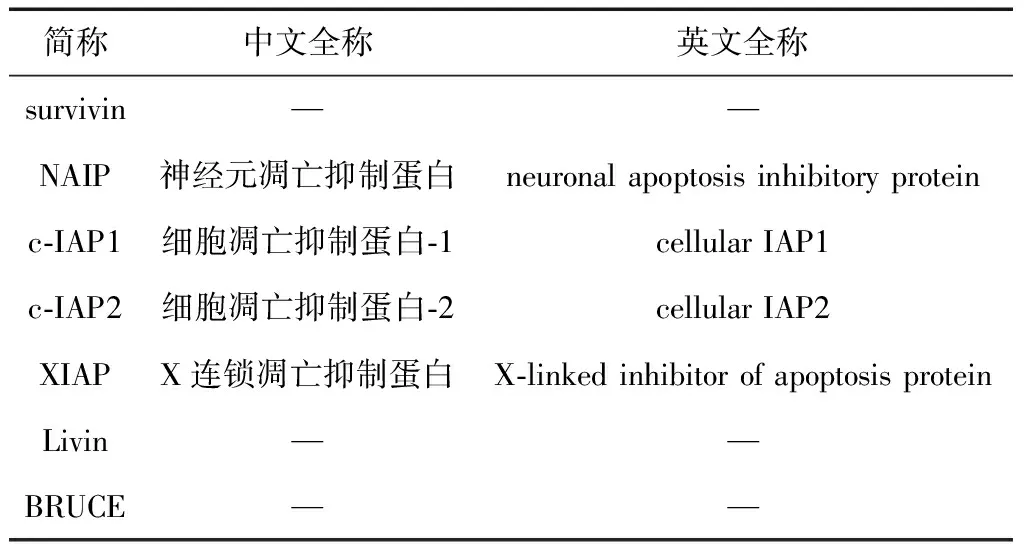
表1 IAPs家族成员
3.3 调控Bcl-2家族蛋白
在细胞凋亡、细胞自吞噬等生命活动过程中,Bcl-2蛋白家族是其重要的调控因子。根据Bcl-2蛋白家族促凋亡、抗凋亡的特性及分子结构的不同,可将其分为促凋亡家族和抗凋亡家族两类,其中促凋亡家族主要包括Bax、Bik、Bak、Bad等,抗凋亡家族成员包括Bcl-2、Bcl-xL、Mcl-l和Bcl-w、A1等。在内源性细胞凋亡途径中,Bcl-2蛋白家族是其“门卫”,Bcl-2蛋白家族在内源性细胞凋亡途径中发挥作用,主要依赖促凋亡家族蛋白与抗凋亡家族蛋白的比例,尤其是Bax和Bcl-2的比例,当增加Bax通道蛋白的表达水平时,可引起保护线粒体膜上的Bcl-2蛋白失去功能,导致大量CytC通过细胞膜进入细胞质,与Apaf-1相结合,形成凋亡复合体,凋亡复合体可进一步激活caspase-9,激活的caspase-9可参与内源性细胞凋亡途径,进而破坏DNA及胞质蛋白,诱导细胞凋亡。Singh等[23]研究表明,姜黄素诱导宫颈癌细胞凋亡有多种路径,其中发挥主要作用的是通过上调促凋亡蛋白Bax的表达以及下调抗凋亡蛋白Bcl-2、Bcl-xL的表达,进一步激活caspase-9、caspase-3,诱导肿瘤细胞凋亡。Zhou等[24]的研究证实,姜黄素与奥沙利铂联合应用在治疗人胃癌细胞BGC-823的体内、体外实验中姜黄素起到协同作用,其机制可能与调控Bcl-2/Bax的比例,激活caspase-8/9/3,诱导肿瘤细胞凋亡有关。Yang等[25]对前列腺癌裸鼠移植瘤的研究中证实姜黄素能抑制裸鼠移植瘤的生长,通过上调 Bax 的表达和下调Bcl-2的表达,降低肿瘤体积及重量,诱导肿瘤细胞凋亡;在对肝癌细胞株SMMC-7721的研究中发现,姜黄素能升高Bax的表达,相反,促进Bcl-2的表达降低,诱导肝癌细胞SMMC-7721细胞凋亡[26]。Lu等[27]研究证实,在对人白血病耐药细胞K562/A02的研究中,短期内应用姜黄素可以减少pro-caspase-3和pro-caspase-9的表达,增加PARP的分裂和Bax/Bcl-xL的比例,明显诱使DNA损伤,减弱细胞活力,触发细胞凋亡。另外Yang等[28]研究表明,细胞质内抗增殖蛋白 (Prohibitin,PHB )可以与Bax相互作用,使Bax的表达水平上调,姜黄素可以通过增加细胞质内的PHB水平,进而升高Bax,诱导细胞凋亡途径的激活。
3.4 调控p53通路
p53是最重要的肿瘤抑制蛋白之一,参与调控细胞增殖、DNA损害以及细胞凋亡等[29]。p53由TP53基因编码。TP53基因是当前研究较为深入、系统化的肿瘤抑制基因(tumor suppressor gene),在人类多种恶性肿瘤中可发现p53基因的突变[30],是目前研究发现与人类恶性肿瘤相关性最高的基因。国外学者Lane等[31]提出TP53基因在细胞内扮演着“分子警察”的角色,密切监视细胞内基因组的完整性,当机体细胞DNA受损时,p53会使受损细胞周期停滞在G0/G1期,受损细胞会进行自我修复,若受损DNA变异较大,难以修复成功,p53将诱导受损细胞凋亡,阻止受损DNA的细胞持续增殖。p53调控细胞凋亡,通过对Bax的表达水平的上调和对Bcl-2的表达水平的下调共同作用完成,另外p53还可通过参与死亡信号受体蛋白途径诱导细胞凋亡。TP53基因分为野生型和突变型两种,野生型TP53基因属于抑癌基因,参与诱导受损细胞凋亡,而突变型,由于其空间构象发生改变,丧失了对机体细胞DNA的修复、诱导细胞凋亡的作用,转变为癌基因。在乳腺癌肿瘤相关成纤维细胞 (cancer-associated fibroblasts,CAF)中,姜黄素通过对CAF中信号转导和转录激活因子-3(signal transducers and activators of transcription-3,STAT-3)相关分型的抑制,对p16、p21及p53表达的上调进而诱导肿瘤细胞凋亡[32]。在紫外线诱导的皮肤癌发生前予以姜黄素的研究表明,姜黄素通过对p53的表达水平和p21/Cip级联反应水平的调控可预防皮肤癌发生[33]。Shehzad等[34]对人结直肠癌HCT-15细胞的研究中,通过蛋白印迹分析显示,姜黄素可通过以时间依赖的方式诱导结直肠癌HCT-15细胞凋亡,升高p53和前体mRNA加工因子4B(pre-mRNA processing factor 4B, Prp4B )的表达,激活caspase-3,诱导结直肠癌HCT-15细胞凋亡。姜黄素对p53基因的调控还可通过多种信号通路实现,Ye等[35]在对非小细胞肺癌的研究中证实姜黄素可以通过激活p53-miR-192-5p/215-XIAP通路促进肿瘤细胞凋亡。在对耐药肿瘤细胞的方面研究证实,姜黄素可通过多种途径使突变型p53基因的结构域被破坏,诱导肿瘤细胞凋亡,进而阻断由突变型p53基因介导的肿瘤细胞的多药耐药[36]。
3.5 调控核转录因子-κB(NF-κB)
NF-κB是一类广泛存在于真核生物细胞内的转录激活因子[37],其未受刺激时,与抑制性蛋白特异性结合,形成无活性的复合体存在于真核生物细胞浆内,当受到外来刺激后可发生磷酸化,进而进入细胞核内,引起靶基因的表达,发挥生物学效应。NF-κB可通过在蛋白和基因水平上对肿瘤坏死因子受体相关因子-1(tumor necrosis factor receptor-associated factor-1,TRAF-1)、肿瘤坏死因子受体相关因子-2(tumor necrosis factor receptor-associated factor-2, TRAF-2)、c-IAP1、c-IAP2的表达的控制,进一步抑制caspase-8的活性,而caspase-8在外源性细胞凋亡途径中起重要作用,故阻止NF-κB的表达,可促进肿瘤细胞的凋亡。Sintara等[38]研究发现,姜黄素可以阻断NF-κB信号通道,诱导N-甲基-N-亚硝基脲和饱和氯化钠诱发的大鼠胃癌细胞的凋亡。Jin等[39]用人工合成姜黄素类似物Da0324体外作用于人胃癌细胞SGC-7901和BGC-823中的研究显示,Da0324可显著抑制NF-κB的活性,抑制肿瘤细胞的增殖及侵袭,使肿瘤细胞的周期停滞,诱导肿瘤细胞凋亡。姜黄素对NF-κB的调控,还可通过相关信号通路,诱导肿瘤细胞凋亡,Cao等[40]对人骨巨细胞瘤的研究显示,姜黄素可以通过抑制NF-κB和基质金属蛋白酶-9(matrix metalloproteinases-9, MMP-9)的活性,激活c-Jun氨基末端激酶(c-Jun N-terminal kinases,JNK)信号通路,进而抑制肿瘤细胞的增殖,诱导其凋亡。Dang等[41]研究证实姜黄素能通过NF-κB-p53-caspase-3 通路提高紫杉醇诱导人HPV阳性宫颈癌细胞凋亡的能力。
3.6 调控PI3K-Akt信号通路
PI3K-Akt信号通路是细胞内主要的信号转导通路之一,在其组成中3-磷酸肌醇激酶(phosphoinositide 3-kinase,PI3K)家族成员属于原癌基因,PI3K活化产生的产物3,4,5-三磷酸磷脂酰肌醇[PI(3,4,5 )P3]是细胞内的第二信使,是Akt(又称蛋白激酶B,PKB)转位于细胞膜以及活化所必须的,PI3K-Akt信号通路在机体细胞有促进增殖,抑制细胞凋亡的作用,其抑制细胞凋亡的机制包括多种:①Akt是促凋亡蛋白Bad的激酶,活化的Akt作用于Bad的Serl36位点使其磷酸化.进而阻断Bad诱导的细胞凋亡;②活化的Akt作用于caspase-9可以使caspase-9的Serl96位点磷酸化而失活,进而抑制其促凋亡作用[42];③作用于NF-κB,研究证实Akt能够调节IκB激酶(IκB kinase,IKK)的活性,使NF-κB的核转位,同时活化NF-κB依赖的促存活基因的转录[43],Akt通过激活NF-κB的转录功能,使Bcl-2家族成员中抗凋亡蛋白Bcl-xL表达增强,从而抑制细胞凋亡。姜黄素可以通过抑制PI3K-Akt信号通路促进多种肿瘤细胞的凋亡。Qiao等[44]研究表明姜黄素可以提升放射诱导人伯基特淋巴瘤细胞凋亡的能力,其机理主要通过抑制PI3K-Akt信号通路的激活。Xu等[45]对甲状腺癌FTC133细胞系的研究中证实,姜黄素通过抑制PI3K-Akt信号通路促进甲状腺癌FTC133细胞的凋亡。Kizhakkayil等[46]在对人乳腺癌MCF-7细胞系的研究中发现,姜黄素通过抑制PI3K-Akt信号通路促进细胞凋亡,并证实姜黄素与PI3K抑制剂LY290042联用能增强姜黄素诱导细胞凋亡的能力。Jiang等[47]对人结肠癌LoVo细胞系的研究证实,姜黄素可以通过抑制PI3K-Akt信号通路促进细胞凋亡和抑制细胞的增殖和侵袭。
3.7 调控MAPK通路
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是将信号由Ras蛋白向下传导的重要信号传递分子,通过自身的磷酸化进行激活,在真核细胞转导中具有核心作用。MAPK有4个主要亚族:细胞外信号调节激酶(extracellular signal regulated kinase,ERK1/2)、JNK、p38MAPK和细胞外信号调节激酶5(extracellular signal regulated kinase 5,ERK5)。MAPK激活后将信号传导到靶细胞细胞核内使细胞核内jun、fos、myc等多种转录因子的某些氨基酸残基磷酸化后而活化,进而形成jun-jun、jun-fos等二聚体,增加与DNA的进一步结合,对细胞分化和生长有关基因的表达起到调节和促进作用。JNK信号通路可通过使Bcl-2和Bcl-xL的磷酸化,促进CytC的释放,激活caspase的级联反应,诱导肿瘤细胞凋亡;p38MAPK活化后,可增强c-myc的表达,参与Fas/FasL介导的凋亡,通过作用于caspase蛋白家族的上游诱导细胞的凋亡,同时也可增强TNF-α的表达;ERK1/2通路中,通过c-myc诱导细胞凋亡,同时也可通过作用于caspase蛋白家族和Bcl-2蛋白家族诱导肿瘤细胞凋亡。Yang等[48]对人单核细胞白血病细胞THP-1的研究中证实,姜黄素通过激活JNK/ERK/AP1通路诱导THP-1细胞凋亡。Collett等[49]对人结肠癌细胞HCT116的研究中发现,姜黄素以时间和剂量依赖的形式通过激活JNK诱导HCT116细胞凋亡。Liang等[50]在对人胃癌细胞BGC-823的研究中表明,姜黄素通过ROS介导的ASK1-MKK4-JNK应激信号通路诱导人胃癌BGC-823细胞凋亡。
4 结 语
综上所述,姜黄素可以通过多种途径发挥其诱导肿瘤细胞凋亡的作用,其诱导肿瘤细胞凋亡的作用靶点、作用途径、分子机制和相关文献见表2。

表2 姜黄素诱导肿瘤细胞凋亡的作用靶点、作用途径、分子机制和引用文献
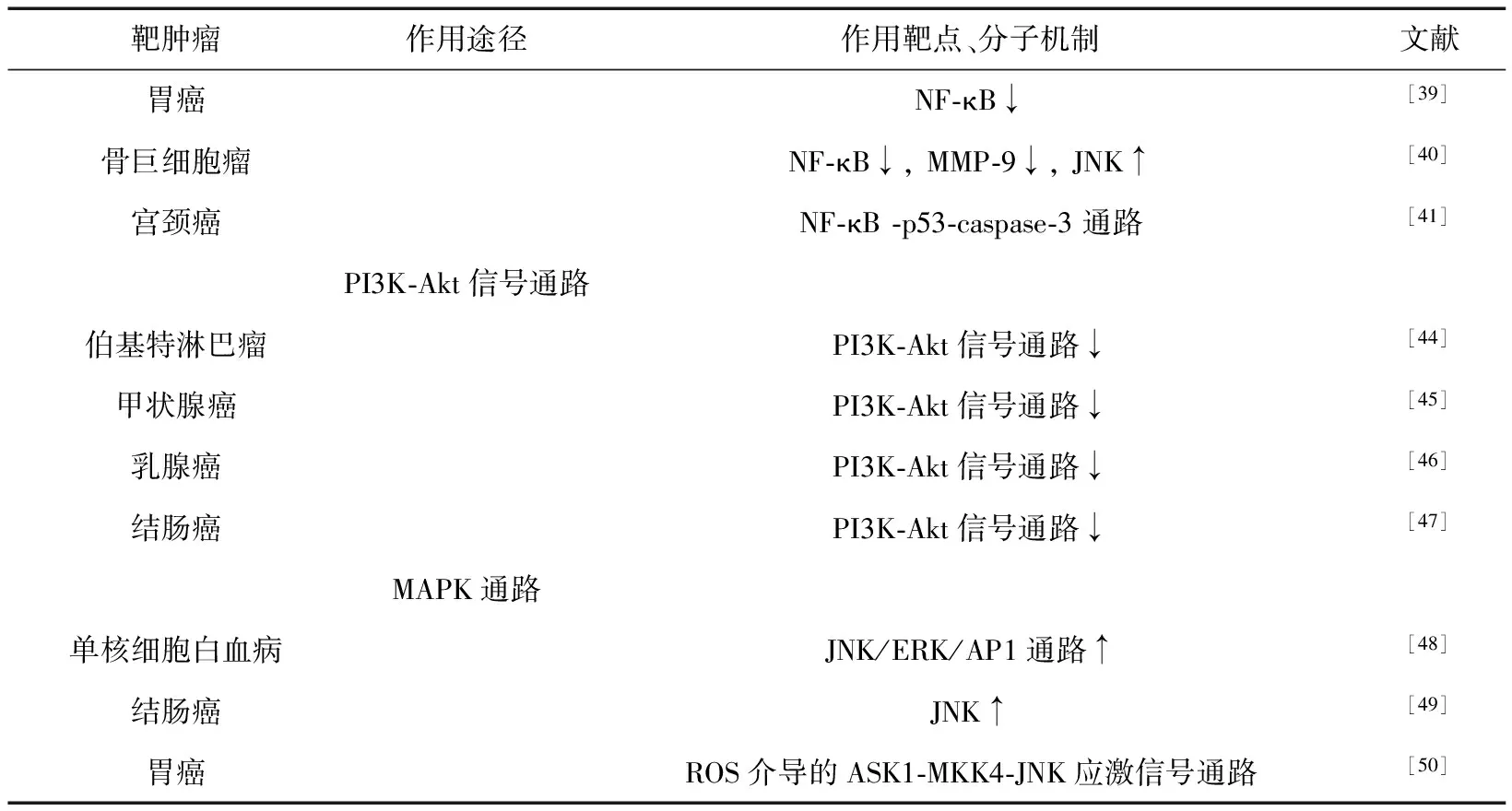
(续上表)
姜黄素诱导肿瘤细胞凋亡的分子机制仍十分复杂,在不同肿瘤细胞系,姜黄素诱导凋亡机制可能不同,在相同肿瘤细胞系内,姜黄素诱导肿瘤细胞的凋亡,也可能涉及多种分子机制, 因此仍需要长时间大量基础实验进行研究及证明。有理由相信,随着研究的不断进展,姜黄素有望成为一种新型、高效、广谱的肿瘤治疗及预防药物。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
[1] Kuttan R, Bhanumathy P, Nirmala K, et al. Potential anticancer activity of turmeric (Curcuma longa)[J].Cancer Lett,1985,29(2):197-202.

[3] Li Y, Zhang T. Targeting cancer stem cells by curcumin and clinical applications[J]. Cancer Cancer Lett, 2014, 346(2): 197-205.
[4] 鲁琼, 徐冉. 姜黄素的药理作用及在治疗膀胱癌中的研究进展[J]. 中药药理与临床, 2012,28(3):133-136.
[5] 张燕, 范娟, 傅少志,等. 姜黄素对宫颈癌放射增敏的研究进展[J]. 中国医药指南, 2015, 13(13):48-50.
[6] Mahmood K, Zia KM, Zuber M, et al. Recent developments in curcumin and curcumin based polymeric materials for biomedical applications: a review[J].Int J Biol Macromol, 2015, 81(6): 877-890.
[7] Kunnumakkara AB, Bordoloi D, Padmavathi G, et al. Curcumin, the golden nutraceutical: multitargeting for multiple chronic diseases[J]. Br J Pharmacol,2016,6(5):28-74.
[8] Osterman C JD, Gonda A, Stiff TR, et al. Curcumin induces pancreatic adenocarcinoma cell death via reduction of the inhibitors of apoptosis[J]. Pancreas, 2016, 45(1): 101-109.
[9] Lv ZD,Liu XP,Zhao WJ, et al.Curcumin induces apoptosis in breast cancer cells and inhibits tumor growth in vitro and in vivo[J].Int J Clin Exp Pathol,2014,7(6):2818-2824.
[10] Robles-Escajeda E,Das U,Ortega NM, et al.A novel curcumin-like dienone induces apoptosis in triple-negative breast cancer cells[J]. Cell Oncol,2016,39(3):265-277.
[11]Sun Y, Zhang J, Zhou J, et al. Synergistic effect of cucurbitacin B in combination with curcumin via enhancing apoptosis induction and reversing multidrug resistance in human hepatoma cells[J]. Eur J Pharmacol, 2015, 768(4): 28-40.
[12]Gou Q, Liu L, Wang C, et al. Polymeric nanoassemblies entrapping curcumin overcome multidrug resistance in ovarian cancer[J]. Colloids Surf B Biointerfaces, 2015, 126(7): 26-34.
[13]McIlwain DR, Berger T, Mak TW. Caspase functions in cell death and disease[J]. Cold Spring Harb Perspect Biol, 2013, 5(4): 962-968.
[14]Chang PY,Peng SF,Lee CY, et al.Curcumin-loaded nanoparticles induce apoptotic cell death through regulation of the function of MDR1 and reactive oxygen species in cisplatin-resistant CAR human oral cancer cells[J].Int J Oncol,2013,43(4):1141-1150 .
[15]Wilken R,Veena MS,Wang MB, et al.Curcumin: a review of anti-cancer properties and therapeutic activity in head and neck squamous cell carcinoma[J].Mol Cancer,2011,10(1):12-30.
[16]Hu A,Huang JJ,Li RL, et al.Curcumin as therapeutics for the treatment of head and neck squamous cell carcinoma by activating SIRT1[J].Sci Rep,2015,5(2):13429-13442.
[17]Yang SJ, Lee SA, Park MG, et al. Induction of apoptosis by diphenyldifluoroketone in osteogenic sarcoma cells is associated with activation of caspases[J]. Oncology reports, 2014, 31(5): 2286-2292.
[18]Watson JL,Greenshields A,Hill R, et al.Curcumin-induced apoptosis in ovarian carcinoma cells is p53-independent and involves p38 mitogen-activated protein kinase activation and downregulation of bcl-2 and survivin expression and akt signaling[J].Mol Carcinog,2010,49(1):13-24.
[19]Sun JG,Liao RX,Zhang SX, et al.Role of inhibitor of apoptosis protein livin in radiation resistance in nonsmall cell lung cancer[J].Cancer Biother Radiopharm,2011,26(5):585-592.
[20]Khaw AK, Hande MP, Kalthur G, et al. Curcumin inhibits telomerase and induces telomere shortening and apoptosis in brain tumour cells[J]. J Cell Biochem, 2013, 114(6): 1257-1270.
[21]Weng G,Zeng Y,Huang J, et al.Curcumin enhanced busulfan-induced apoptosis through downregulating the expression of survivin in leukemia stem-like KG1a cells[J].Biomed Res Int,2015,2015(3):1-16.
[22]Lu WD, Qin Y, Yang C, et al. Effect of curcumin on human colon cancer multidrug resistance in vitro and in vivo[J]. Clinics, 2013, 68(5): 694-701.
[23]Singh M,Singh N.Molecular mechanism of curcumin induced cytotoxicity in human cervical carcinoma cells[J].Mol Cell Biochem,2009,325(1-2):107-119.
[24]Zhou X, Wang W, Li P, et al. Curcumin enhances the effects of 5-fluorouracil and oxaliplatin in inducing gastric cancer cell apoptosis both in vitro and in vivo[J]. Oncol Res, 2016, 23(1-2): 29-34.
[25]Yang J,Ning J,Peng L, et al.Effect of curcumin on Bcl-2 and Bax expression in nude mice prostate cancer[J].Int J Clin Exp Pathol,2015,8(8):9272-9278.
[26]Yu J,Zhou X,He X, et al.Curcumin induces apoptosis involving bax/bcl-2 in human hepatoma smmc-7721 cells[J].Asian Pac J Cancer Prev,2011,12(8):1925-1929.
[27]Lu JJ, Cai YJ, Ding J. The short-time treatment with curcumin sufficiently decreases cell viability, induces apoptosis and copper enhances these effects in multidrug-resistant K562/A02 cells[J]. Mol Cell Biochem, 2012, 360(1-2): 253-260.
[28]Yang HB,Song W,Chen LY, et al. Differential expression and regulation of prohibitin during curcumin-induced apoptosis of immortalized human epidermal HaCaT cells [J].Int J Mol Med, 2014,33(3):507-514.
[29]Kasi PD,Tamilselvam R,Skalicka-Wozniak K, et al.Molecular targets of curcumin for cancer therapy: an updated review[J].Tumour Biol,2016,4(3):1-12.
[30]Kandoth C, McLellan MD, Vandin F, et al. Mutational landscape and significance across 12 major cancer types[J]. Nature, 2013, 502(7471): 333-339.
[31]Lane DP, Cheok CF, Lain S. p53-based Cancer Therapy[J]. Cold Spring Harb Perspect Biol, 2010, 2(9):1388-1396.
[32]Hendrayani SF,Al-Khalaf HH,Aboussekhra A.Curcumin triggers p16-dependent senescence in active breast cancer-associated fibroblasts and suppresses their paracrine procarcinogenic effects[J].Neoplasia,2013,15(6):631-640.
[33]Tsai KD,Lin JC,Yang SM, et al.Curcumin protects against uvb-induced skin cancers in skh-1 hairless mouse: analysis of early molecular markers in carcinogenesis[J].Evid Based Complement Alternat Med,2012,2012(5):300-311.
[34]Shehzad A, Lee J, Huh TL, et al. Curcumin induces apoptosis in human colorectal carcinoma (HCT-15) cells by regulating expression of Prp4 and p53[J]. Mol Cells, 2013, 35(6): 526-532.
[35]Ye M, Zhang J, Zhang J, et al. Curcumin promotes apoptosis by activating the p53-miR-192-5p/215-XIAP pathway in non-small cell lung cancer[J]. Cancer letters, 2015, 357(1): 196-205.
[36]Gouri Sankar S, Suchismita M, Hossain DMS, et al. Curcumin enhances the efficacy of chemotherapy by tailoring p65NFκB-p300 cross-talk in favor of p53-p300 in breast cancer.[J]. J Biol Chem, 2011, 286(49):42232-42247.
[37]Baldwin Jr AS. The NF-κB and IκB proteins: new discoveries and insights[J]. Annu Rev Immunol, 1996, 14(1): 649-683.
[38]Sintara K,Thong-Ngam D,Patumraj S, et al.Curcumin attenuates gastric cancer induced by n-methyl-n-nitrosourea and saturated sodium chloride in rats[J].J Biomed Biotechnol,2012,2012(5): 305-312.
[39]Jin R, Xia Y, Chen Q, et al. Da0324, an inhibitor of nuclear factor-κB activation, demonstrates selective antitumor activity on human gastric cancer cells[J]. Drug Des Devel Ther, 2016, 10(2): 979-995.
[40]Cao F, Liu T, Xu Y, et al. Curcumin inhibits cell proliferation and promotes apoptosis in human osteoclastoma cell through MMP-9, NF-κB and JNK signaling pathways[J]. Int J Clin Exp Pathol, 2015, 8(6): 6037-6045.
[41]Dang YP, Yuan XY, Tian R, et al. Curcumin improves the paclitaxel-induced apoptosis of HPV-positive human cervical cancer cells via the NF-κB-p53-caspase-3 pathway[J]. Exp Ther Med, 2015, 9(4): 1470-1476.
[42]Song G, Ouyang G, Bao S. The activation of Akt/PKB signaling pathway and cell survival[J]. J Cell Mol Med, 2005, 9(1): 59-71.
[43]Vandermoere F,El Yazidi-Belkoura I,Adriaenssens E, et al.The antiapoptotic effect of fibroblast growth factor-2 is mediated through nuclear factor-kappaB activation induced via interaction between Akt and IkappaB kinase-beta in breast cancer cells[J].Oncogene,2005,24(35):5482-5491.
[44]Qiao Q, Jiang Y, Li G. Inhibition of the PI3K/AKT-NF-κB pathway with curcumin enhanced radiation-induced apoptosis in human Burkitt’s lymphoma[J]. J Pharmacol Sci, 2013, 121(4): 247-256.
[45]Xu X,Qin J,Liu W.Curcumin inhibits the invasion of thyroid cancer cells via down-regulation of PI3K/Akt signaling pathway[J].Gene,2014,546(2):226-232.
[46]Kizhakkayil J,Thayyullathil F,Chathoth S, et al.Modulation of curcumin-induced Akt phosphorylation and apoptosis by PI3K inhibitor in MCF-7 cells[J].Biochem Biophys Res Commun,2010,394(3):476-481.
[47]Jiang QG,Li TY,Liu DN, et al.PI3K/Akt pathway involving into apoptosis and invasion in human colon cancer cells LoVo[J].Mol Biol Rep,2014,41(5):3359-3367.
[48]Yang CW,Chang CL,Lee HC, et al.Curcumin induces the apoptosis of human monocytic leukemia THP-1 cells via the activation of JNK/ERK pathways[J].BMC Complement Altern Med,2012,12(4):22-43.
[49]Collett GP,Campbell FC.Curcumin induces c-jun N-terminal kinase-dependent apoptosis in HCT116 human colon cancer cells[J].Carcinogenesis,2004,25(11):2183-2189.
[50]Liang T,Zhang X,Xue W, et al.Curcumin induced human gastric cancer BGC-823 cells apoptosis by ROS-mediated ASK1-MKK4-JNK stress signaling pathway[J].Int J Mol Sci,2014,15(9):15754-15765.
本刊关于建议拟发表论文作者在RDD上备案研究数据的公告
近年,学术论文涉嫌造假的新闻时有报道,给我国的学术声誉造成非常恶劣的影响。由国家科技支撑计划项目资助建设的研究数据备案(Research Data Deposit,RDD)平台,是一个公益的医学研究数据备案平台,为数据的可溯源性提供支持,为数据的真实性核查提供支撑。RDD平台有严密的数据保密措施。对于成功备案的研究数据,RDD会提供唯一的备案号(RDD号),研究者可使用语句“基于本研究结果的数据已备案在RDD平台,备案号为XXXXXXX”在拟发表论文的正文中标注RDD号。
《肿瘤预防与治疗》杂志编辑委员会赞同并认可RDD平台的宗旨,共同推动医学研究的规范和可持续发展。因此,杂志编委会强烈建议,经同行评议后被接收的原创性研究论文,正式出版前将研究数据备案在RDD平台,并在论文中标注RDD号。如有必要,杂志社主编通过向RDD平台申请,可以核查已发表论文的相关数据。有关RDD平台的备案流程见附件。更详细的内容可登陆RDD平台(www.researchdata.org.cn)。
RDD平台研究数据备案指引
1.登录网址:www.researchdata.org.cn。
2.RDD账号:如无RDD账号,请先点击Register进行注册;如已有RDD账号,请点击Login登录后进行数据备案。
3.RDD平台将研究分为“临床/流行病学”和“基础/实验/转化研究”两大类。请研究者依据自己的研究类型,选择对应的大类进行研究数据备案。RDD平台会为每个成功备案的研究数据分配唯一的RDD号,研究者可在拟发表的研究论文中引用RDD号。
4.RDD平台技术支持联系电话:+86-020-87343553,邮箱:rdd@sysucc.org.cn。
5.具体备案流程见下图:

《肿瘤预防与治疗》编辑部
ResearchProgressofMechanisminCurcuminInducedApoptosisofTumorCells*
Zhang Pengfei1, Sun Jianjing2, Zhang Linxi3△
(1.DepartmentofPostgraduate,HeibeiNorthUniversity,Zhangjiakou075000,Hebei,China;2.DepartmentofGastroenterology,FirstAffiliatedHospital,HeibeiNorthUniversity,Zhangjiakou075000,Hebei,China3.LifeSciencesResearchCenter,HebeiNorthUniversity,Zhangjiakou075000,Hebei,China)
Curcumin is a polyphenolic compound extracted from curcuma genus of zingiberaceae. It has functions like anticancer,antiinflammation, antioxidation and so on. Curcumin has antitumor effects in different areas with small toxicity.One of the most important antitumor mechanism is that curcumin can induce tumor cells apoptosis. In this paper,we will review the research advances in target, pathway and molecular mechanism of curcumin induced apoptosis of tumor cells.
Curcumin; Tumor cells; Cell apoptosis
2016- 03- 17 [
] 2017- 01- 10
*河北省自然科学基金(编号:H2014405033)
△张林西, E-mail: zlxwxl@163.com
R730.231
A
10.3969/j.issn.1674- 0904.2017.04.013
Zhang PF, Sun JJ, Zhang LX. Research progress of mechanism in curcumin induced apoptosis of tumor cells[J]. J Cancer Control Treat, 2017,30(4):305-312.[张朋飞,孙剑经,张林西.姜黄素诱导肿瘤细胞凋亡机制的研究进展[J].肿瘤预防与治疗,2017,30(4):305-312.]
