哈萨克传统发酵食品中乳酸菌的分离鉴定及代谢特性研究
2017-09-03翟磊凌空宋振姚粟程池杨玉新
翟磊,凌空,宋振,姚粟,程池,杨玉新*
1(新疆中亚食品研发中心(有限公司),新疆 乌鲁木齐,830001) 2(中国食品发酵工业研究院,北京,100027)
哈萨克传统发酵食品中乳酸菌的分离鉴定及代谢特性研究
翟磊1,2,凌空2,宋振1,姚粟2,程池2,杨玉新1*
1(新疆中亚食品研发中心(有限公司),新疆 乌鲁木齐,830001) 2(中国食品发酵工业研究院,北京,100027)
采用纯培养方法从哈萨克传统发酵骆驼奶、马奶子和奶酪中分离得到11株乳酸菌。通过16S rRNA基因序列和pheS基因序列系统发育学分析,并结合形态特征和生理生化特性,确定这些乳酸菌的分类学地位。通过测定乳酸菌的耐酸耐盐特性、产酸特性、降解亚硝酸盐能力、氨基酸脱羧酶活力及抑菌能力,筛选得到了3株具有潜在生产应用价值的乳酸菌,即LactobacillusparacaseiKCH3 (CICC 6277),LactobacillusfermentumKM1 (CICC 6278)和LactobacillusfermentumKC3 (CICC 6290),为果蔬发酵应用奠定了菌种基础。
哈萨克传统发酵食品;乳酸菌;多相分类学鉴定;代谢特性
哈萨克传统发酵食品的制作和食用历史悠久,风味独特,营养丰富,而经过长时间的自然驯化,这些传统发酵食品中一些具有优良特性的乳酸菌保留了下来,在发酵食品过程中起到了重要作用[1]。乳酸菌主要包括乳杆菌属(Lactobacillussp.)、双歧杆菌属(Bifidobacterialsp.)、链球菌属(Streptococcussp.)、乳球菌属(Lactococcussp.)以及肠球菌属(Enterococcussp.)等[2]。目前研究表明,乳酸菌可以对人体产生健康的功效,摄入一定量的乳酸菌可以促进有益微生物的生存,抑制有害微生物的生长,从而保持肠道内菌群的平衡,减少肠道疾病的发生[3-4],同时由于乳酸菌在生长过程中会合成维生素、产生有机酸、胆盐水解酶(BSH)、胞外蛋白水解酶、肽水解酶、细菌素等多种物质,还具有减缓乳糖不耐症、降胆固醇、抑制和预防肿瘤、延缓人体衰老等有益功能[5-7]。
本研究采用多相分类技术对分离于哈萨克传统发酵骆驼奶、马奶子和奶酪中的乳酸菌进行了鉴定,明确其分类学地位。在此基础上,从耐酸耐盐特性、产酸能力、抑菌能力、降解亚硝酸盐能力和氨基酸脱羧酶能力等方面对乳酸菌的生长代谢特征进行测定分析,筛选得到了3株具有潜在生产应用价值的乳酸菌,为乳酸菌在果蔬发酵中的应用奠定了基础。
1 材料与方法
1.1材料与试剂
1.1.1 实验材料
1.1.2 实验菌株
大肠杆菌 O157:H7 (Escherichiacoli, CICC 10907),肠沙门氏菌 (Salmonellaenteric, CICC 10871),金黄色葡萄球菌 (Staphylococcusaureus, CICC 10790) 和单增李斯特菌 (Listeriamonocytogenes, CICC 21635) 均来自中国工业微生物菌种保藏管理中心。
1.1.3 实验试剂
MRS培养基、胰蛋白胨大豆肉汤(TSB)、胰蛋白胨大豆琼脂(TSA)、革兰氏染色试剂盒和生理生化鉴定管,北京陆桥技术有限公司;API试剂条,生物梅里埃公司;细菌基因组DNA提取试剂盒,OMEGA公司;GoldView,北京赛百盛基因技术有限公司;溶菌酶,Sigma公司、蛋白酶,Merk公司;TaqDNA聚合酶、dNTP、DL2000 marker,天为时代生物有限公司。
1.1.4 实验设备
光学显微镜Olympus BH-2,奥林巴斯有限公司;pH计FE20,梅特勒-托利多仪器(上海)有限公司;紫外分光光度计7200,尤尼科(上海)仪器有限公司;温度梯度PCR仪,Biometra公司;恒温培养箱BHG-8082型,上海一恒科学仪器有限公司。
1.2方法
1.2.1 乳酸菌的分离纯化
利用梯度稀释涂布和平板划线法对哈萨克骆驼奶、马奶子和奶酪中的乳酸菌进行分离纯化[8-9],3次分离纯化后的乳酸菌于-80℃冰箱甘油冷冻保藏。
1.2.2 乳酸菌多相分类学鉴定
通过分子生物学(16S rRNA基因序列测定及pheS基因序列分析),结合表型特征(革兰氏染色、接触酶试验和API 50 CHL试验),对分离筛选的乳酸菌进行多相分类学鉴定。其中利用细菌基因组DNA提取试剂盒(Tiangen公司)提取上述菌株的基因组DNA,操作步骤参见试剂盒说明书,API 50 CHL试验按照梅里埃产品操作说明进行操作。
使用细菌基因组DNA提取试剂盒提取乳酸菌的基因组。利用引物27f (5’-AGAGTTTGATCCTGGCTCAG-3’)和1492r (5’-GGTTACCTTGTTACGACTT-3’) 对16S rRNA基因进行扩增。PCR反应体系为:模板10×PCR buffer 5 μL、dNTP (2.5 mmol/L) 4 μL、模板 2 μL、Taq DNA 聚合酶 1 μL、引物各 1 μL, 补充去离子水至50 μL。反应条件[10]: 94 ℃ 5 min,94 ℃ 50 s,52℃ 50 s,72 ℃ 50 s,33个循环,72 ℃ 7 min。PCR产物送交北京诺赛基因组研究中心有限公司进行测序。利用引物21f (5’-CAYCCNGCH CGYGAYATGC-3’)和23r(5’-GGRTGRACCATVCCNGCHCC-3’)对pheS基因序列进行扩增。PCR反应体系同上,反应条件:95℃ 5 min,95℃ 1 min,46℃ 2min 15 s,72℃ 1min 15 s,3个循环;95℃ 1 min 15 s,46℃ 1 min 15 s, 72℃ 1 min 15 s,30个循环;72℃ 7 min。
将测序结果在GenBank数据库中进行比对分析,以确定其与模式菌种的同源关系。确定并下载各模式菌种的有效序列后,采用ClustalX 1.83进行多序列比对后,使用MEGA 5.0软件中的邻接法(Neighbor-joining)进行系统发育分析[11]。
铅是一种有毒元素,土壤中过量的铅通过生物地球化学循环进入植物和人体后,可使生物体产生不同的慢性和急性中毒现象[19]。
1.2.3 乳酸菌耐酸试验
挑取MRS培养基上生长的单菌落于4 mL MRS液体培养基中,37℃静置培养18 h后,按1%接种量分别接入pH2、3、4、5、6和7的MRS液体培养基中,37 ℃静置培养48 h,测定620 nm下吸光值(OD620),并记录结果[12]。
1.2.4 乳酸菌耐盐试验
挑取MRS培养基上生长的单菌落于4 mL MRS液体培养基中,37℃静置培养18 h后,按1%接种量接入分别含20%、40%、60%、80%和100 g/L NaCl的MRS液体培养基中,37℃静置培养48 h,测定620 nm下吸光值(OD620),并记录结果[13]。
1.2.5 乳酸菌生长曲线及产酸能力测定
挑取MRS培养基上生长的单菌落于4 mL MRS液体培养基中,37℃静置培养18 h后,按1%接种量接种于MRS液体培养基中培养,以不接种培养基作为对照,每隔2 h取样测定620 nm下吸光值(OD620)。同时每隔4 h取出部分发酵液通过pH计直接测定pH值[7, 14]。
1.2.6 乳酸菌亚硝酸盐降解能力测定
挑取MRS培养基上生长的单菌落于4 mL MRS液体培养基中,37℃静置培养18 h后,按1%接种量接种于含125 μg/mL NaNO2的200 mL MRS液体培养基中37 ℃培养,每隔24 h定时取样测定NaNO2含量。参考GB/T 5009.33—2003中的盐酸萘乙二胺法进行测定,不接种的MRS培养基(含125 μg/mL NaNO2)作为空白对照[15]。
1.2.7 乳酸菌氨基酸脱羧酶试验
挑取MRS培养基上生长的单菌落于3 mL无菌生理盐水中研磨,制备成0.5麦氏浊度悬液,分别滴入氨基酸脱羧酶试验的安培瓶中,每瓶3滴,并加无菌液体石蜡覆盖培养基表面,培养24 h后,观察试验管与对照管颜色变化,试验管为紫色,对照管为黄色,结果为阳性;试验管与对照管均为黄色,结果为阴性。
1.2.8 乳酸菌抑菌性研究
采用滤纸片法测定目标菌株的抑菌性能。挑取新鲜培养的指示菌株大肠杆菌 O157:H7 (Escherichiacoli, CICC 10907),肠沙门氏菌 (Salmonellaenteric, CICC 10871),金黄色葡萄球菌 (Staphylococcusaureus, CICC 10790) 和单增李斯特菌 (Listeriamonocytogenes, CICC 21635),将菌悬液浓度调至0.5麦氏浊度并均匀涂布在TSA培养基上,然后将滤纸片浸泡在200 μL培养24 h的乳酸菌发酵液中,置于上述培养基中,37℃培养箱中培养48 h,记录结果[8, 16]。
2 结果与分析
2.1乳酸菌的分离纯化
从MRS平板上挑取11个形态有差异的菌落进行划线纯化菌种,命名为KM1、KM2、KM3、KM4、KC1、KC2、KC3、KC4、KCH1、KCH2和KCH3(表1),经3次分离纯化后加到20%甘油中,保藏于-80℃冰箱供后续实验使用。
2.2乳酸菌多相分类学鉴定
革兰氏染色以及接触酶试验表明11株菌株均为革兰氏阳性,接触酶阴性菌株,符合乳酸菌的特征(表1)。16S rRNA基因系统发育分析表明11株菌株均属于乳酸菌,其中菌株KC2、KM2和KM3与德氏乳杆菌的同源性均在99.37%以上,且与其他近种的同源性均在98.65%以下,鉴定为德氏乳杆菌(Lactobacillusdelbrueckii)。菌株KC3、KC4和KM1与发酵乳杆菌的同源性为99.85%,且与其他近种的同源性均在98.65%以下,鉴定为发酵乳杆菌(Lactobacillusfermentum)。菌株KCH1和KCH2与乳酸乳球菌的同源性均在99.42%以上,且与其他近种的同源性均在98.65%以下,鉴定为乳酸乳球菌(Lactococcuslactis)。其余3株菌株只能鉴定到属水平(图1A)。对于16S rRNA基因序列只能鉴定到属水平的菌株进行pheS基因序列系统发育分析。结果表明,菌株KC1和KM4与唾液链球菌嗜热亚种的同源性为99%,可鉴定为唾液链球菌嗜热亚种(Streptococcussalivariussubspthermophilus)。菌株KCH3与干酪乳杆菌和类干酪乳杆菌的同源性较近,只能鉴定到乳杆菌属(图1B),对其进行API 50 CHL试验,鉴定结果表明菌株KCH3鉴定为类干酪乳杆菌(Lactobacillusparacasei)(表2)。分离鉴定的11株乳酸菌均已保藏于中国工业菌种保藏管理中心(表1)。

表1 分离鉴定的乳酸菌信息统计
2.3乳酸菌耐酸耐盐实验
耐酸试验结果表明,随着pH值降低,乳酸菌的生长受到明显的抑制。其中菌株KC3、KM1和KCH3展现了较强的耐酸能力,其中菌株KC3和KM1在pH 3 条件下OD620值能够达到0.2左右,而其他菌株几乎不生长,其中菌株KC3和KM1在pH4的条件下的OD620值可以达到0.6。而菌株KM4和KC1耐酸能力最弱,不能在pH 4的环境下生长,在pH 5、6和7的环境中生长也较弱(图2A)。

(A):16S rRNA基因 (B):pheS基因图1 分离鉴定的乳酸菌系统发育树 Fig.1 The phylogenetic trees of isolated and identified注:采用MEGA5.0软件,邻位连接法显示菌株与相关模式种系统发育树,进行1000次的相似度重复计算,图中发育树节点只显示Bootstrap值大于50%数值,上标的“T”表示模式菌株。
耐盐试验结果表明,乳酸菌的生长与NaCl浓度成反比,即随着NaCl浓度的升高,乳酸菌的生长受到明显的抑制(图2B)。大部分菌株在2%的NaCl下可以正常生长,但KM2、KM4、KCH1和KCH2几乎不生长。而菌株KCH3的耐盐能力最强,在6%NaCl条件下,OD620值可以达到0.35。菌株KM1和KC3能够耐受4%的NaCl。综合分析乳酸菌的耐酸和耐盐能力,选取菌株KC3、KM1和KCH3进行后续生长代谢特性研究。
2.4乳酸菌的生长曲线和产酸能力测定
生长曲线测定表明,菌株KC3和KM1进入对数期较快,都在4 h进入对数期,分别在12 h和16 h进入稳定期,而KCH3在14 h最晚进入对数期(图3A)。产酸能力测定结果表明,菌株KC3产酸速度最快,pH值可以降到4.0,菌株KM1和KCH3产酸速度次之,pH值可以降到4.2和3.8(图3B)。由此可见,菌株进入对数期越快,其产酸速率也较快。
2.5乳酸菌亚硝酸盐降解能力测定
试验结果表明随着培养时间的延长,菌株降解的亚硝酸盐能力越强。培养24 h后,KC3和KM1的亚硝酸盐降解率分别可达到85.4%和81.3%,而KCH3的亚硝酸盐降解率只有43.7%。培养48 h后,3株的亚硝酸盐降解率均可以达到100%(表3)。

表2 菌株KCH3碳源利用特征
注:“+”,阳性;“-”,阴性。
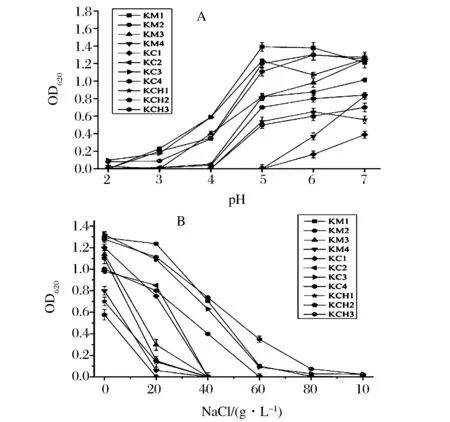
(A): 耐酸特性; (B): 耐盐特性图2 分离鉴定的乳酸菌耐酸耐盐特性 Fig.2 Acid- and salt-resistance properties of isolated and identified lactic acid bacteria

(A): 生长特性;(B): 产酸特性图3 分离鉴定的乳酸菌的生长和产酸特性 Fig.3 Growth and acid production of isolated and identified lactic acid bacteria
2.6乳酸菌氨基酸脱羧酶试验
氨基酸脱羧酶试验测定结果表明,菌株KC3和KM1对精氨酸双水解脱羧酶活性显阳性,剩余菌株对4种氨基酸脱羧酶活性均显阴性(表3)。

表3 分离鉴定的乳酸菌表型特性
注:“a”表示菌株培养24 h后的亚硝酸盐降解率,“b”表示菌株培养48h后的亚硝酸盐降解率;“+”表示阳性;“-”表示阴性。
2.7乳酸菌抑菌能力测定
由抑菌能力实验结果可知,3株乳酸菌均能够抑菌肠炎沙门氏菌和大肠杆菌,其中KCH3的抑菌作用最大,对于肠炎沙门氏菌和大肠杆菌的抑菌直径可达到20 mm和10 mm,对金黄色葡萄球菌和单增李斯特菌无抑菌作用(表3)。
3 讨论
通过多相分类学鉴定,从哈萨克传统发酵食品中共筛选到3个属,11株乳酸菌。其中发酵乳杆菌和德氏乳杆菌各3株,嗜热链球菌和乳酸乳球菌各2株,副干酪乳杆菌1株。从菌株来源看,哈萨克骆驼奶中和马奶子中含有相同种类的乳酸菌,有发酵乳杆菌、德氏乳杆菌和嗜热链球菌。而奶酪中含有乳酸乳球菌和副干酪乳杆菌。由此可见,不同来源的哈萨克传统发酵食品中既含有相同乳酸菌又各具特色(图4)。

图4 分离鉴定的乳酸菌的种类和来源Fig.4 Classification and origin of isolated and identified lactic acid bacteria
ARGYRI[2]等认为乳酸菌对低酸环境和渗透压的耐受性也是作为发酵剂和潜在益生菌的必要条件。BEGANOVIC[11]对筛选到的菌株进行4%~6% NaCl的耐盐试验,优良菌株的OD600值在0.4到0.6之间。HWANHLEM[17]中通过实验得到菌株产酸可以使pH值降至4.3~4.6,认为乳酸可以导致革兰氏阴性病原菌外膜的损伤,引起病原菌LPS层的破坏从而导致的亚致死损伤。AMMOR[18]等认为乳酸菌快速产酸形成的低酸环境可以抑制有害菌群的繁殖从而提升产品的安全性及货架期。本研究中筛选得到的菌株KC3和KM1在pH4的条件下的OD620值可以达到0.6,菌株KCH3在6%NaCl条件下的OD620值可以达到0.35,展现了良好的耐酸和耐盐能力,为后续的果蔬发酵试验奠定了菌种基础。
亚硝酸盐及生物胺的含量也是乳酸菌进行果蔬发酵考虑的因素。摄取过量的亚硝酸盐会引起致癌、抵抗甲状腺素和引起智障等危害[19]。菌株KCH3、KC3和KM1培养48 h后亚硝酸盐的降解率分别可达100%,高于目前报道的乳酸菌[20]。
生物胺是一种有害物质,如果健康人群摄入大量生物胺,或易感人群摄入少量生物胺,生物胺能进入机体各组织系统,导致肾上腺素和胃酸过量分泌、心跳加快、血糖含量增加或血压升高等症状[21]。筛选氨基酸脱羧酶阴性的乳酸菌能够大大降低果蔬发酵中生物胺的含量,进一步提高产品的安全性。菌株KCH3的4种氨基酸脱羧酶均为阴性,并且对3种有害菌的均有抑菌作用,将其应用于果蔬发酵,能够进一步提高产品的安全性。
通过功能筛选,获得了3株具有潜在生产价值的乳酸菌,即LactobacillusparacaseiKCH3 (CICC 6277),LactobacillusfermentumKM1 (CICC 6278)和LactobacillusfermentumKC3 (CICC 6290),为果蔬发酵应用奠定了菌种基础。
[1] 拉提帕·艾尔肯, 唐雪, 新华·那比. 新疆传统发酵驼乳中分离出的一株乳酸菌的分子生物学鉴定 [J]. 新疆医科大学学报, 2014, 37(2): 155-159.DOI:10.3969/j.issn.1009-5551.2014.02.007.
[2] ARGYRI A A, ZOUMPOPOULOU G, KARATZAS K A, et al. Selection of potential probiotic lactic acid bacteria from fermented olives byinvitrotests [J]. Food microbiology, 2013, 33(2): 282-291.DOI:10.1016/j.fm.2012.10.005.
[3] BAO Y, ZHANG Y, ZHANG Y, et al. Screening of potential probiotic properties ofLactobacillusfermentum isolated from traditional food products [J]. Food Control, 2010, 21(5): 695-701.
[4] 高娃. 四川部分地区泡菜中乳酸菌的分离鉴定 [D].呼和浩特:内蒙古农业大学, 2010.
[5] 赖婷, 刘汉伟, 张名位.乳酸菌发酵对果蔬中主要活性物质及其生理功能的影响研究进展 [J]. 中国酿造, 2015,34 (3): 1-4.
[6] 谢明勇,熊涛,关倩倩. 益生菌发酵果蔬关键技术研究进展[J]. 中国食品学报,2014,14 (10):1-9.
[7] 纪晓燚. 优良乳酸菌的筛选及其发酵蔬菜的应用研究 [D].杭州:浙江大学, 2014.
[8] 于微,马春丽,孙婷婷,等. 产细菌素乳酸菌的筛选及对农家干酪保质期的影响[J]. 食品科学,2015, 36 (3):142-146.
[9] XIONG T, LI X, GUAN Q, et al. Starter culture fermentation of Chinese sauerkraut: Growth, acidification and metabolic analyses [J]. Food Control, 2014, 41 (2):122-127.
[10] LIU W, BAO Q, JIRIMUTU, et al. Isolation and identification of lactic acid bacteria from Tarag in Eastern Inner Mongolia of China by 16S rRNA sequences and DGGE analysis [J]. Microbiological research, 2012, 167(2): 110-115.
[11] 熊素玉. 酸马奶中乳酸菌的分离鉴定及其生物学特性的研究[D].乌鲁木齐:新疆农业大学,2007.
[12] 武运,李远,王冰峰, 等. 新疆酸驼乳中细菌素乳酸菌的筛选及其抑菌性[J]. 食品与机械,2011, 27 (3):25-28.
[13] BEGANOVIC J, KOS B, LEBOS PAVUNC A, et al. Traditionally produced sauerkraut as source of autochthonous functional starter cultures [J]. Microbiological research, 2014, 169(7-8): 623-632.
[14] 胡书芳, 王雁萍, 洪爱俊, 等. 自然发酵酸菜中乳酸菌的分离鉴定及其生理特性研究 [J]. 安徽农业科学, 2009, 37(15): 6896-6898.
[15] 高书锋,陈丁,贺莫许. 亚硝酸盐降解菌的分离鉴定及其降解特性 [J]. 环境科学与技术, 2011, 34 (S2): 37-41.
[16] 于娜. 具有抑菌作用乳杆菌的筛选及其抑菌物质特性的研究 [D].呼和浩特:内蒙古农业大学, 2011.
[17] HWANHLEM N, BURADALENG S, WATTANACHANT S, et al. Isolation and screening of lactic acid bacteria from Thai traditional fermented fish (Plasom) and production of Plasom from selected strains [J]. Food Control, 2011, 22(3-4): 401-407.
[18] AMMOR M S, MAYO B. Selection criteria for lactic acid bacteria to be used as functional starter cultures in dry sausage production: An update [J]. Meat science, 2007, 76(1): 138-146.
[19] 姜维. 一株耐盐性高效生物胺降解新菌的筛选、分类鉴定及应用研究[D].青岛:中国海洋大学,2014.
[20] 吴慧昊,牛锋,陈珊珊,等. 高效降亚硝酸盐乳酸菌的驯化复筛及菌株鉴定[J]. 食品科学,2016 (1):1-10.
[21] 管世敏. 降解亚硝酸盐乳酸菌的分离筛选及其在泡菜发酵中的应用研究[D].上海:上海师范大学,2009.
Isolation,identificationandcharacterizationoflacticacidbacteriafromtraditionalfermentationfoodsinKazak
ZHAI Lei1,2, LING Kong2, SONG Zhen1, YAO Su2, CHENG Chi2, YANG Yuxin1*
1(Xinjiang Central Asia Food Research and Development Centre, Urumchi 830001,China) 2(China National Research Institute of Food and Fermentation Industries, Beijing 100027,China)
Eleven lactic acid bacteria were isolated from traditional fermentation foods including camel milk, mare milk and cheese in Kazak by culture-dependent methods. These isolates were identified by 16S rRNA gene andpheS gene sequences phylogenetic analysis, combined with morphology and physiological and biochemical characteristics. The abilities of acid- and salt-resistance, acid production, nitrite degradation, amino acids decarboxylases and antimicrobial properties were detected to screen lactic acid bacteria with potential applications. As a result, three lactic acid bacteria designated asL.paracaseiKCH3 (CICC 6277),L.fermentumKM1 (CICC 6278) andL.fermentumKC3 (CICC 6290) were obtained and laid a foundation for vegetable fermentation application.
traditional fermentation food in Kazak; lactic acid bacteria; polyphasic taxonomy identification; metabolic properties
10.13995/j.cnki.11-1802/ts.013447
博士(杨玉新工程师为通讯作者,E-mail: zhailei@china-cicc.org)。
“十三五”科技计划国家重点研发计划 (No. 2016-YFD0400502);国家微生物资源平台专项 (No. NIMR-2016-4);自治区科技支疆项目 (No. 2016E02021)
2016-11-20,改回日期:2017-04-25
