酪蛋白磷酸肽锌螯合肽的分离及结构性质表征
2017-09-03阚文翰纪晓雯王玉婷梅林王志耕
阚文翰,纪晓雯,王玉婷,梅林,王志耕
(安徽农业大学 茶与食品科技学院,安徽 合肥,230036)
研究报告
酪蛋白磷酸肽锌螯合肽的分离及结构性质表征
阚文翰,纪晓雯,王玉婷,梅林,王志耕*
(安徽农业大学 茶与食品科技学院,安徽 合肥,230036)
酪蛋白磷酸肽(Casein Phosphopeptides,CPPs)是一类具有二价金属元素螯合活性的多肽集,而定向获得特异性营养元素螯合活性的酪蛋白磷酸肽具有理论和实际意义。采用Q强阴离子交换色谱和高效反相制备色谱(RP-HPLC)连续色谱方案分离碱性蛋白酶酶解得到的CPPs,获得锌高螯合活性的CPPs,并运用氨基酸组成、紫外光谱、红外光谱、固体核磁共振13C谱、1H谱、31P谱表征分析酪蛋白磷酸肽螯合锌(CPP-Zn)的螯合性质。结果表明:CPPs经连续色谱分离可得具有高锌螯合活性的肽,其锌螯合活性可达88.68 μg/mg。螯合前后CPPs的结构及氨基酸组成发生了明显变化,其中的磷酸基团参与了螯合,推测其主要结合位点是—COOH、—NH2及P—OH中的—OH。
酪蛋白磷酸肽;分离;锌;螯合;结构
CPPs是一类来源于酪蛋白(含有α-酪蛋白、β-酪蛋白、γ-酪蛋白)的含有磷酸基团的肽集[1],通常可以通过特定蛋白酶解得到,现有的研究多以N/P比、多肽含量等理化指标来衡量CPPs活性。但目前针对其螯合锌离子的螯合活性的研究还很少。大量的研究表明[2-5],CPPs具有多种生理功能,其中促进矿物质吸收和利用生理活性功能备受关注。锌是动物机体代谢中不可或缺的微量营养素之一,锌营养不足是全球性的人类健康问题。目前,市面上的补锌剂大多是无机锌盐和有机酸锌盐,此类补锌剂存在生物利用率不高,摄入后容易在肠道中与植酸、草酸、磷酸等形成不溶性锌盐沉淀,从而降低了锌的生物利用率等问题。[6]新材料酪蛋白磷酸肽螯合锌以锌离子为中心,通过与电负性强的基团如氨基和羰基及羧基结合形成螯合环结构,从而避免了锌离子在碱性肠道环境产生沉淀而损失[7-8],可显著提高锌离子在消化系统中的稳定性、吸收利用率及生物活性,极具开发利用前景。有效获得高螯合活性的CPPs是CPP-Zn制备的前提,定向酶解、高效分离纯化、螯合物结构特征表征等研究对CPP-Zn螯合机制解析及实现高效制备均具有重要意义。
本研究利用碱性蛋白酶水解酪蛋白得到CPPs,采用色谱分离获得较强锌螯合活性的CPPs,并对其结构性质进行表征。
1 材料与方法
1.1材料与仪器
酪蛋白(98%),AMRESCO;碱性蛋白酶(alkaline protease酶活力10 000 U),RUIBIO公司;Q Sepharose FF填料,瑞典GE公司;BCA试剂盒,南京建成生物研究所;ZnSO4(AR),西陇化工股份有限公司;色谱空柱(20cm×15.0mm),瑞典GE公司;透析袋(100 Da),美国光谱公司;uRPC C2/C18ST4.6/100反相制备型色谱柱,瑞典GE公司; Gamma1-16 LSC冷冻干燥机,德国Marin Christ公司;ZEEnit 700p 原子吸收分光光度计:德国Analytik Jena公司;Nicolette is50 傅里叶红外光谱仪,美国Thermo Scientific公司;AKTA UPC 10快速蛋白纯化平台,瑞典GE公司;pH计:上海梅特勒托利多仪器有限公司;电子天平(精度:0.001),上海奥豪斯仪器有限公司;AVANCE III 500核磁共振波谱仪:瑞士Bruker 公司;L-8800氨基酸自动分析仪,日本日立;PE-Lambda紫外分光光度计,美国perkinElmer公司。
1.2CPPs的制备
取适量酪蛋白,将其配制成质量分数7%的蛋白底物溶液,0.1 mol/L NaOH调节溶液pH值至10.0,以每250 g酪蛋白溶液添加0.07 g碱性蛋白酶的比例加酶,55 ℃酶解3 h。酶解液于100 ℃水浴8 min灭酶处理,再用0.1 mol/L HCl调节溶液pH值至4.6,3 500r/min离心15 min,取上清,添加0.1 mol/L CaCl2溶液,使CaCl2终含量为1%,静置1 h,加入等体积的体积分数95%乙醇,8 000 r/min离心15 min,收集CPPs沉淀物,冻干备用。
1.3锌螯合活性的测定
1 mL 0.05 mol/L的Zn2+溶液,加入1 mL酪蛋白磷酸肽酶解液,60 ℃水浴80 min,再加入1 mL去离子水和1 mL醋酸-醋酸钠缓冲液(pH 7.0),室温静置5 min,10 000 r/ min冷冻离心15 min,无水乙醇洗涤沉淀5次,用双硫腙试剂检测洗液无变色反应,即排除游离锌干扰。采用BCA法及原子吸收光谱法分别测定沉淀物中多肽含量P、锌螯合量C[9-10],由此计算CPPs组份锌螯合活性。
锌螯合活性=C/P
(1)
式中:C,锌螯合量,μg;P,多肽含量,mg。
1.4锌螯合肽的分离
将CPPs配制成0.1 g/mL的溶液,采用两步法分离纯化高锌螯合活性肽。
首先,取适量Q sepharose FF填料填柱,用平衡相(A相)pH 8.0 20 mmol/L Tris-HCl缓冲液平衡15个柱体积至UV基线稳定,上样量10 mL,用(B相)pH 8.0 20 mmol/L Tris-HCl缓冲液含有1 mol/L NaCl的溶液作为洗脱相进行洗脱分离操作,于洗脱程序0~10 min 100%A相,10~50 min 0~100%B相,流速0.5 mL/min,5 min/管,214 nm下收集各峰,按1.3方法检测各收集管洗脱液对锌离子的相对螯合活性,获得锌螯合活性最强的CPPs组分。将收集的洗脱液置于透析袋(100 Da)中,4 ℃去离子水脱盐24 h,每10 h更换透析外液,脱盐后冻干备用。
第二步,将上步获得的锌螯合活性最强的CPPs组分,用制备型RP-HPLC色谱进一步分离。流动相A相为0.1%TFA的水溶液,B相为0.1%TFA水溶液V(乙腈)∶V(水)=6∶4,用A相平衡20个柱体积至UV基线稳定。上样量0.5 mL,按洗脱程序0~10min 100%A相,10~30 min 0%~70%B相,30~50 min 70%~0% B相,流速0.1 mL/min,2 min/管,214 nm条件下收集各吸收峰的洗脱液,按1.3方法检测获得锌螯合活性最强的洗脱液组分,冻干备用。
1.5CPP-Zn的制备
取适量纯化CPPs,用去离子水配制成0.1g/mL CPPs溶液,40 ℃10 min保温溶解,用0.1 mol/L NaOH调pH值至7.0,按CPPs∶Zn(质量比)=4∶1比例添加可溶锌,于60 ℃反应80 min,以8 000 r/min离心15 min,沉淀物用无水乙醇洗涤,经60 ℃热风干燥,制得CPP-Zn。
1.6氨基酸组成分析
准确称取上文得到的CPPs、CPP-Zn各10 mg,放入消化管中,加入12 mL 6mol/L的HCl并充入N2,置于120 ℃烘箱中水解10 h,用氨基酸自动分析仪测定其中氨基酸组成及含量。
1.7紫外光谱分析
将上文得到的CPPs以及CPP-Zn配制成1.0 mg/mL的水溶液,在200~400 nm下进行紫外扫描。
1.8红外光谱分析
分别将制备色谱纯化获得的高螯合活性CPPs及CPP-Zn粉末,在50 ℃条件下烘至恒重,各取1 mg晶体,在玛瑙研钵中加入100 mg KBr研磨,压片,抽气加压,压力约为600 kg/cm2,维持3~5 min,卸压得透明KBr样品片,用傅里叶红外光谱仪在4 000~500 cm-1区间内扫描。
1.913C、1H和31P固体核磁共振分析
取适量制备色谱纯化后的CPPs及CPPs-Zn粉末,进行固体核磁共振分析,13C、1H和31P MAS NMR试验均在AVANCE AVIII WB 500宽腔固体核磁共振波谱仪(500 MHz)上进行,其共振频率分别为100.63、400.14和161.98 Hz。
13CMAS NMR结合单脉冲实验下采用2.5 mm三共振MAS探头进行采样,转速为5 kHz,接触时间2 ms,采样时间5 ms,延迟时间5 ms,传感器对信号谱峰采集图像次数为1 000。
1H MAS NMR结合单脉冲实验下采用2.5 mm三共振MAS探头进行采样,魔角旋转转速为5 kHz,采样时间5 ms,延迟时间5 ms,传感器对信号谱峰采集图像采集次数128。
31P MAS NMR结合高功率去耦实验下采用4 mm 三共振MAS 探头进行采样,转速15 000 r/s,采样时间50.2 ms,延迟时间2 s,传感器对信号谱峰采集图像采集次数10 k。13C、1H和31P的固体核磁化学位移分别以甘氨酸、TMS(四甲基硅烷)和85%H3PO4为外标进行校零。
2 结果与讨论
2.1酪蛋白磷酸肽锌螯合肽的分离
CPPs酶解物经Q Sepharose FF阴离子交换色谱柱分离出峰结果如图1-a,各组分经锌螯合活性测定结果表明,峰3具有最高的锌螯合活性。再将峰3组分进一步经过RP-HPLC色谱分离(图1-b),经活性测定发现,峰3组分锌螯合活性最高,命名为CPP-33。两步分离纯化获得高锌螯合活性CPPs的效果参见表1。

图1 高锌螯合活性酪蛋白磷酸肽分离纯化效果Fig.1 Separation and purification of zinc-high-chelating activity Casein Phosphate

表1 高锌螯合活性酪蛋白磷酸肽两步分离纯化效果
2.2高锌螯合活性CPPs螯合前后的氨基酸组成分析
高螯合活性CPPs及CPP-Zn粉末的氨基酸组成分析结果参见表2。
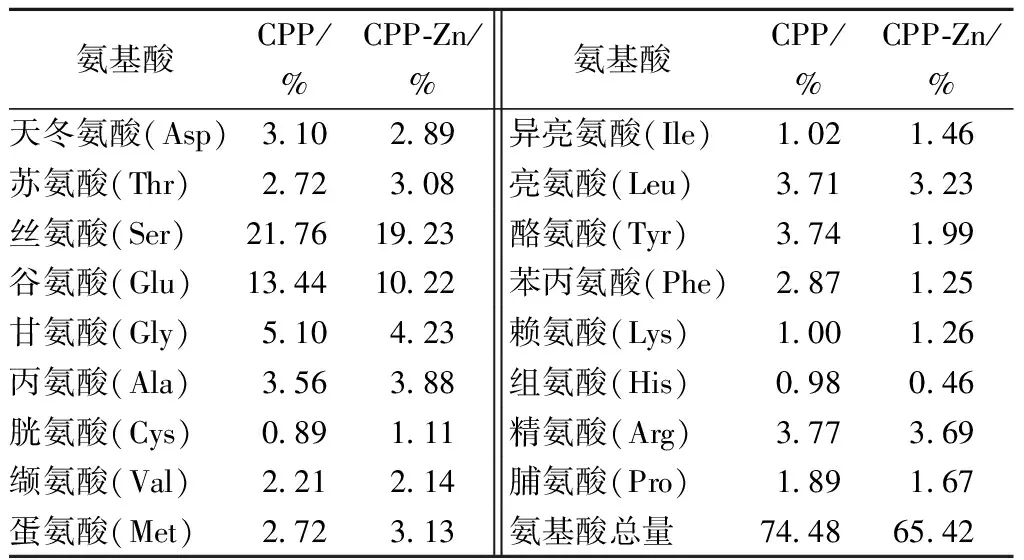
表2 高锌螯合活性酪蛋白磷酸肽螯合前后的氨基酸组成
当Zn2+与CPPs螯合时,对CPPs整体构象产生影响,由于氨基酸的极性与侧链基团的差异,对金属离子的亲和能力会有所不同,所以Zn2+会对其具有较强的亲和能力的氨基酸中的—NH4、—COOH中的N、O形成配位键,单位空间里,当Zn2+与氨基酸配位,原有氨基酸总量发生变化,因此螯合前后氨基酸的组成含量会有不同。
CPPs、CPP-Zn 进行氨基酸组成分析如表2所示,螯合前后酪氨酸(Tyr)、苯丙氨酸(Phe)等芳香族氨基酸的含量减少,分别由3.74%降低到1.99%,2.87%降低到1.25%,且螯合后氨基酸总量减少了9.06%,减少的部分可能由Zn2+代替,变化趋势同张智[7]一致,芳香族氨基酸的结果变化与后文中核磁共振13C谱的变化推导一致。
2.3高锌螯合活性CPPs螯合前后的紫外光谱分析


图2 高锌螯合活性酪蛋白磷酸肽螯合前后紫外吸收光谱图Fig.2 UV-VIS spectra of zinc-high-chelating activity of Caseinphos Phate before and after chelate
2.4高锌螯合活性CPPs的红外光谱分析
高螯合活性CPPs及CPP-Zn粉末的红外光谱检测结果参见图3。

图3 高螯合活性酪蛋白磷酸肽螯合前后红外光谱图Fig. 3 The infrared spectra of zinc-high-chelating activity of Casein Phosphate before and after chelate

螯合前后谱图的形状变化主要表现在1 406.99 cm-1(6)处,该处在螯合前后曲线变化显著。另螯合前曲线的1 535.51 cm-1(4)处,螯合后,出峰位置蓝移至1 551.56 cm-1(4),该变化提示游离的—NH2可能与Zn2+发生了键合反应。1 406.99 cm-1(6)在螯合后曲线中减弱消失,且CPP-Zn中3 400 cm-1附近吸收峰变窄,说明CPP-Zn 结构中无裸露的—COOH 结构,—COOH 已与Zn2+结合,这与周亮[11]结果相似。
2.5高锌螯合活性CPPs的固体核磁共振分析
高螯合活性CPPs及CPP-Zn的13C、1H和31P固体核磁共振分析结果参见图4~图6。

图4 高锌螯合活性酪蛋白磷酸肽螯合前后13C核磁共振谱图Fig.4 13C NMR spectra of zinc-high-chelating activity Casein Phosphate before and after chelate

图5 高锌螯合活性酪蛋白磷酸肽螯合前后1H 核磁共振谱图Fig. 5 1H NMR spectra of zinc-high-chelating activity Casein Phosphate before and after chelate

图6 高锌螯合活性酪蛋白磷酸肽螯合前后31P核磁共振谱图Fig.6 31P NMR spectra of zinc-high-chelating activity Casein Phosphate before and after chelate
由图4可知,CPPs螯合前后均存在5种场区的谱峰,其中位于23 ppm以内场区的谱峰,多来自于脂肪族氨基酸侧链甲基上的C原子贡献,位于23~50 ppm场区的峰,主要由脂肪族氨基酸的亚甲基上的C原子产生;位于165~180 ppm场区的宽峰多是包含氨基酸骨架上羰基上的C原子产生。
螯合前后谱图的变化主要在60 ppm左右以及100 ppm左右峰的消减和位移。位于50~70 ppm场区的谱峰是包含肽链骨架上的C原子贡献而成,螯合前后该场区发生较多峰的位移以及消减,由此猜测CPPs与Zn2+螯合后形成多元螯合环结构,在其配位键的作用下导致肽链的结构发生了改变。而位于100~140 ppm场区内的谱峰均由芳香族氨基酸中的C原子产生,此处谱峰的变化提示苯丙氨酸(Phe)、酪氨酸(Tyr)等芳香族氨基酸的多肽参与了Zn2+的螯合,原有C原子的化学环境的改变,从而导致峰面积和峰高的消减。
由图5可见,CPPs在-24 ppm附近质子信号发生耦合,谱峰裂解产生多重峰,在-19.5 ppm附近质子信号表现为双峰。结果表明,当CPPs和Zn2+螯合后,Zn2+与CPPs上的—COOH键合作用,影响了不同位置上H 的化学环境,致使H 自旋偶合产生的裂解峰发生了位移变化,使氢核周围电子云密度发生变化。当电子云密度变大时,受到电子屏蔽效应强,共振频率降低,化学位移减小;当H 核周围电子云密度变小时,化学位移则增大。图5中,2.11 ppm处谱峰化学位移减小至2.02 ppm且几近消失,应是由于游离-NH2与Zn2+发生螯合后,质子峰向高场移动所致。
由图6可知,CPPs螯合前后均存在5种化学环境的P原子,各谱峰由磷酸化氨基酸的磷酸基团提供。图6中螯合前后谱峰(3)的化学位移发生了变化,从-24.09 ppm向低场移动至-22.80 ppm,这种化学位移变化取决于其核周围电子云密度的大小的变化。在螯合过程中,CPPs所含的磷酸基团P—OH的H被金属离子Zn2+取代后,与P直接相连的O变成了氧负离子,使其电负性增大,其核外的电子云密度发生降低,产生了去屏蔽作用,从而导致31P的化学位移向低场发生移动[12]。此外CPPs发生螯合反应前后的31P MAS NMR 的谱峰(3)的峰值和面积也发生了明显的变化,螯合后的曲线明显低于螯合前的曲线,这说明在CPPs与Zn2+的螯合过程中,磷酸基团的P—OH参与了螯合反应。
3 结论
酪蛋白经碱性蛋白酶酶解,经Q Sepharose FF阴离子交换色谱与RP-HPLC色谱法两步分离,获得高锌螯合活性的CPPs,其螯合活性达88.68 μg/mg。CPPs与CPPs-Zn经氨基酸组成分析、紫外光谱、红外光谱以及固体核磁共振13C谱、1H谱、31P谱解析,结果表明,螯合前后CPPs的结构及氨基酸组成发生了明显变化,其中的磷酸基团参与了螯合,其主要结合位点是—COOH、—NH2及P—OH中的—OH。
[1] 蔡焕新,殷宝茹,姚萍.酪蛋白多肽的制备和色谱分离方法[J].色谱,2010(7):637-643.
[2] MIQUEL E, ALEGRA A, BARBERA R , et al. Speciation analysis of calcium, iron, and zinc in casein phosphopeptide fractions from toddler milk-based formula by anion exchange and reversed-phase high-performance liquid chromatography-mass spectrometry/flame atomic-absorption spectroscopy[J].Analytical and Bioanalytical Chemistry,2005,381:1 082-1 088.
[3] HUANG Guan-grong, REN Zhang-yan, JIANG Jia-xin. Separation of iron-binding peptides from shrimp processing by-products hydrolysates[J]. Food and Bioprocess Technology, 2011(4):1 527-1 532.
[4] ESTHER MIQUE, AMPARO ALEGRIA, REYCS BARBERA, et al. Casein phosphopeplides released by simulated gastrointestinal digestion of infant formulas and their potential role in mineral binding[J].International Dairy Journal, 2006,16:992-1 000.
[5] 卜尔红,刘成国,罗玲泉.碱性蛋白酶在酪蛋白磷酸肽生产中的研究.乳业科学与技术[J],2008(3):143-145.
[6] 韦燕燕. 水稻籽中锌生物有效性与调控机制[D].杭州:浙江大学,2012,2-7.
[7] 张智,刘慧,刘奇,等. 玉米肽-锌螯合物结构表征及抗氧化活性分析[J].食品科学, 2017,38(3):131-135.
[8] 黄顺丽,赵立娜,蔡茜茜,等.乳清蛋白钙螯合肽的分离及结构性质表征[J].中国食品学报,2015(11): 212-218.
[9] 朱志国,胃执安,谷梅,等.用紫外/可见分光光度法测定锌糖浆剂及锌化合物的含量[J].分析仪器,1997(12):48-51.
[10] 王志耕,张胥卿,梅林,等. 酪蛋白磷酸肽锌螯合物[P].CN103494214A.2014-01-08.
[11] 周亮. 鱼鳞胶原小肽螯合锌的制备研究[D].武汉:湖北工业大学,2014,51-55.[12] YU Shan-qing, TIAN Hui-ping.Acidity characterization of rare-earth-exchanged Y zeolite using31P MAS NMR[J].Chinese Journal of Catalysis.2014,35(8): 1 318-1 328.
Separationandstructurecharacterizationsofzinc-bindingpeptidefromCaseinPhosphopeptides
KAN Wen-han, JI Xiao-wen, WANG Yu-ting, MEI Lin,WANG Zhi-geng*
(School of Tea and Food Science& Technology, Anhui Agriculture University, Heifei 230036,China)
Casein Phosphopeptides (Casein Phosphopeptides, referred to as CPPs) is a class of polypeptides which has divalent metal chelating activity. The theory and practical significance of CPPs is its specific nutrient chelated. CPPs was obtained by enzymatic hydrolysis, and separated Q strong anion exchange chromatography and reverse phase preparative chromatography (RP-HPLC); it had highly active zinc chelate peptide(CPP-Zn). Its structural was analyzed by proportion of amino acids、UV-VIS spectra、infrared spectroscopy、13C NMR spectra、1H NMR spectra and31P NMR spectra. Result: CPP purified from continuous chromatographic separation had strong zinc chelating ability of 88.68ug / mg. Structure analysis showed CPP structure and proportion of amino acids before and after chelation significantly changed. The phosphate groups are involved in the chelation, —COOH、—NH2and —OH in P—OH were the primary binding site.
Casein Phosphopeptides; isolated; zinc; chelate; structure
10.13995/j.cnki.11-1802/ts.013274
硕士研究生(王志耕教授为通讯作者,E-mail:wzhg@ahau.com.cn)。
2016-10-26,改回日期:2017-02-22
