苦荞蛋白对肠道有害菌生长抑制机理研究
2017-09-03李恩伟
李恩伟
(山西省食品工业研究所,山西太原 030024)
苦荞蛋白对肠道有害菌生长抑制机理研究
李恩伟
(山西省食品工业研究所,山西太原 030024)
本文以水溶性苦荞蛋白为研究对象,利用体外模拟发酵,通过对苦荞蛋白作用下小鼠粪便发酵液中pH、短链脂肪酸(乙酸、丙酸、丁酸、乳酸)的含量以及有害菌(肠球菌、肠杆菌、产气荚膜梭菌)的数量进行测定,对苦荞蛋白抑制肠道有害菌群生长机理进行了初步研究。结果表明:添加不同浓度的苦荞蛋白与对照组相比,均可以有效降低有害菌的数量,其中高剂量组分别使肠球菌、肠杆菌和产气荚膜梭菌减少了65%、72%和78%(32 h);同时,不同剂量组的苦荞蛋白使小鼠粪便发酵液pH分别下降了35%、39%、40%(32 h)。此外,高剂量组的苦荞蛋白较对照组分别使乙酸、丙酸、丁酸及乳酸的浓度增加了8.94、33.77、27.34、25.55倍(32 h)。综上所述,苦荞蛋白能够提高肠道中短链脂肪酸含量,从而降低肠道环境的pH,抑制肠道有害菌(肠球菌、肠杆菌、产气荚膜梭菌)的生长。
苦荞蛋白,体外模拟,抑制,pH,短链脂肪酸(SCFAs)
肠道菌群被认为是机体的一个重要“器官”,其组成和数量在维持人体健康中起重要作用,且主要由益生菌和有害菌(条件致病菌和病原菌)组成[7]。而有害菌是肠道中的非优势菌群,其在肠道中只占较少的比例,其中肠球菌、肠杆菌以及产气荚膜梭菌等是肠道中主要的有害菌,它们能够将食物中的一些成分变为多种腐败物质(如:胺、吲哚、酚类)、有毒及致癌物质(如:微生物毒素、硝基化合物)等,从而引起某些肠道疾病的发生[8-10]。研究发现,花生蛋白对肠球菌、肠杆菌、产气荚膜梭菌的生长具有明显的抑制作用[11]。目前,对于苦荞蛋白的研究主要集中在降低胆固醇、调节血脂以及其对益生菌增殖作用等方面,而对于其在肠道有害菌方面的研究则鲜有报道。
因此,本文以苦荞蛋白为研究对象,通过模拟结肠发酵进行体外培养,从苦荞蛋白对肠道有害菌(肠球菌、肠杆菌、产气荚膜梭菌)的生长的抑制影响、小鼠粪便发酵液pH以及短链脂肪酸(乙酸、丙酸、丁酸、乳酸)的含量三个方面研究其对肠道有害菌生长及抑制作用的机理。
1 材料与方法
1.1 材料与仪器
黑丰1号苦荞 购于山西省左云县;SPF级C57BL/6小鼠45只 购于上海斯莱克实验动物有限公司;L-半胱氨酸盐酸盐、胆盐、维生素K1、氯高铁血红素、刃天青、胃蛋白酶(≥3000 U/g)、胰酶(≥4000 U/g)、猪胆汁粉,均为BR级 购于上海宝曼生物科技有限公司;伊红美蓝琼脂(EMB)、胰月示-亚硫酸盐-环丝氨酸琼脂基础、胆汁七叶苷叠氮钠、D-环丝氨酸、50%卵黄乳液 购于青岛海博生物技术有限公司;乙酸、丙酸、丁酸、乳酸,均为色谱纯 购于上海麦克林生化科技有限公司;酪蛋白、葡萄糖、蛋白胨、酵母膏,均为AR级 购于国药集团化学试剂(上海)有限公司;其他试剂均为分析纯。
体外模拟基础培养基的制备(1 L):参考Mao Sheng-yong等人[12]的方法,并略作修改。
PBS:磷酸盐缓冲液(Phosphate Buffered Saline),分别配制0.01 mol/L和0.1 mol/L、pH7.0的PBS。其中将配制好的PBS(0.1 mol/L,pH7.0)经高压灭菌后,置于厌氧培养箱中37 ℃过夜,用于稀释肠道内容物。
GCMS-TQ8040气相色谱质谱联用仪 日本岛津公司;YQX-II厌氧培养箱 上海龙跃仪器设备有限公司;3-18K高速冷冻离心机 Sigma仪器有限公司;冷冻干燥机 北京博医康实验仪器有限公司;SW-CJ-IFD垂直洁净工作台 苏州安泰空气技术有限公司。
二维超高效液相色谱-飞行时间质谱联用技术鉴定氯化琥珀胆碱原料药中的杂质 ………………………… 陈 红等(7):941
1.2 实验方法
1.2.1 实验小鼠分组 SPF级C57BL/6小鼠购买后于SPF级动物房内单笼饲养,饲养温度(25±1.0) ℃,湿度 50%±1.0% RH,并喂食2周以适应环境。在此期间,自由进食和饮水(饮用水121 ℃、20 min灭菌,基础饲料和垫料紫外照射30 min杀菌)。然后,将小鼠随机分为五组,空白对照组喂食基础饲料,酪蛋白组喂食酪蛋白添加量1 mg/mL的饲料,其余三组小鼠按苦荞蛋白添加量1、3、5 mg/mL将小鼠分为低、中、高剂量组。
1.2.2 苦荞蛋白的制备 参考郭晓娜等人[13]的方法并略作修改。苦荞籽粒粉碎后过筛,脱脂24 h;取100 g脱脂苦荞粉以料液比1∶10用0.01 mol/L,pH7.0的PBS溶解,在磁力搅拌器上搅拌2 h;在4 ℃条件下,4000 r/min离心30 min,并向上清液中加入(NH4)2SO4使其浓度为40%,搅拌60 min;在4 ℃条件下,10000 r/min离心15 min,并向上清液中加入(NH4)2SO4使其浓度为80%,搅拌60 min;在4 ℃条件下,10000 r/min离心15 min,弃上清,沉淀用少量去离子水复溶;然后将其加入到透析袋中进行透析48 h(每4 h换水一次),透析后进行冻干(-70 ℃,24 h),冻干粉保存备用。
1.2.3 苦荞蛋白含量的测定 参照国标GB 50095-2010中凯氏定氮法进行样品测定。
1.2.4 肠胃道环境模拟 体外消化:参考Mills等人[14]的方法并略作修改。具体如下:分别称取5.0 g苦荞蛋白,将pH调节到2.0±0.05(此时胃蛋白酶的活性最高),加入2.5 mL溶解在0.1 mol/L盐酸中的胃蛋白酶溶液(0.108 g/mL),经37 ℃恒温水浴震荡2 h;经过模拟胃部条件消化后,再用6 mol/L NaOH将溶液的pH调节到6.8±0.05(此时胰酶活性最高),加入12.5 mL溶解在0.5 mol/L Na2CO3中的胰酶胆汁溶液(胰酶和胆汁浓度分别为4.5 mg/mL和28 mg/mL),37 ℃恒温水浴震荡2 h;进一步模拟食物在肠道中的消化。充分混匀后,将混合液置于透析袋进行透析,并于37 ℃,在10 mmol/L NaCl溶液中进行透析过夜,结束后,再次更换NaCl溶液并继续透析2 h,最后将截留消化液进行冷冻干燥,于4 ℃冰箱保存用于体外模拟肠道发酵实验。上述步骤以酪蛋白(Casein)作为对照以及用无菌水代替苦荞蛋白作为空白对照。
1.2.5 体外发酵液的制备 体外发酵:参考Estibaliz等人[15]的方法,并略作修改。向无菌发酵瓶中加入90 mL基础培养基并于厌氧工作站中37 ℃进行预还原(12 h)。1 L基础培养基中含有:2 g葡萄糖,2 g蛋白胨,2 g酵母膏,0.1 g NaCl,0.04 g K2HPO4,0.04 g KH2PO4,0.01 g MgSO4·7H2O,0.01 g CaCl2·6H2O,2 g NaHCO3,0.5 gL-半胱氨酸盐酸盐,0.5 g胆盐,10 mL维生素K1,2 mL吐温-80和1 mL氯高铁血红素溶液,将以上成分溶解后调节基础培养基pH至7.0(±0.05),最后加入4 mL 0.025%(w/v)刃天青溶液并灭菌。
收集小鼠新鲜粪便(尽量保持无菌状态),收集后立即用预还原的磷酸盐缓冲溶液(PBS,0.1 mol/L,pH7.0)稀释10倍,并在涡旋振荡器上充分振荡3 min,使之彻底匀浆化,500 r/min 离心2 min,分别迅速取上清液10 mL到90 mL预还原基础培养基中,再加入低(0.2 g)、中(0.4 g)、高剂量组(0.8 g)经胃肠模拟环境处理后的苦荞蛋白水解样品BWPH(酪蛋白消化冻干样品PC作为对照组,无菌水代替苦荞蛋白的消化冻干产物CK作为空白对照)充分混匀;在厌氧培养箱中37 ℃发酵32 h,并在发酵的第0、8、16、32 h取样。
1.2.6 苦荞蛋白对三种有害菌生长的影响 在发酵的第0、8、16、32 h,分别取小鼠粪便发酵液并对其中的肠球菌、肠杆菌、产气荚膜杆菌进行计数,发酵液用含有5 g/L 蛋白胨的稀释液进行10倍梯度法稀释(10-1~10-7),选择合适稀释度的样品(100 μL)并分别涂布于各选择性培养基上进行培养(培养基、培养方法及条件,见表1),以上操作均在厌氧培养箱中进行,从取样至涂板完成所用时间控制在3 h内。每毫升小鼠粪便发酵液的菌落数用菌落形成单位的以10为底的对数值(lg CFU/mL)表示。

表1 肠道主要菌群培养计数方法Table 1 Cultivation and counting methods of the main intestinal flora
1.2.7 苦荞蛋白对发酵液pH的影响 在发酵的第0、8、16、32 h,分别取不同样品小鼠粪便发酵液,用pH计测定其pH。
1.2.8 苦荞蛋白对短链脂肪酸的影响 短链脂肪酸(SCFAs)是肠道微生物发酵不被人体胃肠道吸收的食物成分而生成的代谢产物,主要包括甲酸、乙酸、丙酸、丁酸、乳酸、延胡索酸和一些相应的支链脂肪酸。其中乙酸、丙酸、丁酸及乳酸占90%以上,具有重要的生理功能[16]。为进一步研究苦荞蛋白对肠道有害菌群生长抑制作用的机理,实验对小鼠粪便发酵液中短链脂肪酸(SCFAs)的浓度变化进行分析。
在发酵的第0、8、16、32 h,分别取不同样品小鼠粪便发酵液,采用气质联用(GC-MS-MS)法测定其中短链脂肪酸(SCFAs,包括乙酸、丙酸、丁酸、乳酸)的含量。
气质分析条件:毛细管柱(Rtx-5MS,30 m×0.25 mm×0.25 μm);柱温:35 ℃保持1 min,以10 ℃/min的速度升温至100 ℃,保持1 min,再以20 ℃/min的速度升温至250 ℃,保持3 min;进样口温度:250 ℃;离子源温度:220 ℃;接口温度:260 ℃;分流方式及分流比:分流进样和10∶1;载气:He,流速:1 mL/min;溶剂延迟1.5 min。GC分析时进样量:1 μL[17]。
发酵液样品的处理参考Fenster等人[18]的方法,并略作修改。
1.2.9 数据分析 采用SPSS 20.0软件进行ANOVA(LSD检验),检验水准=0.05进行显著性分析;每组数据均作3个平行样,结果以平均值±标准差表示,并运用origin 9.0软件进行作图。
2 结果与分析
2.1 苦荞蛋白对三种有害菌生长的抑制作用
由图1可知,不同实验组中肠球菌、肠杆菌及产气荚膜梭菌的数量均呈先上升后下降的趋势,其中,中(MD)、高(HD)剂量组的苦荞蛋白在发酵8 h时达到最大值,而空白组(CK)、酪蛋白组(PC)及低(LD)剂量组的苦荞蛋白在16 h时达到最大值。另外,在发酵至32 h时,不同剂量组的苦荞蛋白中肠球菌、肠杆菌及产气荚膜梭菌的数量均显著低于CK和PC组(p<0.05),且上述三种有害菌群的数量随苦荞蛋白浓度的增加而显著性降低(p<0.05),同时,酪蛋白组中肠球菌、肠杆菌及产气荚膜梭菌的数量与空白对照组之间无显著性差异(p>0.05)。培养至32 h时,低、中、高剂量的苦荞蛋白组较空白对照组,肠球菌减少了50%、57%、65%,肠杆菌减少了13%、52%、72%,产气荚膜梭菌减少了66%、73%、78%;而酪蛋白却使其分别减少了5%、7%、4%。研究结果表明,苦荞蛋白能够显著地抑制肠道有害菌(肠球菌、肠杆菌及产气荚膜梭菌)的生长,与文献[19]报道的结论一致。
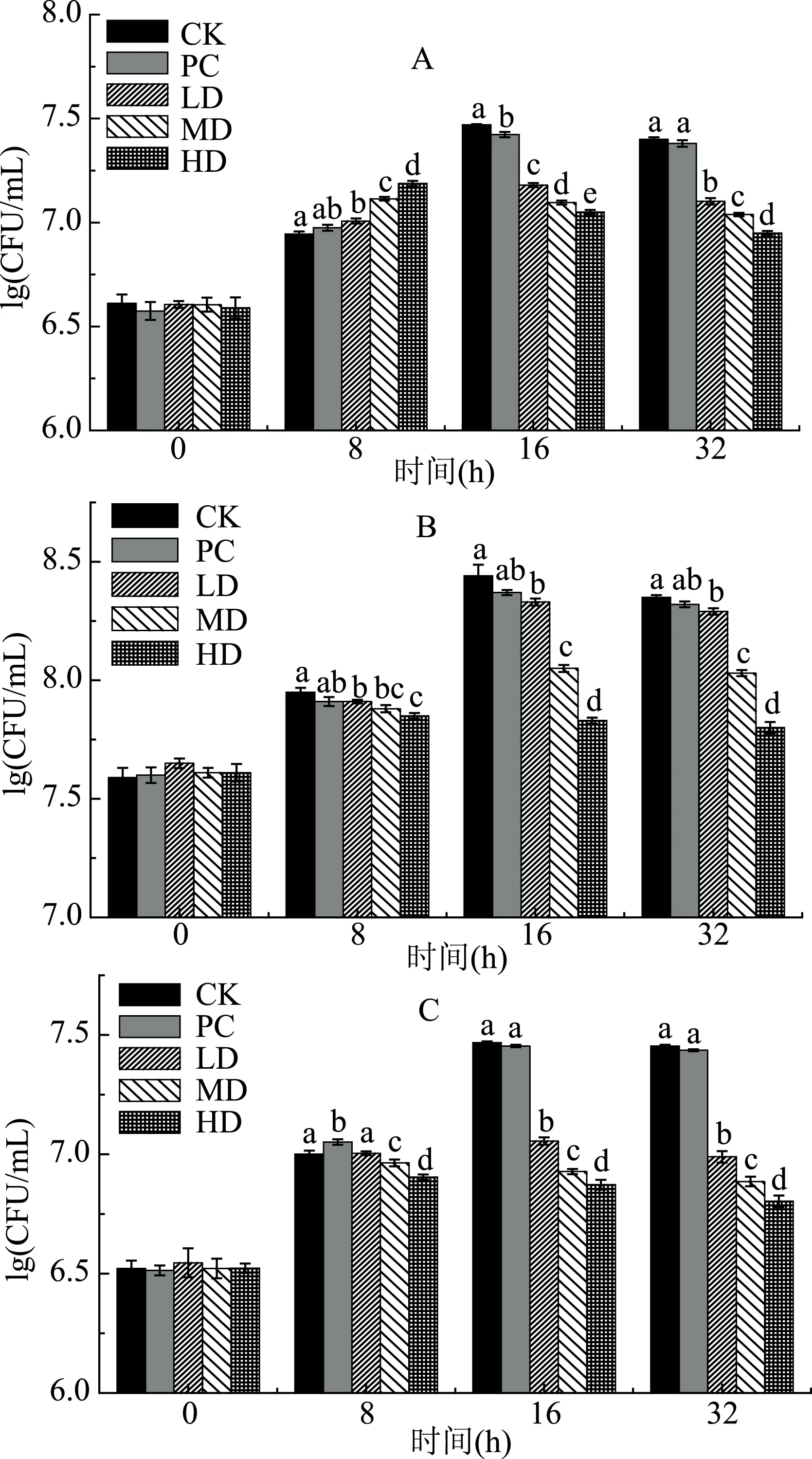
图1 苦荞蛋白体外发酵对三种肠道有害菌生长的影响Fig.1 Effects of in vitro fermentation of different tartary buckwheat protein on numbers of three kinds intestinal harmful bacteria注:CK:空白对照组;PC:酪蛋白组;LD:低剂量苦荞蛋白组;MD:中剂量苦荞蛋白组;HD:高剂量苦荞蛋白组;A:肠球菌;B:肠杆菌;C:产气荚膜梭菌,图2、图3同。
2.2 苦荞蛋白对小鼠粪便发酵液pH的影响
由图2可知,各实验组pH变化趋势均呈下降趋势,而对照组(CK)却呈先下降后上升的趋势,这可能是由于随着培养时间的增加,其菌群发生变化,使产酸菌群减少或氨类物质增多而导致;另外,当培养至32 h时,其中PC组pH由7.21降到4.72,LD组pH由7.18降到4.68,MD组pH由7.09降到4.35,HD组pH由7.17降到4.33,各组pH下降程度高低为HD>MD>LD>PC>CK。酪蛋白组和不同剂量组的苦荞蛋白组发酵液中的pH均低于空白对照组,且与其之间均具有显著性差异(p<0.05)。在培养结束时,不同剂量组的苦荞蛋白组的发酵液pH与肠道中三种有害菌(肠球菌、肠杆菌、产气荚膜梭菌)数量之间存在正相关关系,即发酵液pH越低,肠球菌、肠杆菌及产气荚膜梭菌的数量越少。由此说明,有害菌生长受到抑制可能是由于肠道菌群发酵苦荞蛋白而产生短链脂肪酸等酸性物质,从而使肠道环境pH降低,这对于预防和治疗肠道疾病具有重要意义[20]。
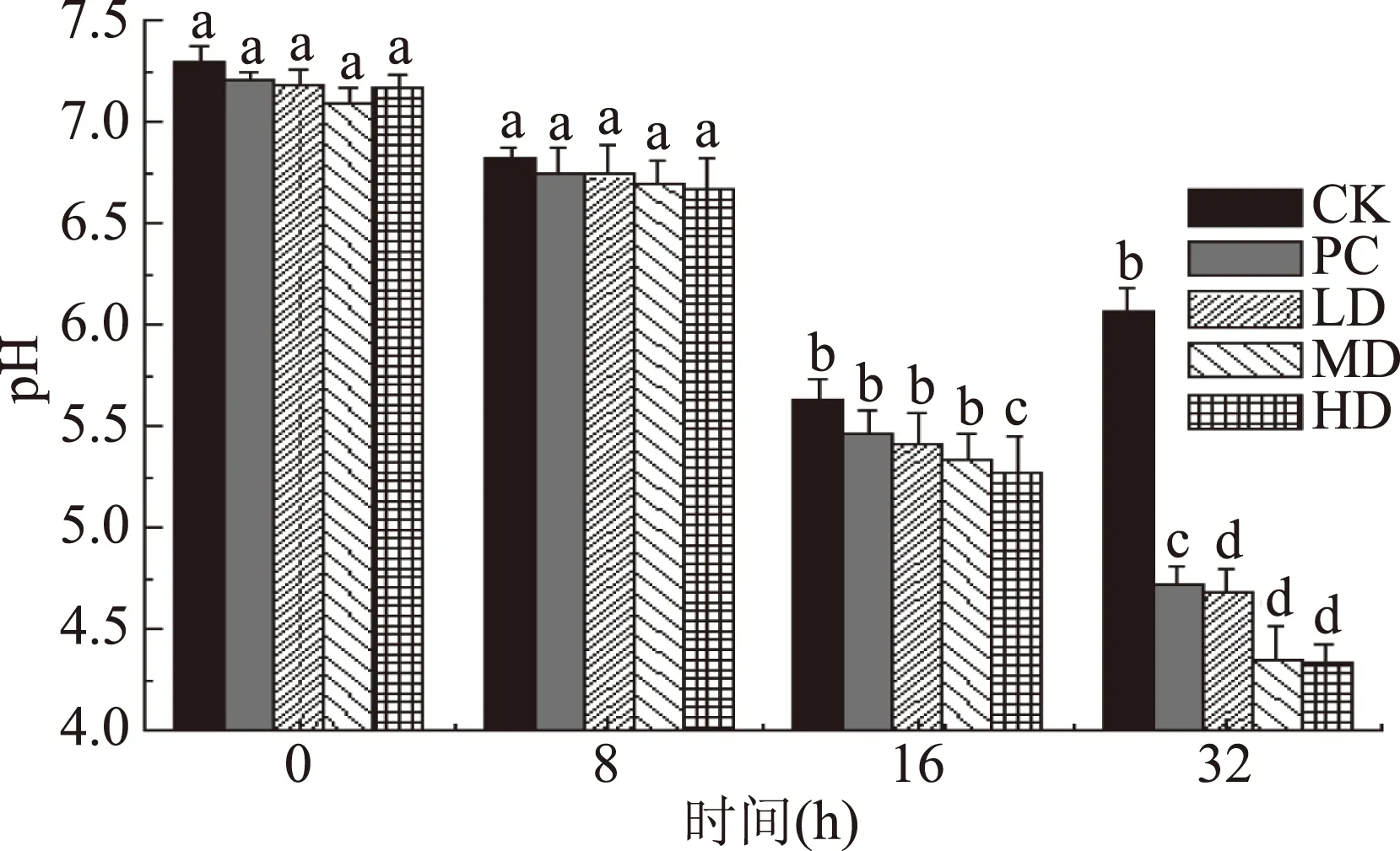
图2 苦荞蛋白体外发酵对pH的影响Fig.2 Effects of in vitro fermentation of different tartary buckwheat protein on pH
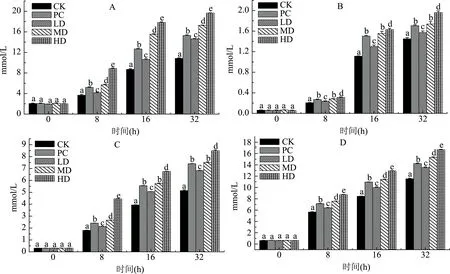
图3 苦荞蛋白体外发酵对短链脂肪酸的影响Fig.3 Effects of in vitro fermentation of different tartary buckwheat protein on SCFAs注:A:乙酸;B:丙酸;C:丁酸;D:乳酸。
2.3 苦荞蛋白对短链脂肪酸的影响分析
由图3可知,不同剂量的苦荞蛋白均能促进乙酸、丙酸、丁酸、乳酸的生成,且随着培养时间的延长,4种短链脂肪酸的浓度均显著性增加(p<0.05),可能是由于肠道菌群将苦荞蛋白作为发酵底物产生短链脂肪酸等有机酸。当培养至32 h时,中、高剂量的苦荞蛋白组(MD、HD)较0 h使乙酸浓度增加了7.29、8.94倍,丙酸浓度增加了25.47、33.77倍,丁酸浓度增加了23.60、27.34倍,乳酸浓度增加了22.61、25.55倍(酪蛋白组(PC)使其浓度分别增加了6.73、27.60、22.93、20.70倍),此结果与方建东等[21]研究结论一致。在培养结束时,不同剂量组的苦荞蛋白中乙酸、丙酸、丁酸及乳酸与对照组之间均具有显著性差异(p<0.05),且中、高剂量组的苦荞蛋白对短链脂肪酸(乙酸、丁酸、乳酸)的促进作用显著高于酪蛋白,即苦荞蛋白对短链脂肪酸的促进作用优于酪蛋白,且高剂量组较低剂量组效果更加显著,其原因可能是苦荞蛋白和酪蛋白均能够被肠道菌群发酵,而且苦荞蛋白更有利于被肠道菌群发酵产生乙酸、丙酸、丁酸、乳酸。当培养结束时,图3中各组中短链脂肪酸的浓度可能与图2中相对应的pH相关,即短链脂肪酸浓度越高,其对应的pH越低,从而表明pH的降低可能是通过发酵代谢产生的短链脂肪酸所引起的。
3 结论
本文初步研究了苦荞蛋白对肠道中三种有害菌(肠球菌、肠杆菌、产气荚膜梭菌)生长的抑制作用及其机理。结果表明,苦荞蛋白对肠道中肠球菌、肠杆菌及产气荚膜梭菌的生长均具有抑制作用且高于酪蛋白,其中,高剂量的苦荞蛋白(HD)对三种菌的抑制作用最强,较空白对照组(CK)分别减少了65%、72%和78%(32 h)。不同剂量的苦荞蛋白可显著性地促进乙酸、丙酸、丁酸、乳酸浓度的增加,且中、高剂量组的苦荞蛋白对其促进作用显著高于酪蛋白(p<0.05),其中,高剂量组的苦荞蛋白较对照组分别使乙酸、丙酸、丁酸及乳酸的浓度增加了8.94、33.77、27.34、25.55倍(32 h)。而产生的短链脂肪酸进一步使肠道pH降低,且不同剂量苦荞蛋白组的pH均低于酪蛋白(高剂量组苦荞蛋白的pH为4.33,而酪蛋白组为4.68)。从而证明了苦荞蛋白对肠道有害菌的生长具有抑制作用,且这种抑制作用是通过促进肠道中短链脂肪酸的产生,进而降低肠道的pH。
综上所述,苦荞蛋白是可能通过促进乙酸、丙酸、丁酸等短链脂肪酸的生成,从而降低肠道的pH来抑制肠道有害菌(肠球菌、肠杆菌及产气荚膜梭菌的)的生长。
[1]侯雪梅,袁仲. 荞麦的营养保健功能与开发利用[J]. 农产品加工(学刊),2014,(01):73-75.
[2]Wang Xu,Feng Bo,Xu Zhibin,et al. Identification and characterization of granule bound starch synthase I(GBSSI)gene of tartary buckwheat(Fagopyrum tataricum Gaertn.)[J]. Gene,2014,534(2):229-235.
[3]王飞. 苦荞麦营养保健酸奶的研制及品质分析[D]. 呼和浩特:内蒙古农业大学,2008,12-13.
[4]曹丽霞. 荞麦分离蛋白-葡聚糖共价复合物的制备及乳化性研究[D]. 无锡:江南大学,2014,23-24.
[5]Adebola O,Corcoran O,Morgan W. Synbiotics:the impact of potential prebiotics inulin,lactulose and lactobionic acid on the survival and growth of Lactobacilli probiotics[J]. Journal of Functional Foods,2014,10(3):75-84.
[6]Kayashita J,Shimaoka I,Nakajoh M,et al. Consumption of buckwheat protein lowers plasma cholesterol and raises fecal neutral sterols in cholesterol-fed rats because of its low digestibility[J]. Journal of Nutrition,1997,127(7):1395-1400.
[7]李瑞,廖振林,方祥,等. 抗性淀粉对HFA小鼠道菌群的影响[J]. 中国微生态学杂志,2013,25(7):762-765.
[8]Ishibashi N,Shimamura S. Bifidobacteria. Research and development in Japan [J]. Food Technology,1993,6:126-135.
[9]王尤丽. 低聚半乳糖调节小鼠肠道菌群的作[D]. 郑州:郑州大学,2012,42-43.
[10]熊德鑫. 微生态制剂[J]. 江西科学,1990,1(52):161.
[11]陈贵堂,赵霖,鲍善芬,等. 不同植物蛋白质对大鼠肠道菌群的影响[J]. 中国食品学报,2006,6(1):238-242.
[12]Mao Shengyong,Zhu Weiyun. Effects of six flavonoid compounds addition on short-chain fatty acids production and human fecal microbial community change duringinvitrofermentation [J]. African Journal of Microbiology Research,2011,5(26):4484-4491.
[13]郭晓娜. 苦荞麦蛋白质的分离纯化及功能特性研究[D].无锡:江南大学,2006,59-60.
[14]Mills D,Tuohy K,Booth J,et al. Dietary glycated protein modulates the colonic microbiota towards a more detrimental composition in ulcerative colitis patients and non-ulcerative colitis subjects[J]. Journal of Applied Microbiology,2008,105(3):706-714.
[15]Estibaliz O,Mountzouris K,Glenn R,et al.Invitrofermentability of dextran,oligodextran and maltodextrin by human gut bacteria[J]. British Journal of Nutrition,2000,83(3):247-255.
[16]陈燕,曹郁生,刘晓华. 短链脂肪酸与肠道菌群[J]. 江西科学,2006,24(1):38-41.
[17]孙晓红,王娅芳,穆秋月等. 不同膳食模式及添加大豆低聚糖对肠道短链脂肪酸的影响[J]. 营养学报,2007,29(3):268-270.
[18]Fenster K,Rankin S,Steele J. Accumulation of short chain ethyl esters by esterases of lactic acid bacteria under conditions simulating ripening parmesan cheese[J]. Journal of Dairy Science,2003,86(9):2818-2825.
[19]申瑞玲,张静雯,党雪雅,等. 苦荞粉对小鼠肠道菌群的影响[J]. 食品与机械,2012,28(1):38-41.
[20]Wang X,Gibson G. Effects of theinvitrofermentation of oligofructose and inulin by bacteria growing in the human large intestine[J]. Journal of Applied Bacteriology,1993,75(4):373-380.
[21]方建东.抗性淀粉对小鼠肠道菌群的影响以及作用机制研究[D].杭州:浙江工商大学,2014,29-35.
Effect of tartary buckwheat protein on the growth of harmful bacteria in intestinal
LI En-wei
(Shanxi Food Industrial Research Institue,Taiyuan 030024,China)
In this paper,water-soluble buckwheat protein was used as the research object,and the pH and the quantity of short-chain fatty acids(acetic acid,propionic acid,butyric acid,lactic acid)and harmful bacteria(Enterococcus,EnterobacteriaceaeandClostridiumperfringens)were determined by simulatedinvitrofermentation. The mechanism of buckwheat protein inhibition of intestinal harmful flora growth was investigated. The results showed that the addition of different concentrations of buckwheat protein could reduce the number of harmful bacteria compared with the control group. The high dose group reduced the quantity ofEnterococcus,EnterobacterandClostridiumperfringensby 65%,72% and 78%(32 h). The tartary buckwheat protein in different dosage groups decreased the pH of the fecal fermentation broth by 35%,39% and 40%(32 h),respectively.In addition,the concentration of acetic acid,propionic acid,butyric acid and lactic acid in high dose group were increased by 8.94,33.77,27.34 and 25.55 times(32 h),respectively,compared with the control group.In summary,tartary buckwheat protein can improve the intestinal short-chain fatty acid content,thereby reducing the intestinal environment pH,inhibit intestinal harmful bacteria(Enterococci,Enterobacteriaceae,Clostridiumperfringens)growth.
tartary buckwheat protein;invitrosimulation;inhibition;pH;short-chain fatty acids(SCFAs)
2017-01-05
李恩伟(1962-),男,本科,研究方向:食品工程,E-mail:sxfood@126.com。
TS201.4
A
1002-0306(2017)15-0306-05
10.13386/j.issn1002-0306.2017.15.057
